黄芪根部黑斑病菌的分离鉴定及培养特征研究



摘 要 旨在明确西北盐碱地种植的黄芪根部黑斑病的主要致病因子。首先采用组织分离法从发病部位分离病原菌,通过纯化和离体回接确定其致病菌,基于形态学及分子生物学方法进行鉴定,进一步研究不同培养条件对其生长繁殖的影响。结果表明,引起黄芪根部黑斑并导致断根腐烂的致病菌主要包括三线镰刀菌(Fusarium tricinctum)和腐皮镰刀菌(Fusarium solani)。F.tricinctum HT2生长的最适pH、NaCl含量、碳源及氮源分别为pH 8、NaCl 2.0%、甘露醇及蛋白胨,产孢的最适碳氮源分别为葡萄糖和酵母粉;F.solani HT4生长的最适条件分别为pH 8、NaCl 0.0%、蔗糖及酵母粉,产孢的最适碳氮源分别为蔗糖和酵母粉。[JP]
关键词 黄芪;黑斑病;致病菌;鉴定;培养特征
中药材黄芪的物种多属于豆科(Leguminosae)黄芪属(Astragalus)的植物蒙古黄芪[Astragalus membranaceus (Fisch.) Bge.var.mongholicus (Bge.) Hsiao]或膜荚黄芪[A.membranaceus (Fisch.) Bunge][1],其多以根部入药。黄芪根中含有多糖、黄酮和皂苷等成分,具有抗衰老、抗肿瘤、免疫调节、降糖调脂、抗纤维化和抗辐射等多重功效[2-5]。目前市售的中药材黄芪多为人工种植,在连年种植的土壤中,其根部容易出现腐烂、断根现象,且多由黑斑病引起,导致黄芪质量和产量严重下降。在中国西北地区的宁夏、甘肃和新疆等地,随着黄芪人工种植面积的不断扩大,种植年限的增加以及大规模种植过程中的机械化程度的提高,黄芪根部病害问题愈发突出,尤其是黑斑病,严重制约了黄芪产业的健康发展。
关于黄芪根部病害的研究多集中在根腐病[6-10],但黄芪黑斑病从发生部位和病症上明显不同于黄芪根腐病,其发病过程较为复杂,发病前期在黄芪根的中部及根尖部位出现大小不一的黑色斑点,随时间延长斑点面积不断扩大,继而造成断根和腐烂。除此之外,黄芪的规模化种植采用的机械化挖苗、移栽方式导致黄芪根部破伤率增大,有利于病原菌入侵,加剧了黄芪黑斑病的发生。本研究对患有黑斑病的黄芪根部进行病原菌分离、纯化和离体回接,以确定致病菌;基于形态学及分子生物学方法对致病菌进行分类鉴定;进一步研究不同培养条件对其菌丝生长和孢子产生的影响。研究结果可明确黄芪黑斑病致病菌的种类并为高效生防菌的筛选提供科学依据。
1 材料与方法
1.1 研究材料
2021年6-7月在宁夏吴忠、新疆巩留县黄芪种植基地等多处采集1 a生黄芪的正常与患黑斑病植株,观察并记录患病株的症状表现。
1.2 致病菌分离纯化
将患黑斑病的黄芪根部用流水冲洗表面泥沙,采用常规组织分离法[3],在无菌条件下将病变组织切割成小块(5.0 mm×5.0 mm),于75%的酒精中浸泡5 s后取出并移至1.5%次氯酸钠溶液中继续消毒1 min。用无菌水冲洗3次,晾干后置于PDA平板表面,在28 ℃培养3~4 d,等平板上长出真菌,用接种铲挑取单一菌落转移至新的无菌PDA平板上继续培养,重复纯化2~3次。将纯化好的菌株分别接种在PDA斜面上培养, 4 ℃保存,备用。
1.3 致病菌致病性分析
采用离体根部组织回接法[11],选择生长状况良好且无任何病害的1 a生黄芪根,用剪刀将其截成约5 cm长的小段。用无菌组织刀在每小段上刺出3个伤口,在超净工作台上用75%的酒精对其表面消毒,接种已分离纯化培养的菌饼,将菌丝面与黄芪伤口处贴合后用保鲜膜包裹,同时接种无菌PDA培养基为阴性对照。每个处理重复3次,置于垫有湿滤纸的培养皿中于培养箱中 28 ℃培养。在培养期间定期观察,待出现黑斑病的典型症状后,对其根部组织进行解剖拍照记录。对所有接种后发病的处理组从发病部位再次分离病原菌,并观察其培养形态、菌丝及孢子与原接种菌是否相同。
1.4 致病菌形态学鉴定
将致病菌接种至PDA平板上,培养5~7 d后,观察并拍照记录其菌落形态、菌丝颜色。使用查氏培养基对病原菌HT2进行培养以得到其分生孢子,使用光学显微镜对两株病原菌的菌丝结构、孢子大小和孢子形态进行观察,根据《真菌鉴定手册》的分类方法和标准对致病菌进行形态学初步鉴定[12]。
1.5 致病菌分子生物学鉴定
1.5.1致病真菌基因组DNA的提取 用无菌打孔器打取3~5块菌饼,置于100 mL PDB培养基中,28 ℃,160 r/min培养3~5 d,用抽滤装置获得菌丝,将菌丝在液氮中冷冻研磨后,参照真菌DNA提取试剂盒(天根生化科技有限公司)中的操作步骤进行操作。
1.5.2 真菌rDNA片段PCR扩增、凝胶电泳、测序及序列分析 PCR引物序列为ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)与ITS4(5′-TCCTCCG CTTATTGATATGC-3′)。PCR扩增体系(20 μL):2×Taq酶10 μL,模板DNA 1 μL,引物各1 μL,ddH2O 7 μL。扩增条件:94 ℃预变性4 min,94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,共30个循环,72 ℃修复延伸10 min,4 ℃保温。PCR产物经1%琼脂糖凝胶电泳进行验证,获取胶带处理样品后送至生工生物工程(上海)有限公司测序。
1.5.3 rDNA序列比较分析与系统发育树构建 将ITS测序结果在核酸序列数据库GenBank (http://blast.ncbi.nlm.nih.gov/)进行同源序列分析比对。选择同源性程度较高的序列进行下载,并用Mega11.0软件通过邻接法(Neighbor-joining,NJ)进行1 000次相似重复度计算并构建系统发育树。
1.6 pH、NaCl浓度和碳氮源种类对致病菌生长的影响
探究不同pH、不同NaCl浓度和不同碳、氮源条件下致病菌菌丝的生长及产孢情况[13]。
1.6.1 pH对致病菌生长的影响 分别用浓度为0.1 mol/L HCl和NaOH溶液调节,制成pH分别为5、6、7、8、9、10的PDA平板,用直径5 mm打孔器在菌落边缘打取菌饼后接至PDA平板上,置于28 ℃培养箱中培养4 d,用十字交叉法测量菌落直径。每个处理重复3次。
1.6.2 NaCl含量对致病菌生长的影响 制成NaCl含量分别为0.0%、0.5%、1.0%、2.0%、 3.0%、4.0%的PDA平板。用直径5 mm打孔器在长好致病菌培养基平板上的菌落边缘打取菌饼,小心接至各PDA平板上,置于培养箱中28 ℃培养,培养4 d后用十字交叉法测量菌落直径。每个处理重复3次。
1.6.3 不同碳氮源对致病菌生长的影响 以查氏培养基为基础培养基,分别用等质量的葡萄糖、甘露醇、淀粉代替原培养基中的蔗糖进行最优碳源的筛选。在培养基中接种菌饼,在28 ℃,180 r/min下培养5 d后统计菌丝干质量。以获取的最优碳源组成的查氏培养基为基础培养基,分别用等质量的酵母粉、蛋白胨及硫酸铵代替原培养基中的硝酸钠筛选最优氮源。在相同条件下培养 5 d后统计菌丝干质量。每个处理重复3次。
1.7 碳氮源种类对致病菌产孢的影响
以查氏培养基为基础培养基,分别用等质量的葡萄糖、甘露醇、淀粉代替原培养基中的蔗糖进行最优碳源的筛选。在培养基中接种相同大小菌饼的致病菌,在28 ℃,180 r/min培养5 d后统计孢子数量。以最优碳源组成的查氏培养基为基础培养基,分别用等质量的酵母粉、蛋白胨及硫酸铵代替原培养基中的硝酸钠来筛选最优氮源。在相同条件下培养5 d后统计孢子数量。每个处理重复3次。
1.8 数据处理
采用Microsoft Excel 2019进行数据处理,使用SPSS 23.0软件进行单因素方差分析,采用Graphpad Prism 9作图。
2 结果与分析
2.1 黄芪黑斑病症状
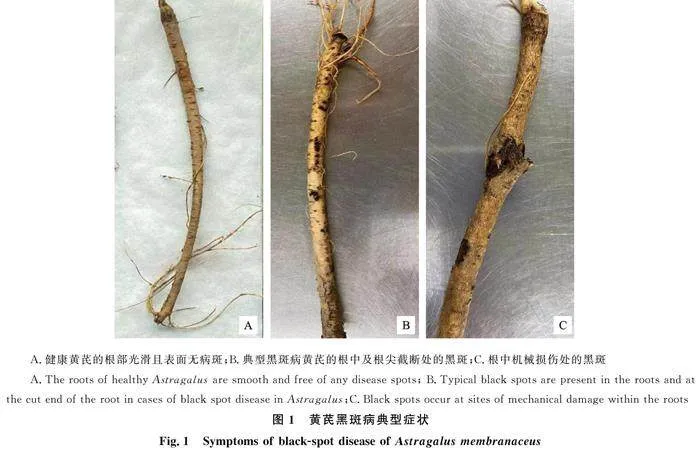
生长良好的黄芪根部表面光滑,通体淡黄透白,有单根或多须毛根。典型黑斑病的发病部位主要集中在根尖和根中部,多在根部被机械损伤处或挖苗时的截断处,发病处组织颜色呈黑色(发病组织内部初期发红)、干枯、成疤、向下洼陷,严重者导致断根或腐烂。不仅影响植株正常生长发育,成品后还在根部留有瘢痕,或根部断根溃烂(图1)。
2.2 致病菌的分离纯化及致病性测定
经组织分离和致病性试验,得到两株具有较强致病性的病原菌菌株HT2与HT4(图2)。对照组织呈粉红色,接种HT2和HT4菌饼的组织均出现发红、变黑和腐烂现象,与原始病株的发病症状基本一致;从发病部位分别分离到相同的病原菌。表明HT2与HT4是引起黄芪黑斑病的主要致病菌。
2.3 致病菌的形态学特征
2.3.1 致病菌菌落形态观察 如图3所示,HT2致病菌在PDA上菌丝呈致密绒毛状,基内菌丝多为紫红色,气生菌丝为白色,从中心处向外呈现出由黄变粉的颜色改变,从侧面图可以看出,HT2菌丝致密突出,培养平板背面呈现红色;HT4致病菌在PDA上菌丝为致密羽毛状,菌丝为白色带有淡黄色,菌落菌丝以接种点为中心向四周呈规则圆形扩散,从侧面图可以看出,HT4菌丝茂密但贴壁生长,培养基背面色素颜色不 明显。
2.3.2 致病菌显微形态观察 如图4所示为HT2和HT4的菌丝及分生孢子形态。HT2菌丝细长平滑有隔膜,菌丝透明(图4-A),HT2在察氏培养基中有分生孢子产生,分生孢子呈短棒状,大小在200~500 μm(图4-C)。HT4菌丝细长,分枝较多,有隔膜(图4-B),其在PDA培养基中就有分生孢子产生,其孢子形态呈镰刀状或短腊肠形,大小不一(图4-D)。
2.4 致病菌的分子生物学鉴定
将两种致病菌的测序结果与GenBank数据库中进行Nucleotide Blast比对,使用Mega 7.0软件,采用邻接法(Neighbor-joining,NJ)建立系统发育树(图5)。HT2与Fusarium tricinctum具有100%的相似性,最终确定黄芪黑斑病的致病菌HT2为三线镰刀菌(Fusarium tricinctum)。HT4与Fusarium solani具有99%的相似性,最终确定黄芪黑斑病致病菌HT4为腐皮镰刀菌(Fusarium solani)。
2.5 pH、盐浓度、碳氮源种类对致病菌生长的影响
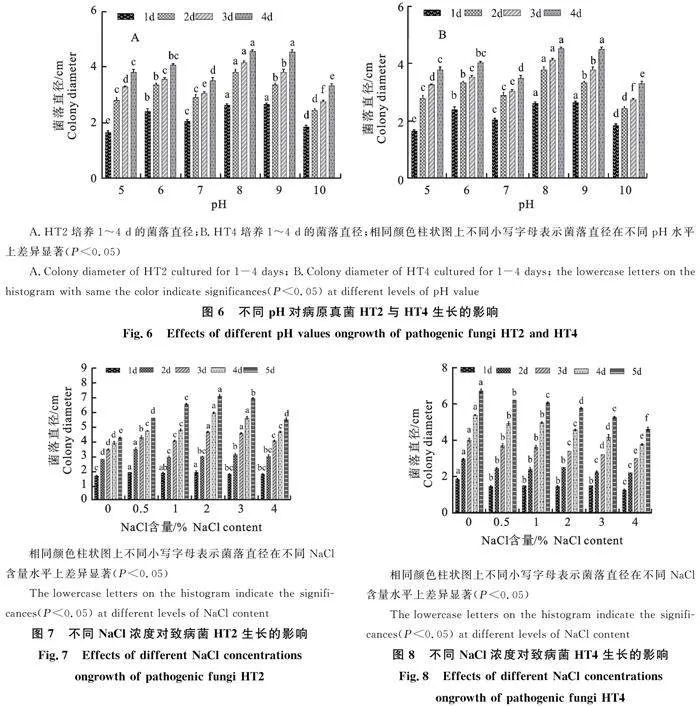
2.5.1 pH对致病菌生长的影响 观察发现致病菌HT2与HT4在pH为5~10的培养基上均能生长。致病菌HT2在pH为8的平板上生长速度最快,4 d时菌落直径为4.5 cm。致病菌HT4在pH为8时生长速度最快,4 d时菌落直径为6.4 cm(图6)。
2.5.2 盐度对致病菌生长的影响 观察发现致病菌HT2在不同NaCl含量的平板上均能生长。培养2 d时,HT2在NaCl含量为0.5%的平板上的菌落直径显著高于其他平板(P<0.05)。培养5 d时,HT2在2.0%的平板上菌落直径显著高于其他处理组,而在不含NaCl的平板上的菌落直径则显著低于其他处理组,说明低盐度可能促进该菌的生长(图7)。
致病菌HT4在不含NaCl的平板上的菌落直径在不同培养时间均显著高于其他处理组 (P<0.05),培养5 d时的菌落直径可达6.7 cm,而在4.0%的平板上的菌落直径均为最小。不同培养时间内的HT4菌落直径均会随NaCl含量的增加而逐渐减小,由此可知NaCl对HT4的生长造成不利影响(图8)。
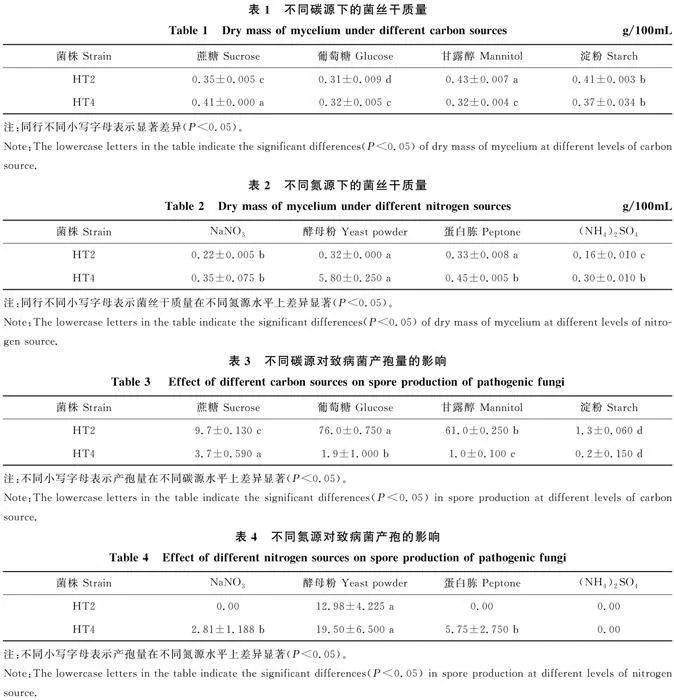
2.5.3 不同碳氮源对致病菌菌丝生长的影响 不同碳源对HT2和HT4菌丝生长的影响如表1所示。培养5 d后,HT2在以甘露醇为基础碳源的查氏培养基中获得最大菌丝干质量(0.43 g/100mL),显著高于其他碳源(P<0.05);HT4在以蔗糖为基础碳源的查氏培养基中具有最大菌丝干质量,为0.41 g/100mL,显著高于其他碳源(P<0.05)。
不同氮源对HT2和HT4菌丝生长的影响如表2所示。以表1数据为依据,分别得到了致病菌HT2与HT4最适菌丝生长碳源为甘露醇和蔗糖。培养5 d后,HT2在以酵母粉或蛋白胨为基础氮源的查氏培养基中具有较大菌丝干质量,分别为0.32 g/100mL和0.33 g/100mL,两者无显著差异(P>0.05);培养5 d后,HT4在以酵母粉为基础氮源的查氏培养基中具有最大菌丝干质量,为5.8 g/100mL,显著高于其他氮源 (P<0.05)。
2.6 不同碳氮源对致病菌产孢的影响
不同碳源对HT2和HT4产孢的影响结果如表3所示。在培养5 d后,HT2在以葡萄糖为基础碳源的查氏培养基中产孢最多,孢子数达到7.6×107 CFU/mL,显著高于其他碳源(P< 0.05);在培养5 d后,HT4在以蔗糖为基础碳源的查氏培养基中产孢最多,达到3.7×106 CFU/mL,显著高于其他碳源(P<0.05)。
不同氮源对HT2和HT4产孢的影响如表4所示。在培养5 d后,HT2在以酵母粉为基础氮源的查氏培养基中可以产生孢子,产孢量达到 1.3×107CFU/mL,在其他氮源的培养基中均无孢子产生;在培养5 d后,HT4在以(NH4)2SO4为基础氮源的培养基中无孢子产生,在其他3种氮源培养基均可产孢。其中在以酵母粉为氮源的查氏培养基中产孢最多,为2.0×107CFU/mL,显著高于其他氮源(P<0.05)。
3 讨 论
在田间,患黑斑病黄芪根部会出现面积大小不同的黑色斑点,严重时导致植株死亡,造成损失。本研究结果表明,引起黄芪根部黑斑病的主要致病菌为镰刀属(Fusarium spp.)的三线镰刀菌(Fusarium tricinctum)和腐皮镰刀菌(Fusarium solani)。三线镰刀菌作为引起黄连、苜蓿等作物根部病害的主要致病菌被研究报道过[14-15],但其引起黄芪根部黑斑病为本研究首次发现。腐皮镰刀菌为最常见的植物根腐病致病菌,能够引起人参、生姜、甘薯和当归[16-19]等作物根腐病的发生,腐皮镰刀菌作为引起根茎类作物根部病害最为常见的病原菌之一,在黄芪黑斑病的防治中应引起重视。
对两株致病菌的培养条件研究时发现,这两株真菌都能够耐受一定程度的盐碱胁迫,pH为8、NaCl含量为2.0%的碱性含盐培养基更适宜三线镰刀菌HT2的生长,pH为8、不含NaCl的碱性无盐培养基更适宜腐皮镰刀菌HT4的生长。由结果可知,腐皮镰刀菌HT4随培养基中NaCl含量的增加而生长减慢,但其在高NaCl含量(4.0%)的培养基仍可以形成一定直径的菌落,说明其具有一定的盐碱耐受性。由此可知,盐碱土壤为这些致病真菌提供了更适宜的生长环境。
土壤盐渍化和酸渍化被认为是导致三七连作障碍的主要原因之一[20],马超等[21]的研究也发现土壤盐渍化会通过影响青枯菌在土壤中的存活能力来影响作物青枯病的发病率,Haddoudi等[22]通过对蚕豆根腐病病原菌在盐胁迫下的体外生长情况及对植株侵染率的探究发现,盐胁迫会促进病原菌的生长,提高病原菌对植株的侵染率而增加根腐病的发病率。土壤盐碱化除会通过直接影响病原微生物的生存及其对植株的侵染率加剧植物病害的发生外,还会通过影响植物自身的生理和防御反应来影响植物与病原体之间的相互作用,进而加剧病害的发生。
综上,盐碱地黄芪种植过程中黑斑病的频发可能受到多方面因素的影响,但黑斑病病原菌对盐碱环境的耐受性可能是加剧黄芪黑斑病发生的主要原因。因此在后续对盐碱地种植的黄芪根部黑斑病的防治中,注重对盐碱土壤的改良可能会对黑斑病的防治起到事半功倍的效果。
目前,根茎类中草药种植的病害问题仍以根部病害问题为主,明确病害发生的根本原因是进行病害防治最为关键的步骤之一,通过本研究明确了引起黄芪黑斑病的病因,为黑斑病的防治奠定了基础。在后续研究中将寻找高效且绿色的生物防治手段。
参考文献 Reference:
[1] 国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2010:283-284.
Chinese Pharmacopoeia Commission.Chinese Pharmacopoeia[M].Beijing:China Medical Science Press,2010:283-284.
[2]刘旭峰,冯 佳,王述进,等.黄芪多糖对糖尿病肾病大鼠氧化应激和自噬的影响及机制[J].山西医科大学学报,2023,54(3):343-351.
LIU X F,FENG J,WANG SH J,et al. Effect and mechanism of Astragalus polysaccharide on oxidative stress and autophagy in diabetic nephropathy rats[J].Journal of Shanxi Medical University,2023,54(3):343-351.
[3]刘建华,孔丽宇,万建伟,等.两种黄酮对HepG-2肝癌细胞增殖抑制作用的对比研究[J].吉林医药学院学报,2022, 43(5):346-348.
LIU J H,KONG L Y,WANG J W,et al.Comparative study on the inhibitory effects of two flavonoids on the proliferation of HepG-2 hepatoma cells[J].Journal of Jilin Medical College,2022,43(5):346-348.
[4]LI Z,QI J,GUO T,et al.Research progress of Astragalus membranaceus in treating peritoneal metastatic cancer[J].Journal of Ethnopharmacology,2023,305:116086.
[5]REN C,ZHAO X,LIU K,et al.Research progress of natural medicine Astragalus mongholicus Bunge in treatment of myocardial fibrosis[J].Journal of Ethnopharmacology,2023,305:116128.
[6]张爱梅,李曦冉,郭保民,等.黄芪根腐病生防菌株的筛选鉴定及其防效评价[J].西北农业学报,2021,30(12):1905-1913.
ZHANG A M,LI X R,GUO B M,et al.Screening,identification,and biocontrol effect of antagonistic bacteria against Astragalus membranaceus root rot[J].Acta Agriculturae Boreali-occidentalis Sinica,2021,30(12):1905-1913.
[7]沈煜铠,李昭煜,李佳佳,等.黄芪根腐病菌分离鉴定及细胞壁降解酶活性比较[J].兰州交通大学学报,2021,40(3):101-109,132.
SHEN Y K,LI ZH Y,LI J J,et al.Isolation and identification of Astragalus membranaceus var.root rot and comparison of cell wall degrading enzyme activities[J].Journal of Lanzhou Jiaotong University,2021,40(3):101-109,132.
[8]高 芬,赵晓霞,秦雪梅,等.山西省蒙古黄芪根腐病优势致病菌群分析[J].植物保护学报,2018,45(4):878-885.
GAO F,ZHAO X X,QIN X M,et al.Analysis of dominant pathogen community causing Astragalus membranaceus var.mongholicus root rot in Shanxi province[J].Journal of Plant Protection,2018,45(4):878-885.
[9]牛世全,赵 丹,豆建涛,等.敦煌盐碱土中抗黄芪根腐病放线菌的筛选、鉴定及发酵条件优化[J].西北师范大学学报(自然科学版),2018,54(3):71-76.
NIU SH Q,ZHAO D,DOU J T,et al.Screening,identification and optimization of fermentation conditions of actinomycetes on Astragalus membranaceus root rot isolated from saline-alkali soils in Dunhuang[J].Journal of Northwest Normal University(Natural Science),2018,54(3):71-76.
[10] 马桂花,段晓明,徐文华,等.蒙古黄芪根腐病病原鉴定及防治药剂室内筛选[J].草地学报,2022,30(5):1122-1130.
MA G H,DUAN X M,XU W H,et al.Identification and laboratory screening of chemical agents of root rot pathogens of Astragalus mongolicus var.mongholicus[J].Acta Agrestia Sinica,2022,30(5):1122-1130.
[11]张永芳,曹 捷,李 侠,等.黄芪不同部位营养成分比较[J].山西大同大学学报(自然科学版),2022,38(4):5-7,21.
ZHANG Y F,CAO J,LI X,et al.Comparison of nutritional components in different parts of Astragalus membranaceus[J].Journal of Shanxi Datong University(Natural Science Edition),2022,38(4):5-7,21.
[12]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
WEI J CH.Fungal Identification Manual[M].Shanghai:Shanghai Scientific and Technical Publishers,1979.
[13]张晓云,李维蛟.黄花蒿烟草醋液对三线镰刀菌生长的抑制作用[J].中国农学通报,2020,36(1):131-134.
ZHANG X Y,LI W J.Inhibitory effect of Artemisia annua tobacco vinegar on the growth of Fusarium tricinctum[J].China Agronomy Bulletin,2020,36(1):131-134.
[14]伍晓丽,王 钰,刘 飞,等.黄连根腐病镰刀菌属病原真菌鉴定[J].中国中药杂志,2020,45(6):1323-1328.
WU X L,WANG Y,LIU F,et al.Identification of Coptis chinensis root rot disease pathogenic Fusarium spp.fungi[J].China Journal of Materia Medica,2020,45(6):1323-1328.
[15]李敏权,柴兆祥,李金花,等.定西地区苜蓿根和根颈腐烂病病原研究[J].草地学报,2003,11(1):83-86.
LI M Q,CHAI ZH X,LI J H,et al.Study on the pathogen of alfalfa root a35735f38b25e74e3711bf8c1dfbb0bf7nd root rot in Dingxi area[J].Journal of Grassland,2003,11(1):83-86.
[16]冯 琳,孙 茹,赵贵佳,等.腐皮镰刀菌对人参根部生理变化的响应机制[J].吉林大学学报(理学版),2022,60(5):1209-1216.
FENG L,SUN R,ZHAO G J,et al.Response mechanism of Fusarium putrescens to physiological changes of ginseng root[J].Journal of Jilin University(Science Edition),2022,60(5):1209-1216.
[17]周 洁,张玲玲,朱永兴,等.生姜腐皮镰刀菌的分离鉴定及PCR快速检测方法构建[J].植物病理学报,2022, 52(4):681-690.
ZHOU J,ZHANG L L,ZHU Y X,et al.Isolation and identification of Fusarium solani and construction of PCR rapid detection method[J].Journal of Plant Pathology,2022,52(4):681-690.
[18]ZHANG Z,ZHANG W,WANG X,et al.Isolation and identification of antagonistic bacteria of Angelica root rot and their mechanism as biological control[J].Biological Control,2023,177:105120.
[19]KIM S,KIM T H,CHUNG M N,et al.Incidence rates of root rot in sweetpotato caused by cultivation soil and soil microorganisms during storage periods[J].Frontiers in Plant Science,2022,13:1178.
[20]孙雪婷,李 磊,龙光强,等.三七连作障碍研究进展[J].生态学杂志,2015,34(3):885-893.
SUN X T,LI L,LONG G Q,et al.The progress and prospect on consecutive monoculture problems of Panax notoginseng[J].Chinese Journal of Ecology,2015,34(3):885-893.
[21]马 超,杨欣润,江高飞,等.病原青枯菌土壤存活的影响因素研究进展[J].土壤学报,2021,58(6):1359-1367.
MA CH,YANG X R,JIANG G F,et al.Research progresses on key factors affecting survival of Ralstonia solanacearum in soils[J].Acta Pedologica Sinica,2021, 58(6):1359-1367.
[22]HADDOUDI I,MHADHBI H,GARGOURI M,et al.Occurrence of fungal diseases in faba bean (Vicia faba L.) under salt and drought stress[J].European Journal of Plant Pathology,2021,159:385-398.
Isolation,Identification and Cultivation Characteristics of Black-spot Disease Pathogen in Roots of Astragalus membranaceus
ZHANG Xiaochen1,LIANG Jian1,2,WANG Qiaoxia1,YANG Jinhui3,SUN Jiahao1,YANG Quansheng4 and MA Xiaokui1
(1.Key Laboratory of Medicinal Resources and Natural Pharmaceutical Chemistry,Ministry of Education,National Engineering Laboratory for Resource Developing of Endangered Chinese Crude Drugs in Northwest of China,Shaanxi Normal University, Xi’an 710055,China; 2.College of Biology and Geography,Yili Normal University,Yining Xinjiang 835000,China;3.College of Modern Agricultural,Changchun Vocational and Technical College,Changchun 130504,China;4.Ningxia Tuoming Agricultural Development Corporation,Wuzhong Ningxia 751503,China)
Abstract The aim of this study is to identify main pathogenic factors of black spot disease in the roots of Astragalus membranaceus in saline-alkali areas of northwest China.In this study,potential fungal pathogens were isolated and purified from the tissue blocks of the diseased parts of root of A.membranaceus in large-scale planting.The taxonomic identification of the obtained pathogens were conducted using the morphological and molecular biological methods.The effects of different culture conditions on the growth and reproduction of the determined pathogenic fungi were further investigated.The results showed that Fusarium tricinctum HT2 and Fusarium solani HT4 were determined to be the main pathogenic fungi causing black spots on the roots of A.membranaceus.The conditions of pH 8,NaCl 2%,mannitol as carbon source,and peptone as nitro9244aca15557589faabcb11e41c44d29gen source were conducive to the growth of F.tricitrium HT2,and the optimum carbon and nitrogen source for sporulation of F.tricitrium HT2 were glucose and yeast powder,respectively.The conditions of pH 8,NaCl 0,sucrose as carbon source and yeast powder as nitrogen source were conducive to the growth of F.solani HT4 and the optimum carbon and nitrogen sources for sporulation were sucrose and yeast powder,respectively.
Key words Astragalus membranaceus; Black-spot disease; Pathogen; Identification; Culture characteristics
Received 2023-03-09 Returned 2023-06-05
Foundation item Natural Science Foundation of Xinjing Uygur Autonomous Region (No.2022D01C458) ; Funds of Ningxia Tuoming Agricultural Co.,Ltd.(No.2021064).
First author ZHANG Xiaochen,female,master student.Research area:fermentation and environmental microorganism.E-mail:ZXiaochen228@163.com
Corresponding author MA Xiaokui,male,associate professor.Research area:microbiology and biological control of medicinal plants,and exploration of molecular mechanisms for the synthesis of natural metabolites of medicinal fungi.E-mail:bioma2003@163.com
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)
基金项目:新疆维吾尔自治区自然科学基金(2022D01C458);宁夏拓明农业有限公司资金及场地支持(2021064)。
第一作者:张晓尘,女,研究生,研究方向为发酵与环境微生物。E-mail:ZXiaochen228@163.com
通信作者:马小魁,男,副教授,主要从事药用植物的生物防治及药用真菌天然代谢产物合成的分子机制研究。E-mail:bioma2003@163.com

