一款含多重神经酰胺的保湿霜对特应性皮炎基础护理的临床观察

目的:探讨一款神经酰胺保湿霜对干性至极干性特应性皮炎的效果。
方法:一共招募358名年龄大于18岁的特应性皮炎试验者,于使用前、使用后28天评估产品对特应性皮炎护理各项临床症状和生活质量的影响,以及试验者对产品耐受度。
结果:在医生临床评估中,特应性皮炎严重程度、炎性反应、干燥程度、皮肤脱屑和红斑等症状均得到显著改善。在试验者自我评估中,皮肤疼痛程度、烧灼感、瘙痒感均得到显著改善,同时试验者生活质量得到显著改善。
结论:在使用神经酰胺保湿霜进行基础护理四周后,特应性皮炎患者不适显著减轻,同时提高试验者生活质量。另外,值得注意的是,本产品只是作为基础辅助护理皮肤,不能替代药品治疗。
关键词:神经酰胺;特应性皮炎;皮肤屏障
特应性皮炎(atopic dermatitis,AD)是一种以瘙痒为主要特征,普遍存在的慢性、反复发作的皮肤疾病。其发病机制十分复杂,涉及遗传、环境、免疫等多个因素的相互作用。特应性皮炎各个年龄段都可能患病,其中成人的患病率在2%至10%之间[1]。近年来有研究表明,皮肤屏障功能受损是特应性皮炎的重要机制之一[2]。外用保湿润肤剂是特应性皮炎的基础护理方法之一,有助于恢复皮肤屏障功能[3]。因为外用保湿润肤剂不仅可以阻止水分的流失,还可以减轻外界不良因素的刺激,从而降低疾病的发作频率和严重程度。含有神经酰胺的产品可以通过填充角质细胞之间的间隙来补充皮肤脂质,来帮助恢复皮肤屏障。此外,它们可以作为信号分子,从内部提供皮肤修护途径,以改善皮肤最外层的完整性和黏附力[4]。医生临床评估和试验者自我评估是评估试验者生理状况的两种重要方法。虽然它们使用的评分系统可能不同,但它们存在相关性。这种相关性的存在意味着,两种评估方法可以提供互补的信息,帮助医生更好地了解试验者状况。同时,也能帮助试验者在临床决策中实现自我评估。本文通过自身对照研究,结合医生评估和试验者自我评估等评价手段, 探讨一款神经酰胺保湿霜对干性至极干性特应性皮肤护理的效果,现报道如下。
Part 1
对象与方法
1. 研究对象
收集2022年11月至2023年6月就诊于中国医科大学附属第一医院以及成都市第二人民医院的358名年龄大于18岁的特应性皮炎试验者。
2. 纳入标准
特应性皮炎试验者;轻度至重度干燥皮肤试验者;试验者年龄大于18岁;自愿加入并签署知情同意书。
3. 排除标准
极其严重的特应性皮炎试验者,这里指的是SCORAD评分>50分的试验者,特应性皮炎可通过SCORAD评分来判断严重度,一般可分为轻度、中度、重度。①轻度(SCORAD评分0~24分):部分皮肤干燥、瘙痒不频繁,对日常生活只有轻微影响。②中度(SCORAD评分25~50分):部分皮肤干燥、瘙痒较为频繁,影响睡眠。③重度(SCORAD评分>50分):大面积皮肤干燥、瘙痒非常频繁,并伴有色素沉着、皮肤出血等现象,严重影响日常生活及睡眠情况。试验者对本保湿霜中的任何成分有过敏、过敏反应或超敏反应史;试验者有继发于化妆品相关接触性皮炎病史;在护理区域有任何临床表现或医生认为可能影响研究产品的评估或结果的其他疾病的试验者;不能或不愿参加所有研究随访并遵循护理方案的试验者。
4. 实验设计
这项研究将在医生办公室/诊所进行,一共进行两次面诊。
初次问诊(D0)试验者入组及基线评估:①交付意向书(知情同意书),医生和试验者必须阅读并签字。皮肤科医生应在研究期间保留这封文件。②医生与试验者共同完成皮肤状况评估。③完成问卷。④开具神经酰胺保湿霜处方,该产品含有神经酰胺EOP(1),神经酰胺NP(3)和神经酰胺AP(6-II)。
四周后二次问诊(D28):①面诊评估。②医生与试验者共同完成皮肤状况评估。③完成问卷。
5. 观察指标及评估标准
(1)医生临床评估
医生对护理前后特应性皮炎等相关症状进行量化评估,0分表示不严重;1分表示轻度 ;2分表示中度;3分表示重度;4分表示极重度。具体评分维度如下:
① 特应性皮炎严重程度;
② 皮肤干燥程度(病灶外);
③ 皮肤脱屑/脱落/鳞屑情况(病灶外);
④ 红斑/泛红(病灶外);
⑤ 炎症反应(影响的皮肤面积):0分=无;1分=< 10% ;2分=10% ≤ S(S表示影响的皮肤面积占比) <30% ; 3分=30% ≤S <50%;4分=50% ≤ S <75%;5分=≥75%。
(2)试验者对不适感觉的自我评估
试验者对护理前后特应性皮炎等相关症状进行量化评估,0分=不严重;1分=轻度;2分=中度 ; 3分=重度;4分=非常严重/无法忍受。具体评分维度如下:
① 目前皮肤疼痛程度;
② 目前皮肤是否有烧灼感;
③ 目前皮肤是否有瘙痒感;
④ 目前皮肤是否刺痛感。
(3)试验者生活质量自我评估
试验者对护理前后特应性皮炎影响生活质量的多个维度进行评估,程度依次为:①非常频繁;②经常 ;③偶尔 ;④从未。
具体评分维度如下:
①近一周内,您因为皮肤情况感到沮丧或易怒;
②近一周内,您因为皮肤情况感到尴尬或不自在;
③近一周内,您因为皮肤情况感到压力增大;
④近一周内,您因为皮肤状态导致让您难以选择合适衣物;
⑤近一周内,您因为皮肤状况对您的日常社交生活和参加社交和休闲活动产生影响;
⑥近一周内,您因为皮肤状况让您难以进行任何体育活动;
⑦近一周内,您因为皮肤状况对您与伴侣或任何亲密朋友或亲戚的关系造成了不良影响。
(4)产品耐受性评估
医生和试验者对使用产品后耐受度进行量化评估,具体评分细则如下:1分,不良;2分,一般;3分,好;4分,极佳。
6. 统计方法
采用统计学软件SPSS 22.0进行数据分析,计量资料采用(x±s)表示,组内前后比较采用配对t 检验,按检验水准P<0.05表示差异有统计学意义。
Part 2
结果
1.一般资料
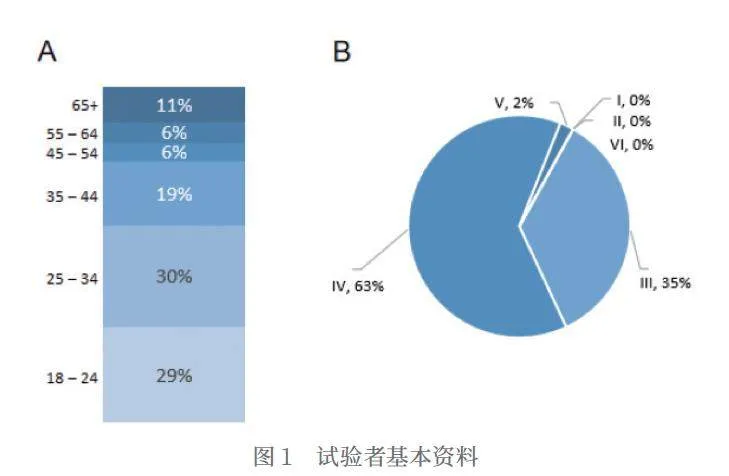
本研究共招募358人,57%是男性,43%是女性,平均年龄36岁(如图1.A),Fitzpatrick皮肤分型主要以IV型、III型为主(如图1.B)。
2. 医生临床评估
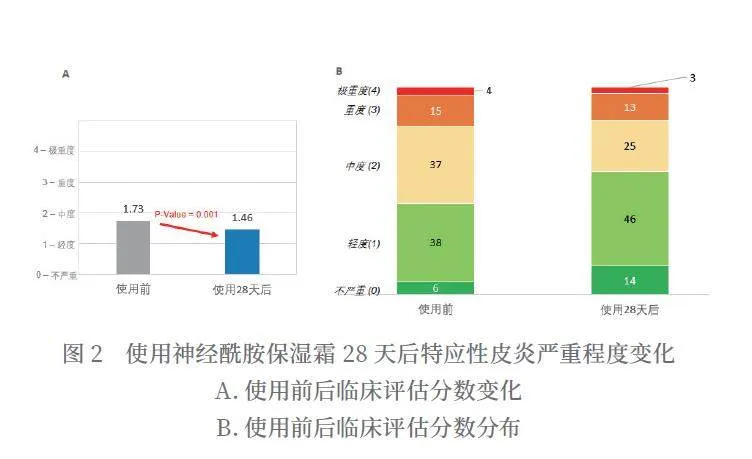
使用神经酰胺保湿霜28天后,特应性皮炎严重程度平均分从1.73分降到1.46分,得到显著改善(P=0.001),改善率为15.6%(如图2所示)。
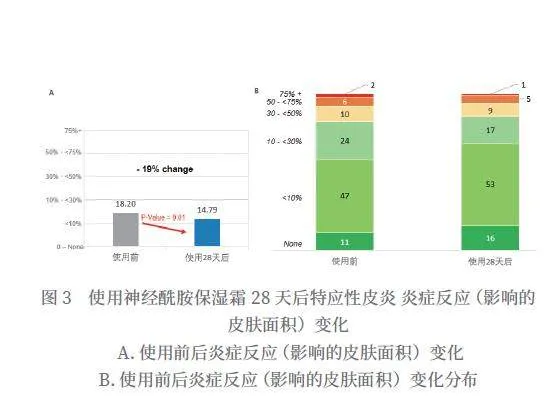
使用神经酰胺保湿霜28天后,特应性皮炎炎症反应(影响的皮肤面积)从18.2%降到14.79%,得到显著改善(P=0.01),改善率为18.7%(如图3所示)。
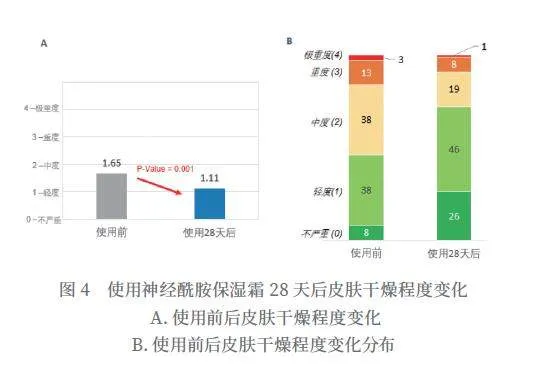
使用神经酰胺保湿霜28天后,特应性皮炎皮肤干燥程度平均分从1.65分降到1.11分,得到显著改善(P=0.001),改善率为32.7%(如图4所示)。
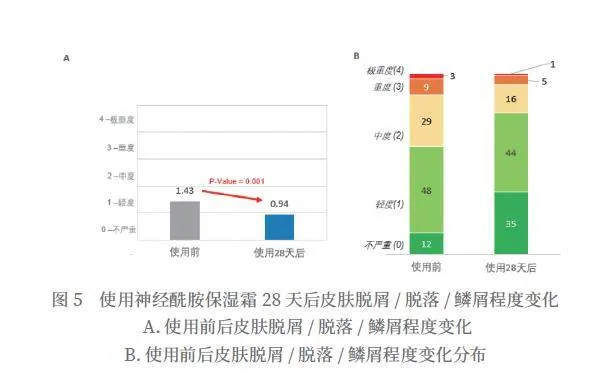
使用神经酰胺保湿霜28天后,特应性皮炎皮肤脱屑/脱落/鳞屑程度平均分从1.43分降到0.94分,得到显著改善(P=0.001),改善率为34.3%(如图5所示)。
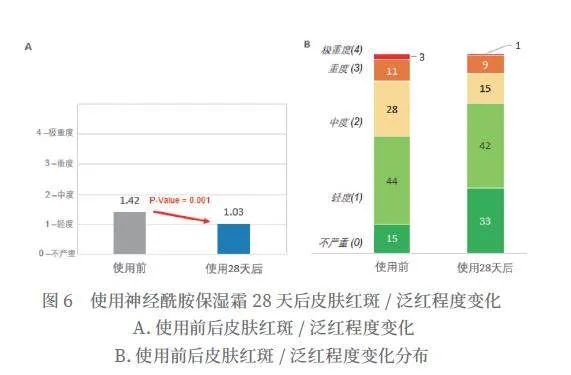
使用神经酰胺保湿霜28天后,特应性皮炎红斑/泛红平均分从1.42分降到1.03分,得到显著改善(P=0.001),改善率为27.5%(如图6所示)。
3. 试验者对不适感觉的自我评估
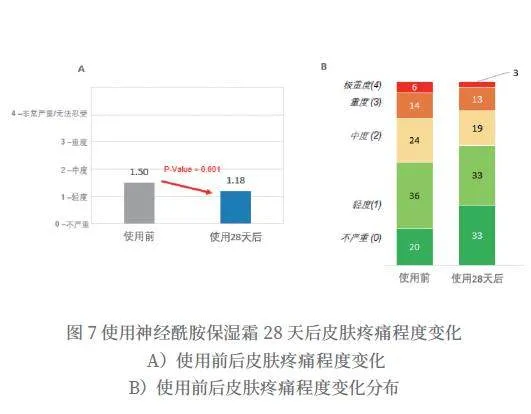
使用神经酰胺保湿霜28天后,特应性皮炎疼痛程度平均分从1.50分降到1.18分,得到显著改善(P=0.001),改善率为21.3%(如图7所示)。
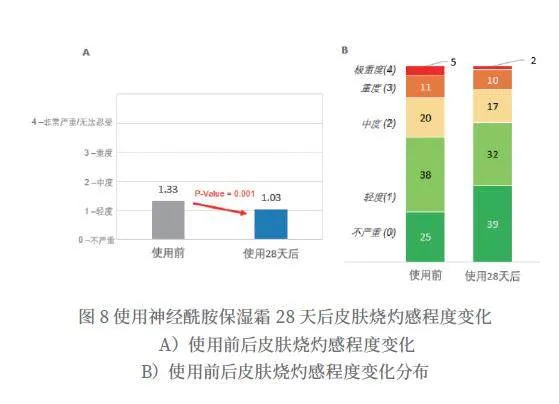
使用神经酰胺保湿霜28天后,特应性皮炎烧灼感平均分从1.33分降到1.03分,得到显著改善(P=0.001),改善率为22.6%(如图8所示)。
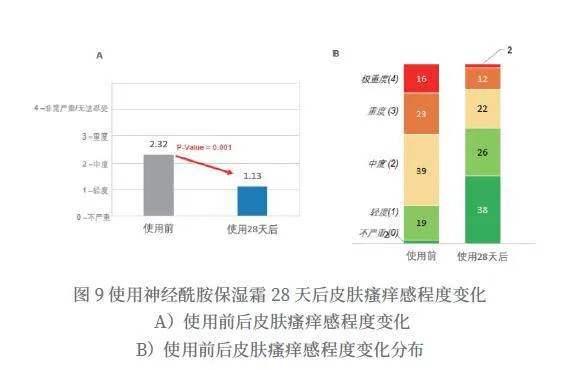
使用神经酰胺保湿霜28天后,特应性皮炎瘙痒感平均分从2.32分降到1.13分,得到显著改善(P=0.001),改善率为51.3%(如图9所示)。
使用神经酰胺保湿霜28天后,特应性皮炎刺痛感没有显著变化(如图10所示)。
4. 试验者生活质量自我评估
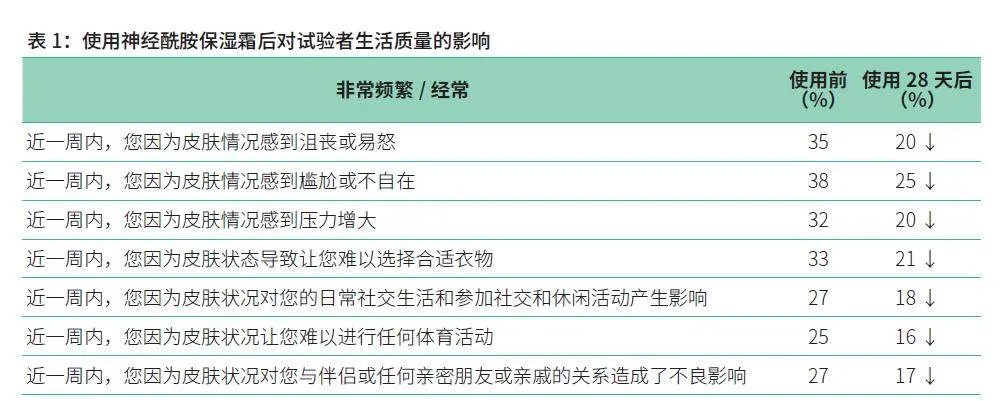
总体而言,使用神经酰胺保湿霜28天后,对试验者因皮肤情况感到沮丧、尴尬等各项指标有明显改善(IJHKM1Wu0RXrP2MnzUokJg==如表1所示)。
5. 产品耐受性评估
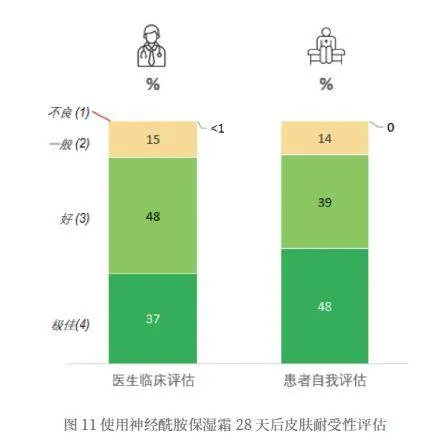
在使用神经酰胺保湿霜28天后,医生对产品的耐受性平均打分为3.32分,试验者对产品的耐受性平均打分为3.34分,87%的试验者认为使用产品后耐受度为“好”(如图11所示)。
Part 3
讨论
在过去的30年中,全球范围内特应性皮炎的患病率逐渐上升[3]。尽管目前尚不清楚特应性皮炎的确切发病机制,但研究认为皮肤屏障功能障碍和免疫异常等因素在该疾病的发病过程中扮演重要角色[5]。当皮肤屏障功能受损时,会直接导致皮肤表面的定植菌群种类和数量发生变化。皮肤菌群的失调进一步破坏皮肤屏障,加剧炎症反应,导致角质层含水量下降,并进一步引发Th2型皮肤炎症反应的发生[6]。
神经酰胺是角质层表皮脂质的重要组成部分,占细胞间脂质含量的50%[7]。它与游离脂肪酸和胆固醇一起,形成了一个疏水性的脂质双分子层结构,对维持皮肤的屏障功能至关重要[8]。然而,干燥皮肤相比正常皮肤神经酰胺含量显著降低,会导致细胞间脂质的不规则堆积,并进一步破坏角质层脂质的稳定结构[9]。类似的,研究表明特应性皮炎试验者的皮肤屏障功能下降可能与表皮脂质代谢异常相关[10]。通过对特应性皮炎试验者非皮损区域的皮肤进行测定,发现长链神经酰胺的含量显著减少,其中神经酰胺1和神经酰胺3的减少最为显著[11]。另有之前的研究表明,含有神经酰胺的产品局部应用后可以促进角质层中细胞间脂质的正交有序排列,从而改善干燥皮肤的屏障功能[12]。有研究更是表明,含有神经酰胺1和3的产品对修护皮肤屏障和减少角质层经表皮失水率(TEWL)具有良好协同效果[13]。类似的,我们的研究结果表明,在使用含有神经酰胺1,3,6-II的保湿产品进行为期28天的护理后,特应性皮炎试验者的干燥和脱屑问题得到了显著改善。更进一步的,皮肤屏障受损、皮肤干燥和瘙痒息息相关,尤其是在特应性皮炎试验者中。这是由于皮肤屏障受损会导致经表皮水分丢失增加,同时激活与瘙痒有关的神经纤维[14]。我们的研究结果表明,使用含有神经酰胺的保湿产品进行为期28天的护理后,特应性皮炎试验者的瘙痒问题显著改善。
皮肤泛红等炎症反应也在特应性皮炎发展起到关键作用[15]。这是由于特应性皮炎干痒引起的反复搔抓,是导致皮肤炎症加重和持续的重要原因之一。具体来说,搔抓刺激角质形成细胞产生炎症介质,进一步导致自身抗原的释放,并产生针对自身抗原的IgE[16]。我们的研究结果表明,使用含有神经酰胺的保湿产品进行为期28天的护理后,特应性皮炎试验者的炎性反应、红斑/泛红等问题显著改善。这是因为产品里面的神经酰胺不仅能修护皮肤屏障,还可以减少炎症相关酶和细胞因子的表达,从而发挥抗炎舒缓作用[17, 18]。但本次研究尚存不足之处,未对相关的皮肤生理参数和皮肤物质进行测量,如皮肤水含量、经表皮失水率(TEWL) 和皮肤脂质代谢的变化,未来可以结合非侵入性皮肤仪器和皮肤脂质组学,探索神经酰胺应用于特应性皮炎试验者后皮肤整体变化。
综上所述,使用神经酰胺保湿霜对特应性皮炎患者进行基础护理后,试验者不适明显减轻,生活质量得到提升。另外,值得注意的是,本产品只是作为基础辅助护理皮肤,不能替代药品治疗。
作者介绍
杨佳鸿、宋纬娜、陈 星、郑一诫、艾云飞:供职于欧莱雅(中国)有限公司皮肤科学美容事业部
[ 参考文献]
[1] 舒虹, 吴盼倩. 特应性皮炎流行病学及疾病负担研究进展[J].《中国实用儿科》, 2023;38(700-704).
[2] Tsakok T, Woolf R, Smith CH, Weidinger S, Flohr C. Atopic dermatitis: .the skin barrier and beyond. British Journal of Dermatology2019;180(3):464-474.
[3] 中华医学会皮肤性病学分会免疫学组, 特应性皮炎协作研究中心. 中国特应性皮炎诊疗指南(2020 版). 中华皮肤科杂志 2020;053(002):81-88.
[4] Cha HJ, He C, Zhao H, Dong Y, An I, An S. Intercellular and intracellular functions of ceramides and their metabolites in skin.International journal of molecular medicine 2016;38(1):16-22.
[5] Kim BE, Leung DY. Significance of skin barrier dysfunction in atopic dermatitis. Allergy, asthma \& immunology research 2018;10(3):207-215.[6] Luger T, Amagai M, Dreno B, et al. Atopic dermatitis: Role of the skin barrier, environment, microbiome, and therapeutic agents. Journal of dermatological science 2021;102(3):142-157.
[7] Mizutani Y, Mitsutake S, Tsuji K, Kihara A, Igarashi Y. Ceramide biosynthesis in keratinocyte and its role in skin function. Biochimie 2009;91(6):784-790.
[8] Narangifard A, den Hollander L, Wennberg CL, et al. Human skin barrier formation takes place via a cubic to lamellar lipid phase transition as analyzed by cryo-electron microscopy and EM-simulation.Experimental cell research 2018;366(2):139-151.
[9] Bouwstra JA, Gooris GS, Dubbelaar FE, Ponec M. Phase behavior of stratum corneum lipid mixtures based on human ceramides: the role of natural and synthetic ceramide 1. Journal of investigative dermatology 2002;118(4):606-617.
[10] Fujii M. The pathogenic and therapeutic implications of ceramide abnormalities in atopic dermatitis. Cells 2021;10(9):2386.
[11] Descamps F, Brouta F, Monod M, et al. Lamellar lipid organization and ceramide composition in the stratum corneum of patients with atopic eczema. J Eur Acad Dermatol Venereol 2011;18:13-26.
[12] Berkers T, Visscher D, Gooris GS, Bouwstra JA. Topically applied ceramides interact with the stratum corneum lipid matrix in compromised ex vivo skin. Pharmaceutical research 2018;35:1-13.
[13] Huang H, Chang T. Ceramide 1 and ceramide 3 act synergistically on skin hydration and the transepidermal water loss of sodium lauryl sulfate-irritated skin. International journal of dermatology2008;47(8):812-819.
[14] Yosipovitch G, Misery L, Proksch E, Metz M, St A Nder S, Schmelz M. Skin barrier damage and itch: review of mechanisms, topical management and future directions. Acta dermato-venereologica2019;99(13):1201-1209.
[15] Hoffmann K, Dirschka T, Schwarze H, et al. Non-invasive evaluation of inflammation in atopic dermatitis. Journal of the European Academy of Dermatology and Venereology 1994;3(3):347-353.
[16] Su H, Luo Y, Sun J, et al. Transglutaminase 3 promotes skin inflammation in atopic dermatitis by activating monocyte-derived dendritic cells via DC-SIGN. Journal of Investigative Dermatology2020;140(2):370-379.
[17] Song M, Kim S, Yun HS, Kwon S. Anti-inflammatory effect of the ceramide mixture extracted from genetically modified Saccharomyces cerevisiae. Biotechnology and Bioprocess Engineering 2017;22:653-658.
[18] Carneiro R, Salgado A, Raposo S, et al. Topical emulsions containing ceramides: Effects on the skin barrier function and antiinflammatory properties. European Journal of Lipid Science and Technology 2011;113(8):961-966.

