还原型谷胱甘肽皮肤渗透性研究
本文以评估还原型谷胱甘肽(Reduced glutathione, GSH)在猪皮肤表面和真皮层的驻留量为目的,以巴马小型猪离体皮肤作为皮肤模型材料,并应用Franz扩散池和HPLC法分别测定两种制剂(QRMT和D-5X)中GSH在不同时间点的皮肤表面和真皮层中驻留量。结果显示, QRMT中的GSH释放到皮肤表面的速度更快。在1小时和2小时的时间点,QRMT中的GSH驻留量分别是D-5X中的5.5倍和3.4倍。同样地,QRMT中的GSH也更快地渗透进入皮肤真皮层。在1小时和2小时的时间点,QRMT中的GSH在猪皮肤真皮层中的驻留量分别是D-5X中的25.1倍和21.8倍。这些研究结果为QRMT中的GSH在皮肤表面和真皮层中发挥功效提供了更充分的化学基础。结论表明,QRMT中的GSH释放和渗透进入真皮层的速度更快,且在皮肤表面和皮肤真皮层中的驻留量都显著高于D-5X中的GSH驻留量。
关键词:还原型谷胱甘肽;巴马小型猪皮肤模型; 皮肤表面驻留量;皮肤真皮层中驻留量
近年来,随着人们对健康和美丽的追求,皮肤护理研究越来越受到关注。在众多的皮肤护理成分中,还原型谷胱甘肽(Reduced glutathione,GSH)因其独特的抗氧化、抗衰老和皮肤修复功效而备受关注。GSH是一种天然存在于人体内的三肽,由谷氨酸、半胱氨酸和甘氨酸组成[1]。GSH具有较强的抗氧化作用,能够清除体内的自由基,防止自由基对皮肤细胞的损伤。此外,还原型谷胱甘肽还具有抗衰老、抗炎和促进皮肤修复的作用。研究表明,还原型谷胱甘肽能够抑制胶原蛋白的降解,促进胶原蛋白的合成,从而延缓皮肤老化[1-3]。
功效成分在产品中的释放量,及其在皮肤的驻留剂量是其发挥功效作用的关键[4,5]。保湿和美白等化妆品功效成分的开发与应用,需要建立在透皮吸收的基础上。例如,防晒产品中的紫外线吸收剂的更多剂量应能驻留在皮肤表面,以执行吸收和反射紫外线的功能;美白产品中的活性美白成分应能靶向皮肤的基底层,以干预和阻断黑色素的形成过程;而抗衰老产品的有效成分通常应作用于真皮层的成纤维细胞,从而促进皮肤弹性和紧致度的提升。因此,化妆品活性成分是否能在皮肤的不同部位达到足够的驻留量对其能否发挥功效是有显著影响的。
本研究建立了测定GSH含量测定分析方法,并采用巴马小型猪皮肤模型,测定不同时间点的GSH在单位皮肤表面驻留量和皮肤真皮层中驻留量,并且比较了两个含有GSH供试样品在不同时间点单位皮肤表面和皮肤真皮层中驻留量。此研究所建立的猪皮肤模型能为评估皮肤美容功效产品提供重要的实验方法。
Part 1
仪器与材料
1.仪器
BSA323S电子天平(精度0.001g,德国赛多利斯公司);PR224ZHE型电子天平(精度0.0001g,沙鹰科学仪器有限公司);LC-2030C型高效液相色谱仪(日本岛津公司);UV-2600型紫外检测器(日本岛津公司);TT-B(D)型Franz透皮试验仪(天津市正通科技有限公司);800D-1型离心机(常州天瑞仪器有限公司);F6/10型电动均浆机(上海净信实业发展有限公司)。
2.材料
谷胱甘肽闪释膜片(QRMT, 规格130mg,批号HLG2405,常州伟博海泰化妆品有限公司研制);LYUH ESTHER SALMON DNA DIRECT 5X (D-5X,规格326mg, 批号YGY 13028, 韩国BIO 360生产);谷胱甘肽标准品(纯度:98%,阿拉丁生化科技股份有限公司); Luna C18色谱柱(Phenomenex公司);FiveEasy Plus型pH计(梅特勒—托利多仪器有限公司);BIO-DL型移液枪(赛多利斯公司);滤膜(0.22 μm,天津津腾公4579da2f0b67ce21d849af674d7e19fd司);色谱纯乙腈(Fisher 公司);5,5′—二硫双-2—硝基苯甲酸(DTNB,批号 E1922062,阿拉丁生化科技股份有限公司);试剂实验用水为超纯水(杭州娃哈哈集团有限公司);生理盐水,磷酸二氢钾,磷酸为分析纯(北京化工集团股份有限公司)。
3.动物
巴马小型猪【合格证号:SCXK (苏) 2022-0013,泰州泰和生物科技有限公司,雄性,日龄30,体重2.5-3.5 kg】。
Part 2
方法与结果
1.GSH含量测定与方法学验证
(1)柱前衍生化:GSH化学结构中的巯基与DTNB试剂化学反应,生成的衍生物在pH值偏酸性流动相中,有明显的紫外线吸收。
(2)色谱条件:色谱柱为C18 (4.6 mm150 mm,3.0 μm);流动相A为乙腈, 流动相B为0.025%磷酸水(pH3.8),梯度洗脱程序:0~3 min, 12% A; 3~4.5 min, 12%~18% A;4.5~15 min, 18%~40%A;流速 0.8 mL/min;柱温 40℃,检测波长 330 nm;进样量 20 μL。
(3)对照品溶液制备:精密称取GSH对照品约10 mg,加入生理盐水溶液溶解并定容于10 ml量瓶中,摇匀,即得浓度约为1.0 mg·mL-1的混合对照品储备溶液,备用。
(4)线性关系考察:用移液枪分别量取对照品溶液不同体积,再加入生理盐水溶液进行稀释,摇匀,配制成质量浓度分别为100、50、10、5、1.0、0.10 μg·mL-1的系列对照品溶液。分别吸取上述各浓度对照品溶液各1mL,加入100 g·mL-1 DTNB 溶液1 mL,涡旋3 min,取20 L依次注入液相色谱仪,按上述色谱条件测定,以对照品浓度为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,得GSH回归方程为Y=1.66E+04X+7.57E+03,r=0.9998。结果表明,GSH的线性浓度分别为0.103—102.68 μg·mL-1。
(5)精密度试验:取对照品(约1.0 μg·mL-1)溶液 20 μL,分别于同1 d之内连续进样测定6次,并在6 d 之内连续进样测定,记录峰面积。结果显示3个对照品溶液日内精密度RSD分别为2.68%、1.93%、1.31%,日间精密度RSD分别为2.12%、2.38%、18.7%。
(6)稳定性试验:精密量取供试品溶液(QRMT离体猪皮肤透皮试验中制备的猪皮肤表面和真皮层样品) 0.5 mL,各加入100 g·mL-1 DTNB 溶液0.5 mL,涡旋反应3 min,0.22 m微孔滤膜过滤,续滤液分别于0h、1h、2h、4h、8h、24h测定峰面积,结果显示峰面积RSD分别为1.38%和1.62%,表明供试品溶液在室温条件下24 h内稳定性良好。
(7)回收率试验:将剪碎的猪皮肤中加入GSH对照品溶液(100 μg·mL-1) 1.0 mL,再加入生理盐水超声,提取2次,每次5.0 mL水,合并提取液。取0.25 mL,按1:1比例分别加入对照品溶液0.25 mL,加入100 g·mL-1 DTNB 溶液0.5 mL,涡旋反应3 min,12000转离心10 min, 上清液0.22 μm滤膜过滤。每个样品平行制备3份供试品,按“2.1.2”项下色谱条件测定,计算回收率。GSH平均回收率范围为97.2%—103.6%,平均RSD值为2.81%。
(8)专属性试验:取供试品溶液,对照品溶液、阴性样品(猪皮提取液),按“2.1.2”项下色谱条件检测,记录色谱图。对照品峰形良好,供试品与对照品在相应位置上存在相同峰,且阴性样品溶液对测定结果不产生干扰。
2.离体猪皮透皮试验
(1)离体猪皮制备:巴马小型猪处死后立即剪取腹部皮肤,剥离皮下脂肪和结缔组织,用95%酒精棉球反复擦试皮肤表面,再用生理盐水冲冼干净,滤纸吸干水分,备用。
(2)透皮试验:参考文献方法[6,7],应用Franz透皮试验仪进行透皮试验,将猪皮肤置于接收池顶面,皮肤角质层向上与供给池接触,真皮层与透皮接受液接触。透皮接收液为生理盐水5 mL。样品(约含谷胱甘肽10 mg)直接加入至透皮供给池内(生理盐水溶液)。扩散池水浴温度37±0.5°C,搅拌速度450 r·min-1,取样时间点1 h、2 h、4 h、6 h、8 h、12 h。皮肤表面样品:用3只棉球分别擦试干净皮肤表面残留物,再用生理盐水溶液冲洗皮肤表面3次,每次1 mL,然后将这些棉球放在生理盐水中超声提取,冷却置室温,定容置5 mL。为了减少实验误差对结果的影响,每个时间点平行6份。真皮层样品制备:用棉球擦试干净皮肤表面的残留物,然后胶带粘贴法粘贴表皮20次,将皮肤角质层粘下。然后将处理后剩余皮肤剪碎,在匀浆机内加入5 mL生理盐水溶液进行匀浆处理,离心,取上清液,0.22 m微孔滤膜过滤。所有样品均取 0.5 mL, 加入100 g·mL-1 DTNB 溶液0.5 mL,涡旋反应3 min,0.22 μm微孔滤膜过滤后进针HPLC分析。
(3)数据分析:单位面积皮肤上GSH在皮肤表面驻留量和皮肤内驻留量,按如下公式(1)计算:
Qr = C1×V1/S(1)
式中Qr (μg·cm-2)代表GSH在某个时间点的单位面积皮肤内驻留量;Ci (μg·mL-1)代表在GSH浓度;Vi (mL)代表提取溶液体积(5.0 mL);S (cm2)代表扩散池暴露离体皮面积(0.71 cm2)。
3. 猪皮肤模型中GSH在皮肤表面和真皮层中驻留量
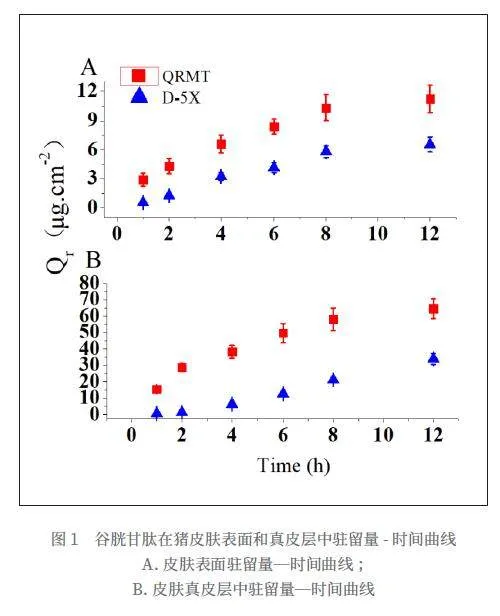
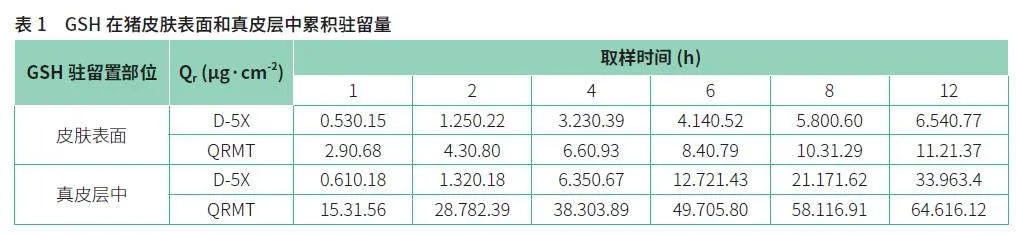
图1显示了QRMT和D-5X中GSH在猪皮肤模型中皮肤表面驻留量—累积时间曲线。相比较于D-5X,QRMT中GSH释放皮肤表面速度更快,尤其是在1 h和2 h,Qr分别为5.5 倍和3.4倍(如表1所示)。如图1B所示,QRMT中GSH可以更容易和更快速渗透进入皮肤真皮层。相反,D-5X中GSH在猪皮肤真皮层中驻留量相对较低。尤其是在1 h,2 h和12 h,QRMT中GSH在猪皮肤真皮层中驻留量分别是D-5X中GSH的25.1, 21.8和 1.9倍(如表1所示)。此外,QRMT中GSH在皮肤真皮层中的驻留量显著高于皮肤表面驻留量,2小时后,真皮层中的驻留量约是皮肤表面驻留量的6.7倍(如表1所示)。
Part 3
讨论
本研究通过建立一种猪皮肤模型评估方法,对GSH在皮肤表面和皮肤真皮层中的驻留行为进行了研究。通过柱前衍生化方法[8],我们成功测定了GSH在不同时间点单位皮肤表面驻留量和皮肤真皮层中驻留量,为理解GSH在发挥皮肤美容功效中的作用提供了重要的实验数据。
研究发现,QRMT中GSH在猪皮肤模型中的释放和驻留行为表现出了显著的时间依赖性。在皮肤表面,GSH的释放速度较快,8h内即可达到相对稳定的表面驻留量。这表明GSH成分可能迅速作用于皮肤表层,提供即时的抗氧化和护肤效果。此外,QRMT 中GSH 在皮肤真皮层中的驻留量显著高于皮肤表面驻留量,2h 后,真皮层中的驻留量约是皮肤表面驻留量的21.8 倍,这表示GSH 在更深层皮肤中的渗透速率和美白功效将达到更好的效果。这些结果对于皮肤护理产品的开发具有重要意义。QRMT 中GSH 的快速表面和真皮层中驻留可能使其成为理想的即时护肤成分。此外,12h 后, QRMT 中GSH 在皮肤表面和真皮层中具有较大驻留量,这可以增强GSH 在皮肤表层和深层皮肤中的功效的持久性。此外,研究还揭示了GSH 在不同皮肤层中的不同驻留行为,这为设计针对不同皮肤问题的护肤产品提供了科学依据。
尽管本研究取得了重要发现,但仍有一些局限性需要考虑。首先,本研究使用的猪皮肤模型与人类皮肤存在一定差异,尽管在很多研究中公认猪皮肤是与人类的皮肤生理结构最为接近的[9,10],但也不能完成等同。因此,研究结果向人类皮肤的推广需要注意不同皮肤之间的差异性。其次,研究仅评估了GSH 在短期内的驻留行为,长期效果尚未明确。
GSH 对皮肤有多种攻效,为了实现这些功效,需要GSH 在皮肤表面和皮肤真皮层均有足够的驻留量,并且要能在皮肤内部持续足够长的时间。目前的多数文献研究主要是测定药物在皮下接收液中透过量[11-13],较少的研究同时测定皮肤中皮肤表面和皮肤真皮层中驻留量[14,15]。本研究以巴马小香猪皮肤作为皮肤模型,同时测定GSH 在皮肤表面和皮肤真皮层中驻留量。该研究为开发能充分利用GSH 护肤功效的化妆品提供了一种新的研究途径。
作者介绍
李和伟:博士,高级工程师,主要研究方向:化妆品和生物医药研究,
供职于常州伟博海泰化妆品有限公司
代 颖、魏国志:供职于常州伟博海泰化妆品有限公司
[ 参考文献]
[1] 黄佳, 鲁朝刚, 罗琳娜, 等. 活性肽在护肤品中的应用研究进展[J]. 日用化学品科学,2023,46(06):52-58.
[2] Weschawalit S, Thongthip S, Phutrakool P, et al. Glutathione and its antiaging and antimelanogenic effects[J]. Clin Cosmet Investig Dermatol, 2017, 10: 147-153.
[3] Dilokthornsakul W, Dhippayom T, Dilokthornsakul P. The clinical effect of glutathione on skin color and other related skin conditions:a systematic review[J]. J Cosmet Dermatol, 2019, 18(3): 728-737.
[4] 李和伟, 魏国志, 许飞飞. 多层非均相制剂技术制备固态花青素面膜及其稳定性评价[J]. 中国美容医学,2023,32(11):76-81.
[5] 李和伟, 魏国志, 许飞飞. 固体面膜中花青素皮肤渗透性评价[J]. 中国化妆品,2023(04):84-88.
[6] 杨雅丽, 童想柳, 林国钡, 等. 地佐辛外用制剂的体外透皮特性比较[J].中国医药工业杂志, 2019, 50(12):1463-1467.
[7] Kichou H,Dancik Y,Eklouh-Molinier C,et al. Highlighting the efficiency of ultrasound-based emulsifier-free emulsions to penetrate reconstructed human skin [J]. Int J Cosmetic Sci,2022,44:262-270.
[8] 胡北, 张小勇, 沈丽, 等. 柱前衍生化HPLC 法测定蚯蚓中还原型谷胱甘肽(GSH) 和半胱氨酸(CySH)[J]. 化学试剂,2014,36(06):537-540.
[9] Pavlačková J, Egner P, Polašková J, et al. Transdermal absorption of active substances from cosmetic vehicles[J]. Journal of Cosmetic Dermatology, 2019, 18(5): 1410-1415.
[10] 魏国志, 许飞飞, 李和伟. 不同来源猪皮与重建人类表皮模型对面膜中咖啡因透过性比较研究[J]. 中南药学,2023,21(08):2095-2100.
[11] Davies DJ, Heylings JR, Gayes H, et al. Further development of an in vitro model for studying the penetration of chemicals through compromised skin[J]. Toxicol In Vitro, 2017, 38: 101-107.
[12] 李花花, 杨畅, 杨艳玲等. 活血止痛凝胶贴膏与微乳凝胶剂的体内外渗透性比较研究[J]. 中国中药杂志,2022,47(07):1857-1863.
[13] 张金伟, 李翰铭, 尹虹等. 肉豆蔻酸单萜醇酯对布南色林经皮透过的影响[J]. 化学通报,2022,85(07):853-859.
[14] 肖伟莉, 王雪梅, 闫广义, 等.3 种水溶性美白剂的渗透性研究[J]. 安徽大学学报( 自然科学版),2018,42(04):75-81.
[15] 唐泽严, 郭学平, 温喜明, 等. 不同相对分子质量透明质酸对还原型谷胱甘肽透皮吸收的影响[J]. 中国药科大学学报,2021,52(02):203-210.

