解密晋祠千年铁人不腐之谜





【教学目标】
1.了解金属发生电化学腐蚀的本质,知道金属腐蚀的危害,了解防止金属腐蚀的措施。
2.能利用电化学原理解释金属腐蚀现象,选择并设计防腐措施。
【学情分析】
1.知识:初中化学了解了关于物质与氧气发生化学反应的特点,谈到金属腐蚀的条件,高一必修谈到原电池工作的原理,到现在涉及的电化学基础知识,这些呈现螺旋式上升的化学知识,有利于学生构建系统的知识网络。
2.能力:学生已经具备一定的实验设计观察能力和归纳能力,学生对金属腐蚀的理解程度存在差异,教师要针对学生的实际情况进行教学,帮助学生建立正确的金属腐蚀观念。
3.心理:强烈的好奇心和求知欲,有利于学生学习新知识,具备了主动探究的原动力;存在的问题是学生注重表面现象,缺少生活经验,缺乏一定的深入理解能力和综合思维能力。
【教学目标】
(一)知识目标
1.理解和掌握金属腐蚀的基本原理,包括电化学腐蚀过程和影响因素,如湿度、温度、电解质溶液等。
2.应用所学的金属腐蚀知识,对实际金属腐蚀问题进行分析和解决。
3.能够根据不同金属和环境选择适当的防护方法,如涂层、干燥、阴极保护等,并能够正确操作金属防护实验。
(二)素养目标
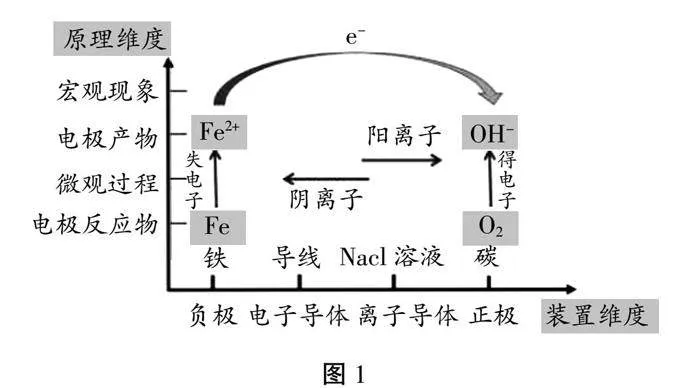
1.宏观辨识与微观探析:引导学生从氧化还原反应的宏观现象探究金属腐蚀的本质是微观世界金属失去电子变成金属阳离子的过程。
2.证据推理与模型认知:以“晋祠铁人千年不腐”和课本实验为依据推理金属腐蚀的本质,构建金属防腐的基本措施。
3.科学探究与创新意识:通过课本知识的学习,课后搜集资料进一步完善防腐的新技术、新方法,并从本质上创新防腐新方法。
4.科学精神与社会责任:通过探究“晋祠铁人千年不腐”“太原市输暖管道的防腐措施”的原因以及观看“沧州铁狮子腐蚀”的惨痛教训,进一步培养学生的环保意识,唤醒当代青年重视环保的社会意识。
【教学重难点】
教学重点:运用二维模型认知金属电化学腐蚀的原理以及金属电化学防腐的方法。
教学难点:能够利用电化学腐蚀的模型解释生产、生活中的某些金属腐蚀现象,能够理解一些先进的防腐措施。
【教学过程】
【情境引课】视频介绍“晋祠铁人千年不腐”。
【过渡】宋代铁人千年不腐,它是如何防腐防锈的呢?解决问题之前,我们先要探究金属腐蚀的本质原因。
目标一:探究金属腐蚀的本质和分类
任务一:用已有知识解释铁器文物是如何被腐蚀
【展示实验】学生认真阅读教材第11~12页,认真观察图4-19、4-20,教师展示课本实验4-3,学生认真观察,小组讨论并回答下列问题。
【问题1-1】在初中化学的学习中我们做过铁钉腐蚀的实验,铁钉什么位置腐蚀最严重?
【活动1-1】学生回答铁钉腐蚀最严重的位置是与空气、水接触的地方。
【问题1-2】我们知道铁锈的主要成分是Fe2O3,请你从氧化还原的角度考虑铁钉生锈还需要什么物质的参与?如何来证明?
【活动1-2】小组讨论,给出方案一:测定压强的变化。方案二:测定氧气的含量。
【问题2】铁钉在腐蚀过程中发生的化学反应是什么?如何进行验证?
【活动2】根据资料卡片利用铁氰化钾对铁钉腐蚀的生成物进行检验。
【过渡】实验使用的铁钉是用NaCl溶液浸泡过一段时间的。为什么浸泡在海水中的钢铁制品更容易腐蚀呢?腐蚀过程中发生了氧化还原反应,NaCl溶液又是电解质溶液,这里是否符合原电池的构成条件,形成电流了呢?
【问题3】请大家利用原电池的二维模型分析、判断你的猜想。
【活动3】学生分组讨论,利用原电池的二维认知模型分析铁钉腐蚀过程中的四个要素及半极反应。
【归纳展示】
【板书】金属的腐蚀:
1.定义:金属的腐蚀是指金属或合金与接触的气体或液体发生氧化还原反应而腐蚀损耗的过程。
2.本质:M-ne-=Mn+金属失去电子被氧化变成金属阳离子。
【过渡】铁钉中含有的杂质碳可以作为正极材料,这样的金属与电解质溶液接触,会在杂质附近形成许多微小的原电池。
任务二:探究金属腐蚀的类别
【问题4】理论上,我们在二维模型上构建了铁钉腐蚀的原电池模型;实际上,大家能否将“铁钉腐蚀过程中形成了原电池”这一猜想进行实验验证呢?
【活动4】学生在学案上设计铁钉腐蚀的原电池图形,并书写半极反应和总反应方程式。
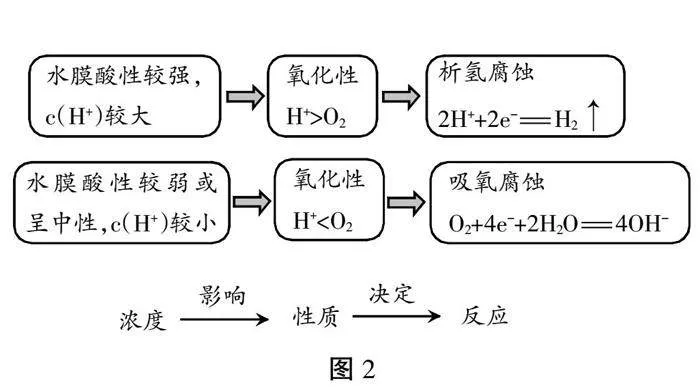
【拓展】酸雨会加速金属的腐蚀,那pH值的变化对金属的腐蚀有什么影响呢?化学兴趣小组的学生通过压强传感器可以测出随着pH值的降低,体系压强增大。经分析在这个过程中H+代替氧气得到电子,生成H2。
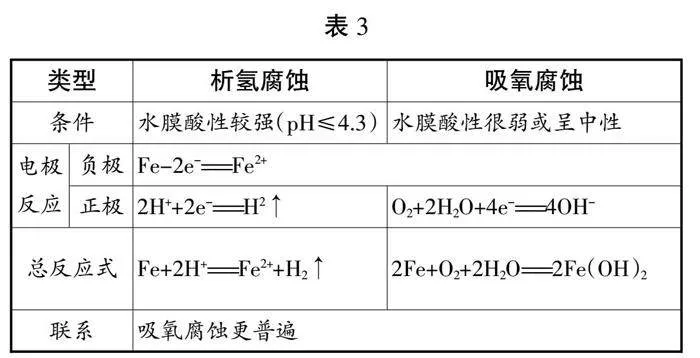
【问题5】请大家根据以上探究,对析氢腐蚀和吸氧腐蚀进行总结。
【学生总结、归纳并板书】
1.化学腐蚀:金属与接触到的干燥气体(如O2、Cl2、SO2等)或非电解质液体(如石油)等直接发生化学反应而引起的腐蚀。
2.电化学腐蚀:不纯的金属与电解质溶液接触时,会形成原电池,其中比较活泼的金属作为负极,失去电子而发生氧化还原反应。
3.电化学腐蚀的分类:
(1)吸氧腐蚀
负极Fe:Fe-2e-=Fe2+
正极C:O2+2H2O+4e-=4OH-
总反应:2Fe+O2+2H2O=2Fe(OH)2
铁锈的生成:4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe(OH)3=Fe2O3·xH2O+(3-x)H2O
(2)析氢腐蚀:金属处在软性较强的环境
负极Fe:Fe-2e-=Fe2+
正极C:2H++2e-=H2↑
总反应:Fe+2H+=Fe2++H2↑
任务三:猜测铁器文物发生了哪种电化学腐蚀
猜测1:发生了吸氧腐蚀,O2得电子生成OH-,Fe失电子成为Fe2+,两者结合生成Fe(OH)2。
猜测2:发生了析氢腐蚀,水中H+得电子生成 H2,Fe失电子成为Fe2+,Fe2+与水中的OH-结合生成Fe(OH)2。
【活动5】学生讨论得出(见图2)。
【板书】日常环境中,铁质文物表面水膜酸性较弱,主要发生吸氧腐蚀。
目标二:探究金属的防护方法和措施
任务四:解密“晋祠铁人千年不腐”之谜
【提示】从金属腐蚀的本质出发,思考防腐的措施。
金属防护的本质:阻止 M-ne-=Mn+的发生
思考角度切断原电池反应改变金属材料组成在金属表面履盖保护层给予电子
【再次观看视频】“晋祠铁人千年不腐”之谜
【注意】1.“分节叠铸法”(切断原电池)
2.“含有镍铬等成分”(合金,改变金属结构)
【归纳总结】化学防腐法
1.切断原电池(如“分节叠铸法”)
2.改变金属结构(如制成合金等)
3.增加保护层(如刷漆、电镀等)
【过渡】以上方法都是从切断原电池角度有效地减缓了钢铁的腐蚀,钢铁腐蚀的本质是铁单质失去电子做还原剂被氧化的过程,如果我给钢铁连接一个比铁还原性更强的金属会有什么样的效果呢?
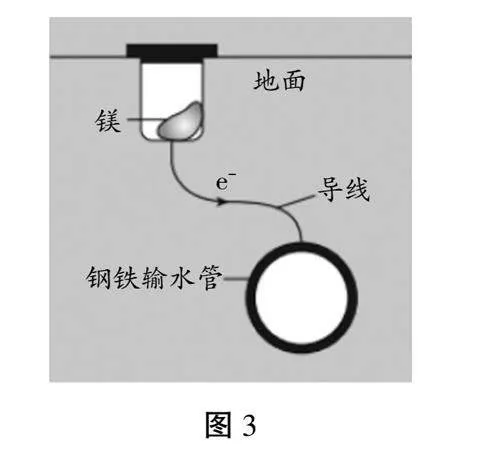
任务五:太原市输暖管道的防腐技术分析
【观看视频】冬季太原市取暖公司工作人员给地下管道换镁块的过程(见图3)。
【金属的电化学防护】
教师讲解电化学防腐(参考教材图4-24)。
(一)牺牲阳极法
1.原电池原理:正极:被保护金属→不发生反应;负极:活泼金属→需要定期更换。
2.应用:该法主要用来保护一些钢铁设备,如在锅炉内壁、船体外壳上装上镁合金或锌块。
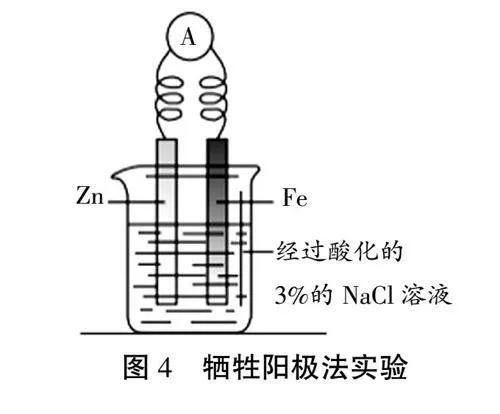
【自主学习】阅读教材第EpTFOC37YasrDuTRHoA18Q==110页,实验4-4,按照图4安装仪器。
【问题1】以Fe作保护电极,以Zn作辅助电极,以经过酸化的3%的NaC1溶液作电解质溶液,观察电流表指针的变化,以及烧杯中两个电极附近发生的现象。(投屏见表1)
【问题2】过一段时间,用胶头滴管从Fe电极区域取少量溶液滴入试管中,再向试管中滴入2滴K3[Fe(CN)6](铁氰化钾)溶液,观察试管中溶液颜色的变化。
【总结】Fe2+的检验:Fe2+与K3[Fe(CN)6]溶液(黄色)反应生成KFe[Fe(CN)6]沉淀(带有特征蓝色)。这是检验溶液中Fe2+的常用方法。
结论:Fe、Zn和经过酸化的NaCl溶液构成原电池;该装置中铁未被腐蚀。
【实验2】实验过程:将1g琼脂加入250 mL烧杯中,再加入50 mL饱和食盐水和150 mL水。搅拌、加热煮沸,使琼脂溶解。稍冷后,趁热把琼脂溶液分别倒入两个培养皿中。
现象:靠近锌皮处颜色无变化,靠近裸露在外的铁钉处出现红色。
原因:构成原电池反应,Zn作阳极(负极),铁作阴极(正极),锌被腐蚀,铁被保护。
现象:靠近铜丝处出现红色,靠近裸露在外的铁钉处出现蓝色。
原因:构成原电池反应,铁作阳极(负极),铜作阴极(正极),铁被腐蚀,阳极上发生Fe-2e-=Fe2+,Fe2+与K3[Fe(CN)6]溶液反应生成KFe[Fe(CN)6]蓝色沉淀。
【总结】牺牲阳极保护法本质是:被保护金属连接一种更活泼的金属,构成原电池,让活泼金属作负极(阳极),保护不活泼金属,记忆:“找替罪阳”。
【过渡】金属的电化学防腐本质是:阻止金属失去电子变成阳离子而被腐蚀,除了原电池的牺牲阳极保护法,根据生活经验和现有知识,还有什么方法可以防止金属失去电子而被腐蚀呢?
(二)外加电流法
【问题1】请同学们回忆“电解法精炼铜”的原理,如果将被保护的金属与电源的负极相连,作电解池的阴极,金属还会因为失去电子而腐蚀吗?
【学生1】不会,金属被保护了。
【自主学习】阅读教材第115页,观察图4-28,并小组合作总结“外加电流法”。
【学生2】原理:被保护金属与外接电源负极相连作电解池的阴极。
【归纳总结】具体方法:外加电流法是把被保护的钢铁设备作为阴极,用惰性电极作为辅助阳极,两者均放在电解质溶液(如海水)里,外接直流电源。通电后,调整外加电压,强制电子流向被保护的钢铁设备,使钢铁表面腐蚀电流降至零或接近零。在这个系统中,钢铁设备被迫成为阴极而受到保护。
任务六:课堂总结
1.化学腐蚀和电化学腐蚀的比较(见表2)
2.析氢腐蚀和吸氧腐蚀的比较(见表3)
(三)金属的防护
1.阻断原电池的形成
(1)改变金属材料的组成,制成合金、分叠铸造法等。
(2)在金属表面覆盖保护层。
2.电化学防护
(1)牺牲阳极法。
(2)外加电源保护法。
【教学反思】
本节课以情境教学的方式,将知识建构、深化模型、实验探究相结合。教学过程沿着问题解决和素养形成的设计思路全面展开;教学环节由宏观现象的感知发展到微观原理的分析,逐步落实核心素养。立足生产生活实际,以解决实际问题“解密晋祠铁人千年不腐之谜”为主线,从金属腐蚀原理的能量变化与物质变化两个角度不断深化金属电化学腐蚀的模型,培养学生形成二维认识化学反应的思维模式。
需要改进之处:(1)实验设计还需要进一步改进,尽可能更直观、快速地看到实验现象。(2)由于实验条件对学生现有能力的限制,还可以通过计算O2的消耗量或者曲线的拟合公示,或者残余物中铁、氧化铁含量的测定等方法,进一步对比金属防腐措施的优劣。(3)课堂上评价方式应该更多样化。
(作者单位:1.太原师范学院附属中学;2.太原市第十一中学校;3.太原市晋源区实验中学校;4.太原市第三十七中学校)
编辑:赵文静

