荚膜B型多杀性巴氏杆菌外膜囊泡生物学特性分析与免疫效果评价




摘 要: 旨在探究荚膜B型多杀性巴氏杆菌外膜囊泡(outer membrane vesicles, OMVs)的生物学特性及免疫保护效果。本研究利用超高速离心和密度梯度离心方法提取荚膜B型多杀性巴氏杆菌的OMVs,通过透射电子显微镜(transmission electron microscope, TEM)观察OMVs的形态及大小,采用SDS-PAGE、LC-MS/MS分析OMVs主要蛋白,以蛋白定量试剂测定其蛋白浓度以及鲎试剂法测定其内毒素含量,然后以新西兰白兔为动物模型,开展免疫保护效果评价。结果显示,荚膜B型多杀性巴氏杆菌的OMVs呈完整规则的球形结构,平均粒径108.3 nm,其中的蛋白质主要集中在33、40、53 ku处,内毒素含量为3.31×106 EU·mL-1,用制备的OMVs以50 μg·只-1免疫新西兰白兔2次后,免疫兔血清抗体效价可达1∶405 600,外周血淋巴细胞IFN-γ和IL-4转录水平明显升高,对荚膜B型多杀性巴氏杆菌攻击的保护效率为75%。综上表明,荚膜B型多杀性巴氏杆菌的外膜囊泡具有良好的免疫保护效果,有作为候选疫苗的潜质,本研究为外膜囊泡疫苗的研究奠定了基础。
关键词: 多杀性巴氏杆菌;外膜囊泡;生物学特性;疫苗
中图分类号:S852.612
文献标志码:A""" 文章编号:0366-6964(2024)05-2168-08
收稿日期:2023-08-03
基金项目:国家重点研发计划(2021YFD1800300)
作者简介:高 洁(1997-),女,内蒙古乌兰察布人,硕士,主要从事动物疫病防控研究, E-mail: gj821196400@163.com
*通信作者:张 慧,主要从事重大动物疫病防控技术研究,E-mail: zhanghui@cahec.cn;穆 杨,主要从事动物疫病病原感染与致病机制和疾病诊断与病原检测新技术研究,E-mail: muyang@nwafu.edu.cn
Biological Characteristics and Immune Effect Evaluation of Outer Membrane Vesicles of
Capsular Type B Pasteurella multocida
GAO" Jie1, LI" Xiaocheng2, MU" Yang1*, ZHANG" Hui2*, WEI" Rong2, LI" Jie3
(1.Department of Preventive Veterinary Medicine, College of Veterinary Medicine,
Northwest Aamp;F University, Yangling 712100," China;
2.China Animal Health and Epidemiology Center, Qingdao 266032," China;
3.The Spirit Jinyu Biological Pharmaceutical Co., Ltd, Huhhot 010111," China)
Abstract: In order to explore the biological characteristics and immune effect of outer membrane vesicles (OMVs) of capsular type B Pasteurella multocida. Outer membrane vesicles were extracted by ultra-high speed and density gradient centrifuge methods. The shape and size of the outer membrane vesicles were observed by transmission electron microscope (TEM), the proteins of OMVs were analyzed by SDS-PAGE and LC-MS/MS, the protein concentration was determined by the BCA method, and the endotoxin content was determined by limulus lysate test. Antibody titers and immune protection test were proceeded in New Zealand white rabbits. The results showed that OMVs had a regular spherical structure, the average particle size was 108.3 nm. OMVs contained a variety of protein bands, the protein bands were mainly 33,40,53 ku. The endotoxin content was 3.31×106 EU·mL-1. The serum antibody titer of immunized New Zealand white rabbits was 1∶405 600 when the injection dose was 50 μg per rabbit. The transcription levels of IFN-γ and IL-4 in peripheral blood lymphocytes increased. The immune protection efficiency against capsular tybe B Pasteurella maltocida was 75%. In conclusion, the OMVs of capsular type B Pasteurella multocida have good immunoprotective effcet and has the potential to be an candidate vaccine. This study lay the foundation for the research of OMVs vaccines.
Key words: Pasteurella multocida; outer membrane vesicles; biological characteristics; vaccine
*Corresponding authors: ZHANG Hui,E-mail: zhanghui@cahec.cn;MU Yang,E-mail:muyang@nwafu.edu.cn
多杀性巴氏杆菌(Pasteurella multocida, Pm)是一种革兰阴性菌,Pm由路易斯·巴斯德于1880年首次从禽霍乱病例中分离获得并以其名字命名[1]。该菌广泛分布于世界各地。在不同种动物间可以相互传染,也可以感染人,人感染Pm大多因动物咬伤所致。Pm能感染家禽、猪、牛、羊等多种动物,其中,牛、羊感染多杀性巴氏杆菌通常表现为出血性败血症,家禽感染可引起禽霍乱,猪感染可引起猪肺疫,成为危害畜牧行业的重要病原之一。
目前,预防由多杀性巴氏杆菌引起的出血性败血症主要依靠灭活疫苗,该疫苗能够对多杀性巴氏杆菌感染产生较好的免疫保护效果,但与此同时与之相对应的副作用也随之产生。首先,高浓度的灭活疫苗带来高含量的细菌内毒素,在注射的同时极易引起免疫牛肌肉抽搐,甚至休克、死亡;其次,灭活疫苗的使用会降低肉类的品质,严重影响其经济价值[2]。至于弱毒疫苗,虽然其在多杀性巴氏杆菌不同血清型之间具有交叉免疫保护作用,但到目前为止,对弱毒疫苗的基础性研究仍处于盲区,人们不能正确划分保护力与毒力之间准确的分界点,弱毒疫苗是否会引起多杀性巴氏杆菌病新的暴发[3-4],至今仍备受质疑。
外膜囊泡(outer membrane vesicles,OMVs)是由细菌外膜衍生而来的球形纳米结构。研究表明,OMVs表面包含LPS、外膜蛋白和受体等,内部含有大量的周质蛋白、酶和核酸等[5-6],可特异性激活宿主免疫系统,同时其表面携带的病原相关分子模式(pathogen-associated molecular patterns,PAMP)成分还可激活机体天然免疫。因此,OMVs是一种很有前景的候选疫苗和佐剂[7-8]。本研究采用超高速离心和密度梯度离心方法提取荚膜B型多杀性巴氏杆菌的外膜囊泡,旨在分析其生物学特性及免疫保护效果,为巴氏杆菌病新型疫苗研发奠定研究基础。
1 材料与方法
1.1 试验动物、菌株与试剂
新西兰白兔购自北京百尔康纳特实验兔繁育生物技术开发有限公司;荚膜B型多杀性巴氏杆菌CVCC 44502株及CVCC 44702株、多杀性巴氏杆菌病灭活疫苗由金宇保灵生物药品有限公司提供;Optiprep密度梯度分离液购自上海山进生物科技有限公司;蛋白定量试剂购自赛默飞世尔科技公司(Thermo Fisher Scientific);内毒素检测试剂购自Genescript公司;TAE溶液和兔外周血单个核细胞分离液试剂盒购自北京索莱宝生物有限公司;山羊抗兔IgG-HRP二抗购自Sigma公司;TSA、TSB培养基购自BD公司。
1.2 外膜囊泡的提取及纯化
将荚膜B群多杀性巴氏杆菌CVCC 44502株在1 L培养基中培养22~24 h到达稳定期。菌液10 000 r·min-1,4 ℃,离心10 min,取上清,0.45 μm滤膜过滤。将过滤得到的无菌液用截留分子量为100 ku的切向流超滤装置浓缩,最终得到200 mL浓缩液;将浓缩液42 000 r·min-1,4℃,离心2 h,弃上清,PBS重悬沉淀,重复超高速离心,用PBS重悬沉淀。此为粗提OMVs。
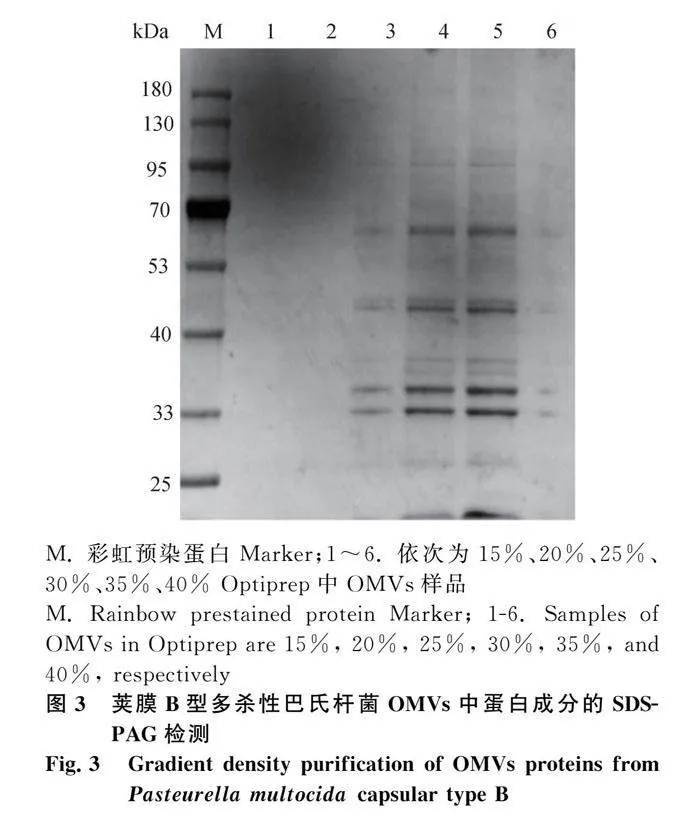
取上述粗提OMVs溶液2 mL置于超高速离心管底部,并将40%、35%、30%、25%、20%、15% Optiprep溶液依次铺管中,35 000 r·min-1,4℃,离心16 h。通过SDS-PAGE确定OMVs所处密度层,收集该层成分,PBS稀释后用100 ku蛋白浓缩管浓缩,0.22 μm滤膜过滤,分装于-80℃保存备用。
1.3 OMVs透射电镜形态学观察及粒径分析
将分散均匀的OMVs溶液适当稀释,取10 μL稀释液滴在铜网上,吸附30 min后,用滤纸吸干;然后滴加10 μL的1%磷钨酸染色3~5 min,滤纸吸干并过夜风干。透射电子显微镜(transmission electron microscope,TEM)观察OMVs的大小及形态。取冻存的OMVs解冻,对样本用PBS进行100倍稀释,直接采用纳米颗粒跟踪分析技术检测分析其粒径大小[9]。
1.4 测定OMVs蛋白浓度
根据蛋白定量试剂说明书,用梯度稀释的蛋白标准品建立蛋白浓度-吸光度标准曲线,取20 μL OMVs样品,加入200 μL BCA工作液,重复3孔。37 ℃孵育30 min,在562 nm波长测定吸光度,并根据标准曲线方程计算OMVs样品的蛋白浓度。
1.5 鲎试剂法检测OMVs的内毒素含量
将内毒素工作标准品进行梯度稀释,并与复溶好的鲎试剂混合,进行标准曲线的绘制,将样品进行107稀释后采用鲎试剂法测定OMVs样品中的内毒素含量。
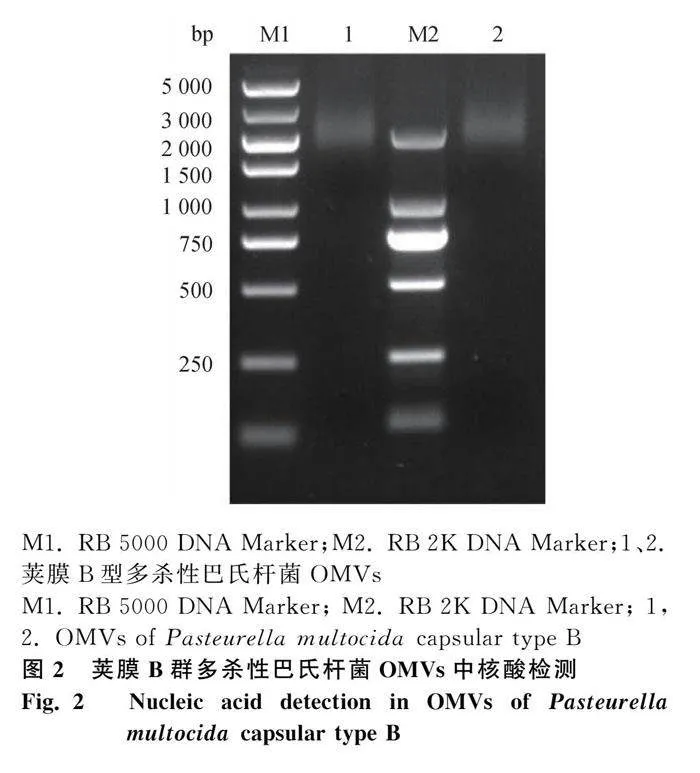
1.6 OMVs中核酸检测
吸取纯化好的OMVs 100 μL,沸水浴10 min,冷却后10 000 r·min-1离心10 min,吸取上清后,分光光度计检测DNA含量。上清液加入5×Loading buffer混匀,120 V,1%琼脂糖凝胶电泳30 min,紫外光下检测有无核酸条带。
1.7 OMVs中蛋白的SDS-PAGE检测
吸取纯化好的OMVs 50 μL,与2×蛋白上样缓冲液等体积混合后煮沸10 min,取10 μL进行12%SDS-PAGE,电泳时先80 V电泳20 min,再100 V电泳30 min,考马斯亮蓝染色后观察。
1.8 蛋白质谱分析
将提取纯化的外膜囊泡送生工生物工程(上海)股份有限公司进行LC-MS/MS,分析OMVs蛋白质组成,并进一步进行蛋白质组学分析。鉴定出样品中的蛋白质,在Uniprot(https://www.uniprot.org/)进行检索获取蛋白具体信息进行分析。
1.9 OMVs免疫保护效果评价
将试验兔分成4组,每组4只,分组及免疫情况见表1。OMVs疫苗组和多杀性巴氏杆菌病灭活疫苗组均免疫2次,中间间隔21 d。将牛荚膜B型多杀性巴氏杆菌CVCC 44702株培养至对数生长期,用PBS稀释计数后,参照《中国兽药典》(2020年版),于第2次免疫后21 d,以2 CFU·只-1剂量肌肉注射所有试验兔进行攻菌。攻菌后每天观察2次,记录试验兔死亡数量,连续记录1周。试验时分别于免疫前、首次免疫后21 d、第2次免疫后21 d对试验兔进行耳缘静脉采血,分离血清,-20 ℃保存备用。
1.10 间接ELISA方法检测血清抗体效价
用实验室已建立的OMVs间接ELISA方法测定血清抗体效价。具体操作如下,将多杀性巴氏杆菌OMVs稀释至0.23 μg·mL-1,100 μL·孔-1包被于96孔酶标板中,4 ℃孵育过夜;次日洗板后用含5% BSA的PBST封闭2 h;之后依次加入1∶2 000稀释的血清样本和1∶5 000稀释的山羊抗兔IgG-HRP二抗,置37 ℃温箱孵育,反应1 h,洗涤后在酶标板中加入TMB显色液,每孔100 μL,避光反应10 min。终止显色反应后用酶标仪测定450 nm波长的吸光度值(OD450 nm)。比较血清样本(S)与阴性对照血清(N)在波长为450 nm处吸光度的比值(S/N),以S/N≥2.1判定为阳性,以S/N≥2.1的最高血清稀释倍数作为每份血清样本的抗体效价。
1.11 外周血淋巴细胞中细胞因子含量检测
分别在免疫前、第1次免疫后21 d以及第2次免疫后21 d采集抗凝血,离心弃去血浆并裂解红细胞,洗涤后按照试剂盒说明书分离淋巴细胞层,将细胞浓度调整为1×107个·mL-1,TRIzol法提取细胞RNA。参考文献[10-11]进行细胞因子检测引物合成。染料法荧光定量PCR测定每组新西兰兔淋巴细胞中相应细胞因子的转录水平,采用2-ΔΔCT方法进行数据分析,计算相对表达水平。
2 结 果
2.1 OMVs形态及粒径分析
透射电镜观察结果显示,大多数OMVs呈完整、规则的球形结构(图1)。粒径分析结果显示,提取的OMVs平均粒径在108.3 nm,符合经典外膜囊泡粒径20~200 nm的大小,浓度为1.6×1010 particles·mL-1(图1)。
2.2 OMVs蛋白浓度检测
根据蛋白定量试剂说明书操作步骤得到标准曲线方程:y=0.789 2x-0.082 7,R2=0.997 5;在562 nm波长测定样品吸光度分别为0.215、0.228、0.207。代入标准曲线方程得到OMVs蛋白浓度为(8.882×10-2±0.007)mg·mL-1,提取的外膜囊泡共有5 mL,则1 L菌液共获得4.41×10-1 mg纯化的OMVs。
2.3 OMVs中内毒素浓度检测
以标准品浓度为横坐标,测得的吸光度值为纵坐标绘制标准曲线,得到回归方程为LgTg=2.825 8-0.247 0LgC,相关系数为r=0.998 0。根据测定结果计算获得提取纯化的OMVs样品中内毒素含量为3.31×106 EU·mL-1。
2.4 OMVs中核酸检测
对OMVs样品进行琼脂糖凝胶电泳后,紫外光下观察可见弥散性抹带,无特定大小条带。微量分光光度计检测显示DNA浓度为29.55 ng·μL-1(图2)。
2.5 SDS-PAGE分析
对纯化的OMVs进行SDS-PAGE,结果如图3所示。纯化的OMVs中蛋白成分主要集中在30%~35% Optiprep中,包含多种不同大小的蛋白质,蛋白分子大小分布在25~130 ku之间,主要集中在33、40、53 ku处。
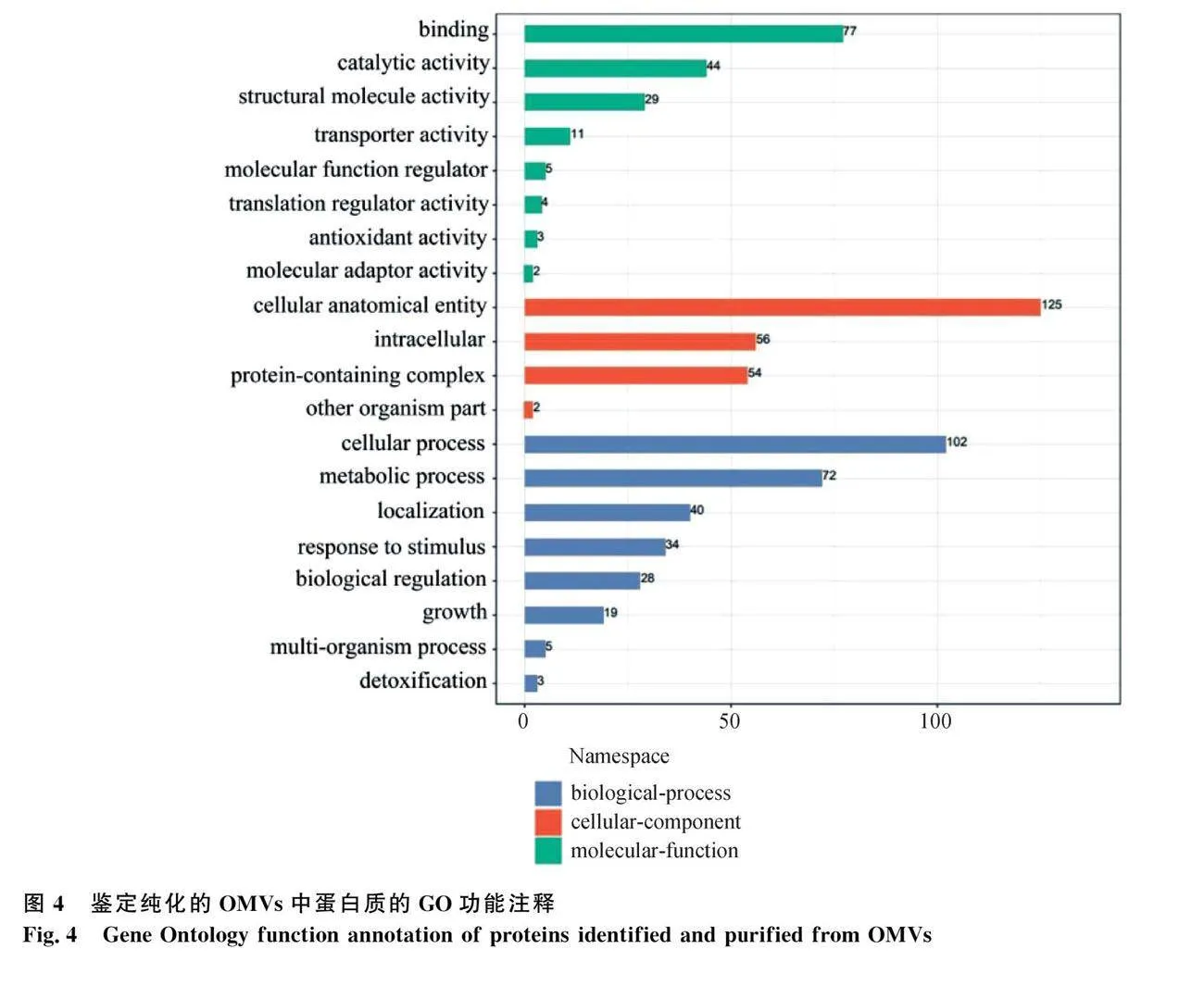
2.6 纯化 OMVs 中蛋白的质谱分析
质谱分析共鉴定到232种蛋白和2 263个肽段。为进一步确定从 OMVs 鉴定到的232种蛋白质的功能,对这些蛋白进行了GO功能注释,分类结果如图4所示。其中,在参与生物学过程的蛋白中,102种蛋白参与细胞过程(Cellular process),72种"" 蛋白参与代谢过程(Metabolic process),40种蛋白参与定位(Localization),34种蛋白参与刺激反应(Response to stimulus),少数蛋白参与了生物调节(Biological regulation)、生长(Growth)、多生物过程(Multi-organism process)等;在参与分子功能过程的蛋白中,有77种蛋白具有结合(Binding)功能,44种蛋白具有催化活性(Catalytic activity),29种蛋白具有结构分子活性(Structural molecule activity),还有少量蛋白具有转运活性(Transporter activity)、分子调控(molecular function regulator)功能、转录调节活性(Transcription regulator activity)等;在参与细胞组成过程的蛋白中,125种蛋白参与细胞结构体(Cellular anatomical entity)组成、56种蛋白参与细胞内(Intracellular)组成、54种蛋白参与蛋白复合物组成,少数参与其他细胞组成过程。在鉴定的蛋白中,包含具有免疫活性的细菌外膜蛋白OMP A、OMP H[12]。
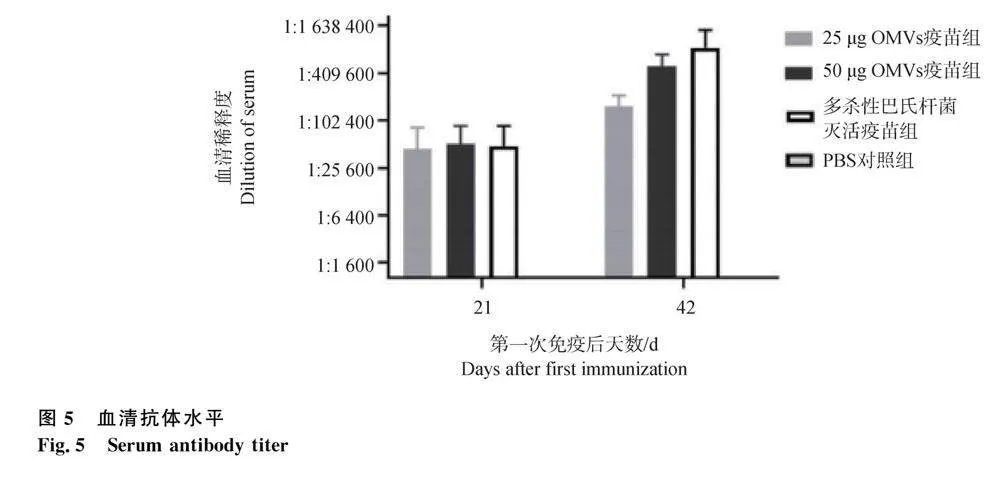
2.7 血清抗体效价检测
在免疫前、第1次免疫后21 d和第2次免疫21 d后,分别收集免疫组和对照组新西兰白兔血清,采用ELISA方法检测抗体效价。结果见图5。50 μg OMVs疫苗组一免后平均抗体效价达1∶51 200,二免后达1∶405 600。25 μg OMVs疫苗组二免后平均抗体效价为1∶102 400,多杀性巴氏杆菌灭活免疫组二免后平均抗体效价为1∶811 200,50 μg OMVs疫苗组和多杀性巴氏杆菌灭活免疫组抗体水平增长幅度均高于25 μg OMVs疫苗组。PBS对照组抗体均为阴性。
2.8 外周血淋巴细胞中细胞因子转录水平
提取分离到的淋巴细胞RNA,采用荧光定量PCR测定相应细胞因子转录水平,结果如图6所示。免疫组IFN-γ和IL-4的含量较对照组转录水平均显著升高。
2.9 免疫保护效果评价
免疫前后及攻毒后12 h内,动物无异常表现;攻毒后24~72h内,部分试验兔出现萎靡不振、精神沉郁、被毛粗乱、停止进食等症状,且试验兔出现死亡;攻毒后72 h,50 μg OMVs疫苗组和多杀性巴氏杆菌灭活疫苗组的保护率均为75%,25 μg OMVs疫苗组保护率为25%,PBS对照组试验兔全部死亡。结果见表2。OMVs疫苗的保护效果符合《中国兽药典》(2020年版)针对多杀性巴氏杆菌疫苗保护效果的规定。
3 讨 论
本研究利用超高速离心法结合 Optiprep 密度梯度离心法成功提取了多杀性巴氏杆菌外膜囊泡。透射电子显微镜观察显示,获得的外膜囊泡为大小不等(粒径范围在20~200 nm)的双层膜球状结构;利用纳米颗粒跟踪分析确定纯化的外膜囊泡平均粒径为108.3 nm,浓度为1.6×1010 particles·mL-1。SDS-PAGE 分析显示 OMVs 包含多种不同大小的蛋白质,蛋白分子大小在 25~130 ku 之间,主要集中在 33、40、53 ku 处。BCA法测得外膜囊泡的蛋白浓度为(8.882×10-2±0.007)mg·mL-1,鲎剂试验测定其中的内毒素含量为3.31×106 EU·mL-1。
本研究在前期提取OMVs的过程中发现,有很多外在条件会影响外膜囊泡的提取效率,且在纯化过程中,会损失大量的外膜囊泡。由于外膜囊泡是革兰阴性菌在生长过程自然分泌的,当温度、培养时间、培养基类型或者化学刺激发生改变时,细菌分泌的外膜囊泡的形态、数量、蛋白组成以及功能都会发生改变[13],因此,为保证提取的外膜囊泡状态稳定,本研究首先测定了细菌的生长曲线,参考文献[7]报道的在细菌生长对数期与稳定期交界时期(对数期后期)提取外膜囊泡,并严格控制接菌数量、培养时间以及培养条件,且在每次提取后,通过透射电子显微镜观察外膜囊泡形态特征,以获得相同稳定的外膜囊泡。
脂多糖是内毒素的重要组成部分。目前,降低外膜囊泡中内毒素的方法主要是在超高速离心回收OMVs时在重悬缓冲液中加入去污剂脱氧胆酸钠,通过孵育、离心等方式获得去内毒素OMVs,但这种做法通常会洗去外膜囊泡中的部分蛋白,造成外膜囊泡的免疫原性降低。另外,通过基因敲除或修饰LPS结构,降低LPS对外膜囊泡的影响也是一种很好的办法。本研究提取的外膜囊泡虽内毒素含量较高,但在本实验室先前研究基础上发现,一定浓度以下,皮下注射到小鼠体内,并没有产生不良效果,所以本研究未对提取纯化的OMVs进行降低内毒素的处理。
本研究对外膜囊泡进行了蛋白组学分析,GO功能注释可知本研究提取纯化的外膜囊泡中包含的蛋白质主要参与细胞过程、代谢过程、定位功能、结合功能、催化活性功能、结构分子活性功能以及细胞构成等。OMVs中包含了参与细菌生命活动的多种蛋白,细菌外膜蛋白如OMP A、OMP H也在其中,进一步说明外膜囊泡与细菌外膜的相关性,具有潜在的免疫保护作用。
从血清抗体水平的结果可以看出,疫苗免疫后,各免疫组新西兰白兔血清抗体水平均有大幅升高,其中50 μg OMVs疫苗组和多杀性巴氏杆菌灭活疫苗免疫组抗体水平升高显著,50 μg OMVs疫苗组二免后达1∶405 600。有研究报道在小鼠模型,OMVs免疫刺激小鼠产生的抗体可以为小鼠提供针对多杀性巴氏杆菌感染的保护作用[14]。本研究利用荚膜B型多杀性巴氏杆菌CVCC 44702作为攻菌株,50 μg OMVs疫苗组和多杀性巴氏杆菌灭活疫苗免疫组的保护效果均为75%,符合《中国兽药典》(2020年版)针对多杀性巴氏杆菌疫苗保护效果的规定。
以上结果表明,基于OMVs的多杀性巴氏杆菌病疫苗能提供较好的同源攻毒保护效果及高的抗体水平,表明OMVs具有良好的安全性及免疫效果,具有潜在的临床应用价值。
4 结 论
本研究提取纯化了荚膜B型多杀性巴氏杆菌外膜囊泡,分析其粒径大小等生物学特性,免疫新西兰白兔后,产生与全菌灭活疫苗相当的抗体水平和攻毒保护效果,说明本研究提取的外膜囊泡具有良好的免疫原性,为今后荚膜B型多杀性巴氏杆菌疫苗研究提供了理论依据。
参考文献(References):
[1] 胡 旭. 牛多杀性巴氏杆菌OmpH蛋白与大肠杆菌OmpA蛋白的融合表达及免疫原性研究[D]. 大庆:黑龙江八一农垦大学,2013.
HU X. Expression and Immunogenicity Research of Fusion Protein of P.multocida OmpH and E.coli OmpA[D]. Daqing:Heilongjiang Bayi Agricultural University,2013.(in Chinese)
[2] WILSON B A, HO M. Pasteurella multocida: from zoonosis to cellular microbiology[J]. Clin Microbiol Rev, 2013,26(3):631-655.
[3] MYINT A, CARTER G R, JONES T O. Prevention of experimental haemorrhagic septicaemia with a live vaccine[J]. Vet Rec, 1987,120(21):500-501.
[4] 谢倩茹, 陈颖钰, 胡长敏, 等. 牛多杀性巴氏杆菌疫苗研究进展[J]. 中国奶牛, 2015(15):22-27.
XIE Q R, CHEN Y Y, HU C M, et al. Progress on the vaccine of Pasteurella multocida in cattle[J]. Dairy Health, 2015(15):22-27.(in Chinese).
[5] MEI C, SUN A H, BLACKALL P J, et al. Component Identification and Functional Analysis of Outer Membrane Vesicles Released by Avibacterium paragallinarum[J]. Front Microbiol, 2020,11:518060.
[6] CHRISTIANE C, SARTHAK M S, RIKHAV P G, et al. Potential applications of microparticulate-based bacterial outer membrane vesicles(OMVs) vaccine platform for sexually transmitted diseases(STDs): Gonorrhea, Chlamydia, and Syphilis[J]. Vaccines, 2021, 9(11): 1245.
[7] DAVIES C, TAYLOR A J, ELMI A, et al. Sodium taurocholate stimulates Campylobacter jejuni outer membrane vesicle production via down-regulation of the maintenance of lipid asymmetry pathway[J]. Front Cell Infect Microbiol, 2019,9:177.
[8] ZHU Z, ANTENUCCI F, VILLUMSEN K R, et al. Bacterial outer membrane vesicles as a versatile tool in vaccine research and the fight against antimicrobial resistance[J]. mBio, 2021, 12(4): e0170721.
[9] KASHKANOVA A D, BLESSING M, REISCHKE M, et al. Label-free discrimination of extracellular vesicles from large lipoproteins[J]. J Extracell Vesicles, 2023,12(8):12348.
[10] 仇汝龙, 范志宇, 王 芳,等. 兔出血症病毒感染机体后炎性因子的检测分析[J]. 江苏农业科学,2016,44(2): 238-241.
QIU R L, FAN Z Y, WANG F, et al. Detection and analysis of inflammatory factors after rabbit hemorrhagic disease virus infection[J]. Jiangsu agricultural sciences, 2016:44(2): 238-241.(in Chinese).
[11] 廖晓霞, 赵习彬, 赖为民,等. 痒螨病患兔皮损中细胞因子IFN-γ、IL-4和转录因子T-bet、GATA-3的表达[J]. 四川农业大学学报,2018: 36(2): 247-253.
LIAO X X,ZHAO X B,LAI W M, et al. Expression of cytokine factors IFN-γ,IL-4 and transcription factors T-bet,GATA-3 in psoroptic mange with different lesion scores in rabbits[J]. Journal of Sichuan Agricultural University, 2018: 36(2): 247-253.
[12] DAVIES R L, MACCORQUODALE R, CAFFREY B. Diversity of avian Pasteurella multocida strains based on capsular PCR typing and variation of the OmpA and OmpH outer membrane proteins[J]. Vet Microbiol, 2003, 91(2-3):169-82.
[13] LEE J, KIM O Y, GHO Y S. Proteomic profiling of Gram-negative bacterial outer membrane vesicles: Current perspectives[J]. Proteomics Clin Appl, 2016,10(9-10):897-909.
[14] DAVIES C, TAYLOR A J, ELMI A, et al. Sodium Taurocholate Stimulates Campylobacter jejuni Outer Membrane Vesicle Production via Down-Regulation of the Maintenance of Lipid Asymmetry Pathway[J]. Front Cell Infect Microbiol, 2019,9:177.
[14] ROIER S, FENNINGER J C, LEITNER D R, et al. Immunogenicity of Pasteurella multocida and Mannheimia haemolytica outer membrane vesicles[J]. Int J Med Microbiol, 2013,303(5):247-256.
(编辑 范子娟)

