生物炭改性策略及其在铬(Ⅵ)污染修复中的研究进展




摘要 六价铬(Cr(Ⅵ))是自然环境中毒性很强的重金属污染物之一,对生态系统构成严重威胁。生物炭是生物质在缺氧条件下热解产生的一种富碳固体物质,因具有比表面积大、孔结构发达和官能团丰富等优点,可作为修复Cr(Ⅵ)污染的高效吸附材料。目前,研究人员主要通过物理改性、化学改性、负载金属改性及生物改性等多种策略进一步增强生物炭对Cr(Ⅵ)的吸附能力。本文综述了近年来生物炭改性的研究进展,系统梳理了不同生物炭改性策略,比较了不同改性策略制备的生物炭对Cr(Ⅵ)污染的修复效率,分析了其作用机制,并对生物炭的改性修饰及其在实际应用中的未来发展方向进行了讨论。
关键词 生物炭;改性策略;铬(VI);吸附机制;评述
铬(Cr)是工业(如颜料和电镀)废水副产品中最常见的重金属物种[1-4],在环境中以Cr(Ⅲ)和Cr(Ⅵ)两种价态存在[5]。其中, Cr(Ⅲ)通常以阳离子形式存在,易以Cr(OH)3/Cr2O3 的形式固定,迁移性和毒性均较弱;而Cr(Ⅵ)通常以铬酸盐(CrO42‒和HCrO4‒等)形式存在[6],水溶性和迁移性都较强,毒性约为Cr(Ⅲ)的100 倍,皮肤接触即可能造成遗传性基因缺陷,吸入或摄入可能致癌[7-8],已被国际癌症机构列为Ⅰ类致癌物。美国环境保护署(EPA)严格规定饮用水中Cr(Ⅵ)浓度不得超过50 μg/L。因此,高效去除环境中的Cr(Ⅵ)具有重要意义。将有毒的Cr(Ⅵ)还原为稳定的Cr(Ⅲ)并从环境中去除,被认为是修复土壤和水系统中铬酸盐污染的有效途径[9]。
目前,去除Cr(Ⅵ)的方法主要包括吸附法、电化学沉淀法、膜分离、光催化和生物修复等[2]。其中,吸附法因具有成本低、经济效益好、可重复利用性强、操作简便和去除效率高等优点,在重金属Cr 污染处理方面展现出广阔的应用前景。生物炭(Biochar)是由富碳的生物质(通常是农林废弃物)在限氧条件下通过高温热解产生的一类难溶且稳定的高度芳香化物质[10]。生物质在热解过程中会经历脱水、脱羧、分解和还原等过程,部分有机物挥发后,生成具有不同理化性质的多孔生物炭。生物炭是一种新兴的低成本且可持续使用的环境修复材料,具有来源广泛、多孔结构、芳香性高、官能团较丰富以及阳离子交换能量高等特点,在重金属修复方面发挥了关键作用[11];但是,生物炭由于粒径小、孔隙率/比表面积相对不足以及存在大量分散的π电子等缺点而导致其表面带负电,对Cr(Ⅵ)的吸附效果较差,并且较难与水溶液实现快速分离,回收再利用程度有限,因而在实际应用中仍面临诸多挑战[12]。
为改善上述情况,研究者对生物炭的改性方法进行了大量研究,主要从增大生物炭的比表面积、增加含氧官能团数量、提高表面正电性、增强还原特性或赋予磁性分离等角度出发构建功能化改性生物炭。本文对近年来生物炭的改性策略及其用于Cr(Ⅵ)污染修复的研究成果进行了综述,系统梳理了生物炭改性方法的种类和作用(图1),比较了不同改性方法对Cr(Ⅵ)污染的修复效率,探索了其作用机制,讨论了其未来的研究方向,以期为改性生物炭的设计及其对Cr(Ⅵ)污染修复的相关研究提供新思路。
1 生物炭改性方法及机制
1.1 物理改性
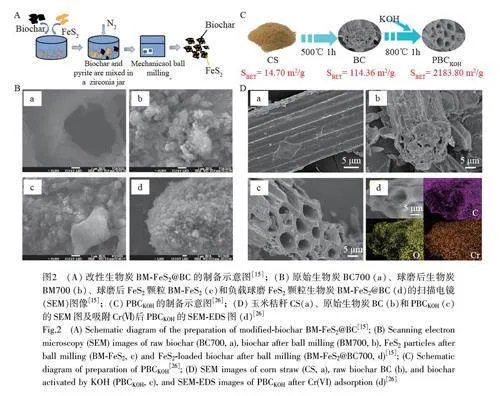
球磨法(Ball milling)是指利用外部机械力的作用,通过研磨介质和生物炭的强烈碰撞、碾磨和搅拌,原料颗粒被反复地挤压、变形、断裂以及焊合,从而产生细小且均匀的生物炭颗粒[13]。在此过程中,生物炭的比表面积和孔隙度均增加。Xiao 等[14]发现球磨法可增加生物炭表面官能团含量,尤其是含氧官能团含量(由0.2~2.1 mmol/g 增至0.8~2.8 mmol/g),这可能与球磨法改善了生物炭的开口尖端、影响界面粘附、促进开口端官能团的生成有关。Tang 等[15]将松木粉高温炭化,再进行球磨改性并负载FeS2,制得生物炭BM-FeS2@BC(图2A)。球磨后生物炭表面变得粗糙,粒径从微米级减至纳米级(图2B),BM-700 球磨生物炭对Cr(Ⅵ)的吸附效率是原始生物炭的2.0~3.5 倍;负载FeS2 颗粒后(BM-FeS2@BC),吸附效率大幅提升12 倍。前者主要归功于球磨后生物炭中含氧官能团和比表面积的增加,促进了其对Cr(Ⅵ)的静电吸引和表面络合,后者则得益于FeS2 具有较高的还原性。
超声波法(Sonication)和微波处理(Microwave)是改善生物炭结构的有效方法。超声波除了能清洁生物炭表面外,还能通过空化作用促使生物炭表面的部分热解产物的残余物脱落,打开堵塞的微孔,并产生新的微孔,极大地提高了生物炭的微孔率。Sajjadi 等[16]采用低频超声波物理改性生物炭,发现其微孔率随着超声时间延长而持续增加,在0~60 s 范围内,超声处理时间每增加20 s,微孔率增加约10%。微波加热时,在粒子内部形成的挥发物可自由逃逸,直接提高了生物炭的孔隙率和比表面积[17]。Masek等[18]研究发现,微波热解条件下制备的生物炭的比表面积是在同等温度下通过常规加热制备的生物炭的2~3倍。
气体活化(Gas activation)主要通过炭骨架的部分气化增加生物炭比表面积,并丰富表面官能团,常用的方式主要包括二氧化碳活化[19]、氮气活化[20]和蒸气活化[21]等。Zhang 等[19]发现, CO2 气流下活化的玉米秸秆生物炭比表面积(977 m2/g)远高于单独对照处理的生物炭(411 m2/g),这是因为CO2 可打开封闭的孔隙,并通过活化作用拓宽现有孔隙,更容易渗入孔隙结构发达的生物炭内部。蒸气活化改性生物炭可以促进生物炭挥发和形成结晶碳,并去除第一次热解过程中不完全燃烧的截留产物[21]。
1.2 化学改性
生物炭的化学性质主要由表面的化学官能团、表面杂原子和氧化物决定。化学改性是指通过引入化学试剂处理生物炭,增大生物炭的比表面积和孔隙率,改变生物炭表面的官能团,赋予生物炭表面金属/金属氧化物的还原性和吸附性。与物理改性方法相比,化学改性方法具有能耗低、省时与成本低等特点。目前,常用的化学改性策略主要包括酸碱改性、有机化合物改性、表面活性剂/碳质材料改性和负载金属改性等。目前,负载金属改性的生物炭复合体系因具有稳定性好、表面活性强和吸附性能高等优点而成为研究热点,本文将在1.3 节中进行详细阐述。
1.2.1 酸碱改性
酸改性是指通过去除生物炭表面沉积的矿物或杂质成分而扩大生物炭比表面积,并引入更多的酸性官能团,增加生物炭对Cr(Ⅵ)的吸附位点。考虑到HCl 和HNO3 的酸性过强且易产生腐蚀作用, H3PO4 成为应用更广泛的酸改性剂。Parameswari 等[22]以水葫芦为原料,采用85% H3PO4 活化制备酸改性生物炭PA-WBC,不仅增加了生物炭表面羟基和羧基的数量,比表面积也提高了389.95 m2/g。这是因为碳基质与H3PO4 相互作用,在生物炭表面产生了大量孔洞;同时, H3PO4 通过降解芳香族、脂肪族和木质纤维素等物质形成的磷酸盐和多聚物磷灰石发挥了“桥梁”作用,防止孔洞收缩。通过Langmuir 模型计算得到PA-WBC 对Cr(Ⅵ)的最大单层吸附量为50 mg/g,高于原始水葫芦生物炭(35.7 mg/g)。此外,有机酸改性生物炭主要是通过酯化作用将羧基引入生物炭表面[23]。Lonappan 等[24]发现,原料和有机酸的种类对改性效果均有影响。柠檬酸改性松木、猪粪和杏仁壳后,生物炭的总酸性官能团数量可分别增加23%、10%和26%。有机酸由氨基酸分解代谢产生,可作为绿色和可持续的酸改性剂。
与酸改性相比,碱改性可更有效地获得高比表面积,并可改变生物炭表面官能团[25]。Qu 等[26]通过两步KOH 活化热解工艺将玉米秸秆转化为具有高比表面积(2183.80 m2/g)的多孔生物炭(PBCKOH,图2C)。实验结果表明,经KOH 活化后, PBCKOH 呈现出孔隙发达的3D 蜂窝状结构(图2D),具有微孔特性,对Cr(Ⅵ)的理论单层吸附量达到116.97 mg/g。该研究深入挖掘了BC 生成PBCKOH 的激活机制,并将其归纳为3 个步骤:(1)通过提高热解温度, BC 发生热聚合和固化,形成多孔球体结构,同时, KOH 逐渐开始结晶, KOH 晶体颗粒插入并固定在孔隙中;(2)随着热解温度进一步升高, KOH 晶体颗粒逐渐融化并与BC 反应,产生的钾碱化合物(如K2CO3、K2O 和K)进一步腐蚀BC,导致原有的中孔和大孔被微孔取代,比表面积增大;(3)产生的CO、CO2 和其它气体通过孔隙扩散挥发,在PBCKOH 表面形成更多的微孔。
1.2.2 有机化合物改性
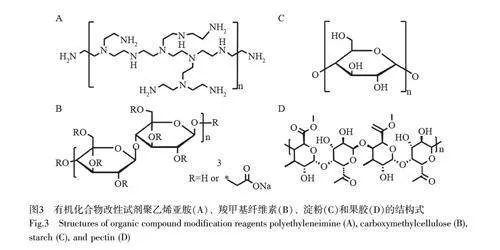
活性官能团接枝共聚改性是提高生物炭吸附能力的有效途径之一。有机化合物常具有丰富的官能团(如—NH2、—OH 和—COOH 等),经有机化合物改性后的生物炭表面被赋予丰富的吸附位点,增强与Cr(Ⅵ)的相互作用。常用的改性有机化合物主要有聚乙烯亚胺(PEI)(图3A)、羧甲基纤维素(图3B)、淀粉(图3C)和果胶(图3D)[27-29]等。其中, PEI 线型大分子链上含有大量的伯胺和仲胺基团,含氮官能团和金属离子之间的强化学亲和力使得PEI 表现出优异的络合能力[27]。Ma 等[30]制备的PEI 改性生物炭对Cr(Ⅵ)的最大吸附量约为435.7 mg/g,远高于原始生物炭(23.09 mg/g)。在低pH 值条件下, PEI 改性生物炭表面的氨基质子化(—NH2→ —NH3+),通过正负电荷吸引Cr(Ⅵ)至生物炭表面,并利用Cr(Ⅵ)的强氧化性将胺基(—NH—)氧化为亚胺基(=N—),毒性较高的Cr(Ⅵ)转化为低毒性的Cr(Ⅲ)。此外,通过添加不同的富氮有机试剂增加生物炭的氮含量,可以提供额外的吸附位点和电子供体。Deng 等[31]在HNO3和烟酰胺存在下制备出的氨基功能化水热炭对Cr(Ⅵ)表现出3 倍增强的吸附作用。
1.2.3 其它化学改性
非金属杂原子掺杂在炭质材料中广泛运用,特别是氮掺杂。氮原子具有不成对电子,可以提高相邻碳原子对的电子密度,并通过sp2 共轭增强电子迁移率,同时产生更多的官能团与缺陷位点。Zhu 等[32]研究发现,通过Maillard 反应可有效地将氮掺杂剂嵌入到碳晶格中,进而改变生物炭的电荷分布,增加持久性自由基(PFRs)的比例(图4A),所制备的改性生物炭对Cr(Ⅵ)的动力学速率提高了1.4~5.0 倍。Guo 等[33]在不同温度下通过水热炭化策略制备氮掺杂生物炭(HTC),随着温度升高,中孔和微孔结构开始显现并逐渐增多(图4B)。元素测定分析结果表明, HTC 中氮含量高达5.5%(图4C),主要包括吡咯型(N-5)、吡啶型(N-6)和石墨型(N-G)氮等,在高温下,氮由吡啶型和吡咯型逐渐转变为石墨型。在pH=2.0 时,所制备的改性生物炭对Cr(Ⅵ)的最大吸附量为184.86 mg/g。
此外,由于生物炭本身表面疏水性和亲水性基团较少,这导致其吸附水中污染物的能力较差,尤其是对阴离子形式的铬酸盐,研究者采用表面活性剂对生物炭改性,以改善该问题。非离子表面活性剂TritonX-100 与生物炭结合时,通过调节界面张力和pH 值,可改善生物炭对Cr(Ⅵ)的固定作用[34]。石墨烯和碳纳米管等碳质材料涂层生物炭不仅可改善生物炭的热稳定性,碳质材料上含氧官能团和π-π相互作用还为生物炭提供了更丰富的结合位点吸附Cr(Ⅵ)[35]。
1.3 负载金属改性
Zn、Mn、Mg、Al 和Fe 等金属盐或金属氧化物常用于改性修饰生物炭,以提高生物炭吸附Cr(Ⅵ)的能力。此类金属盐或氧化物改性生物炭的方法可以归纳为两种主要方法:(1)将金属盐或金属氧化物与原料混合,经热解一步合成金属改性生物炭;(2)先高温炭化得到生物炭,然后用金属盐溶液活化得到金属改性生物炭。
1.3.1 提高生物炭的比表面积和孔隙率
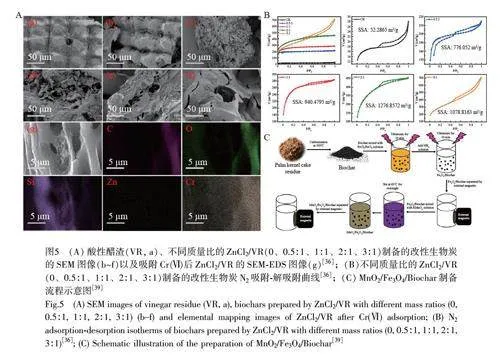
Ding 等[36]探究了ZnCl2 改性酸性醋渣(VR)生物炭去除Cr(Ⅵ)的能力。如图5A 和5B 所示,不同质量比的ZnCl2/VR 改性后生物炭表面呈现出不同大小的孔结构,比表面积增至776~1277 m2/g,是天然生物炭的14.84~24.42 倍,这主要与ZnCl2 沸点较低以及热解过程中产生的Zn 从天然固相中解离有关[37]。Ling 等[38]合成了纳米MgO 颗粒稳定的氮掺杂生物炭MgO@N-biochar,其比表面积(83.24 m2/g)远高于N-biochar(3.19 m2/g)。这是因为在热解过程中MgCl2 分解, HCl 和H2O 等挥发性物质的释放导致生物炭基体中形成孔隙结构;同时, MgCl2 本身对纤维素和半纤维素等碳水聚合物有很强的脱水能力,从而改变了木质纤维素的分解途径,抑制了可阻塞孔隙结构的重焦油的形成。Maneechakr 等[39]采用KMnO4 活化法制备MnO2 改性磁性生物炭MnO2/Fe3O4/Biochar(图5C), MnO2 的掺杂使原始生物炭在结构上产生了新的超粗糙表面和孔隙(比表面积增加约14 倍),并且将—OH 部分氧化为羧基,导致羧基含量由0.04 meq/g 增至0.15 meq/g。除了这些常见的金属外,活化剂Bi2O3 也可通过抑制孔焦油的形成,产生新的微孔,通过扩大生物炭比表面积提升其吸附去除Cr(Ⅵ)的能力[40]。
1.3.2 提高正电性, 增强生物炭对Cr(Ⅵ)的静电吸附作用
虽然金属改性有利于提高生物炭比表面积进而增强吸附效果,但并不是所有金属氧化物的掺杂都会使生物炭比表面积增加。Chen 等[41]研究发现,经FeCl3 溶液浸渍热解后的生物炭表面出现γ-Fe2O3 晶体颗粒,其比表面积比改性前下降55.64%,这可能是由于γ-Fe2O3 晶体颗粒堵塞生物炭表面/内部的孔隙。然而,吸附实验结果表明,改性后生物炭对Cr(Ⅵ)的吸附效率却提高了9~24 倍,说明比表面积只能部分解释改性生物炭吸附Cr(Ⅵ)的机理。由于Cr(Ⅵ)在自然环境条件下常以CrO42–的形式存在,而生物炭一般呈现负电性[11],对金属阴离子的吸附能力较弱。因此,通过负载金属改性改变生物炭表面的电荷性质(提高正电性),将有利于增强生物炭对CrO42–的吸附能力。Dong 等[42]以柚子皮为原料烧制生物炭,经FeCl3 改性后,改性生物炭表面形成了铁氧化物颗粒FeOOH、Fe3O4 和Fe2O3 等, Zeta 电位由‒31.16 mV 变为+19.23 mV, pH 值较小时,正电荷效应增强了改性生物炭对Cr(Ⅵ)等阴离子污染物的吸附性能,去除效率由原始生物炭的0.28%大幅提高至91.67%。
1.3.3 提供无机电子供体, 促进Cr(Ⅵ)向Cr(Ⅲ)的转化
由于Cr(Ⅲ)的环境毒性远低于Cr(Ⅵ),因此促进Cr(Ⅵ)向Cr(Ⅲ)的转化并固定是治理水和土壤中Cr(Ⅵ)污染的有效策略。由于该转化过程涉及到氧化-还原反应,若所负载化合物能够向生物炭提供一定的外加电子供体,将极大地提高生物炭对Cr(Ⅵ)的还原能力。常见的金属盐/金属氧化物电子供体主要有铁基Fe(0)、Fe(Ⅱ)材料和硫化物S(-Ⅱ)两类,如纳米零价铁(nZVI)[43-44]、FeS[45]和Fe2O3[42]等,还原后的Cr(Ⅲ)不需进一步处理,可通过络合作用与Fe(Ⅲ)形成稳定的螯合物而吸附在生物炭的表面,避免Cr(Ⅲ)的二次污染。
nZVI 因具有较大的比表面积和较高的化学还原率被广泛应用。Xie 等[44]采用湿球磨法制备草酸改性零价铁生物炭(OA-ZVI/BC)用于修复高浓度铬污染(525.0 mg/kg)的场地。研究结果表明, OA-ZVI/BC可以钝化96.7%的Cr(Ⅵ),并稳定修复90 d;毒性特征浸出程序(TCLP)结果表明, OA-ZVI/BC 处理后Cr(Ⅵ)含量降至0.11 mg/L, 78.1%的Cr(Ⅵ)被还原,其去除机制涉及吸附、还原(Fe0/Fe2+, Fe2+/Fe3+)和共沉淀等多项过程。此外,由于nZVI 易聚集和钝化,导致暴露的活性位点减少[46-47],生物炭作为载体材料在一定程度上可改善nZVI 的团聚现象。Zhang 等[48]以Fe(Ⅱ)为铁源,通过NaBH4 还原合成一种新型羧甲基纤维素(CMC)稳定的nZVI 改性生物炭复合材料CMC-nZVI@BC(图6A)。实验结果表明,通过CMC稳定的nZVI 颗粒粒径较小,并且分散更均匀, Cr(Ⅵ)还原率高达84.8%。与原始生物炭(2.4 mg/g)相比,CMC-nZVI@BC 对Cr(Ⅵ)吸附量高达104.4 mg/g。此外, Wang 等[49]用秸秆和KHCO3 分别作为碳源和成孔剂,合成了负载FeNi 双金属纳米粒子的分级多孔碳(FeNi@HPC),生物炭载体和Ni 掺杂充分提高了nZVI 的稳定性并防止其氧化,这可能是由于Fe0 和Ni0 之间形成的原电池促进了电子流动。所制备的改性生物炭对Cr(Ⅵ)的去除率高达99.7%,并且不同Ni 掺杂含量与Cr(Ⅵ)去除率密切相关。
另一方面,硫化金属中S2–的存在使其具有潜在的还原能力。Lyu 等[45]制备了CMC 稳定的FeS 改性生物炭(CMC-FeS@Biochar,图6B),其生物炭骨架结构较好地抑制了FeS 纳米粒子间的聚集,反应活性位点大量暴露。实验结果表明,将其用于Cr(Ⅵ)加标(加标量210 mg/kg)土壤修复时, 57%的Cr(Ⅵ)被还原为Cr(Ⅲ),表现出较高的还原率,基于TCLP 的浸出率降至94.7%,大幅降低了小麦和蚯蚓等动植物对Cr(Ⅵ)的生物利用度。但是,制备FeS 时需要N2 纯化过的去离子水,并且整个装置都需要N2 保护,导致程序复杂,成本高。相比于FeS, MnS 的溶解度更高,这表明更多的Mn(II)释放到溶液中并参与Cr(Ⅵ)的氧化过程[50]。因此, Zhang 等[50]采用一锅法制备了新型MnS 改性生物炭吸附剂,该吸附剂通过均相和非均相方式有效吸附和还原水溶液中的Cr(Ⅵ),在pH 5.0~6.0 时对Cr(Ⅵ)的吸附量约为98.15 mg/g。
1.3.4 赋予生物炭磁学性能, 实现将Cr(Ⅵ)从环境中完全剥离同时提高生物炭的回收及重复利用
Akila 等[51]采用共沉淀法制得磁性花旗松生物炭(MBC,图6C),在10 和300 K 时,其饱和磁化强度分别为23.85 和20.41 emu/g,磁性对温度的低依赖性使得吸附剂材料在很宽的温度范围内均有较高的磁饱和量,有利于通过外加磁场分离,便于回收再利用。Shi 等[52]利用EDC/NHS 酰胺化反应将氨基二氧化硅磁性纳米粒子(Fe3O4@SiO2-NH2)附着在由凤凰树叶制得的羧化生物炭上(图6D),该改性策略赋予生物炭优异的磁学性能,所制备磁性生物炭的磁饱和量为23.0 emu/g,对Cr(Ⅵ)的吸附量为27.2 mg/g,明显高于原羧化生物炭(18.2 mg/g)。因此,磁改性是一种既能增加吸附能力,又能实现快速回收再利用的改性方法,在实际生产和生活中具有极大的应用前景。
1.4 生物改性
传统的物理改性和化学改性方法工艺相对复杂,需要大量化学试剂,可能会对环境造成二次污染。利用不同微生物(包括细菌[53-54]、真菌[55]和微藻[56]等)修复环境是一种环保且有前景的方法。
Chen 等[57]筛选出一种Cr(Ⅵ)还原菌株蜡状芽孢杆菌WHX-1,并将该菌株固定在浒苔衍生的生物炭上建立了微生物聚集体系统WBC,将其应用于青岛某化工厂实际铬污染土壤修复(109.83 mg/kg)。结果表明,添加微生物团聚体(WBC)后, 94.22%的Cr(Ⅵ)转化为Cr(Ⅲ), Cr(Ⅵ)含量降至2.89 mg/kg;此外,经WBC 处理后,在Cr 污染土壤上种植的黑麦草的生理特性明显改善。另一方面,菌株附着在生物炭上建立了微生物团聚体系统后,生物炭为微生物提供了栖息地,保护菌株不受环境因素的影响,提高了菌株的存活率,同时复合材料具备了吸附和还原的双重功效。此外,研究人员利用某些微生物对生物质进行预处理,降解生物质的内部结构,形成具有松散结构的前体,再通过碳化和活化构建多孔材料。Zhang 等[58]选取以荷叶为代表的废弃植物生物质,利用特定的微生物菌株对原料中的木质素和纤维素成分进行降解(木质素被黄孢原毛菌降解,纤维素被绿色木霉降解),而后高温活化,所制备的改性生物炭具有丰富的孔隙结构,比表面积从1094 m2/g 提高至2290 m2/g。
2 不同改性策略对生物炭去除Cr(Ⅵ)的作用机制
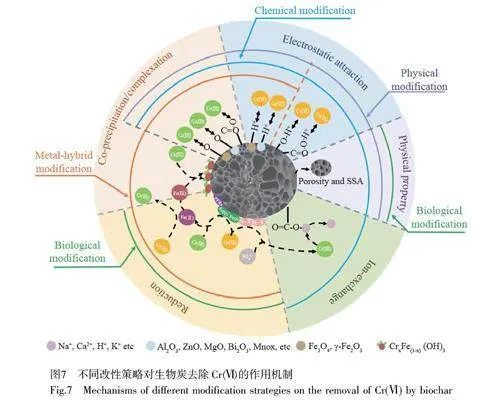
生物炭对Cr(Ⅵ)的吸附与降解主要通过静电吸引、离子交换、表面配位/共沉淀以及氧化-还原等作用实现。通常,静电吸引作为前导作用力,先将游离的铬酸盐吸引到生物炭的表面,随后生物炭表面存在的无机或有机电子供体直接或间接将Cr(Ⅵ)还原为Cr(Ⅲ), Cr(Ⅲ)再通过离子交换、络合/共沉淀等作用以沉淀物的形式吸附沉积在改性生物炭表面,因此Cr 固定化可归纳为“吸附-还原-再吸附”过程。基于此,对不同改性策略的主要作用力类型进行了总结(图7)。(1)改变物理性质 物理、化学、负载金属和生物改性等策略均可改变生物炭的比表面积和孔隙率等物理性质,为进一步发挥吸附亲和作用或还原作用而提供物理基础。(2)提高吸附/再吸附能力(静电吸引、共沉淀络合和离子交换等) 物理和化学改性首先可通过丰富生物炭表面官能团(羟基、氨基、羧基及羰基等)种类或/和数量以强化生物炭与Cr(Ⅵ)/Cr(Ⅲ)之间的静电吸引/络合作用力;其次,某些带负电的官能团(如羧基)通过范德华力、氢键及静电吸附等物理作用力在生物质炭表面吸附大量的K+、Ca2+、Na+、Mg2+等碱土金属离子,这些离子还可与阳离子Cr(Ⅲ)发生离子交换从而将其捕获并固定在生物质炭上。此外,负载金属改性后,金属盐热解后通常生成相应的金属氧化物,其质子化和氧原子配位可促进生物炭对Cr(Ⅵ)/Cr(Ⅲ)的静电吸引/络合作用。特别地, nZVI/铁氧化物负载时,将赋予生物炭独特的磁性,并且Cr(Ⅲ)极易以CrxFe(1–x)(OH)3 形式共沉淀于生物炭表面。(3)强化生物炭还原能力 还原作用主要由负载金属改性和生物改性实现。负载金属改性后,生物炭上的酚羟基、醌类基团和外源性nZVI、S2–等均可作为电子供体,生物炭热解过程中由于化学键的断裂而生成的PFRs 均可直接参与Cr(Ⅵ)的还原过程[59]。将具有还原性的微生物固定于生物炭上,主要是利用其自身代谢作用还原Cr(Ⅵ)。
表1 列举了不同改性生物炭的制备条件及其对Cr(Ⅵ)的吸附条件、去除效果和重复利用性。从表中可知,生物炭炭化时间通常约为2 h,热解温度显著影响生物炭理化性质,随着热解温度升高,生物炭产率降低,芳香碳结构和纳米孔径相应增大,碱性官能团数量会增加,但是,需注意温度过高会使孔隙坍塌,导致比表面积降低,吸附值下降。优化炭化条件可制备比表面积较大的改性生物炭,对Cr(Ⅵ)的吸附能力在10~450 mg/g 之间,在酸性(pH 2.0~6.0)条件下去除效果更佳。这是由于酸性条件下,生物炭表面官能团因质子化而带正电,对铬氧阴离子存在强烈的静电吸引,同时Cr(Ⅵ)氧化-还原电位在酸性条件下较高,易发生氧化-还原反应。此外,在Cr(Ⅵ)的吸附过程中共存离子、初始浓度和吸附剂用量等均可产生较大的影响,例如SO42–和PO43–共存时,结构和电荷的相似性会产生竞争吸附,占据吸附位点,降低Cr(Ⅵ)吸附量[60-61]。
作为生态友好型吸附剂,生物炭的再生能力是其吸附性能的重要参数,决定了吸附剂在废水处理等大规模工业生产中的应用价值。通常,在高pH 值(如pHgt;13.0)时,改性生物炭的吸附性能明显降低甚至无吸附。因此,已吸附Cr(Ⅵ)的改性生物炭常在碱性环境下解吸附,实现资源再生,并且重复循环使用效果良好。其中, NaOH 是广泛使用的洗脱介质,这主要基于离子交换机制,即NaOH 电离释放的高浓度OH‒竞争解吸附Cr(Ⅵ),以实现改性生物炭材料的高效循环再利用。此外,通过金属改性赋予生物炭磁学性能,在外加磁场下可从应用环境中快速高效地剥离,进而提高生物炭的回收及重复利用性能。
3 总结与展望
尽管改性后的生物炭对Cr(Ⅵ)的去除效率显著提升,但如何更高效提升生物炭的吸附性能、更好地将其应用于实际生产中仍是科研工作者持续关注的方向。现有的研究尚处于实验室阶段,真实环境比实验室环境复杂得多,并且生物炭对环境的潜在影响也不清晰,因此,后续研究需注意以下问题。(1)系统深入地研究原料/热解条件与生物炭理化性质之间的关系(如生物炭结构与稳定性之间的关系;纤维素、半纤维素和木质素含量的作用等)。值得注意的是,若原料本身含有污染物(如某些类型的污水或污泥),则不应忽视污染物释放的相关风险。(2)改性生物炭去除Cr(Ⅵ)的过程主要涉及静电引力的吸附作用和氧化还原作用,“吸附-还原-再吸附”过程在很大程度上依赖于低pH 值的实验条件。由于实际土壤或水体环境通常偏中性,为了扩大生物炭在实际生产中的应用范围,克服生物炭吸附剂材料对Cr(Ⅵ)吸附的pH 值依赖性具有重要意义。(3)生物炭通过吸附或还原作用修复Cr(Ⅵ)污染的环境时,大多是将Cr(Ⅵ)转化为Cr(Ⅲ),降低Cr(Ⅵ)的迁移性和潜在毒性,但该过程中Cr 总量并未减少,吸附在生物炭上较为稳定的Cr(Ⅲ)很可能随着环境发生变化而再次造成二次污染。因此,实现吸附剂材料从环境中高效回收,降低可能的二次污染是需要高度重视的的问题。另外,还需要更深入地研究Cr(Ⅵ)还原过程中的电子转移机制,详细研究其它共存电子给体(如溶解性有机物)对电子转移过程的影响。(4)物理改性通常对能源要求较高;化学改性通常涉及多步骤反应,消耗化学试剂,存在高污染、有毒性等缺点,对于源自金属基质改性的生物炭,可能在吸附过程存在浸出现象,这是个棘手的技术问题;微生物改性生物炭同样存在微生物活性不高、无法大规模应用的局限。生物炭的改性策略并不是单一而独立的存在,发展简单、高效且易于工业化生产的方法,结合不同的改性策略,发挥协同作用,有望进一步提高生物炭对Cr(Ⅵ)的去除效率。未来可更多尝试将新型热解方法与新兴改性策略相结合生产更有效的生物炭,例如共热解不仅可降低富金属原料热解生物炭的环境风险,而且可作为合成生物炭与层状双氢氧化物等新兴纳米复合材料的新方法,提高生物炭的固碳潜力。(5)生物炭具有较窄的带隙、良好的可见光效应和电荷分离效率,能够有效降低光生电子-空穴的复合,这使其在光催化还原领域显示出良好的应用前景[64]。因此,可利用高温煅烧等手段将富集Cr(Ⅵ)后的生物炭转化为具有高附加值的光催化剂,并用于去除有机污染物,符合污染物减排、资源回收和环境材料再利用的绿色环保理念。
References
[1] AO M, CHEN X T, DENG T H, SUN S S, TANG Y T, MOREL J L, QIU R L. J. Hazard. Mater. , 2022, 424: 127233.
[2] CHEN Y N, LIANG W Y, LI Y P, WU Y X, CHEN Y R, XIAO W, LI Z, ZHANG J C, LI H. Chem. Eng. J. , 2019, 362: 144-159.
[3] HUI C, ZHANG Y P, NI X, CHENG Q L, ZHAO Y P, ZHAO Y H, DU L N, JIANG H. J. Hazard. Mater. , 2021, 406:124650.
[4] IHDE M H, TROPP J, DIAZ M D, SHILLER A M, AZOULAY J D, BONIZZONI M. Adv. Funct. Mater. , 2022, 32(33):2112634.
[5] HE Jie, YU Jia-Sheng, HUANG Zhong-Ping, ZHU Zuo-Yi, WANG Mu-Hua, WANG Na-Ni, ZHANG Jia-Jie, ZHANG Pei-Min, LI Gang, ZHU Yan. Chin. J. Anal. Chem. , 2014, 42(8): 1189-1194.
贺婕, 余家胜, 黄忠平, 朱作艺, 王幕华, 王娜妮, 张嘉捷, 张培敏, 李刚, 朱岩. 分析化学, 2014, 42(8): 1189-1194.
[6] WAN J, LIU F, WANG G H, LIANG W Y, PENG C, ZHANG W, LIN K F, YANG J. Bioresour. Technol. , 2021, 337:12538.
[7] YANG Z H, ZHANG X M, JIANG Z, LI Q, HUANG P C, ZHENG C J, LIAO Q, YANG W C. Sci. Total Environ. , 2021,773: 145654.
[8] JIANG X Y, TANG C C, ZHAO Z Y, LIAO Y X, ZHAO J H, HU J A, YU Q. ACS Sustainable. Chem. Eng. , 2023, 11:6610-6618.
[9] XIE Yue, LI Fei-Yue, FAN Xing-Jun, HU Shui-Jin, XIAO Xin, WANG Jian-Fei. Chin. J. Anal. Chem. , 2018, 46(4): 609-615.
谢越, 李飞越, 范行军, 胡水金, 肖新, 汪建飞. 分析化学, 2018, 46(4): 609-615.
[10] WANG J L, WANG S Z. J. Cleaner Prod. , 2019, 227: 1002-1022.
[11] ZHENG C J, YANG Z H, SI M Y, ZHU F, YANG W C, ZHAO F P, SHI Y. J. Hazard. Mater. , 2021, 407: 124376.
[12] CHEN H B, GAO Y R, LI J H, FANG Z, BOLAN N, BHATNAGAR A, GAO B, HOU D Y, WANG S S, SONG H, YANG X,SHAHEEN S M, MENG J, CHEN W F, RINKLEBE J, WANG H L. Carbon Res. , 2022, 1: 4.
[13] LIU Lu. Sichuan Chem. Ind. , 2019, 22(3): 14-16.
刘露. 四川化工, 2019, 22(3): 14-16.
[14] XIAO Y, LYU H H, TANG J C, WANG K, SUN H W. Chem. Eng. J. , 2020, 384: 123311.
[15] TANG J C, ZHAO B B, LYU H H, LI D. J. Hazard. Mater. , 2021, 413: 125415.
[16] SAJJADI B, BROOME J W, CHEN W Y, MATTERN D L, EGIEBOR N O, HAMMER N, SMITH C L. Ultrason. Sonochem. ,2019, 51: 20-30.
[17] WAHI R, ZUHAIDI N F, YUSOF Y, JAMEL J, KANAKARAJU D, NGAINI Z. Biomass Bioenergy, 2017, 107: 411-421.
[18] MASEK O, BUDARIN V, GRONNOW M, CROMBIE K, BROWNSORT P, FITZPATRICK E, HURST P. J. Anal. Appl.Pyrolysis, 2013, 100: 41-48.
[19] ZHANG T Y, WALAWENDER W P, FAN L T, FAN M F, DAUGAARD D, BROWN R C. Chem. Eng. J. , 2004, 105(1-2):53-59.
[20] KONCZAK M, HUBER M. J. Cleaner Prod. , 2022, 331: 129994.
[21] BISWAS A K, UMEKI K, YANG W H, BLASIAK W. Fuel Process. Technol. , 2011, 92(10): 1849-1854.
[22] PARAMESWARI E, KALAIARASI R, DAVAMANI V, KALAISELVI P, SEBASTIAN S P, SUGANYA K. Int. J. Environ.Anal. Chem. , 2023, 103(18): 6816-6834.
[23] SUN L, CHEN D M, WAN S G, YU Z B. Bioresour. Technol. , 2015, 198: 300-308.
[24] LONAPPAN L, LIU Y, ROUISSI T, BRAR S K, SURAMPALLI R Y. J. Cleaner Prod. , 2020, 244: 118841.
[25] DING Z H, HU X, WAN Y S, WANG S S, GAO B J. J. Ind. Eng. Chem. , 2016, 33: 239-245.
[26] QU J H, WANF Y X, TIAN X, JIANG Z, DENG F X, TAO Y, JIANG Q, WANG L, ZHANG Y. J. Hazard. Mater. , 2021,401: 12329.
[27] WANG X, FENG J H, CAI Y W, FANG M, KONG M G, ALSAEDI A, HAYAT T, TAN X L. Sci. Total Environ. , 2020,708: 134575.
[28] XIAO F F, CHENG J H, CAO W, YANG C, CHEN J F, LUO Z F. J. Colloid Interface Sci. , 2019, 540: 579-584.
[29] QU J H, DONG M, BI F X, TAO Y, WANG L, JIANG Z, ZHANG G S, ZHANG B, ZHANG Y. J. Cleaner Prod. , 2022, 346:131165.
[30] MA Y, LIU W J, ZHANG N, LI Y S, JIANG H, SHENG G P. Bioresour. Technol. , 2014, 169: 403-408.
[31] DENG J Q, LI X D, WEI X, LIU Y G, LIANG J, SHAO Y N, HUANG W, CHENG X J. Bioresour. Technol. , 2020, 310:123438.
[32] ZHU S S, HUANG X C, YANG X B, PENG P, LI Z P, JIN C. Environ. Sci. Technol. , 2020, 54(13): 8123-8132.
[33] GUO S S, WANG Y C, WEI X N, GAO Y F, XIAO B, YANG Y J. Environ. Sci. Pollut. Res. , 2020, 27(15): 18866-18874.
[34] CHAI Q W, LIN Y, JI X Q, YANG C P, HE S Y, ZHANG D. Environ. Sci. Pollut. Res. , 2018, 25(19): 18443-18450.
[35] ZHANG Y, CAO B, ZHAO L L, SUN L L, GAO Y, LI J J, YANG F. Appl. Surf. Sci. , 2018, 427: 147-155.
[36] DING K L, ZHOU X Y, HADIATULLAH H, LU Y L, ZHAO G Z, JIA S R, ZHANG R F, YAO Y P. J. Hazard. Mater. ,2021, 420: 126551.
[37] HU J, SHEN D K, WU S L, XIAO R. J. Anal. Appl. Pyrolysis, 2017, 127: 444-450.
[38] LING L L, LIU W J, ZHANG S, JIANG H. Environ. Sci. Technol. , 2017, 51(17): 10081-10089.
[39] MANEECHAKR P, MONGKOLLERTLOP S. J. Environ. Chem. Eng. , 2020, 8(6): 104467.
[40] ZHU N Y, YAN T M, QIAO J, CAO H L. Chemosphere, 2016, 164: 32-40.
[41] CHEN Y Y, WANG B Y, XIN J, SUN P, WU D. Ecotoxicol. Environ. Saf. , 2018, 164: 440-447.
[42] DONG F X, YAN L, ZHOU X H, HUANG S T, LIANG J Y, ZHANG W X, GUO Z W, GUO P R, QIAN W J. J. Hazard.Mater. , 2021, 416: 125930.
[43] SU H J, FANG Z Q, TSANG P E, ZHENG L C, CHENG W, FANG J Z, ZHAO D Y. J. Hazard. Mater. , 2016, 318: 533-540.
[44] XIE L H, CHEN Q J, LIU Y Y, MA Q Y, ZHANG J L, TANG C L, DUAN G L, LIN A J, ZHANG T T, LI S Y. Sci. Total Environ. , 2023, 905: 167399.
[45] LYU H H, TANG J C, HUANG Y, GAI L S, ZENG E Y, LIBER K, GONG Y Y. Chem. Eng. J. , 2017, 322: 516-524.
[46] LI S F, YOU T T, GUO Y, ZANG S H, XIAO M, ZHANG Z G, SHEN Y M. RSC Adv. , 2019, 9(22): 12428-12435.
[47] AHMAD S F, LIU X M, TANG J C, ZHANG S C. Chem. Eng. J. , 2022, 431: 133187.
[48] ZHANG S, LYU H H, TANG J C, SONG B R, ZHEN M N, LIU X M. Chemosphere, 2019, 217: 686-694.
[49] WANG H, ZHUANG M, SHAN L, WU J, QUAN G X, CUI L Q, ZHANG Y H, YAN J L. J. Hazard. Mater. , 2022, 423:127098.
[50] ZHANG S Q, ZHANG H Q, LIU F, YANG F, ZHOU S N, ZHENG K, CHU C L, JU M T. RSC Adv. , 2019, 9(54): 31333-31342.
[51] AKILA G K, CHANAKA M N, SAMEERA R, GUNATILAKE , MORGAN C. ACS Appl. Nano Mater. , 2019, 2(6): 3467-3479.
[52] SHI S Q, YANG J K, LIANG S, LI M Y, GAN Q, XIAO K K, HU J P. Sci. Total Environ. , 2018, 628-629: 499-508.
[53] FU G T, JIANG X, WU R, WEI S H, TANG Y W, LU T H, CHEN Y. ACS Appl. Mater. Interfaces, 2014, 6(24): 22790-22795.
[54] TAN H, WANG C, ZENG G Q, LUO Y, LI H, XU H. J. Hazard. Mater. , 2020, 386: 121628.
[55] WANG X T, LI H, HUANG H Y, LUO H Y, LUO S H, JIANG L L, SU F, XU H. J. Environ. Chem. Eng. , 2022, 10(3):107231.
[56] KAFIL M, BERNINGER F, KOUTRA E, KORNAROS M. Bioresour. Technol. , 2022, 346: 126665.
[57] CHEN Y Y, WU H X, SUN P, LIU J X, QIAO S X, ZHANG D K, ZHANG Z M. Front. Microbiol. , 2021, 12: 641913.
[58] ZHANG W X, CHENG H R, NIU Q, FU M L, HUANG H M, YE D Q. Environ. Sci. Technol. , 2019, 53(13): 7632-7640.
[59] KONG L, YAN R X, LIU M, XU J Q, HAGIO T, ICHINO R, LI L, CAO X D. J. Hazard. Mater. , 2022, 431: 128592.
[60] HERATH A, LAYNE C A, PEREZ F, HASSAN E B, PITTMAN C U, MISNA T E. Chemosphere, 2021, 269: 128409.
[61] HUANG T, CAO S, LUO D, ZHANG N, LEI Y Z, WANG Y. Chemosphere, 2022, 287: 132054.
[62] AMIN M, CHETPATTANANONDH P. Bioresour. Technol. , 2019, 289: 121578.
[63] ZHU Xiao-Li, LI Xue, KOU Zhi-Jian, WANG Jun-Qiang, SHANG Xiao-Qing, CHEN Chao. J. Agro-Environ. Sci. , 2021,40(4): 866-875.
朱晓丽, 李雪, 寇志健, 王军强, 尚小清, 陈超. 农业环境科学学报, 2021, 40(4): 866-875.
[64] MAO W, ZHANG L X, LIU Y, WANG T Y, BAI Y C, GUAN Y T. Chemosphere, 2021, 263: 127988.

