红鲫胚胎发育过程中Sox8基因对壬基酚胁迫的响应




摘要:【目的】明确红鲫SRY相关高迁移率族盒蛋白8基因(Sox8)表达模式及壬基酚(NP)暴露对红鲫胚胎发育过程中Sox8基因表达的影响,为揭示NP胁迫下红鲫胚胎发育畸形的分子机制提供科学依据。【方法】运用RACE克隆红 鲫Sox8基因cDNA全长序列,通过ProtParam、ProtScale、InterPro、PredictProtein、DeepTMHMM等在线软件进行生物信 息学分析,利用实时荧光定量PCR检测红鲫Sox8基因在各成体组织及不同胚胎发育阶段的表达情况,以及不同浓 度NP暴露对红鲫胚胎期Sox8基因表达的影响。【结果】红鲫Sox8基因cDNA序列全长2163bp,其开放阅读框(ORF)1176bp,共编码391个氨基酸残基;红鲫SOX8蛋白相对分子量为43798.30Da,理论等电点(pI)为6.90,脂溶指数为49.92,不稳定指数为66.04,总平均亲水性指数(GRAVY)为-1.026,其N端含有Sox_N二聚化结构域和HMG-box结构域;基于SOX8氨基酸序列相似性构建的系统发育进化树显示红鲫与鲫的亲缘关系最近。红鲫Sox8基因在各成体组织中广泛表达,以脑组织中的Sox8基因相对表达量最高,显著高于其他组织(Plt;0.05,下同);在红鲫胚胎发育过程中,Sox8基因的表达从受精后到14体节期呈逐渐下降趋势,但从21体节期开始Sox8基因相对表达量显著增高,直到孵化期始终维持在较高水平。在大多数情况下,NP暴露能显著影响红鲫胚胎发育过程中Sox8基因的表达,特别是14体节期后的发育阶段,NP暴露主要是不同程度地激活Sox8基因表达。【结论】Sox8基因表达在红鲫成体中具有组织特异性,且在胚胎发育过程中呈先降低后升高的变化趋势。NP暴露能显著影响红鲫胚胎发育过程中Sox8基因的表达,14体节期后Sox8基因表达水平升高可能是NP致畸红鲫胚胎的重要原因之一。
关键词:红鲫;Sox8基因;壬基酚;胚胎发育;毒性;致畸
文章编号:2095-1191(2024)04-1149-11
中图分类号:S965.117
文献标志码:A
Response of Sox8 gene to nonylphenol stress during red crucian carp(Carassius auratus red var.) development
ZHANG Qiong-yu1, PENG Juan1, TIAN Yu-su2, SUN Yuan-dong2*
(1School of Fundamental Sciences, Yongzhou Vocational Technical College, Yongzhou, Hunan 425100, China; 2School of Life and Health Sciences, Hunan University of Science and Technology, Xiangtan, Hunan 411201, China)
Abstract: 【Objective】To elucidate the expression pattern of the SRY-related high mobility group box protein 8 gene (Sox8) in red crucian carp (Carassius auratus red var.) and the impact of nonylphenol (NP) exposure on Sox8 gene expression during embryonic development, providing a scientific basis for uncovering the molecular mechanisms of NP- induced embryonic developmental deformities in red crucian carp. 【Method】The full-length cDNA sequence of Sox8 gene from red crucian carp was cloned using RACE technique. Bioinformatics analysis were conducted using online tools such as ProtParam, ProtScale, InterPro, PredictProtein and DeepTMHMM. Real-time fluorescence quantitative PCR was em- ployed to detect the expression of Sox8 gene in various adult tissues and at different embryonic developmental stages, as well as the effect of different NP concentrations exposure on Sox8 gene expression during the embryonic stage of red cru- cian carp. 【Result】The full-length cDNA sequence of Sox8 gene in red crucian carp was 2163 bp, with an open reading frame (ORF) of 1176 bp encoding 391 amino acid residues. The relative molecular weight of the SOX8 protein was 43798.30 Da, with a theoretical isoelectric point (pI) of 6.90, a lipophilicity index of 49.92, an instability index of66.04, and a grand average of hydropathicity (GRAVY) of -1.026. The N-terminus contained a Sox_N dimerization do-main and an HMG-box domain. Phylogenetic analysis based on the SOX8 amino acid sequences revealed a close relationship between C. auratus red var. and Carassius carassius (common crucian carp). The Sox8 gene was broadly expressed in various adult tissues of red crucian carp, with the highest relative expression in the brain, which was significantly higher than that in other tissues (Plt;0.05, the same below). During embryonic development, Sox8 gene expression decreased gradually from post-fertilization to the 14-somite stage, but significantly increased from the 21-somite stage, maintained at a high level until the hatching stage. Under most conditions, NP exposure significantly affected Sox8 gene expression during embryonic development of red crucian carp, particularly activating Sox8 gene expression to varying degrees after the 14-somite stage. 【Conclusion】Sox8 gene expression exhibits tissue specificity in adult red crucian carp and presents a trend of initial decrease followed by increase during embryonic development. NP exposure significantly affects Sox8 gene expression during embryonic development, with the increased expression of Sox8 gene after the 14-somite stage potentially contributing to NP-induced embryonic deformities in red crucian carp.
Key words: red crucian carp; Sox8 gene; nonylphenol; embryonic development; toxicity; deformity
Foundation items: National Natural Science Foundation of China (3187130957) ;Outstanding Youth Project of Scientific Research Fund of Hunan Education Department(21B0923)
0 引言
【研究意义】壬基酚(Nonylpheno,NP)是典型的烷基酚类环境激素,广泛应用于现代工业生产,通过污水进入水环境中而对各类水生动物的生理和发育造成负面影响,并经生物富集对人类健康造成威胁(Bhandari et al.,2021)。NP污染问题日趋严重,引起了社会的广泛关注,我国已将其列入《重点管控新污染物清单(2023年版)》。作为兼具食用与观赏经济价值的重要淡水鱼类——红鲫(Carassius auratusred var.)对NP较敏感,已有研究表明NP暴露可导致红鲫胚胎发育畸形(田雨苏等,2020)。SRY相关高迁移率族盒蛋白(SRY-related high mobility group box,Sox)基因家族是一类与Sry(Sex determining regionof Y chromosome)基因同源的转录因子,其编码蛋白SOX通过保守的高迁移率族盒(HMG-box)结构域与DNA结合,从而调控靶基因表达,在动物胚胎发育、细胞增殖和分化过程中挥重要作用(Wegner,2010;Haseeb and Lefebvre,2019)。根据序列同源性及蛋白结构特征,Sox基因家族又可分为SoxA~SoxK等11个亚族(Hu et al.,2021)。其中,SoxE亚族转录因子在软骨和骨发生、性别决定与分化、神经分化和神经系统发育及多种组织器官形成过程中发挥重要作用(She and Yang,2017;Weider and Wegner,2017;Lefebvre,2019)。Sox8基因是SoxE亚族的重要成员之一,因此,明确红鲫Sox8基因表达模式及其在胚胎发育阶段对NP胁迫的响应,对揭示NP致畸胚胎的分子毒理机制具有重要意义。【前人研究进展】NP对机体的影响已得到广泛关注。NP在机体内可模拟雌激素干扰内分泌代谢并引发机体多种毒性应答和应激反应,导致生殖系统、神经系统及免疫系统等受损(Corrêa et al.,2020)。除此之外,NP还具有显著的发育毒性作用(Sun et al.,2021)。在大鼠(Rat-tus norvegicus)中,NP可导致其卵黄囊生长和血管分化不良、胚胎生长迟缓及多个器官形态分化异常(龙鼎新等,2004)。在爪蟾(Xenopus laevis)中,NP可导致胚体长度缩短及弯曲、出现水肿和肠道卷曲异常,并干扰蝌蚪发育及变态发生(Sone et al.,2004;Xu et al.,2019)。在玫瑰无须鲃(Puntius con-chonius)中,NP会暴露引发受精卵发育延迟和胚胎脊椎畸形,其最敏感的阶段为体节形成期(肖勤和许玉艳,2010)。在斑马鱼(Danio rerio)中,NP暴露会影响斑马鱼的脊索形态发生、肌肉功能和神经内分泌系统,导致脊索畸形、运动能力下降及行为异常等(Chandrasekar et al.,2011;Phillips et al.,2022)。在红鲫中,NP暴露可导致胚胎脊柱弯曲、尾部畸形、心包异常和循环障碍等发育异常(田雨苏等,2020)。SoxE亚族基因包括Sox8、Sox9和Soxl0等3个主要成员,在诸多发育事件中扮演着重要角色(Haseeb and Lefebvre,2019)。其中,Sox9基因对多个器官的发育至关重要,包括骨骼、睾丸、心脏、肺脏、胰腺、肠道和神经系统(Ming et al.,2022);Soxl0基因主要参与神经嵴的诱导、发育、迁移和分化,以及神经胶质的发生(Stolt and Wegner,2010)。Sox8基因表达模式及其编码产物所结合的DNA靶序列与其他 SoxE 亚族基因成员类似(Schepers et al.,2000;Haseeb and Lefebvre,2019)。一般认为,Sox8基因是SoxE 亚族其他基因成员的备份,具有功能冗余或功能补偿的作用(Stolt et al.,2004;Barrionuevoand Scherer,2010;Richardson et al.,2020)。至今,已在包括斑马鱼、泥鳅(Misgurnus anguillicaudatus)、河豚(Takifugu rubripes)、牙鲆(Paralichthys oliva-ceus)、金头鲷(Sparus aurata)等多种鱼类中克隆获得 Sox8 基因,根据其表达模式,推测 Sox8基因在鱼类性别决定、性腺发育、神经发生及多种组织器官的形成过程中发挥重要作用(Hu et al.,2021)。[本研究切人点]目前,有关NP对动物发育毒性影响的研究主要聚焦在精子活性、半致死浓度(LCo)、致死率及形态学变化等方面(Hong et al.,2020),鲜见探究NP导致胚胎发育畸形的分子机制,尤其在胚胎发育的关键阶段尚未明确NP如何影响特定基因表达而导致胚胎发育异常。[拟解决的关键问题]克隆红鲫Sox8基因并进行生物信息学分析,利用实时荧光定量 PCR检测 Sox8 基因表达模式,同时探究NP暴露对红鲫胚胎发育过程Sox8基因表达的影响,为揭示NP胁迫下红鲫胚胎发育畸形的分子机制提供科学依据。
1 材料与方法
1.1试验材料
2龄性成熟红鲫(体质量约200±10g,平均体长 15±3cm)取自湖南省水产养殖实践教学示范中心。 试验前将12尾红鲫暂养于(25±1)°℃的室内淡水池 中,每天上午8:00-9:30和下午16:00-17:30各投 喂1次商业饲料,2次投喂需间隔8h。暂养1周后观 察无异常症状即进行后续试验。动物试验由永州职 业技术学院科技伦理委员会审查和批准,批准号EAE-YZZY-2022-P02。
随机选取3尾红鲫,麻醉后剖检采集鳃、肝脏、 脾脏、肠道、头肾、肾脏、肌肉、心脏、脑、垂体及精巢/ 卵巢等组织样品,液氮速冻后置于-80℃冰箱保存备 用。红鲫胚胎在繁殖季节通过干法人工授精获得: 将卵子和精液挤入干燥的培养皿中,用羽毛轻轻搅 拌,使卵子与精子充分结合,30s后加入曝气水激活 精子,使卵子受精。受精5min后将培养皿中的曝气 水换成不同浓度的NP试验液,体视显微镜下观察胚 胎发育过程,用镊子挑走未受精卵,再进行后续试 验。胚胎发育时期参考Tsai等(2013)的研究结果进 行判断确定。
1.2试验方法
1.2.1胚胎毒性试验
以无水乙醇为助溶剂配制NP储备液,4℃避光保存备用。用曝气水配制NP试验液,最终乙醇体积分数控制不超过0.01%(以免造成胚胎死亡和器官发育畸形)。通过预试验确定红鲫胚胎对NP的敏感性,结果显示,NP处理74h的红鲫胚胎LC3。为3.51umol/L;当NP浓度提升至5 umol/L时,胚胎发育的畸形表型更明显;当NP浓度增加至7umol/L时,胚胎存活率急剧下降。基于此,NP暴露胚胎毒性试验设3个浓度组(3、5和7umol/L)和1个空白对照组(0.01%无水乙醇,CK),每个浓度设3个平行。受精5min后,将红鲫受精卵(200枚/组)分别暴露于不同浓度的NP试验液中,置于(25±1)℃下继续孵育。各处理组分别在神经胚期(Neurula stage,N)、5体节期(5-somitestage,5S)、14体节期(14-somite stage,14S)、21体节期(21-somite stage,21S)、25%耳囊闭合期(25% oticvesicle closure stage,25% OVC)、65%耳囊闭合期(65%OVC)及孵化期(Hatching period,H)等7个发育时期,混合取样12~20枚胚胎,液氮冻存备用。
1.2.2总RNA提取及cDNA合
成采用TRIzol分别提取红鲫各成体组织及不同发育时期胚胎材料的总RNA,以DNase I(TaKaRa)处理去除基因组DNA,然后通过琼脂糖凝胶电泳和NanoDrop2000超微量分光光度计检测总RNA质量及其浓度。利用Oligo(dT)接头引物和ReverTra Ace逆转录酶(日本TOYOBO公司)将红鲫成体组织及不同发育阶段胚胎的总RNA逆转录合成cDNA第一条链。
1.2.3红鲫Sox8基因克隆
根据GenBank已公布的鲫Sox8基因(XM 026277412.1)和鲤Sox8基因(XM019063104.1)的编码区保守序列设计引物(表1),以神经胚期红鲫胚胎RNA逆转录合成的cDNA为模板进行PCR扩增。PCR反应体系25.0μL:10×Ex Taq Buffer (Mg2+ Plus) 2.5 uL, dNTP Mixture(2.5 mmol/L)2.0 μL,Sox8-F/Sox8-R(10 umol/L)各1.0 μL,cDNA模板1.0 μL,Ex Taq DNA聚合酶(5U/pL)0.25uL,ddH2O补足至25.0μL。扩增程序:94℃预变性5min;94℃30s,53℃30s,72℃1min,进行35个循环;72℃延伸10min。目的片段经纯化回收及测序后,通过NCBI网站(https:∥/www.ncbi.nlm.nih.gov)的BLAST功能进行序列比对分析,以确认其是否扩增获得红鲫Sox8基因cDNA序列。依据已获得的Sox8基因cDNA序列设计合成特异的3'-RACE和5'-RACE嵌套扩增引物(表1),然后按照 SMARTTM RACE cDNA Amplification Kit(Clonetech)说明完成3'-RACE和5'-RACE扩增(张琼宇等,2020)。RACE扩增产物经纯化回收及测序鉴定后,与扩增获得的cDNA序列进行拼接,得到红鲫Sox8基因cDNA全长序列,并提交至GenBank。所有扩增引物合成及测序均委托天一辉远生物科技有限公司完成。
1.2.4生物信息学分析
利用DNASTAR7.0中的SeqMan功能进行序列拼接,以获得Sox8基因cDNA全长序列。使用ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)查找开放阅读框(ORF)并推导其氨基酸序列;通过ProtParam(https://web.expasy.org/protparam/)预测SOX8蛋白理化性质;运用Prot-Scale(https://www.expasy.org/resources/protscale)预测 SOX8 蛋白亲/疏水性;采用InterPro(http://www.ebi.ac.uk/interpro/)预测 SOX8 蛋白保守结构域;以PredictProtein(https://predictprotein.org/)预测 SOX8蛋白序列核定位信号(Nuclear localization signal,NLS)及核输出信号(Nuclear export signal, NES);使用DeepTMHMM(https://dtu.biolib.com/DeepTMHMM)预测 SOX8蛋白跨膜结构;利用NetPhos 3.1(http://www.cbs.dtu.dk/services/NetPhos/)查找 SOX8 氨基酸磷酸化位点;通过 SOPMA(https://npsa-prabi.ibcpfr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)和 SWISS-MODEL(http://swissmodel.expasy.org/)分别预测 SOX8蛋白二、三级结构;运用BLASTp(https://blast. ncbi.nlm.nih.gov/Blast.cgi)搜索GenBank的 Nr数据库,进行 SOX8 氨基酸序列同源比对分析;在MEGA 11.0 中利用ClustalW 进行多序列比对,并通过邻接法(Neighbor-joining,NJ)构建系统发育进化树,Bootstrap设为1000次(潘传燕等,2021)。
1.2.5实时荧光定量PCR检测
根据Sox8基因 cDNA全长序列设计实时荧光定量PCR扩增引物Sox8-qF和Sox8-qR(表1),利用NCBI网站的BLAST功能对引物特异性进行评价,并通过SDS-PAGE电泳检测其目的条带,然后利用StepOnePlusTM Real-Time PCR System(ABI)检测Sox8基因在红鲫各成 体组织和胚胎样本中的相对表达量。各成体组织或 不同发育阶段的胚胎材料均来源于3次独立采样, 每个样本设3次重复。以β-Actin为内参基因,采用 2:A△a法计算相对表达量(Livak and Schmittgen, 2001)。比较不同组织中Sox8基因表达水平时,以心脏中的Sox8基因表达量为基线(1.0);比较不同发育阶段Sox8基因表达水平时,则以对照组神经胚期胚胎Sox8基因表达量为基线(1.0)。
1.3统计分析
试验数据通过SPSS20.0进行单因素方差分析(One-way ANOVA)及Tukey's多重比较检验,并以GraphPad Prism 8制图。
2结果与分析
2.1红鲫Sox8基因cDNA序列及其推导氨基酸序列分析结果
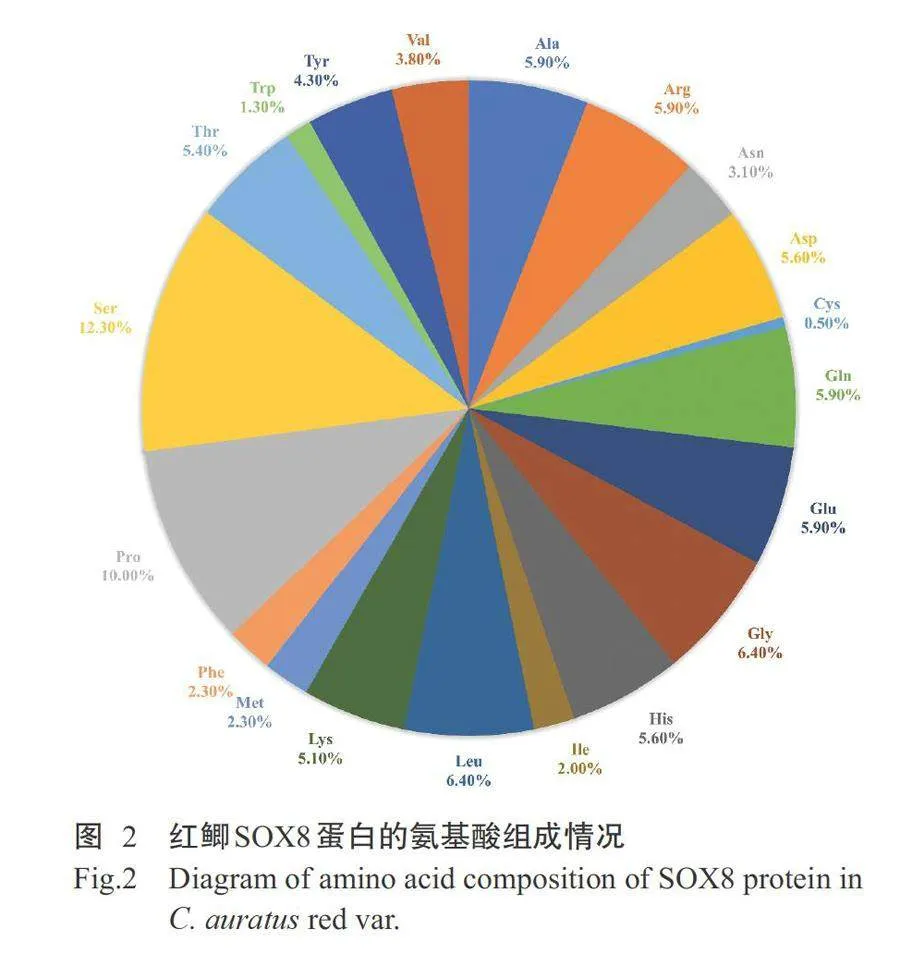
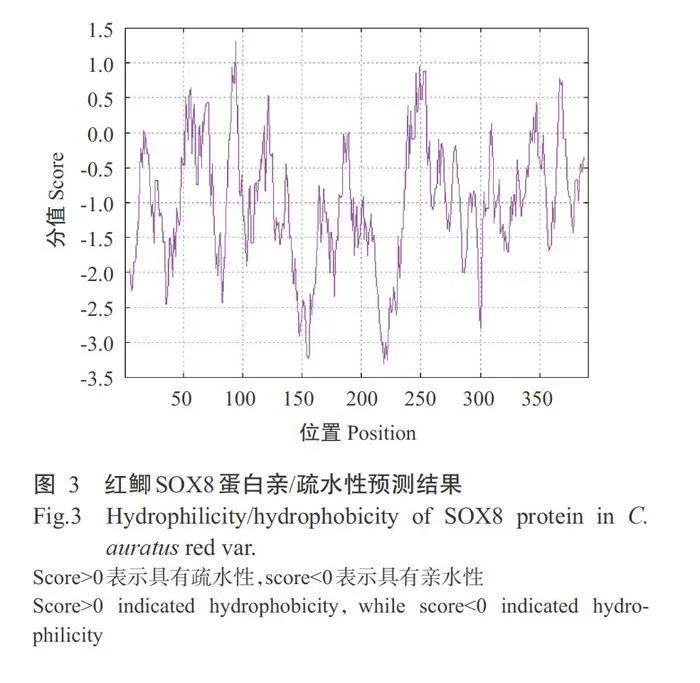
红鲫Sox8基因cDNA序列(GenBank登录号MT322309)全长2163bp,包含1176bp的ORF、194bp的5'非编码区(5'-UTR)和793bp的3'非编码区(3'-UTR),且3'-UTR含有2个“aataa”多聚腺苷酸加尾信号(图1)。红鲫Sox8基因共编码391个氨基酸残基,以丝氨酸(Ser)和脯氨酸(Pro)的含量较高,分别占12.30%和10.00%(图2)。红鲫SOX8蛋白分子式为C191H292N564O603S11,相对分子量为43798.30 Da,理论等电点(pI)为6.90,脂溶指数为49.92,不稳定指数为66.04。ProtScale预测结果表明,红鲫SOX8蛋白序列中位于第94位的色氨酸(Trp)得分为1.300,疏水性最强;位于第219位的天冬酰胺(Asn)得分为-3.300,亲水性最强;总平均亲水性指数(GRAVY)为-1.026(图3),即该蛋白是一种不稳定的酸性亲水性蛋白。NetPhos3.1预测分析发现,红鲫SOX8蛋白 含有36个丝氨酸磷酸化位点、12个苏氨酸磷酸化位 点和8个酪氨酸磷酸化位点。InterPro预测结果表明,在红鲫SOX8蛋白序列第10~72位氨基酸为Sox N二聚化结构域,含特征性基序“YDW”;第82~160位氨基酸是SOX蛋白家族特有的HMG-box结构域,含特征性基序“AQAARRKL”及2个独立的NLS和1个NES(图1)。DeepTMHMM预测结果显示,红鲫SOX8蛋白不含跨膜结构。
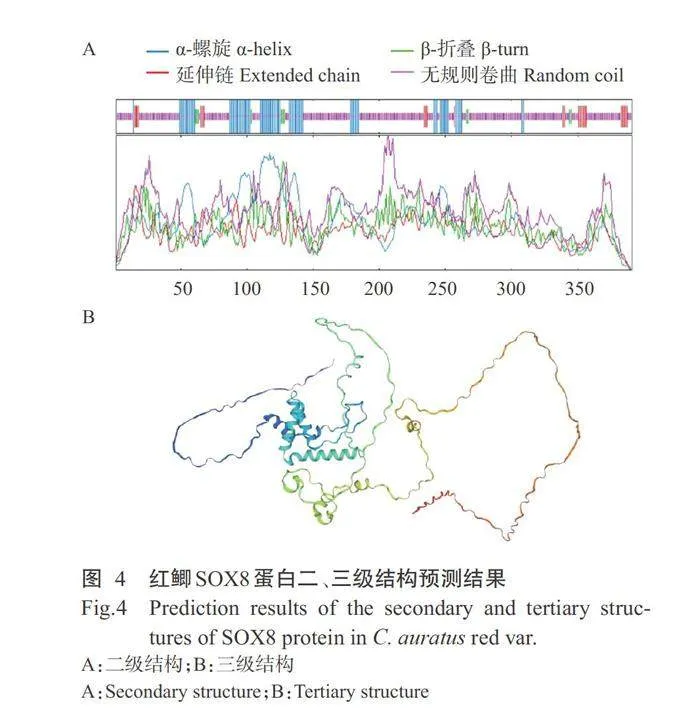
利用SOPMA预测红鲫SOX蛋白二级结构,结 果显示,该蛋白二级结构由无规则卷曲、α-螺旋、 延伸链和β-折叠组成,其中,无规则卷曲占70.34%,
a-螺旋占20.46%,延伸链占6.39%,β-折叠占2.81% (图4-A)。以斑马鱼SOX8蛋白三级结构(A0A0R4ITJ3.1.A)为模板,通过SWISS-MODEL对红鲫SOX8蛋白三级结构进行建模,结果(图4-B)显示,红鲫SOX8蛋白三级结构与模板的一致性为81.56%,模型覆盖率为98.0%,主要由无规则卷曲和a-螺旋组 成,与其二级结构预测结果一致。
2.2同源比对分析及系统发育进化树的构建
通过NCBI查找红鲫SOX8蛋白的直系同源物, 经BLASTp在线比对发现红鲫SOX8蛋白与其他物 种SOX8蛋白的HMG-box结构域氨基酸序列高度
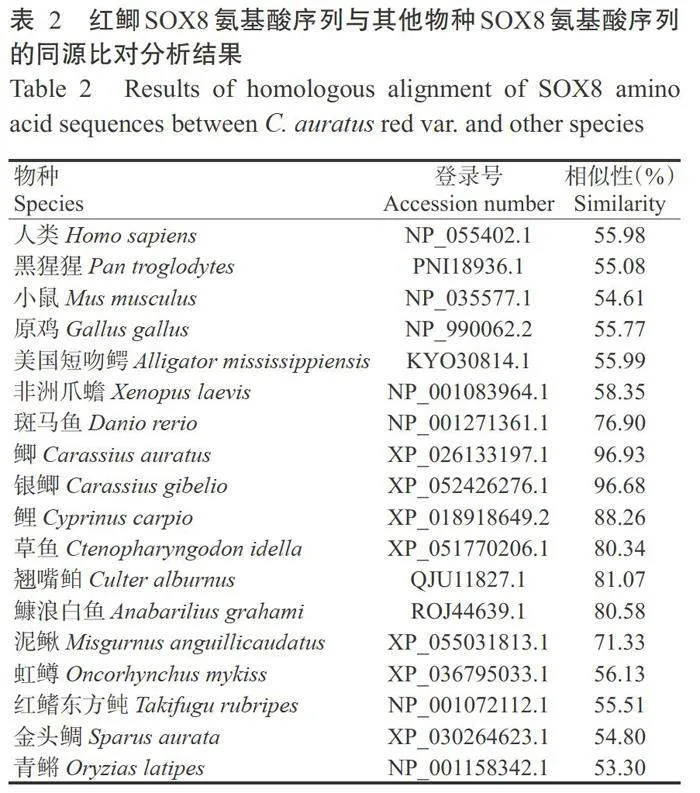
一致(图5),说明该结构域高度保守。同源比对分析 结果(表2)显示,红鲫SOX8氨基酸序列与其他鲤形目鱼类的SOX8氨基酸序列高度同源,与泥鳅、斑马 鱼、翘嘴鲌(Culter alburnus)鱇浪白鱼(Anabarilius grahami)、草鱼(Ctenopharyngodon idella)、鲤(Cyp- rinus carpio)、鲫(C.auratus)和银鲫(C.gibelio)的SOX8氨基酸序列相似性为71.33%~96.93%;与非鲤形目鱼类的SOX8氨基酸序列相似性较低,与 青鳉(Oryzias latipes)、金头鲷、红鳍东方鲀(Takifugu rubripes)和虹鳟(Oncorhynchus mykiss)的SOX8氨基酸序列相似性为53.30%~56.13%;与哺乳、鸟类、 爬行、两栖等脊椎动物的SOX8氨基酸序列相似性 为54.61%~58.35%。
基于SOX8氨基酸序列相似性,以MEGA11.0的NJ法构建系统发育进化树,结果(图6)显示,构建 的系统发育进化树分为两大支,所有鱼类聚为一支, 而哺乳、鸟类、爬行、两栖等脊椎动物聚为一支。其中,红鲫与鲫的亲缘关系最近,最先聚类在一起,再与其他鲤形目鱼类聚为一小支。可见,基于SOX8氨基酸序列相似性构建的系统发育进化树反映了这些物种在进化过程中的遗传关系。
2.3红鲫Sox8基因在各成体组织中的表达
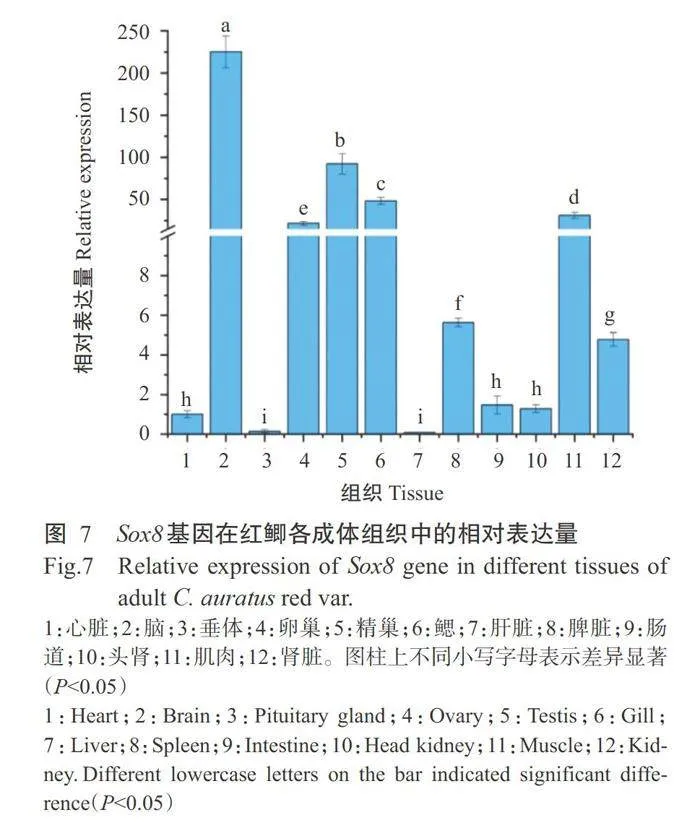
情况以β-Actin为内参基因,通过实时荧光定量PCR检测红鲫Sox8基因在各成体组织中的表达情况, 结果显示,在心脏、脑、垂体、卵巢/精巢、鳃、肝脏、脾 脏、肠道、头肾、肌肉及肾脏等组织中均可检测到 Sox8基因表达。以心脏中Sox8基因表达量为基线(1.0),进一步对其他组织中的Sox8基因表达量进行数据校准,结果(图7)表明,以脑组织中的Sox8基因 相对表达量最高(225.10倍),显著高于其他组织中 的相对表达量(Plt;0.05,下同);其次是精巢(92.23 倍)、鳃组织(48.32倍)、肌肉(31.09倍)及卵巢(21.61 倍);在垂体和肝脏中的相对表达量较低,显著低于 其他组织中的相对表达量。
2.4红鲫Sox8基因在不同胚胎发育阶段的表达情况
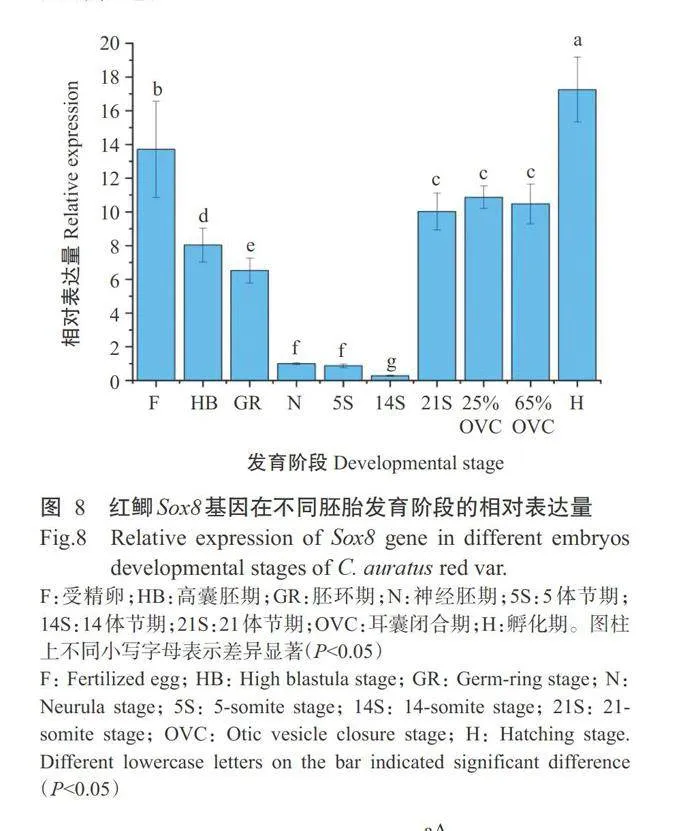
采用实时荧光定量PCR检测红鲫Sox8基因在 不同胚胎发育阶段的表达情况,结果(图8)显示,在 正常胚胎发育过程中红鲫Sox8基因相对表达量呈 先降低后升高的变化趋势。受精后,随着胚胎发育 的进行,红鲫Sox8基因相对表达量逐渐降低,至14S 期降至最低值,显著低于其他发育阶段的相对表达 量;但从21S期开始红鲫Sox8基因相对表达量迅速 增加,且一直维持在较高水平,H期的相对表达量达 最高值,显著高于其他发育阶段的相对表达量。
2.5NP暴露对红鲫胚胎期Sox8基因表达的影响
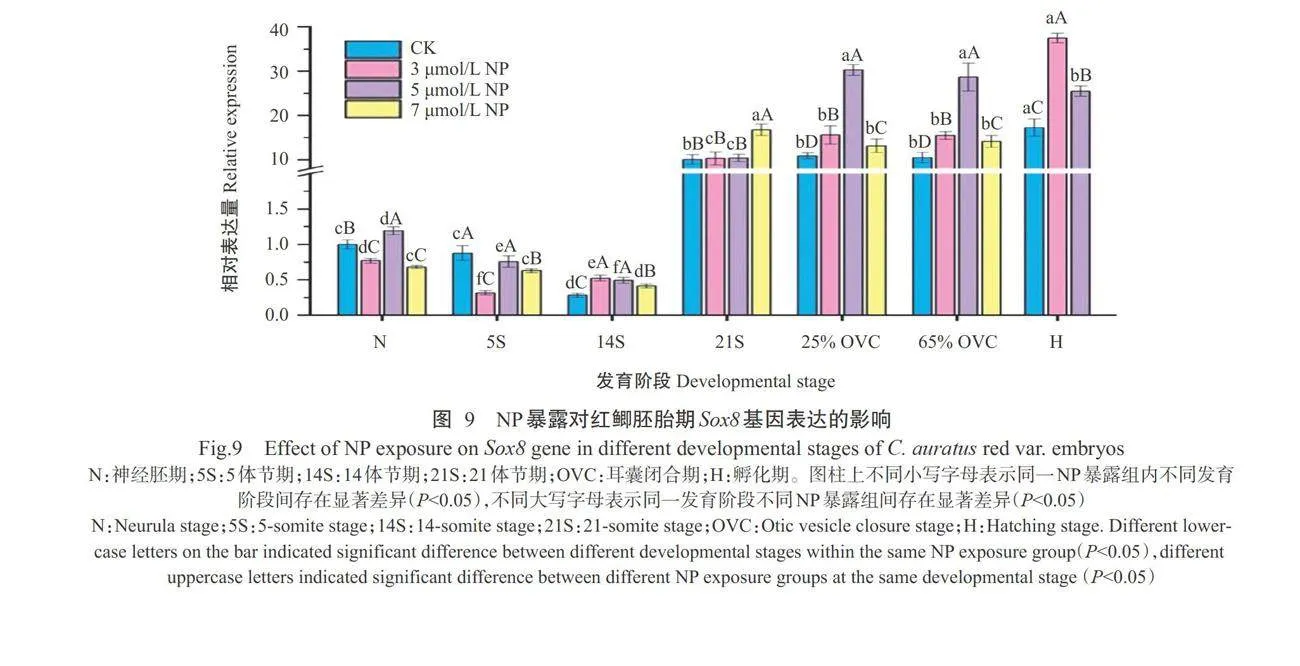
通过比较各发育阶段正常胚胎和NP暴露胚胎 中的Sox8基因表达情况,以确定NP暴露对红鲫胚胎期Sox8基因表达的影响。实时荧光定量PCR检测结果(图9)显示,在胚胎发育过程中,3umol/LNP 暴露组红鲫胚胎中Sox8基因相对表达量的最低值 出现在5S期,最高值出现在H期;Sox8基因在N期、5S期、14S期、25%OVC期、65%OVC期和H期的相对表达量与CK正常胚胎间存在显著差异。5umol/LNP 暴露组红鲫胚胎中Sox8基因相对表达量的最低值 出现在14S期,最高值出现在25%OVC期;Sox8基因在N期、14S期、25%OVC期、65%OVC期和H期的相对表达量与CK组正常胚胎间存在显著差异。7umol/LNP暴露组红鲫胚胎中Sox8基因相对表达量的最低值出现在14S期,最高值出现在21S期;Sox8基因在N期、5S期、14S期、21S期、25%OVC期 和65%OVC期的相对表达量与CK组正常胚胎间存 在显著差异(7μmol/LNP暴露组H期因没有存活 胚胎而缺少相关数据)。综上所述,在大多数情况 下,NP暴露能显著影响红鲫胚胎发育过程中Sox8基 因的表达。
3讨论本研究通过RACE克隆获得的红鲫Sox8基因 cDNA序列全长2163bp,共编码391个氨基酸残基;红鲫SOX8蛋白是一种不稳定的酸性亲水性蛋白, 与其他鲤形目鱼类的SOX8氨基酸序列相似性较 高,在其N端含有Sox N二聚化结构域和HMG-box结构域,其中,HMG-box结构域氨基酸序列与其他物种SOX8蛋白的HMG-box结构域氨基酸序列高度一致,含有2个独立的NLS(NLS1和NLS2)及1个NES,表明SOX蛋白功能在进化过程中非常保守,也提示红鲫SOX8蛋白可形成同源或异源二聚体,通过HMG-box结构域与DNA核心基序(A/T)(A/T)CAA(A/T)G相结合,而调控下游基因表达,进而在胚胎发育及细胞分化过程中发挥重要作用(Kondoh and Kamachi,2010)。红鲫SOX8氨基酸序列与鲫、银鲫的SOX8氨基酸序列相似性分别为96.93%和96.68%,低于鲫与银鲫的SOX8氨基酸序列相似性 (99.00%)。由于红鲫长期由人工饲养、驯化及选育(吴端生,2016),与鲫和银鲫在自然界的生存条件明 显不同,因此这种氨基酸序列差异可能源于人工环 境中的选择压力和遗传漂变。
实时荧光定量PCR检测结果显示,红鲫Sox8基 因在成体多种组织中广泛表达,但不同组织中的相 对表达量存在差异,相对表达量较高的是脑和精巢, 其次是鳃、肌肉和卵巢,呈现明显的组织表达特异 性,与在许多其他鱼类中观察到Sox8基因主要表达于神经系统、性腺和骨骼肌(Hu et al.,2021)的结论基本一致。已有研究表明,Sox8基因在这些器官系 统中发挥重要功能作用。在哺乳动物和两栖动物 中,Sox8基因在神经胶质的特化过程中发挥重要作 用(Weider and Wegner,2017);在小鼠性腺发育过程中,虽然Sox8基因不起决定性作用,但在小鼠出生 后其表达对血睾屏障形成及精子发生微环境的维持 具有重要意义(Barrionuevo et al.,2009);Sox8在哺 乳动物胚胎肌肉发生时高表达,而成体骨骼肌中 Sox8基因的表达局限于肌卫星细胞中,以维持其未分化的状态(Schmidt et al.,2003)。此外,红鲫Sox8 基因在精巢中的相对表达量明显高于卵巢,与在大 鳞副泥鳅(Xia et al.,2010)、泥鳅(Xia et al.,2011)和牙鲆(Yu et al.,2019)中的研究结论一致,故推测 Sox8基因对促进精巢发育分化及维持雄性生育能力 更重要。
在红鲫胚胎发育过程中,Sox8基因从受精后到14体节期呈逐渐下降趋势,但从21体节期开始Sox8基因相对表达量显著增高,直到孵化期始终维持在 较高水平,在其他脊椎动物胚胎中也有类似的表达模式(Sock et al.,2001;Xia et al.,2010,2011;Yu etal.,2019)。综合考虑到Sox8基因在红鲫成体组织中广泛表达,提示Sox8基因在体节形成后的发育过 程中参与多个组织器官形成及其功能维持。实时荧 光定量PCR检测结果表明,NP暴露能显著影响红鲫胚胎发育过程中Sox8基因的表达。虽然不同浓度 NP暴露对红鲫胚胎发育过程中Sox8基因表达的影 响存在差异,有时呈上调表达,有时呈下调表达,但 发育至14体节期后,NP暴露主要是不同程度地激活Sox8基因表达。田雨苏等(2020)观察到NP暴露组红鲫胚胎均在胚体伸长后出现明显畸形,与Sox8基因表达的升高同步发生。因此,推测Sox8基因表达水平升高在NP致畸红鲫胚胎中发挥重要作用。
目前,SoxE亚族基因功能研究最清楚的是Sox9基因。在Sox9基因缺陷型小鼠及其他物种中的研究已证实,Sox9基因在骨骼、性腺、心脏、视网膜、胰 腺、神经系统等多个器官系统的发育过程中发挥重 要作用(Ming et al.,2022)。一般认为,Sox8基因在功能上与Sox9基因存在冗余或补偿关系,但也有研 究指出Sox8基因在发育过程中具有其独特的生物 学功能。在小鼠中,Sox8基因参与睾丸分化及其性功能维持,成体支持细胞产生的SOX8蛋白对维持精子发生和正常精子功能至关重要(O'Bryan et al.,2008);Sox8基因还是肌卫星细胞的特异性标记物, 对保持肌卫星细胞的未分化状态起重要作用,过 表达Sox8基因可抑制成肌细胞分化为肌纤维 (Schmidt et al.,2003)。在鸡胚中,Sox8基因是启动 耳形态发生的主调控基因,能诱导颅外胚层发育产 生耳(Buzzi et al.,2022)。在中华绒螯蟹中,骨形态发生蛋白2基因(Bmp2)是SOX8蛋白的潜在靶基因,体外试验证实SOX8蛋白可通过结合Bmp2基因启动子而激活其转录(Jia et al.,2022)。本课题组前期研究观察到,红鲫胚胎暴露于NP后,在胚体尾部 延伸阶段出现明显的脊椎畸形、神经管缺损、尾部向上卷曲和肌纤维分化异常等发育畸形现象(田雨苏 等,2020)。这些畸形可能与NP暴露导致14体节期后Sox8基因的过表达有关,但NP调控Sox8基因表 达的具体分子机制还需进一步研究证实。
4 结论
Sox8基因表达在红鲫成体中具有组织特异性, 且在胚胎发育过程中呈先降低后升高的变化趋势。NP暴露能显著影响红鲫胚胎发育过程中Sox8基因的表达,14体节期后Sox8基因表达水平升高可能是NP致畸红鲫胚胎的重要原因之一。
参考文献(References):
龙鼎新,李勇,裴新荣.2004.壬基酚对体外培养大鼠胚胎发 育的毒性研究[J].中国公共卫生,20(1):13-15.[LongDX,Li Y,Pei X R. 2004. Study on developmental toxicity of 4-nonylphenol on cultured rat embryos [J]. Chinese Journal of Public Health, 20 (1) : 13-15.] doi: 10.3321/j. issn:1001-0580.2004.01.009.
潘传燕,余艳玲,罗洪林,冯鹏霏,宋漫玲,肖蕊,张永德.2021.卵形鲳JunB基因克隆及其胚胎组织表达分析[J].南方农业学报,52(11):3102-3110.[PanCY,YuYL, Luo H L, Feng P F, Song M L,Xiao R, Zhang Y D. 2021. Cloning of JunB gene in Trachinotus ovatus and its expres- sion in embryonic tissues[J]. Journal of Southern Agricul- ture, 52 (11) : 3102 -3110.] doi: 10.3969/j.issn.2095-1191.2021.11.022.
田雨苏,孙远东,欧密,刘雨芳,崔小娟,周定港,车文安,陈昆 慈.2020.壬基酚致红鲫发育畸形的机制[J].水产学报,44(10):1619-1636. [Tian Y S,Sun Y D, Ou M,Liu Y F, Cui X J, Zhou D G, Che W A, Chen K C. 2020. Preliminary studies on the mechanism of nonylphenol-induced malformation of Carassius auratus red var.[J]. Journal of Fisheries of China, 44(10): 1619-1636.] doi: 10.11964/jfc.20190911996.
吴端生.2016.实验红鲫标准化研究与应用的现状及展望[J].实验动物科学,33(3):56-60.[Wu D S.2016.Cur-rent situation and prospect of the standardization researchand application of laboratory red crucian carp [J]. Labora-tory Animal Science, 33 (3) : 56-60.] doi: 10.3969/j. issn.1006-6179.2016.03.010.
肖勤,许玉艳.2010.壬基酚对玫瑰无须鲃(Puntius concho-nius)胚胎发育的影响[J].安全与环境学报,10(6):9-12.[Xiao Q, Xu Y Y. 2010. On the effects of nonylphenol onthe embryonic development of Puntius conchonius[J]. Jour-nal of Safety and Environment, 10(6):9-12.] doi:10.3969/j.issn.1009-6094.2010.06.003.
张琼宇,胡海星,唐云云,罗湘玲,孙远东.2020.金鱼etv2基因的克隆及在雌核发育单倍体和自交二倍体胚胎中的差异表达[J].水生生物学报,44(6):1159-1167.[ZhangQY,Hu H X,Tang Y Y,Luo X L, Sun Y D. 2020. Cloningand expression of etv2 in gynogenetic haploid and inbreddiploid embryos of goldfish, Carassius auratus [J]. ActaHydrobiologica Sinica, 44 (6) : 1159-1167.] doi: 10.7541/2020.134.
Barrionuevo F, Georg I, Scherthan H, Lécureuil C, Guillou F,Wegner M, Scherer G. 2009. Testis cord differentiationafter the sex determination stage is independent of Sox9but fails in the combined absence of Sox9 and Sox8[J].Developmental Biology , 327 (2) : 301-312. doi : 10.1016/j.ydbio.2008.12.011.
Barrionuevo F,Scherer G. 2010. SOXE genes:SOX9 and SOX8 in mammalian testis development[J]. The International Journal of Biochemistry amp; Cell Biology, 42 (3):433-436.doi:10.1016/j.biocel.2009.07.015.
Bhandari G, Bagheri A R, Bhatt P, Bilal M. 2021. Occurrence, potential ecological risks,and degradation of endocrine disrupter,nonylphenol, from the aqueous environment[J]. Chemosphere, 275: 130013. doi: 10.1016/j. chemosphere.2021.
130013. Buzzi A L, Chen J C, Thiery A, Delile J, Streit A. 2022. Sox8 remodels the cranial ectoderm to generate the ear[J]. Proceedings of the National Academy of Sciences of the United States of America, 119 (28) : e2118938119. doi: 10.1073/pnas.2118938119.
Chandrasekar G, Arner A, Kitambi S S, Dahlman-Wright K, Lendahl M A. 2011. Developmental toxicity of the environmental pollutant 4-nonylphenol in zebrafish[J]. Neurotoxicology and Teratology,33(6): 752-764. doi: 10.1016/j.ntt.2011.09.009.
Corrêa J M M, Sanson A L, Machado C F, Aquino S F, Afonso R J C F. 2020. Occurrence of contaminants of emerging concern in surface waters from Paraopeba River Basin in Brazil: Seasonal changes and risk assessment[J]. Environ- mental Science and Pollution Research, 28: 30242-30254.doi:10.1007/s11356-021-12787-z.
Haseeb A, Lefebvre V. 2019. The SOXE transcription factorsSOX8, SOX9 and SOX10—Share a bi-partite transactiva- tion mechanism[J]. Nucleic Acids Research,47(13) :6917-6931. doi: 10.1093/nar/gkz523.
Hong Y J,Feng C L, Yan Z F, Wang Y, Liu D Q, Liao W,Bai Y C. 2020. Nonylphenol occurrence, distribution, toxicity and analytical methods in freshwater [J]. Environmental Chemistry Letters,18:2095-2106. doi:10.1007/s10311-020-01060-3.
Hu Y C,Wang B Z,Du H J. 2021. A review on sox genes in fish [J]. Reviews in Aquaculture, 13 (4) : 1986-2003. doi: 10.1111/raq.12554.
Jia K, Tan F Q, Hao S L, Yang W X. 2022. Es-SOX8 regulates the morphological changes of the sperm nucleus of Eriocheir sinensis by activating Es-BMP2 transcription[J]. Biocell,46(11):2399-2413. doi:10.32604/biocell.2022.022015.
Kondoh H,Kamachi Y. 2010. SOX-partner code for cell specifi-
cation: Regulatory target selection and underlying molecular mechanisms[J]. The International Journal of Biochemistry amp; Cell Biology,42(3):391-399. doi: 10.1016/j.biocel.2009.09.003.
Lefebvre V. 2019. Chapter Seven—Roles and regulation of SOX transcription factors in skeletogenesis [J]. Current To- pics in Developmental Biology, 133: 171-193. doi: 10.1016/ bs.ctdb.2019.01.007.
Livak K J, Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2=AAcT method[J]. Methods, 25(4) :402-408. doi: 10.1006/meth.2001.1262.
Ming Z H, Vining B,Bagheri-Fam S,Harley V. 2022. SOX9 in
organogenesis: Shared and unique transcriptional functions [J]. Cellular and Molecular Life Sciences, 79 (10) : 522.doi:10.1007/s00018-022-04543-4.
O'Bryan M K, Takada S, Kennedy C L, Scott G, Harada S I, Ray M K, Dai Q S, Wilhelm D, de Kretser D M, Eddy E M, Koopman P, Mishina Y. 2008. Sox8 is a critical regulator of adult Sertoli cell function and male fertility[J].
Developmental Biology, 316 (2) : 359-370. doi: 10.1016/j.ydbio.2008.01.042.
Phillips J, Haimbaugh A S, Akemann C,Shields J N, Wu C C, Meyer D N, Baker B B, Siddiqua Z, Pitts D K, Baker T R.
2022. Developmental phenotypic and transcriptomic effects of exposure to nanomolar levels of 4-nonylphenol, triclosan, and triclocarban in zebrafish (Danio rerio) [J].
Toxics, 10(2): 53. doi: 10.3390/toxics10020053.
Richardson N, Gillot I, Gregoire E P, Youssef S A, de Rooij D, de Bruin A, de Cian M, Chaboissier M C. 2020. Sox8 and Sox9 act redundantly for ovarian-to-testicular fate reprogramming in the absence of R-spondinl in mouse sex reversals[J]. eLife,9: e53972. doi:10.7554/eLife.53972.
Schepers G E, Bullejos M, Hosking B M, Koopman P. 2000. Cloning and characterisation of the Sry-related transcription factor gene Sox8[J]. Nucleic Acids Research, 28 (6): 1473-1480. doi:10.1093/nar/28.6.1473.
Schmidt K, Glaser G, Wernig A, Wegner M, Rosorius O. 2003. Sox8 is a specific marker for muscle satellite cells and inhibits myogenesis [J]. Journal of Biological Chemistry,278(32):29769-29775. doi:10.1074/jbc.M301539200.
She Z Y,Yang W X. 2017. Sry and SoxE genes:How they participate in mammalian sex determination and gonadal development?[J]. Seminars in Cell amp; Developmental Biology,63:13-22. doi:10.1016/j.semcdb.2016.07.032.
Sock E, Schmidt K, Hermanns-Borgmeyer I, Bösl M R, Weg- ner M. 2001. Idiopathic weight reduction in mice deficient in the high-mobility-group transcription factor Sox8[J].
Molecular and Cellular Biology,21 (20) : 6951-6959. doi:10.1128/MCB.21.20.6951-6959.2001.
Sone K, Hinago M, Kitayama A, Morokuma J, Ueno N, Watanabe H, Iguchi T. 2004. Effects of 17β-estradiol, nonylphe- nol, and bisphenol—A on developing Xenopus laevis em- bryos[J]. General and Comparative Endocrinology,138(3): 228-236. doi: 10.1016/j.ygcen.2004.06.011.
Stolt C C, Lommes P, Friedrich R P, Wegner M. 2004. Transcription factors Sox8 and Sox10 perform non-equivalent
roles during oligodendrocyte development despite functional redundancy[J]. Development, 131 (10) : 2349-2358.doi: 10.1242/dev.01114.
Stolt C C, Wegner M. 2010. SoxE function in vertebrate nervous system development [J]. The International Journal of Biochemistry amp; Cell Biology,42(3):437-440. doi:10.1016/ j.biocel.2009.07.014.
Sun D, Chen Q, Zhu B,Zhao H, Duan S S. 2021. Multigenerational reproduction and developmental toxicity, and HPG axis gene expression study on environmentally-relevant concentrations of nonylphenol in zebrafish [J]. Science of the Total Environment, 764: 144259. doi: 10.1016/j. scitotenv.2020.144259.
Tsai H Y, Chang M, Liu S C, Abe G, Ota K G. 2013. Embryonic development of goldfish (Carassius auratus):A model for the study of evolutionary change in developmental mechanisms by artificial selection [J]. Developmental Dynamics,242(11): 1262-1283. doi:10.1002/dvdy.24022.
Wegner M. 2010. All purpose Sox: The many roles of Sox proteins in gene expression [J]. The International Journal of Biochemistry amp; Cell Biology,42(3):381-390. doi:10.1016/ j.biocel.2009.07.006.
Weider M, Wegner M. 2017. SoxE factors: Transcriptional regulators of neural differentiation and nervous system development[J]. Seminars in Cell amp; Developmental Biology, 63: 35-42. doi: 10.1016/j.semcdb.2016.08.013.
Xia X H, Zhao J,Du Q Y, Chang Z J. 2010. cDNA cloning and expression analysis of two distinct Sox8 genes in Paramisgurmus dabryanus (Cypriniformes)[J]. Journal of Genetics,89(2):183-192. doi:10.1007/s12041-010-0024-z.
Xia X H, Zhao J, Du Q Y, Chang Z J. 2011. Isolation and expression of two distinct Sox8 genes in mudloach (Misgurnus anguillicaudatus)[J]. Biochemical Genetics,49(3):161-176. doi:10.1007/s10528-010-9396-2.
Xu Y, Park S J, Gye M C. 2019. Effects of nonylphenols on embryonic development and metamorphosis of Xenopus laevis: FETAX and amphibian metamorphosis toxicity test (OECD TG231) [J]. Environmental Research, 174: 14-23.
doi: 10.1016/j.envres.2019.04.010.Yu H Y,Wang Y J,Li X J,Ni F F,Sun M M,Zhang Q Q,Yu H Y, Wang X B. 2019. The evolution and possible role of two Sox8 genes during sex differentiation in Japanese flounder (Paralichthys olivaceus) [J]. Molecular Reproduction and Development,86(5):592-607. doi:10.1002/mrd.23136.
(责任编辑
兰宗宝)

