广西苦瓜白粉病菌优势生理小种鉴定及ITS序列分析



摘要:【目的】明确广西苦瓜主产区白粉病病原菌种类和生理小种,为苦瓜白粉病防治及抗病育种提供科学依据。【方法]2016—2021年,在广西南宁、柳州、桂林、北海、玉林、贺州、崇左和贵港8个苦瓜产区采集并分离白粉病病原菌246份,通过显微镜观察分生孢子形态及ITS序列分析构建系统进化树明确苦瓜白粉病菌种类,并采用国际通用的13个甜瓜白粉病菌生理小种鉴别寄主和鉴别标准体系对白粉病菌的生理小种进行鉴定;通过调查白粉病菌优势生理小种在广西苦瓜栽培品种桂农科6号、清脆277、翠华和海加仕183上的危害程度和致病力分析,明确广西苦瓜主产区白粉病菌种类及生理小种的分化。【结果】通过形态学与分子生物学相结合的方法确定广西苦瓜白粉病病原菌为单囊壳白粉菌(Sphaerotheca fuliginea),存在小种1和2F两个生理小种,其中,2016—2021年生理小种1的平均分离频率为95.72%,是广西苦瓜白粉病菌的优势小种,生理小种2F仅在贵港苦瓜种植基地发现,平均分离频率为4.29%。苦瓜白粉病菌优势小种致病力测定结果显示,4个广西苦瓜栽培品种的病情指数逐年增加,生理小种1致病力强度呈上升趋势,田间病害发生较严重。【结论】导致广西苦瓜白粉病的病原菌为单囊壳白粉菌,存在小种1和2F两个生理小种,其中生理小种1为广西苦瓜白粉病菌优势小种。广西苦瓜白粉病菌菌株的遗传进化与地域有一定关系,但差异不明显。
关键词:苦瓜;白粉病;单囊壳白粉菌;生理小种;ITS序列分析;广西
中图分类号:S436.429文献标志码:A文章编号:2095-1191(2024)01-0096-09
Identification and ITS sequence analysis of dominant physiologi-cal races of powdery mildew pathogen of bitter gourd in Guangxi
FENG Cheng-cheng',CHEN Xiao-feng',HUANG Xiong-juan¹,JU Xi-xi²,HUANG Yu-hui²,LIANG Jia-zuo¹,LIU Xing-lian',HUANG Ru-kuil
('Vegetable Research Institute,GuangxiAcademy of Agricultural Sciences,Nanning,Guangxi530007,China; ²Guangxi Crop Genetic Improvementand Biotechnology Laboratory,Nanning,Guangxi530007,China)
Abstract:[Objective]To identify the species and physiological races of powdery mildew pathogen of bitter gourd in Guangxi,and provide scientific basis for prevention and control of powdery mildew of bitter gourd and breeding for di sease resistance.【Method]From2016to2021,246strains of powdery mildew pathogens were collected and isolated from8producing areas of bitter gourd in Nanning,Liuzhou,Guilin,Beihai,Yulin,Hezhou,Chongzuo and Guigang of Guangxi,and phylogenetic tree was constructed to identify the species of powdery mildew pathogen of bitter gourd through microscopic observation of conidial morphology and ITS sequence analysis.The host identification and identifica-tionstandard system of13physiological species of muskmelon were used to identify the physiological races of powdery mildew pathogens.By investigating the damage degree and pathogenicity of the dominant physiological races of powdery mildew pathogens in Guinongke6,Qingcui277,Cuihua and Haijiashi183,the species and physiological races diffe-rentiation of powdery mildew pathogens in the main producing areas of bitter gourd in Guangxi were determined.[Result]According to morphology and molecular biology,the bitter gourd powdery mildew disease in Guangxi was caused by Sphaerothecafuliginea,belonging to the physiological race Iand2F.Race Iwas the dominant race ofpowdery mildew pathogen in Guangxi with95.72%average isolation frequency during2016-2021;race2F was detected only in Guigang with4.29%average isolation frequency.Through pathogenicity analysis of dominant races of powdery mildew pathogen of bitter gourd,the disease index of the four bitter gourd varieties showed an increasingtrend year by year,pathogenicity in-tensity of physiological race1increased,and the disease in the field was serious.[Conclusion]The pathogen causing pow-dery mildew of Guangxi bitter gourd is S.fuliginea,and there are twophysiological races Iand2F,of which physiologi-cal race listhe dominant race of Guangxi bitter gourd powdery mildew pathogen.The genetic evolution of powdery mil-dew strains of bitter gourd in Guangxi has certain relationship with the region,but the differenceis not obvious
Key words:bitter gourd;powdery mildew;Sphaerothecafuliginea;physiological race;ITS sequence analysis;Guangxi
Foundation items:National Natural Science Foundation of China(32060686);Guangxi Science and Technology Key Project(GuikeAA23023001);Basic Research Project of Guangxi Academy of Agricultural Sciences(Guinongke2021JM20)
0引言
【研究意义】苦瓜(Momordica charantia L.)是葫芦科(Cucurbitaceae)苦瓜属一年生攀缘草本植物,主要分布在亚洲和非洲的热带地区(Schaefer and Renner,2010;赵秀娟等,2013;Cui et al.,2020)。苦瓜富含多肽、多糖、皂苷和类黄酮等多种生物活性成分,是我国重要的药食兼用蔬菜种类之一,其降血糖、抗炎症、抗癌症的药用功能被广泛关注(Raja-" sekhar et al.,2010;龚斌等,2015;Yang et al.,2015;Lu and Lin,2016;Dhillon et al.,2017)。苦瓜是广西“南菜北运”主要蔬菜种类(冯诚诚等,2018),因其产量高、易栽培、周期短及收益稳定等特点,已成为推动乡村振兴的优选品种,对农民增收与农业结构调整具有重要意义。广西苦瓜年种植面积约40000ha,占全国苦瓜总种植面积的17%,总产量约160万t,产值超过54亿元,在苦瓜产业快速发展的同时,高温高湿、低温寡照的气候条件及产区长期规模化种植,导致白粉病成为苦瓜生产中危害最严重的病害。苦瓜白粉病从苗期到收获期均可发生,苦瓜植株被病菌侵染后会在叶片上形成厚厚的白粉层,苦瓜叶片光系统被破坏,导致光合速率下降,造成苦瓜严重的品质和产量损失(周萌萌等,2019;Chen et al.,2021;秦健等,2022)。白粉病菌的致病性和毒力存在极强的地域性,生理小种多,分化演替速度快,因此,明确危害苦瓜白粉病的病原菌及生理小种,并针对本地区的优势生理小种开展种质鉴定和高抗种质创制,对苦瓜抗白粉病育种具有重要意义。【前人研究进展】导致苦瓜及其他葫芦科作物发生白粉病的病原菌主要是单囊壳属(Sphaerotheca)单囊壳白粉菌(S.fuliginea)和白粉菌属(Erysiphe)二孢白粉菌(E.cichoracearum)(王晓敏等,2021),单囊壳白粉菌分化出0、1、2F和2US等11个生理小种,二孢白粉菌分化出0号和1号2个生理小种(Davis et al.,2007)。目前,白粉病菌种类鉴定主要通过形态学和分子生物学方法,通过病原菌形态和分子ITS鉴定葫芦科蔬菜病原菌种类,以及根据国际通用的甜瓜生理小种鉴别体系对白粉病菌生理小种开展鉴定。通过对我国不同地区的葫芦科蔬菜病原菌种类和生理小种鉴定,发现导致我国葫芦科蔬菜白粉病主要为单囊壳白粉菌,不同地区的生理小种有所差异。其中,海南省的苦瓜白粉病菌均为单囊壳白粉菌,属生理小种2F(包海清等,2008;周萌萌等,2019);导致黑龙江省葫芦科蔬菜白粉病菌的生理小种为单囊壳白粉菌小种1和6,采用了孢子悬浮液喷雾法接种鉴定(马鸿艳等,2011);新疆北疆地区籽瓜、甜瓜白粉病病原菌为单囊壳白粉菌生理小种1,南疆地区为生理小种5(苏瑞等,2013);武汉及江浙沪、淮北地区甜瓜白粉病致病菌均为单囊壳白粉菌生理小种1,主要通过镜检白粉孢子、考马斯亮蓝染色菌丝及ITS序列分析的方法明确病原菌种类(李苹芳等,2015;张慧君等,2017;袁悦等,2022);山东济南、潍坊寿光等地甜瓜白粉病菌为单囊壳白粉菌小种1,采用13个甜瓜白粉病生理小种鉴别寄主进行生理小种鉴定(莫龙飞等,2021);徐兵划等(2022)对采集自江苏淮安、南京、常熟、连云港,浙江杭州,上海青浦区和金山区的甜瓜、南瓜、黄瓜白粉病病原菌开展形态学及分子鉴定,明确优势生理小种为单囊壳白粉菌生理小种2F,并对8个甜瓜品种开展白粉病抗性筛选,研究不同抗性甜瓜材料生理生化机制。目前国内未见白粉病病原菌为二孢白粉菌及其相关生理小种的报道。【本研究切入点】目前,关于广西苦瓜产区白粉病病原菌及生理小种的鉴定研究尚未见报道。【拟解决的关键问题】采集广西8个苦瓜产区的246份白粉病病原菌,经分离纯化后采用形态学与分子生物学相结合的方法进行白粉病菌种类鉴定,通过国际通用甜瓜白粉病菌生理小种鉴别体系进行白粉病菌生理小种鉴定,以明确广西苦瓜主产区白粉病致病菌并追踪生理小种的分化类型及致病力情况,为苦瓜白粉病防治及抗病育种提供科学依据。
1材料与方法
1.1试验材料
1.1.1供试病原菌2016—2021年春季,从广西8个苦瓜产区(南宁市兴宁区和武鸣区、桂林市灵川县、北海市合浦县和银海区、柳州市柳北区、玉林市容县和玉州区、贺州市八步区、崇左市扶绥县、贵港市港北区和覃塘区)采集246份自然发病的苦瓜植株叶片,挑取单个病斑接种于高感苦瓜种质MC402分离纯化和扩繁。每个地区的苦瓜白粉病菌置于1个蔬菜大棚中保存扩繁,在大棚中搭建小拱棚,每个小拱棚开展1份病菌的纯化扩繁,3个重复,在小拱棚中用塑料薄膜隔离,保证严格分离,避免交叉污染。
1.1.2供试植物高感苦瓜种质MC402由Narinder P.S.Dhillon博士(世界蔬菜中心)提供。国际通用甜瓜白粉病菌生理小种鉴别寄主(共13份种质材料)由北京农林科学院蔬菜研究中心许勇研究员提供。所有鉴别寄主材料在广西农业科学院里建科研基地严格套袋、自交扩繁保存。苦瓜栽培品种桂农科6号、清脆277、翠华和海加仕183由广西农业科学院蔬菜研究所苦瓜科研团队提供。
1.1.3主要试剂及仪器Biospin真菌基因组DNA提取试剂盒(杭州博日科技有限公司);2×Es Taq Master Mix(康为世纪生物科技股份有限公司);Invitrogen Agarose(美国英杰生命技术有限公司);pMDTM19-T Vector(日本宝生物工程有限公司);5×TBE Buffer、6×Glycerol DNALoading Buffer(南宁国拓生物科技有限公司)。梯度PCR仪(德国耶拿分析仪器股份公司);全自动化学发光荧光图像分析系统(上海天能科技有限公司);GelDoc XR+凝胶成像系统(美国伯乐生命医学产品有限公司);台式冷冻离心机、微孔板孵育器和移液器(德国艾本德股份公司);电泳仪(北京六一生物科技有限公司)。
1.2试验方法
1.2.1白粉病病原菌分离纯化挑选MC402未发病的健康植株叶片置于装有滤纸的培养皿中,分别从收集的246份白粉病叶片挑取单个病斑接种于MC402叶片上,保持滤纸湿润。接种后置于28℃光周期L:D=14h:10h、光强40μmol(m²·s)的培养箱中培养,经4次分离纯化后,利用MC402扩繁保存用于后续试验。同时,将8个广西苦瓜产区纯化后的白粉病菌分生孢子收集保存于1.5mL离心管,-20℃冰箱保存,用于白粉病菌ITS序列比对分析和系统发育进化树构建。
1.2.2苦瓜白粉病菌形态观察分别取采集自8个广西苦瓜产区的246份白粉病菌无性世代分生孢子置于载玻片上,加入1滴3%KOH溶液,盖上盖玻片,于10×40倍显微镜下观察白粉病菌分生孢子形态特征。先观察病原菌是否含有纤维状体,含有纤维状体的为单囊壳白粉菌,无纤维状体的为二孢白粉菌。每个地区的白粉病菌制作10个玻片,观察载玻片上所有视野的分生孢子是否包含纤维状体。1.2.3苦瓜白粉病菌生理小种鉴定在广西农业科学院蔬菜研究所里建科研基地搭建2个长10m、宽5m、高2m的双层矩形棚。将13份甜瓜鉴别寄主的种子催芽后播种于口径为30cm的育苗钵,每个育苗钵播种5株同种鉴别寄主,出苗后选取长势旺盛的苗钵分组,每组包括一整套13个鉴别寄主,每个鉴别寄主以5株为1个重复,设3次重复。每组苗置于1个塑料小棚,每个小棚用塑料薄膜隔离,每个小棚只开展1个地区的白粉病菌生理小种鉴定,保证严格分离,避免交叉污染。待鉴别寄主培育至6叶期,分别从MC402取新鲜白粉病菌,配制成浓度为5×10⁴个/mL的孢子悬浮液,采用喷雾法接种于鉴别寄主叶片上,控制棚内温湿度,温度白天24~26℃、夜晚20~22℃,相对湿度60%~80%。接种后12~15d,待接种叶片充分发病,参考瓜类蔬菜白粉病菌生理小种分化鉴定病级分级标准对甜瓜发病情况进行统计,判断其生理小种(Sakata et al.,2006)。
白粉病发病等级分级标准:0级,无病症;1级,有少量病斑,病斑面积少于总叶面积的1/3;2级,病斑面积占总叶面积的1/3~2/3;3级,病斑面积超过总叶面积的2/3;4级,病斑遍布整张叶片;5级,病斑布满整张叶片,黄化严重,叶片枯死。
按照下述公式进行病情指数(DI)计算:
DI=Σ(发病级别×相应发病级别的叶数)/5×调查总叶数×100
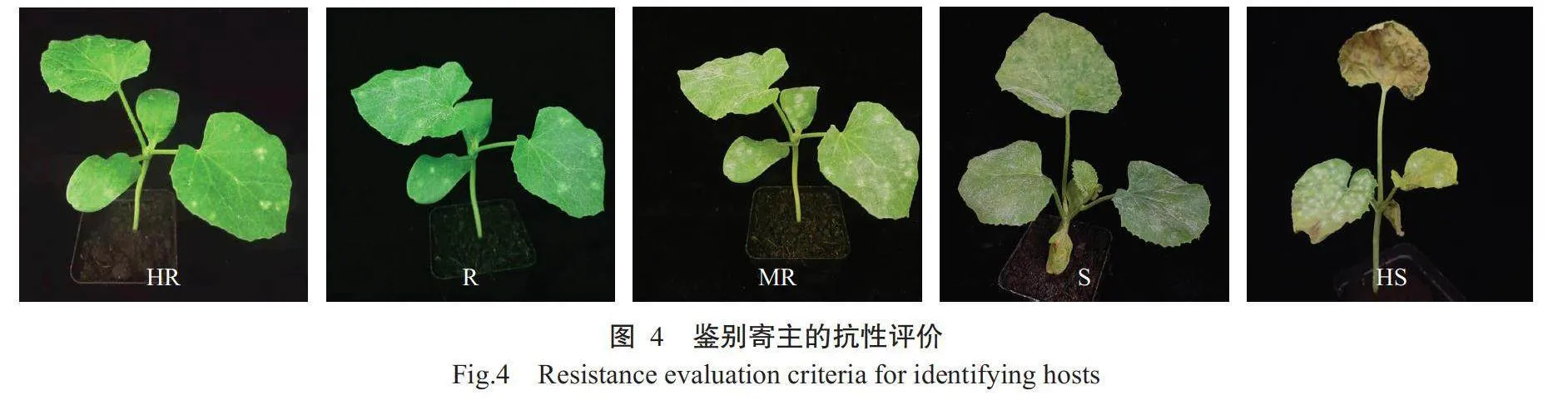
白粉病抗性依据病情指数分为5级:高抗(HR),DI≤10;抗病(R),10lt;DI≤40;中抗(MR),40lt;DI≤60;感病(S),60lt;DI≤80;高感(HS),DIgt;80。
1.2.4苦瓜白粉病菌优势生理小种致病力测定
2021年4月10日,于广西农业科学院蔬菜研究所里建科研基地播种桂农科6号、清脆277、翠华和海加仕183苦瓜品种,种子播于50孔穴盘。4月28日,苦瓜苗生长至4叶1心时喷雾法接种白粉病菌,病原菌为南宁地区分离纯化的生理小种1,每个材料接种50株,3次重复。接种后5、7和10d观察发病情况,第12d统计病情指数。
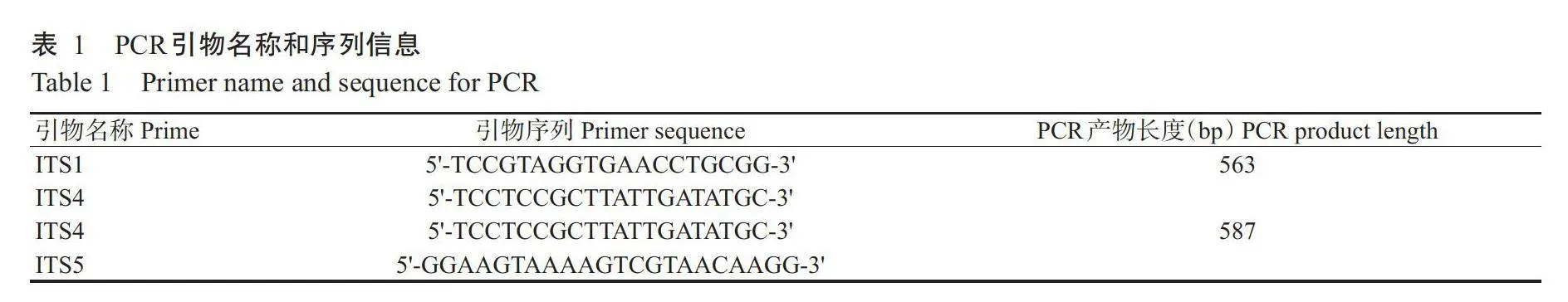
1.2.5白粉病菌ITS序列比对分析和系统发育进化树构建白粉病菌DNA提取按照Biospin真菌基因组DNA提取试剂盒操作步骤进行。苦瓜白粉病菌ITS序列采用真菌核糖体通用引物ITS1/TS4和ITS4/ITS5(表1)进行PCR扩增。PCR反应体系40μL:DNA模板1μL(约30ng),2×Es Taq Master Mix20μL,上、下游引物(2μmol/L)各1μL,ddH₂O补足至40μL。扩增程序:94℃预变性3min;94℃30s,56℃30s,72℃30s,进行35个循环;72℃延伸5min。PCR产物经纯化后连入pMDM19-T载体,经PCR验证阳性克隆后送至广州擎科生物技术有限公司进行测序。运用MEGA6.0对测序结果与从GenBank中下载的相关序列进行比对分析。通过MEGA6.0对8个广西苦瓜产区的白粉病菌ITS1/ITS4序列进行系统发育进化树构建,采用最大似然估计法(Maximum likelihood estimation,MLE)进行数据分析,Bootstrap值为1000,建立模型为Tamura3-parameter model。
2结果与分析
2.1苦瓜白粉病病害及病原菌形态学观察
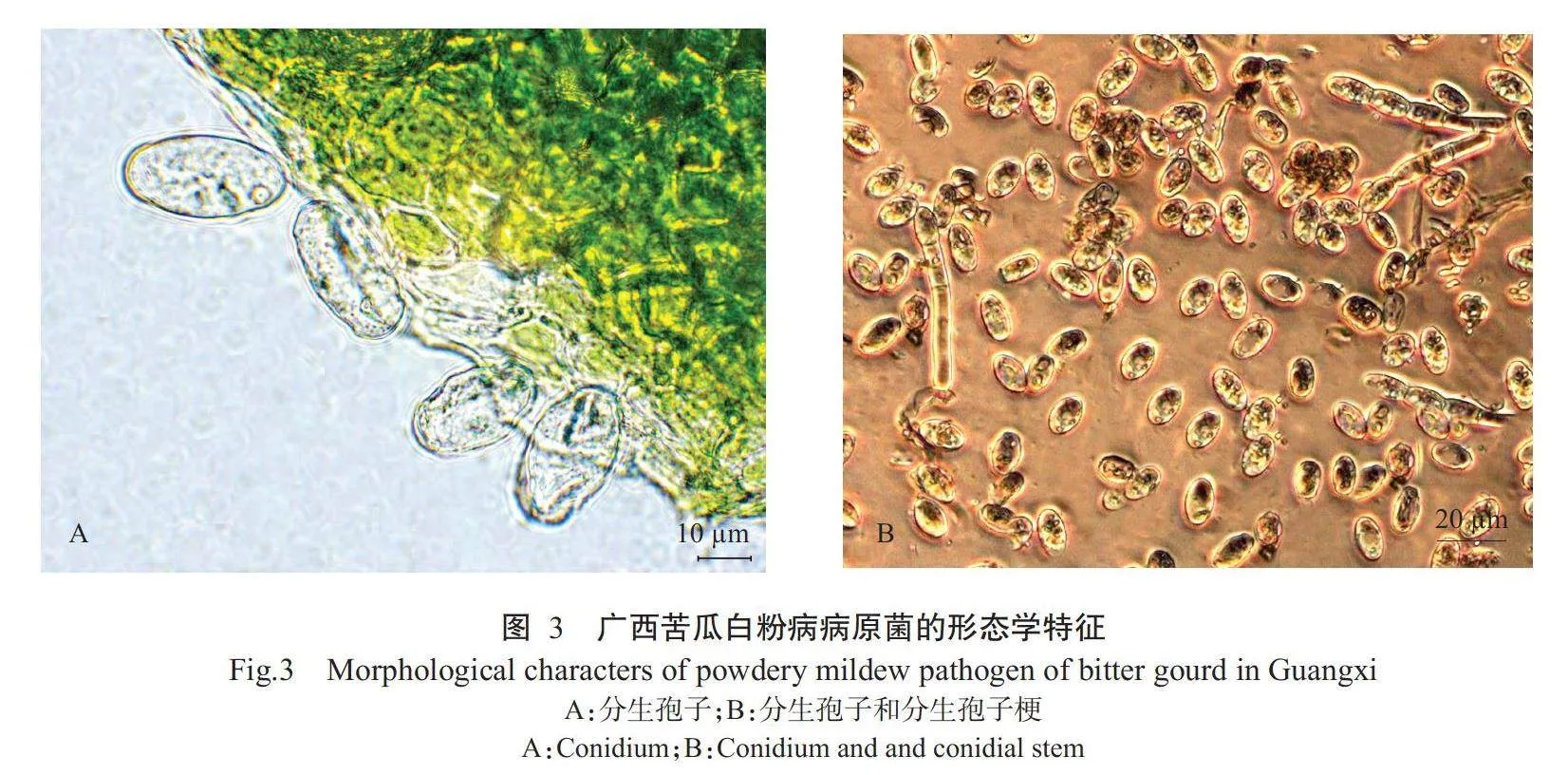
白粉病菌主要危害苦瓜植株的叶片,发病初期在苦瓜叶片的正面和背面形成近圆形小粉斑,随后逐渐扩大成边缘不明显的连片白粉斑,严重时白粉布满整张叶片,叶片逐渐枯黄失去光合作用功能(图1和图2)。电子显微镜下观察发现,苦瓜白粉病菌无性世代的分生孢子均为椭圆形,无色,单胞,有发达的纤维体,长24.35~32.60μm,宽10.40~19.80μm。分生孢子串生于分生孢子梗上,呈长圆柱形,白粉病菌分生孢子个数不唯一,2~10个分生孢子串生呈念珠状,长24.35~60.50μm,宽7.40~16.20μm(图3)。8个苦瓜主产区的白粉病菌形态、大小无差异,分生孢子中均含有纤维状体,纤维状体盘状、新月形。根据分生孢子和分生孢子梗的形态特征,初步鉴定广西苦瓜白粉病菌为单囊壳白粉菌(S.fuliginea)。
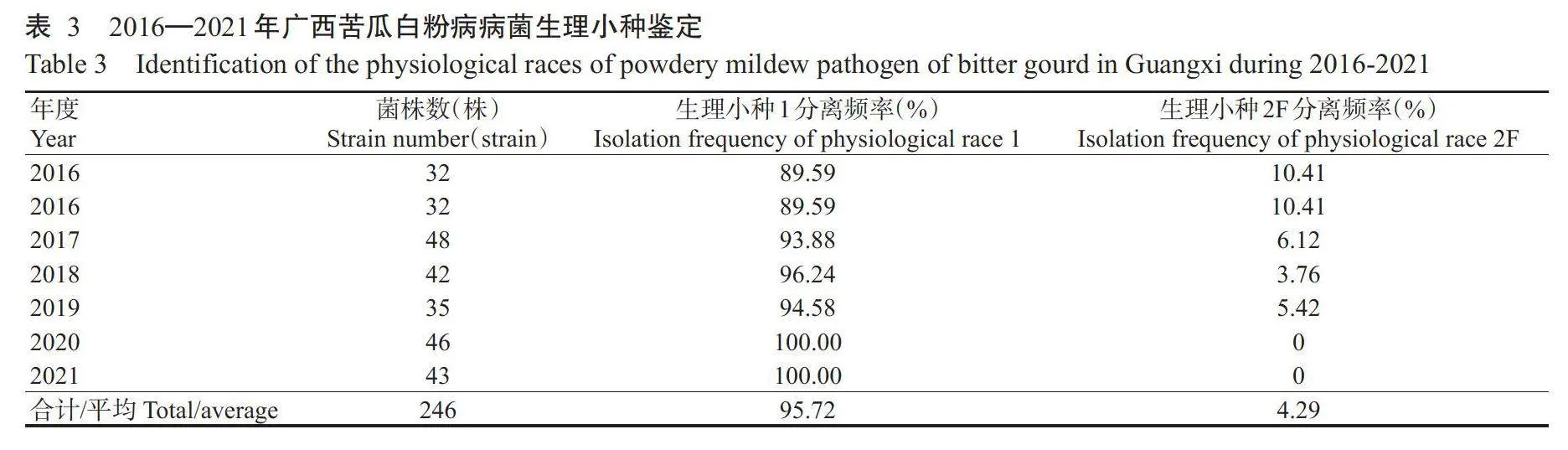
2.2白粉病菌生理小种鉴定结果
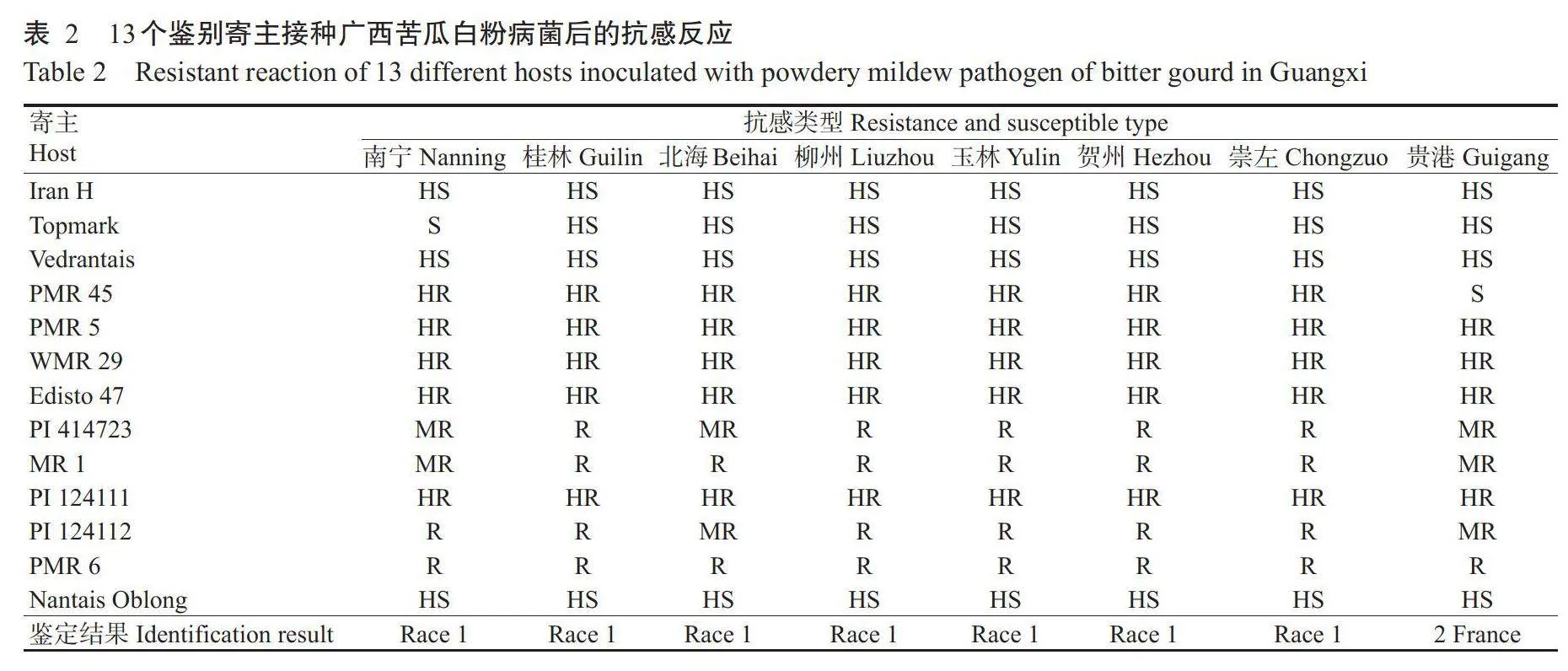
对246份苦瓜白粉病菌菌株进行生理小种鉴定,鉴别寄主抗性评价标准见图4。由表2可知,鉴别寄主PMR45、PMR5、MR1、PI124111、PI124112、PMR6、WMR29、Edisto47和PI414723对广西南宁、桂林、北海、柳州、玉林、贺州和崇左7个苦瓜种植基地的苦瓜白粉病菌均表现为抗病,鉴别寄主Vedrantais、Nantais Oblong、Iran H和Topmark均表现为感病,与单囊壳白粉菌Race1(生理小种1)的抗感反应类型一致。鉴别寄主PMR5、MR1、PI124111、PI124112、PMR6、WMR29、Edisto47和PI414723对贵港苦瓜种植基地的苦瓜白粉病菌均表现为抗病,鉴别寄主Iran H、Topmark、Vedrantais、PMR45和Nantais Oblong均表现为感病,属于单囊壳白粉菌2France(生理小种2F)。
2016—2021年,广西苦瓜白粉病菌鉴定发现单囊壳白粉菌生理小种1和2F两个生理小种,其中生理小种1的平均分离频率为95.72%,且呈逐年上升趋势,生理小种1为广西苦瓜白粉病菌的优势小种;2016—2019年,仅在广西贵港苦瓜种植基地发现生理小种2F,平均分离频率为4.29%,2020—2021年未检测到生理小种2F,表现出逐年降低趋势(表3)。
2.3广西苦瓜白粉病菌优势生理小种致病力分析
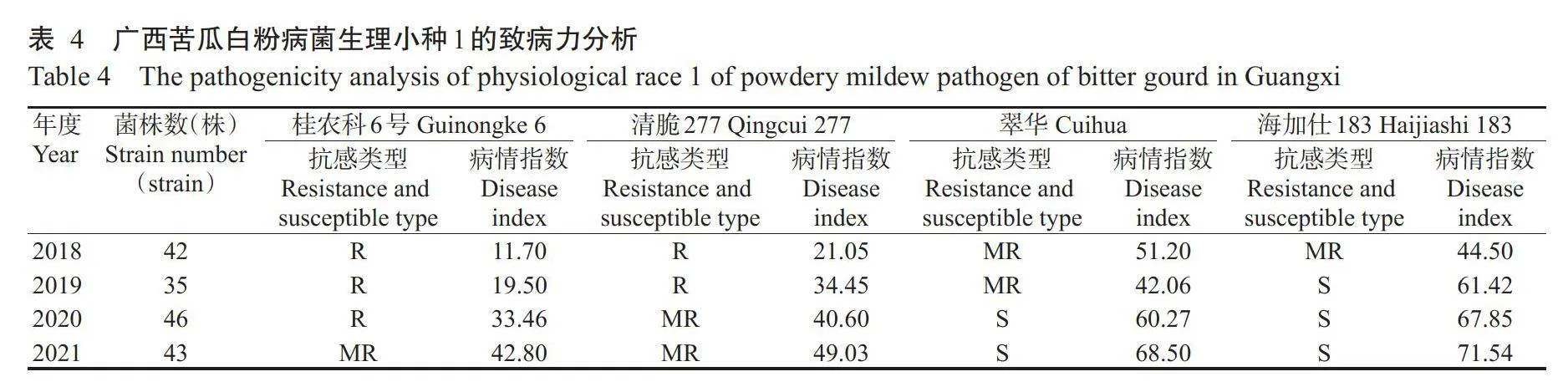
在广西苦瓜栽培品种桂农科6号、清脆277、翠华和海加仕183上苗期人工接种测定白粉病菌优势生理小种的致病力强度。由表4可看出,2018—2021年,生理小种1对海加仕183的致病力最强,2021年的平均病情指数最高达71.54,生理小种1对桂农科6号的致病力最弱,对清脆277的致病力介于二者之间。4个苦瓜品种的病情指数总体上呈逐年上升趋势,生理小种1致病力强度呈上升趋势,田间病害发生较严重。
2.4ITS序列分析结果
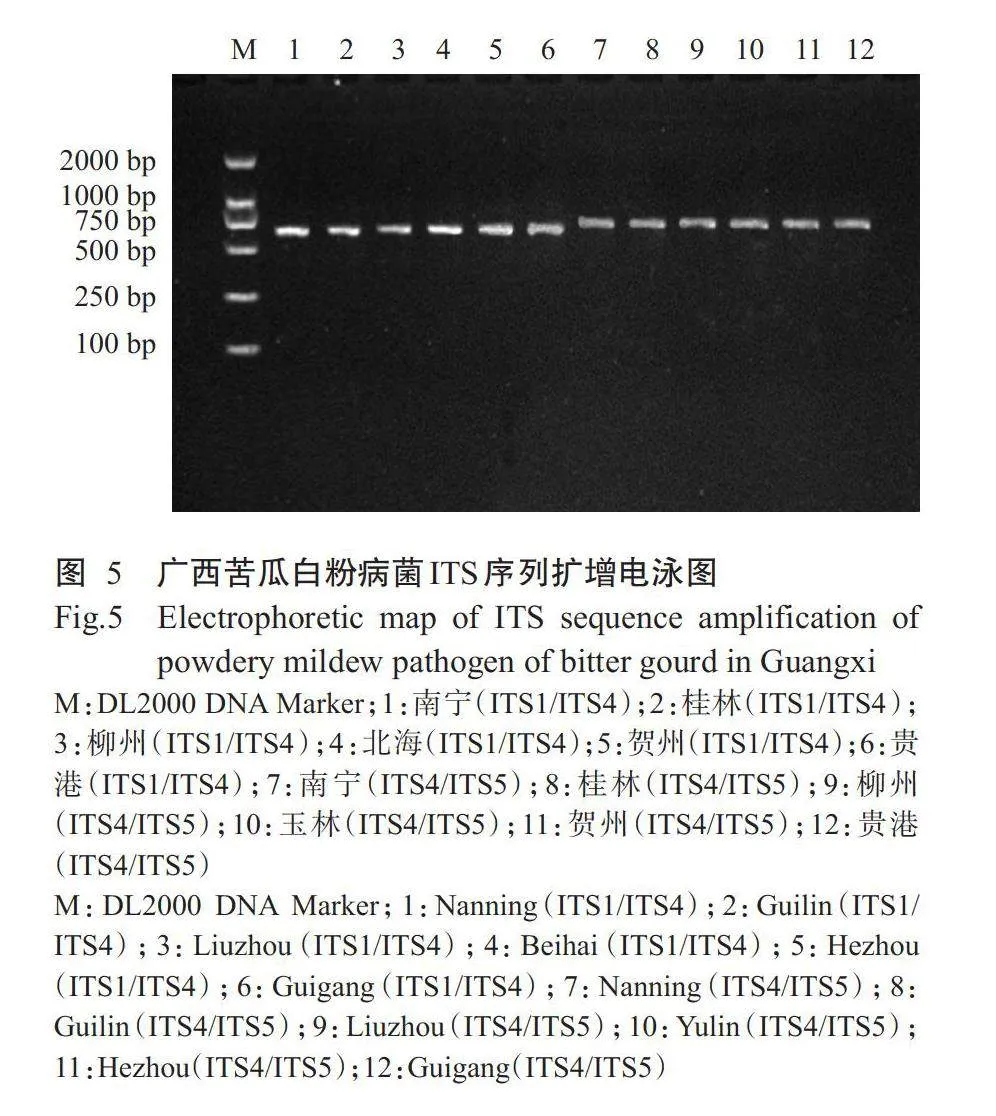
提取南宁、桂林和北海等广西8个苦瓜产区共计51株苦瓜白粉病菌菌株的基因组DNA,用ITS特异性引物ITS1/ITS4和ITS4/ITS5进行PCR扩增,获得苦瓜白粉病菌ITS序列长度约570bp(图5)。挑取单克隆后测序结果显示,8个苦瓜产区的白粉病菌通过ITSI/ITS4和ITS4/ITS5扩增获得的ITS序列分别为563和587bp,除贵港外,其余7个地区的测序结果完全一致,每个地区的序列比对结果也无差异。将测序所得的ITS序列与GenBank中的其他同源序列进行比对,发现该序列与单囊壳白粉菌(P.xanthii)(序列号MT242593.1)的同源性为
99.82%。通过MEGA6.0对8个苦瓜主产区的8株白粉病菌ITS序列(ITS1/ITS4)构建系统发育进化树,结果(图6)显示,来源于不同作物同源性较高的ITS序列均为单囊壳白粉病菌ITS序列,共分成2个大支,4个亚支。本研究中广西8个苦瓜种植基地的白粉病菌聚集在同一大支上,其中南宁、桂林、北海、柳州、玉林、贺州和崇左7个苦瓜种植基地的苦瓜白粉病菌聚集在同一分支上,进一步验证了这7个苦瓜种植基地的苦瓜白粉病菌都是单囊壳白粉病菌,均属于生理小种1的结果;贵港苦瓜种植基地的苦瓜白粉病菌与越南河内苦瓜白粉病菌(登录号KM260704.1)和越南河内黄瓜白粉病菌(登录号KM260715.1)的亲缘关系较近,聚在另一分支上。结果表明广西苦瓜白粉病菌的遗传进化与地域有一定关系,但差异不明显。
3讨论
本研究对2016—2021年从广西南宁、柳州、桂林、北海、玉林、贺州、崇左和贵港8个苦瓜种植基地采集的246份白粉病病原菌进行生理小种鉴定,通过显微镜观察病菌分生孢子的形态,均观察到发达的纤维状体,系统进化分析进一步证实广西苦瓜的白粉病菌为单囊壳白粉菌,与国内众多研究结果一致(包海清等,2008;李苹芳等,2015;张慧君等,2017;周萌萌等,2019;袁悦等,2022),在广西未发现二孢白粉菌,可能与2种病原菌对温度的喜好性差异引起的地理分布上的不同有关(Miazzi et al.,2011)。本研究对广西不同地区8株苦瓜白粉病菌进行ITS基因遗传进化分析,来源于不同作物同源性较高的ITS序列均为单囊壳白粉病菌ITS序列,共分成2个大支,4个亚支;来自广西8个苦瓜种植基地的白粉病菌聚集在同一大支上,其中南宁、桂林、北海、柳州、玉林、贺州和崇左7个苦瓜种植基地的苦瓜白粉病菌聚集在同一分支上,进一步验证了这7个苦瓜种植基地的苦瓜白粉病菌都是单囊壳白粉病菌,均属于生理小种1的结果。贵港苦瓜种植基地的苦瓜白粉病菌与越南河内苦瓜白粉病菌和越南河内黄瓜白粉病菌的亲缘关系较近,同属于一个分支,表明广西苦瓜白粉病菌的遗传进化与地域有一定关系,但差异不明显。周萌萌等(2019)发现白粉病菌的进化与地域没有直接关系,而是与其自身小种进化有关,本研究结果与之不一致,可能与采集地域范围相对较集中有关。
本研究采用国际通用的白粉病菌生理小种鉴别寄主和鉴别标准体系对广西苦瓜白粉病菌进行生理小种鉴定,发现广西苦瓜白粉病菌属于单囊壳白粉菌生理小种1和2F两个生理小种,其中生理小种1的分离频率从2016年的89.59%提高至2021年的100.00%,平均分离频率为95.72%,并呈逐年上升趋势。2016—2019年仅在贵港苦瓜种植基地发现生理小种2F,其中2019年的分离频率为5.42%,之后连续2年(2020—2021)未检测到生理小种2F。近6年来,生理小种1为广西苦瓜白粉病菌的优势小种。导致这一现象的原因,一方面与广西各个产区种植的苦瓜品种差异有关,由于同种类型苦瓜品种长期种植,导致苦瓜白粉病菌的生理小种出现频率上升;另一方面受不同气候环境条件的影响,生理小种1与当地环境气候条件的适合度较高,其发生的频率高,生理小种2F与当地的环境气候条件不适合,导致该生理小种出现频率降低并消失。
本研究在4个广西苦瓜栽培品种上人工苗期接种测定白粉病菌优势生理小种1的致病力强度,发现4个苦瓜品种的病情指数总体上呈逐年上升趋势,生理小种1致病力强度呈上升趋势,田间病害发生较严重。原因可能是高抗白粉病的品种较少,生产上主要通过喷施化学农药进行防治,由于化学农药的长期大量使用,苦瓜白粉病菌对不同类型的杀菌剂产生了抗药性,导致防治效果不理想,出现病情指数逐年上升的情况。种植抗病品种,寻找最佳防治时期,精准用药是防治苦瓜白粉病最经济、有效的解决途径。白粉病病原菌致病力会随着气候、种植结构、栽培模式、品种抗性等原因引起致病力变化,白粉病菌生理小种众多,分化演替快。为避免苦瓜白粉病发生流行的潜在危险,需长期监测白粉病菌生理小种类型及其致病力,密切关注生理小种的分布变化。
4结论
导致广西苦瓜白粉病的病原菌为单囊壳白粉菌,存在生理小种1和2F两个生理小种,其中生理小种1为广西苦瓜白粉病菌优势小种。广西苦瓜白粉病菌株的遗传进化与地域有一定关系,但差异不明显。
参考文献:
包海清,许勇,杜永臣,李劲松,杨晓峰.2008.海南三亚地区葫芦科作物白粉病菌生理小种分化的鉴定[J].长江蔬菜,(1):45-51.[Bao HQ,Xu Y,DuYC,LiJS,Yang XF.2008.Identification of physiological races of powdery mildew on cucurbits in Sanya,Hainan[J].Journalof Chang jiang Vegetables,(1):45-51.]doi:10.3865j.issn.1001-3547.2008.01.030.
冯诚诚,黄如葵,黄熊娟,陈小凤,黄玉辉,梁家作,刘杏连,王齐旭.2018.基于SLAF-seq技术的苦瓜白粉病SNP分子标记开发[J].热带作物学报,39(1):108-115.[Feng CC,Huang RK,Huang XJ,Chen XF,Huang YH,Liang JZ,Liu XL,Wang QX.2018.Development of SNP molecular markers for powdery mildew in bitter gourd using SLAF-seq technique[J].Chinese Journal of Tropical Crops,39(1):108-115.]doi:10.3969/j.issn.1000-2561.2018.01.017.
龚斌,申明月,何陵玲,谢建华.2015.苦瓜多糖的提取、结构及生物活性研究进展[J].食品科学,36(21):279-283.[Gong B,Shen MY,He LL,Xie JH.2015.Recent prog-ress in extraction,chemical structure and bioactivities of Momordica charantia polysaccharides[J].Food Science,36(21):279-283.]doi:10.7506/spkx1002-6630-201521052
李苹芳,朱凌丽,羊杏平,徐锦华,刘广,姚协丰,牛徐江.2015.江浙沪甜瓜白粉病菌及其生理小种的鉴定[J].中国瓜菜,28(6):16-20.[LiPF,Zhu LL,Yang XP,Xu JH,Liu G,Yao XF,Niu XJ.2015.Species and physiologi-cal race identification of melon powdery mildew fungus in Jiangsu[J].China Cucurbits and Vegetables,28(6):16-20.]doi:10.16861/j.cnki.zggc.2015.06.004.
马鸿艳,魏尊苗,祖元刚,栾非时.2011.2009—2010年黑龙江省主要瓜类作物白粉病菌生理小种鉴定[J].植物保护学报,38(3):287-288.[Ma HY,Wei ZM,Zu YG,Luan FS.2011.Physiological race indentification of powdery mil-dew on main cucurbits in Heilongjiang Province during2009-2010[J].Journal of Pant Protection,38(3):287-288.
莫龙飞,孙建磊,高超,董玉梅,王崇启,肖守华,吴春燕,焦自高.2021.山东地区甜瓜白粉病生理小种的鉴定[J].中国瓜菜,34(4):36-40.[Mo LF,Sun JL,Gao C,Dong YM,Wang CQ,Xiao SH,WuCY,Jiao ZG.2021.Identifi-cation of physiological races of melon powdery mildew pathogen in Shandong[J].China Cucurbits and Vegetables,34(4):36-40.]doi:10.16861/j.cnki.zggc.2021.0084.
秦健,刘杏连,康德贤,黄如葵,吴永官.2022.广西苦瓜棒孢叶斑病的病原鉴定[J].植物病理学报,52(3):489-492.
Qin J,Liu XL,Kang DX,Huang RK,Wu YG.2022.Identification of pathogen from Corymespora leaf spot on balsam in Guangxi[J].Acta Phytopathologica Sinica,52(3):489-492.]doi:10.13926j.cnki.apps.000580
苏瑞,王惠林,高强,贾宋楠,郑健.2013.新疆部分地区籽用西瓜、甜瓜白粉病菌生理小种鉴定[J].中国蔬菜,(10):90-94.[Su R,Wang HL,Gao Q,Jia SN,ZhengJ.2013.Physiological race identification of powdery mildew for edible seed watermelon and melonin some regions of Xin-jiang[J].ChinaVegetables,(10):90-94.]doi:10.3969/j.issn.1000-6346.2013.10.015.
王晓敏,王禄星,宋建宇,刘艳,高艳明,李建设,张海英,许勇.2021.宁夏西瓜、甜瓜白粉病病原菌鉴定及抗性种质资源筛选[J].甘肃农业大学学报,56(5):83-91.[Wang XM,WangLX,Song JY,Liu Y,Gao YM,LiJS,Zhang HY,Xu Y.2021.Identification of powdery of waterme-lons and muskmelonsin Ningxia and screening of resistant germplasm resources[J].Journal of Gansu Agricultural Uni-versity,56(5):83-91.]doi:10.13432/j.cnki.jgsau.2021.05.012.
徐兵划,汪国莲,仲秀娟,黄大跃,顾妍,张朝阳,程瑞,孙玉东.2022.瓜类白粉病菌生理小种鉴定及抗白粉病甜瓜品种筛选[J].江苏农业科学,50(23):102-109.[Xu BH,Wang GL,Zhong XJ,HuangD Y,Gu Y,Zhang ZY,Cheng R,Sun YD.2022.Identification ofphysiological racesof melon powdery mildew pathogen and screening of melon varieties with resistance to powdery mildew[J]Jiangsu Agricultural Sciences,50(23):102-109.]doi:10.15889/j.issn.1002-1302.2022.23.015.
袁悦,任俭,王转茸,李煜华,曾红霞,张娜,熊建顺,朱志坤,汤谧.2022.武汉地区甜瓜白粉病病原菌生理小种鉴定[J].长江蔬菜,(22):65-69.[Yuan Y,Ren J,Wang ZR LiYH,Zeng HX,Zhang N,Xiong JS,Zhu ZK,Tang M.2022.Identification of physiological races of melon pow-dery mildew pathogens in Wuhan[J].Journal of Chang-iang Vegetables,(22):65-69.]doi:10.3865j.issn.1001-3547.2022.22.021.
张慧君,张佩,吴乔歆,余静.2017.淮北地区甜瓜白粉病生理小种的鉴定[J].分子植物育种,15(3):1084-1089.[Zhang HJ,Zhang P,Wu QX,Yu J.2017.Identification on races"of powdery mildew of melon in Huaibei[J].Molecular Plant Breeding,15(3):1084-1089.]doi:10.13271/j.mpb.015.001084.
赵秀娟,宋建文,胡开林.2013.苦瓜种质遗传多样性的SRAP标记分析[J].植物遗传资源学报,14(1):78-84.[Zhao XJ,Song JW,Hu KL.2013.Genetic diversity analysis of bitter gourd germplasm resources based on SRAP Markers[J].Journal of PlantGenetic Resources,14(1):78-84.]doi:10.3969/j.issn.1672-1810.2013.01.012.
周萌萌,田丽波,商桑,邹凯茜,潘琼玉,曾丽萍.2019.苦瓜白粉病病原菌和生理小种的鉴定及苦瓜对白粉病的抗性遗传分析[J].植物保护学报,46(2):313-322.[Zhou MM,Tian LB,Shang S,Zou KX,PanQY,Zeng LP.2019.Identification ofpowdery mildew physiological races and genetic resistance analysis of bitter melon to the disease[J].Journal of Plant Protection,46(2):313-322.]doi:10.13802/j.cnki.zwbhxb.2019.2018138.
Chen LZ,Liu J,Liu ZY,Xia PF,Yuan XH,NingY.2021.Genome-wide identification and expression analysis ofthe MLO gene family reveal acandidate gene associated with powderymildew susceptibility in bitter gourd(Momordica charantia)[J].European Journal of Plant Pathology,159(1):163-178.doi:10.1007/s10658-020-02152-0.
CuiJJ,Yang Y,Luo SB,Wang L,Huang RK,Wen QF,Han XX,Miao NS,Cheng JW,Liu ZJ,Zhang CY,Feng CC,Zhu HS,Su JW,Wan XJ,Hu F,Niu Y,Zheng XM,Yang YL,Shan D,Dong ZS,HeWM,DhillonNPS,Hu"K L.2020.Whole-genome sequencing provides insights"into the genetic diversity and domestication of bitter gourd(Momordica spp.)[J].Horticulture Research,7:2-11.doi:10.1038/s41438-020-0305-5.
Davis AR,Levi A,Tetteh A,Wehner T,Russo V,Pitrat M.2007.Evaluation of watermelon and related species for resistance to race1W powdery mildew[J].Journal of the American Society for Horticultural Science,132(6):790-795.doi:10.21273/jashs.132.6.790.
Dhillon NPS,Lin CC,Sun ZY,Hanson PM,Ledesma DR,Habicht SD,Yang RY.2017.Varietal and harvesting stage variation in the content of carotenoids,ascorbic acid and tocopherols in the fruit of bitter gourd(Momordica charantia L.)[J].Plant Genetic Resources,15(3):248-259.doi:10.1017/S147926211500057X.
Lu HY,Lin BF.2016.Wild biter melon alleviates dextran sul-phate sodium-induced murine colitis by suppressing inflammatory responses and enhancing intestinal regula-tory Tcells(Article)[J].Journal of Functional Foods,23:590-600.doi:10.1016/jjff.2016.03.014.
Miazzi M,Laguardia C,Faretra F.2011.Variation in Podos-phaera xanthii on cucurbits in Southern Italy[J].Journa of Phytopathology,159(7-8):538-545.doi:10.111j.1439-0434.2011.01801.x.
Rajasekhar MD,Badri KR,Kumar KV,Babu KR,Fatima SS,Kumar MT S,Rao CA.2010.Isolation and characteri-zation of anovel antihyperglycemic protein from the fruits"of Momordica cymbalaria[J].Journal of Ethnopharmaco-logy,128(1):58-62.doi:10.1016/j.jep.2009.12.025.
Sakata Y,Kubo N,Morishita M,Kitadani E,Sugiyama M,Hirai M.2006.QTL analysis of powdery mildew resis-tance in cucumber(Cucumis saivus L.)[J].Theoretical and Applied Genetics,112:243-250.doi:10.1007/s00122-005-0121-1.
Schaefer H,Renner SS.2010.Athree-genome phylogeny of Momordica(Cucurbitaceae)suggests seven returns from dioecy to monoecy and recent long-distance dispersal to Asia[J].Molecular Phylogenetics and Evolution,54(2):553-560.doi:10.1016/j.ympev.2009.08.006.
Yang SJ,Choi JM,Park SE,Rhee EJ,Lee WY,Oh KW,Park SW,Park CY.2015.Preventive effects of bitter"gourd(Momordica charantia)against insulin resistance"and diabetes are associated with the inhibition of NF-kB and JNK pathways in high-fat-fed OLETF rats[J].The Jour-nal of Nutritional Biochemistry,26(3):234-240.doi:10.1016j.jnutbio.2014.10.010.
(责任编辑 麻小燕)

