金鱼草WAK/WAKL基因家族鉴定及 抗核盘菌候选基因挖掘


摘要:【目的】鉴定金鱼草细胞壁相关受体激酶(Wall-associated kinase,WAK)及类WAK蛋白(WAK-like kinases,WAKL)基因家族成员,并挖掘抗核盘菌的候选基因,为深入解析金鱼草抗核盘菌的WAK/WAKL分子调控机制提供理论参考。【方法】以拟南芥WAK/WAKL家族蛋白为参考序列,利用生物信息学方法从金鱼草基因组数据库中鉴定出WAK/WAKL基因家族成员,并对其理化性质、系统发育、基因结构、保守基序、顺式作用元件及共线性关系等进行预测分析,并通过转录组测序和实时荧光定量PCR对该家族基因在金鱼草抗感核盘菌材料中的表达模式进行分析。【结果】从金鱼草基因组中共鉴定出27个WAK/WAKL基因家族成员,其中WAK家族基因16个(AmWAKI~AmWAK₁6),WAKL家族基因11个(AmWAKLI~AmWAKLI1),编码的氨基酸数量为615~1085个;理论等电点(pI)为4.94~8.69,绝大多数蛋白呈酸性;所有蛋白的总平均亲水性指数(GRAVY)值小于0,均为亲水性蛋白;大多数蛋白亚细胞定位于细胞质膜区域,少部分定位于细胞外、液泡、高尔基体和细胞核。27个WAK/WAKL基因家族成员不均匀地分布在金鱼草的8条染色体上,且与拟南芥WAK/WAKL家族基因存在7对共线性同源基因;基因启动子区域含有与防御和胁迫响应、茉莉酸甲酯响应及水杨酸响应等顺式作用元件。通过叶片离体接种核盘菌试验,筛选出抗性差异明显的易感病品种Aml和抗病品种Am6。有12个WAK/WAKL家族基因在金鱼草抗感材料中显著差异表达(Plt;0.05),有9个基因表达模式与转录组测序结果基本一致。这9个基因中,有5个基因(AmWAK7、AmWAKL2、AmWAKL8、AmWAK6和AmWAK13)在金鱼草的根、茎和叶组织中高表达,而剩余4个基因(AmWAK2、AmWAK8、AmWAK9和AmWAK12)在根、茎和叶中基本不表达。【结论】筛选出的27个金鱼草WAK/WAKL基因家族成员,具有相似的基因结构和蛋白功能结构域,其中AmWAK6、AmWAK7、AmWAK13、AmWAKL2和AmWAKL8为金鱼草抗核盘菌的关键候选基因,具有介导抗病的潜在功能。
关键词:金鱼草;WAK/WAKL基因家族;鉴定;核盘菌抗性;转录组测序;候选基因挖掘
中图分类号:S681.9文献标志码:A文章编号:2095-1191(2024)01-0024-13
Genome-wide identification and mining of candidate genes against Sclerotinia sclerotiorum ofWAK/WAKL gene family in snapdragon(Antirrhinummajus L.)
YANG Dong-mei,XIA Wen-nian,SONG Jia-yi,YANG Jie,YAN Cang-hai,SU Yun-li,WANG Zhong-yi,HU Hui-zhen*
(College of Landscape and Horticulture Sciences,Southwest Forestry University/Engineering Research Center of Func-tional Flower Resources and Industrialization Technology of Yunnan Province,Kunming,Yunnan650224,China)
Abstract:[Objective]To identify the gene family members of the cll wallassociated kinase(WAK)and WAK-like kinases(WAKL)of Amtirhimm majus L.,and explore the candidate genes against Sclerotinia scleroliorum.This study provided atheoretical reference for further analysis of WAKWAKL molecular regulatory mechanism of A.majus against S.sclerotiorum.【Method]JUsingArabidopsis thaliana L.WAK/WAKL family proteins as reference sequences,theWAK/WAKL gene family members were identified from the A.majus genome database by bioinformatics method,and their physicochemical properties,phylogeny,gene structure,conserved mods,cis-acting elements and collinear relationships were predicted.Transcriptome sequencing and real-time fluorescence quantitative PCR were used to analyze the expres-sion patterns of the family genes involved in S.sclerotiorum resistance.[Result]Atotal of27WAK/WAKL gene family members were identified from the A.majus genome,including16WAK genes(AmWAK1-AmWAK16)and11WAKL genes(AmWAKLI-AmWAKLII),encoding615-1085amino acids.The theoretical isoelectricpoint(pI)ranged from4.94to8.69,and the most proteins were acidic.The total mean hydrophilic index(GRAVY)of all proteins was lessthan0,indi cating that all proteins are hydrophilic proteins.Most of the subcellular proteins werelocated in the plasma membrane re-gion of thecell,and afew were located in the extracellular,vacuole,Golgi apparatus and nucleus.There were27members of WAK/WAKL gene family distributed unevenly on8chromosomes of A.majus,and7pairs of collinear homologous genes with A.thaliana WAK/WAKL gene family.The gene promoter region contained cis-acting elements involved in de-fense and stress response,methyl jasmonate response and salicylic acid response.The susceptible variety Aml andresis-tant variety Am6were screened by inoculating the leaves of sclallodiscus in viro.There were12WAK/WAKL family genes significantly differentially expressed(Plt;0.05)among the resistant materials,and the expression patterns of9genes were basically consistent with the transcriptome sequencing results.Of the nine genes,five(AmWAK7,AmWAKL2,Am-WAKL8,AmWAK6and AmWAK₁3)were highly expressed in the root,stem,and leaf tissues of A.majus,while the remai-ning four(AmWAK2,AmWAK8,AmWAK9and AmWAK12)were largely unexpressed in the root,stem and leaf tissues
【Conclusion]Twenty-seven members of the WAK/WAKL gene family arescreened,which havesimilar gene structure and protein functional domains.Among them,AmWAK6,AmWAK7,AmWAK13,AmWAKL2and AmWAKL8are key candidate genes for resistance to S.sclerotioram,and have potential functionsof mediating disease resistance.
Key words:Antirrhinum majus L.;AmWAK/WAKL gene family;identification;Sclerotinia sclerotiorum resis-tance;transcriptome sequencing;candidate gene mining
Foundation items:Youth Project of National Natural Science Foundation of China(31901571);Yunnan College Stu dent Innovation and Entrepreneurship Training Project(202110677078);Southwest Forestry University Research Initia-tion Project(01102-112109)
0引言
【研究意义】金鱼草(Antirrhinum majus L.)是车前科金鱼草属的多年生草本植物,其花型独特、花色艳丽、花香浓郁、花期长,是重要的观赏花卉和切花材料(罗维平等,2008)。金鱼草花卉品质及观赏价值极易受到真菌性病害的影响,特别是由核盘菌(Sclerotinia sclerotiorum)侵染其根、茎和叶引起的根腐病、茎腐病和苗腐病是影响金鱼草生长发育的典型病害(韩月冷,2019)。近年来,植物细胞壁抗性(Cell wall-mediated resistance)因其具有广谱性,且能与病程相关分子模式(Pathogen-associated molecular pattern,PAMPs)激活的免疫反应(PAMPs-triggered immunity,PTI)协同互作(Bigeard et al.,2015),已成为植物抗病领域的研究热点,也是研究植物抗核盘菌的理想突破口。植物细胞壁抗性指通过识别植物细胞壁自身产生的损伤相关分子模式(Damage-associated molecular patterns,DAMPs)而激活的免疫反应(DAMPs-triggered immunity,DTI)。其中,植物细胞壁相关受体激酶(Wall-associated kinase,WAK)及类WAK蛋白(WAK-like kinases,WAKL)(WAK/WAKL)是受体样激酶(Receptor-like kinases,RLK)家族中一类特殊的植物类受体激酶,在病原菌侵染过程中可通过与果胶相关的DAMPs结合来监测细胞壁的完整性,将信息传递到细胞内,激活相应的信号途径调控植物抗病原菌、逆境胁迫及生长发育等生理过程(Anderson et al.,2001)。因此,对金鱼草WAK/WAKL基因家族成员进行鉴定,并挖掘金鱼草抗核盘菌的关键候选基因,为植物抗核盘菌育种提供新的基因资源,对深入解析金鱼草抗核盘菌的分子机制具有重要的意义。【前人研究进展】植物细胞壁是高度复杂的异质型动态复合网络,由纤维素、半纤维素、果胶、木质素和壁蛋白等组成,是植物重要的保护屏障(Christensen et al.,2010;Wang et al.,2016)。近年来,研究发现植物细胞壁不仅是结构性的被动防御屏障,更是动态性的主动防御体系,其微小损伤或结构成分的改变均会引起植物抗病信号途径和防卫反应的激活(Lipka et al.,2005)。WAK/WAKL蛋白结构包括细胞丝氨酸/苏氨酸(Ser/Thr)蛋白激酶结构域、跨膜区、0-2表皮生长因子(EGF)结构域及与细胞壁果胶紧密相连的细胞外半乳糖醛酸结合(GUB)结构域。因此,WAK/WAKL被认为是果胶相关DAMPs的识别受体(Kohorn,2016),可激活钙离子内流、活性氧(ROS)迸发、有丝分裂原活化激酶(MAPK)信号途径、防御相关激素和乙烯(ET)/茉莉酸(JA)信号等途径,并与PTI和效应因子触发的免疫(Effector-triggered immunity,ETI)胁同互作,从而全面激活植物的免疫反应(Hu et al.,2021)。目前,在模式植物拟南芥中共鉴定了5个AWAKs和22个AIWAKLs基因(He et al.,1999;Zhang et al.,2005),这些基因在生物和非生物胁迫下均能被显著诱导表达(Meier et al.,2010),其中AtWAK1和AtWAK2可与寡聚半乳糖醛酸(Oligogalacturonides,OGs)结合来激活活性氧(ROS)爆发及MPK3、MPK6等相关防御基因的表达,从而增强拟南芥对灰葡萄球菌的抗性(Ferrari et al.,2013)。在大豆中,GmWAK1通过促进细胞内钙浓度上调来提高大豆对疫霉菌的抗性(赵明等,2020)。在番茄中,微生物相关分子模式(MAMPs)如细菌鞭毛蛋白N端22个氨基酸的肽段flg22及其衍生物flgII-28,分别激活模式识别受体Flagellin-sensitive2(Fls2)/Flagellin-sensitive3(Fls3),诱导SIWAK1转录本增加,从而调控质外体后期的PTI(Zhang et al.,2020)。在棉花中,GhWAK7A分别与GhLYK5和GhCERK1互作,促进几丁质诱导的GhLYK5-GhCERK1二聚化,从而介导对枯萎病病原体的反应(Wanget al.,2020)。【本研究切入点JWAK/WAKL是通过识别DAMPs介导细胞壁抗性的关键因子,但目前WAK/WAKL家族基因只在部分模式植物或作物中有研究(Decreux and Messiaen,2005),在金鱼草等观赏性花卉中鲜见报道。【拟解决的关键问题】以拟南芥WAK/WAKL家族蛋白为参考序列,利用生物信息学方法从金鱼草基因组数据库中鉴定出WAK/WAKL基因家族成员,并对接种核盘菌后的金鱼草抗感材料进行转录组测序及实时荧光定量PCR检测,挖掘出金鱼草抗核盘菌的WAK/WAKL家族候选基因,为植物抗核盘菌育种提供新的基因资源,为深入解析金鱼草抗核盘菌的WAK/WAKL分子机制提供理论参考。
1材料与方法
1.1试验材料
以种植于云南省昆明市西南林业大学后山温室的7个云南省常见金鱼草切花品种——波托马克系列为研究材料,包括Aml(深紫色A.majus L.‘Royal Purple')、Am2(樱桃红色A.majus L.'Cherry Red')、Am3(橙红色A.majus L.‘Orange')、Am4(苹果花色A.majusL.‘Apple Flower')、Am5(粉色A.majusL‘Early Pink')、Am6(白色A.majus L.'White')及Am7(黄色A.majus L.‘Yellow')。核盘菌Ss-1由华中农业大学微生物国家重点实验室李国庆老师提供。Eastep⁹Super总RNA提取试剂盒购自普洛麦格(北京)生物技术有限公司;All-In-One5×RT Master-Mix逆转录试剂盒和BlastaqTM2×qPCR Master Mix试剂盒购自南京爱必梦生物材料有限公司。主要设备仪器:RXM型智能人工气候箱(宁波市科技园区新江南仪器有限公司)和实时荧光定量PCR仪[赛默飞世尔科技(中国)有限公司]。
1.2金鱼草WAK/WAKL基因家族成员鉴定及理化性质分析
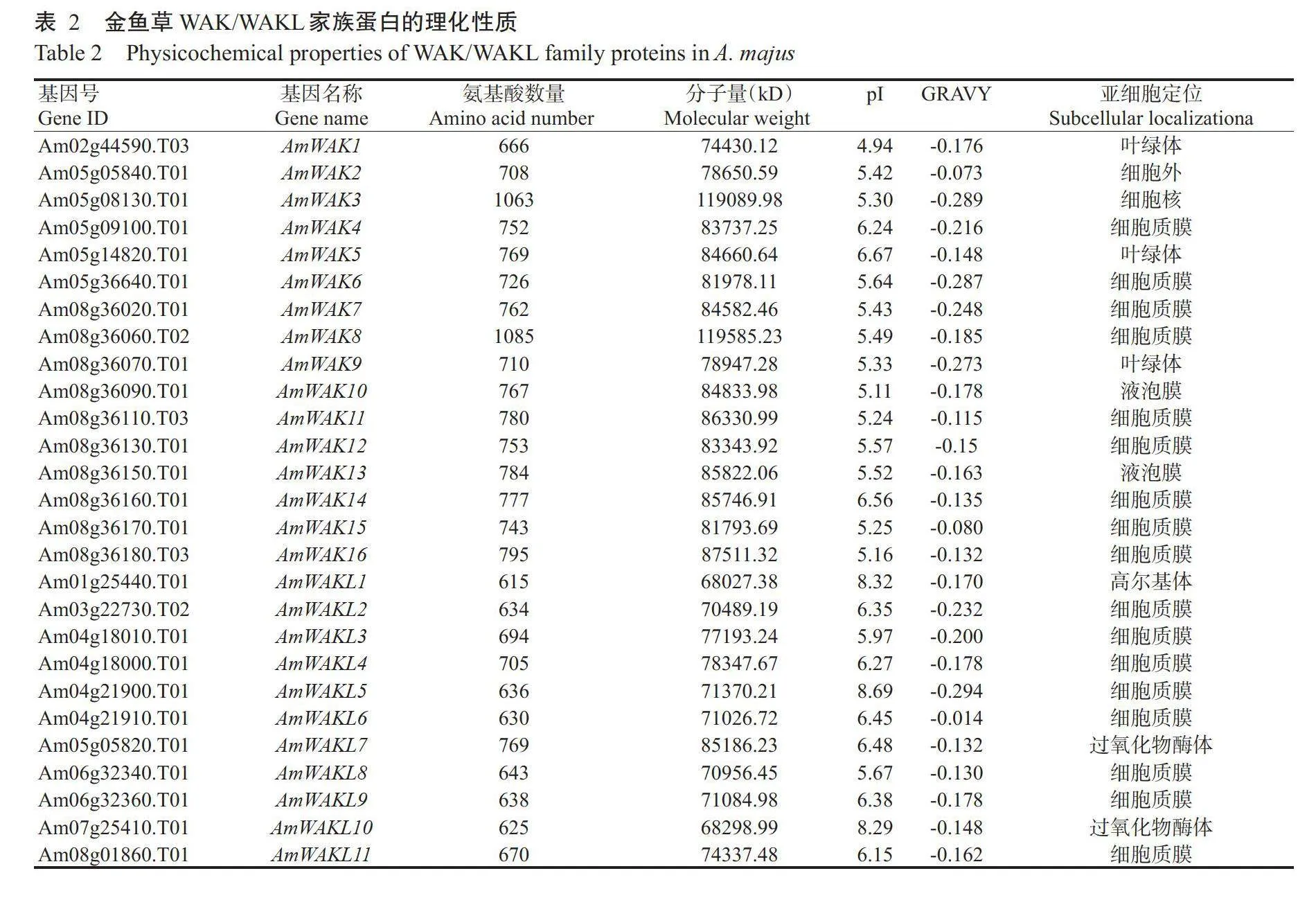
分别从拟南芥数据资源库TAIR(http://www.Arabidopsis.org)和金鱼草基因组数据库(http:/bio-info.sibs.Ac.Cn/Am/download_vl.php)下载拟南芥和金鱼草基因组的WAK/WAKL家族基因及编码区(CDS)序列和蛋白序列。将所获得的拟南芥序列作为子序列,通过TBtools的本地Blast(Elt;1×10¹0)初步筛选金鱼草WAK/WAKL家族基因,通过HMMER3.0(http:/hmmer janelia.org/)对其进行结构域预测分析,利用Pfam和SMART(http://smart.emblheidel-berg.De/)对鉴定获得的WAK/WAKL家族成员进行保守结构域预测分析,将同时含有N-末端WAK结合域、EGF结构域(Pfam)和C-末端Pkinase结构域的成员判定为WAK家族成员,将包含N-端WAK结合域和C-末端Pkinase结构域,且不含EGF结构域的成员判定为WAKL家族成员。通过ExPASy对WAK/WAKL家族成员进行理化性质预测分析,最后利用在线预测工具ProtComp9.0进行亚细胞定位预测。
1.3金鱼草WAK/WAKL家族基因染色体定位及共线性分析
分别下载金鱼草和拟南芥的全基因组及注释文件,利用TBtools中的Gene Location Visualize from GTF/GFF对已下载的金鱼草基因组文件及相应注释文件进行染色体定位的可视化分析。使用TBtools中Dual systeny Plot for MC scanX功能分别将金鱼草与拟南芥WAK/WAKL家族基因的共线性关系进行可视化分析。
1.4系统发育进化树构建
利用DNAMAN9.0对获得的金鱼草WAK/WAKL家族蛋白进行氨基酸序列多重序列比对,并利用MEGA11.0的最大似然法(Maximum likelihood estimation,ML)构建系统发育进化树,自展值1000,其他参数默认(Tamura et al.,2021)。
1.5金鱼草WAK/WAKL家族基因结构及蛋白保守基序分析结果
根据金鱼草WAK/WAKL家族基因序列及基因组GFF3数据进行基因结构分析,利用在线软件MEME对WAK/WAKL家族蛋白进行保守基序分析,利用TBtools中的Gene Location Visualize from GTF/GFF进行保守基序和基因结构可视化分析(Chen et al.,2020)。
1.6金鱼草WAK/WAKL基因家族启动子分析
从NCBI数据库提取WAK/WAKL家族基因上游2000bp启动子序列,使用PlantCARE预测其顺式作用元件。顺式作用元件分为三大类:环境应激元件、激素响应元件和发育相关元件。使用TBtools进行可视化并绘制热图(Lescot et al.,2002)。
1.7金鱼草抗感材料筛选
对7个金鱼草切花品种进行叶片离体接种核盘菌Ss-1,比较抗性差异。取抗性显著差异的品种进行核盘菌的离体接种处理(取金鱼草同一叶龄的叶片排置于一个透明的方形盒中,下面铺多层滤纸片,取新鲜制备的直径1~2mm菌丝块,有菌丝的面朝下,接种于叶片中部稍稍偏离主脉的位置,盖上盖子保湿),置22℃黑暗培养。从接种后0~42h持续对叶片进行观察拍照,并分别在0、6、12和24h取样,于-80℃保存。
1.8实时荧光定量PCR验证
通过深圳华大基因科技有限公司的DNBSEQ平台,对金鱼草苗腐病易感(S)品种Aml和抗苗腐病(R)品种Am6离体接种核盘菌24h后病斑周围新鲜叶片进行转录组测序,设3个生物学重复。为了检测金鱼草WAK/WAKL家族基因在核盘菌侵染下的表达模式,分别对离体接种核盘菌后0、6、12和24h的叶片进行取样,利用EasteTSuTer总RNA提取试剂盒提取核盘菌处理0、6、12和24h叶片的总RNA,并利用All-In-One5×RT MasterMix试剂盒将RNA反转录成cDNA第一链,使用Primer Premier5.0在该基因的编码区(CDS)设计特异性引物(表1),通过BlastaqTM2×qPCR Master Mix分析WAK/WAKL家族基因在核盘菌诱导下的表达模式。此外,提取金鱼草的根、茎、叶和花的总RNA,进一步分析WAK/WAKL家族基因在不同组织中的表达模式。反应体系15.0μL:2×SYBR qPCR MasterMix7.0μL,正、反向引物(10μmol/L)各0.5μL,cDNA(100ng/μL)模板2.0μL,焦碳酸二乙酯(DEPC)处理过的无菌水补足至15.0μL。扩增程序:95℃预变性30s;95℃5s,60℃30s,72℃27s,进行40个循环。以AmUBI为内参基因,使用2-AAQ法计算基因的相对表达量。
2结果与分析
2.1金鱼草WAK/WAKL家族基因鉴定及蛋白理化性质分析
通过比对分析拟南芥和金鱼草WAKWAKL家族蛋白的氨基酸序列和保守结构域,从金鱼草中共鉴定出27个WAK/WAKL家族基因,其中WAK家族基因16个(AmWAKI~AmWAK₁6),WAKL家族基因11个(AmWAKLI~AmWAKLI1),根据染色体定位的结果依次编号,如表2所示。这些金鱼草WAK/WAKL家族基因编码的氨基酸数量为615~1085个;分子量为68027.38~19585.23kD;理论等电点(pI)为4.94~8.69,其中24个成员呈酸性(pilt;7.00),3个成员为碱性(plgt;7.00);所有蛋白的总平均亲水性指数(GRAVY)值均小于0,表明均为亲水性蛋白。此外,亚细胞定位结果显示,17个WAK/WAKL家族蛋白定位于细胞质膜区域,其余10个分别定位于细胞外、液泡、高尔基体和细胞核等位置。
2.2金鱼草WAK/WAKL家族基因染色体定位及共线性分析结果
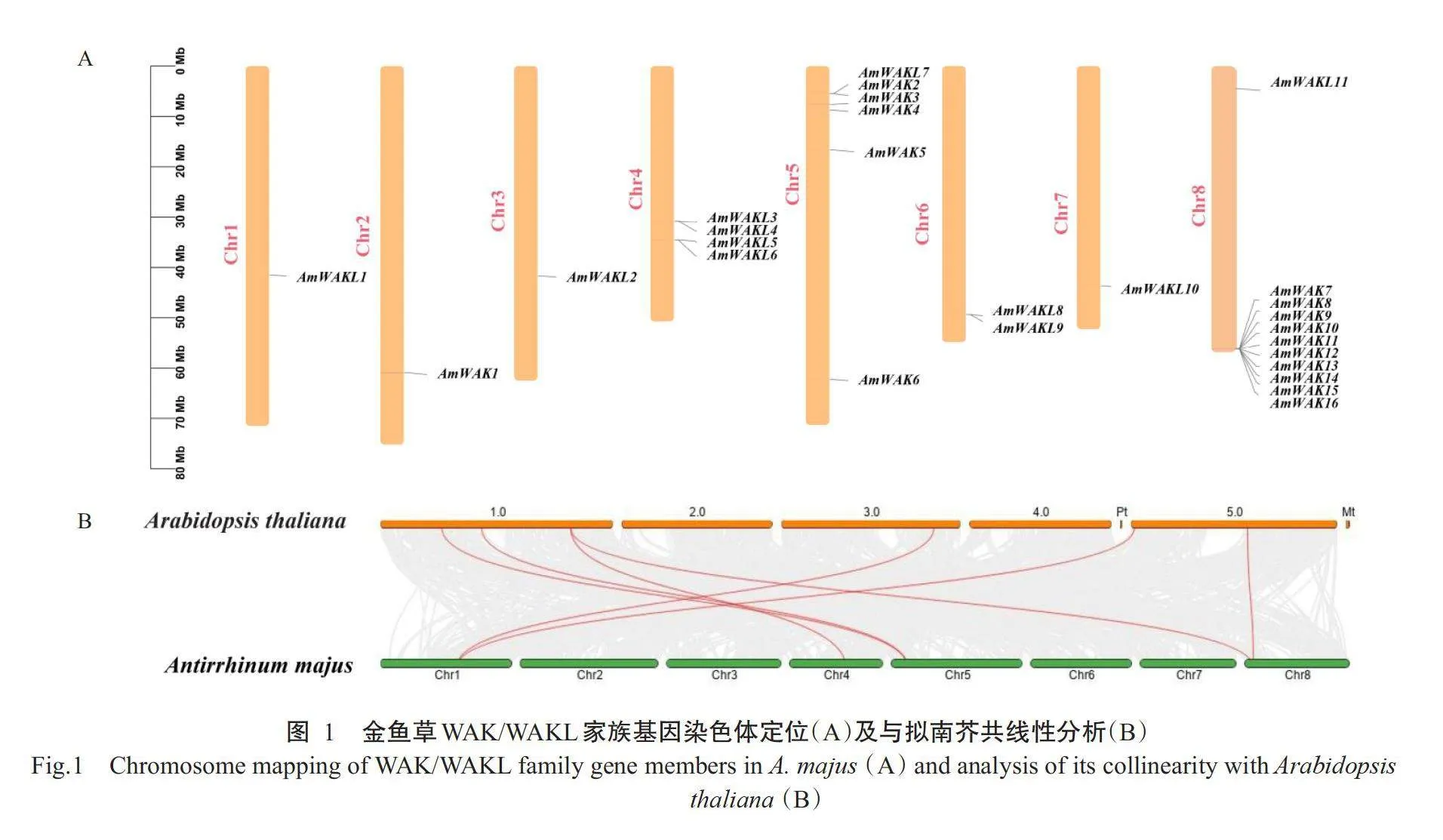
为了探究金鱼草WAK/WAKL家族基因的进化关系,利用TBtools对27个WAK/WAKL家族基因进行染色体定位,同时分析了该基因家族在拟南芥与金鱼草种间的共线性关系。染色体定位分析结果显示,WAK/WAKL家族基因在金鱼草8条染色体上均有分布,其中除AmWAK1基因定位在Chr2外,其余AmWAKs基因主要定位于Chr8和Chr5上;而AmWAKLs主要定位于Chr4和Chr6上(图1-A)。共线性分析结果显示,金鱼草与拟南芥共有7对同源基因,主要定位于AmWAKs和AmWAKLs基因集中分布的Chr8、Chr5和Chr4上(图1-B)。
2.3金鱼草WAK/WAKL家族基因系统发育分析结果
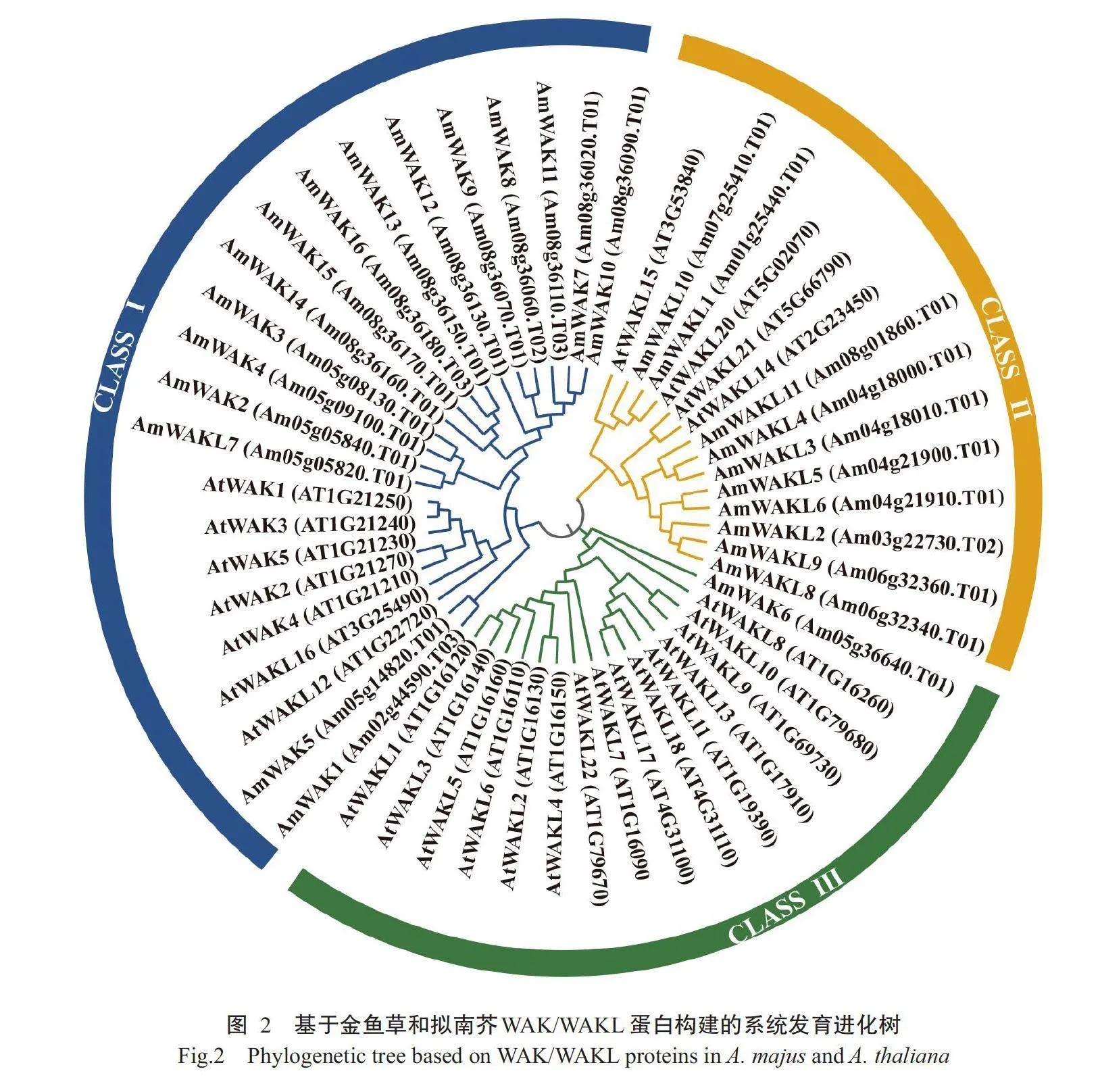
通过MEGA7.0中的最大似然法(ML)和氨基酸序列的多重比对,构建了金鱼草和拟南芥的系统发育进化树,结果(图2)显示,所有WAK/WAKL蛋白可分为三大组(I、Ⅱ和Ⅲ)。16个AmWAKs(AmWAK10、AmWAK7、AmWAK11、AmWAK8、AmWAK9、AmWAK12、AmWAK13、AmWAK16、AmWAK15、AmWAK14、AmWAK3、AmWAK4、AmWAK2、AmWAKL7、AmWAK5和AmWAK1)蛋白均与拟南芥AtWAK1~AtWAK5蛋白聚在第I组,其余3个AmWAKs(AmWAK1、AmWAK5和AmWAK6)聚在第Ⅲ组,而10个AmWAKLs蛋白(AmWAKL10、AmWAKL1、AmWAKL11、AmWAKL4、AmWAKL3、AmWAKL5、AmWAKL6、AmWAKL2、AmWAKL9和AmWAKL8)则聚在第Ⅱ组。
2.4金鱼草WAK/WAKL家族基因结构及蛋白保守结构域分析结果
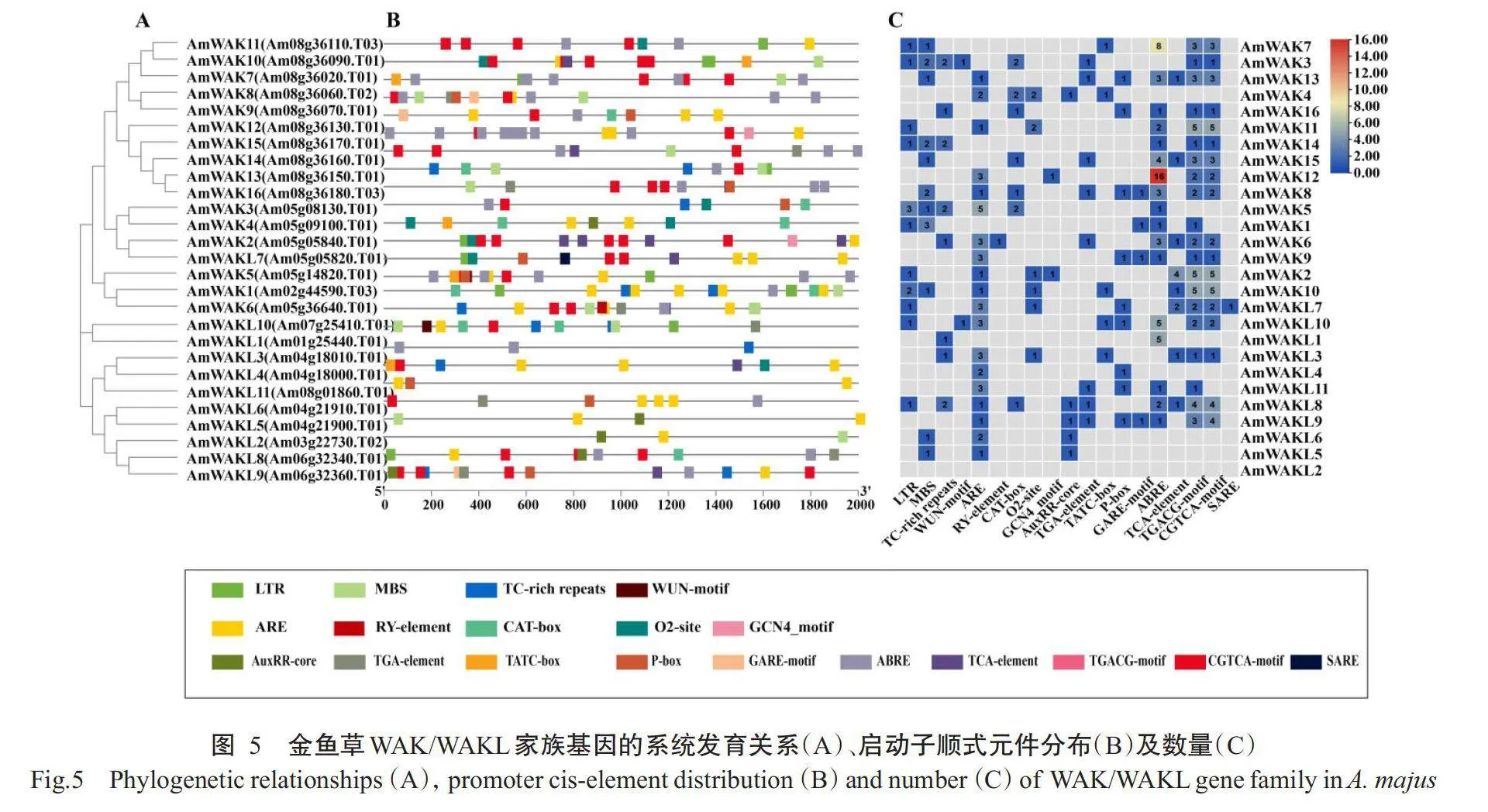
对金鱼草WAK/WAKL家族基因的外显子和内含子分布和位置进行分析,结果发现金鱼草WAK/WAKL家族基因的外显子数量为1~7个,同一组基因外显子的数量也各不相同,如在第Ⅲ组中,AmWAK6基因仅有1个外显子,而AmWAK8基因有7个外显子(图3-A和图3-B)。推测金鱼草WAK/WAKL家族基因结构的差异会导致基因功能出现分化或冗余。
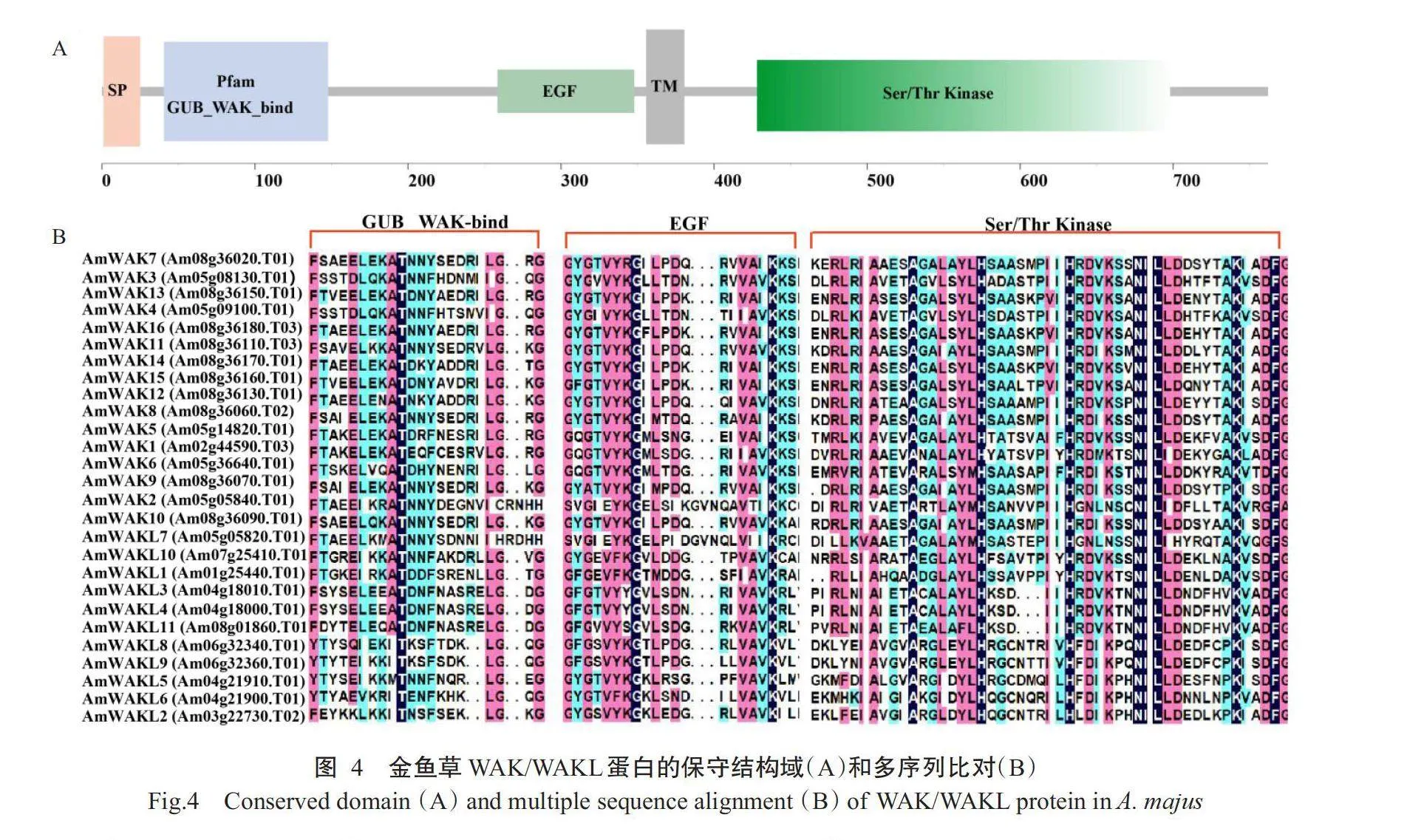
WAK/WAKL基因家族编码蛋白含有特征结构域,即GUB-WAK结合域、EGF或EGF-Ca和Ser/Thr蛋白激酶结构域,其中含有EGF或EGF-Ca结构域为WAK家族成员,其余则为WAKL家族成员。此外,大多数WAK/WAKL家族蛋白结构含有跨膜结构域(TM)和信号肽结构域(SP)(图4-A)。蛋白序列比对结果显示,WAK/WAKL家族蛋白成员含有WAK基因家族典型的结构域特征(图4-B)。蛋白保守基序分析结果显示,27个金鱼草WAK/WAKL蛋白可分为三大组(I、Ⅱ和Ⅲ)(图3-A),与图2中系统发育进化树分类结果一致,相较于Ⅱ,I和Ⅲ的基因结构相似性更大(图3-B)。金鱼草WAK/WAKL家族蛋白含有12个保守基序,Motif1、Motif3、Motif4、Motif9、Motif6和Motif10为WAK/WAKL家族蛋白共有,组间差异主要体现在N端(图3-C)。
2.5金鱼草WAK/WAKL家族基因启动子顺式作用元件分析结果
进一步对27个金鱼草WAK/WAKL基因上游2000bp的启动子序列进行顺式作用元件预测,并筛选出应激、生长发育相关和植物激素信号响应的元件(图5)。在应激相关元件中,只有AmWAKL10和AmWAK3基因启动子序列具有创伤反应元件WUN基序。此外,约65%的WAK/WAK家族基因启动子含有干旱诱导元件MBS和低温胁迫元件LTR,30%的WAK/WAKL家族基因启动子包含用于防御和胁迫反应的调控顺式作用元件TC富集重复序列。在激素响应相关元件中,90%的WAK/WAK基因启动子含有茉莉酸甲酯(MeJA)响应元件(TGACG和CGTCA),少数WAK/WAKL家族基因启动子含有生长素(IAA)响应元件(AuxRR核心和TGA元件)、赤霉素(GA)响应元件(GARE基序)和水杨酸(SA)响应元件(TCA元件)。在生长发育相关元件中,绝大多数WAK/WAKL家族基因含有分子组织响应元件(CAT-box),仅AmWAK6有1个参与种子特异性调控的元件(RY-element)。
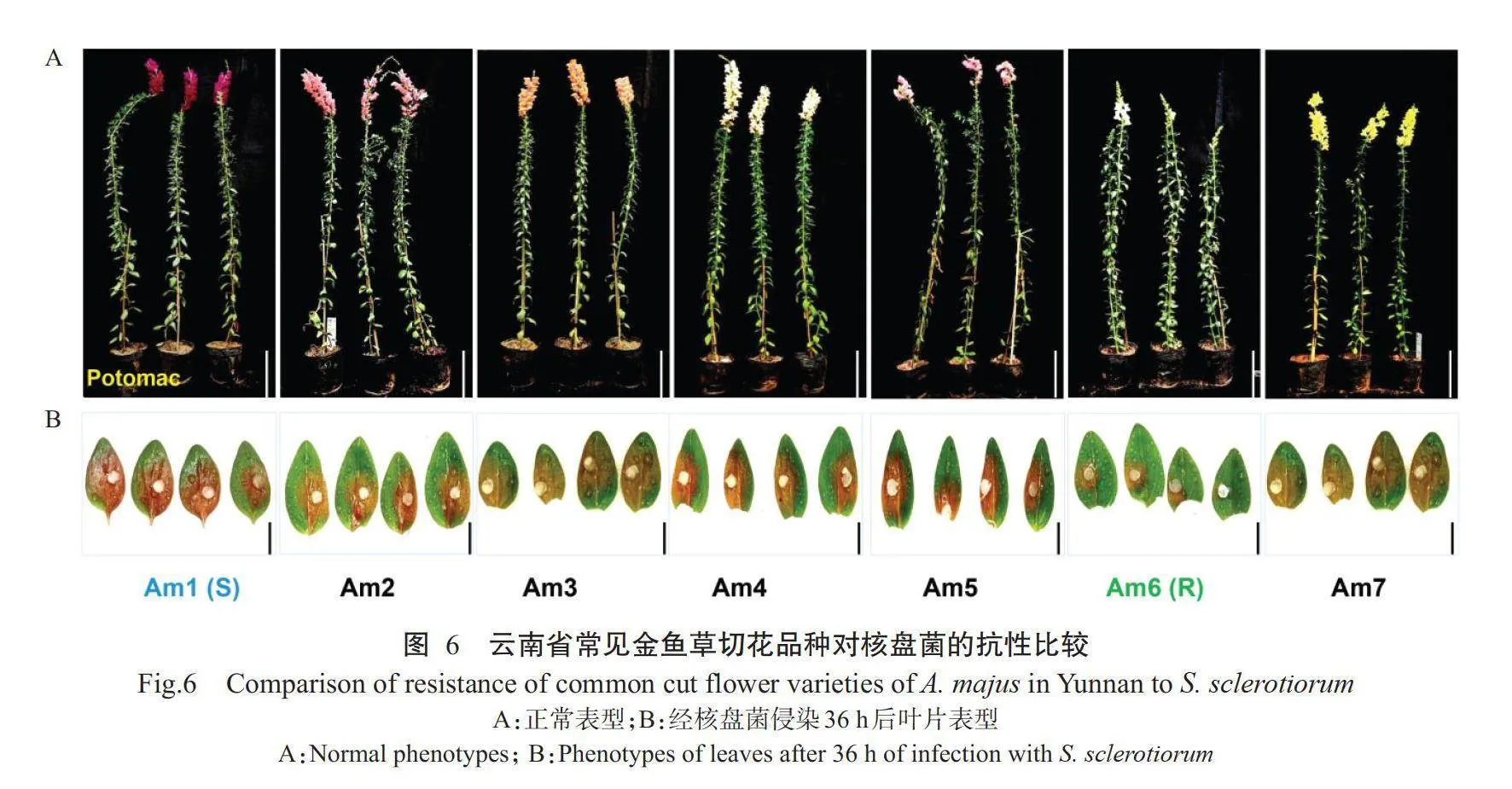
2.6叶片离体接种筛选金鱼草抗感材料
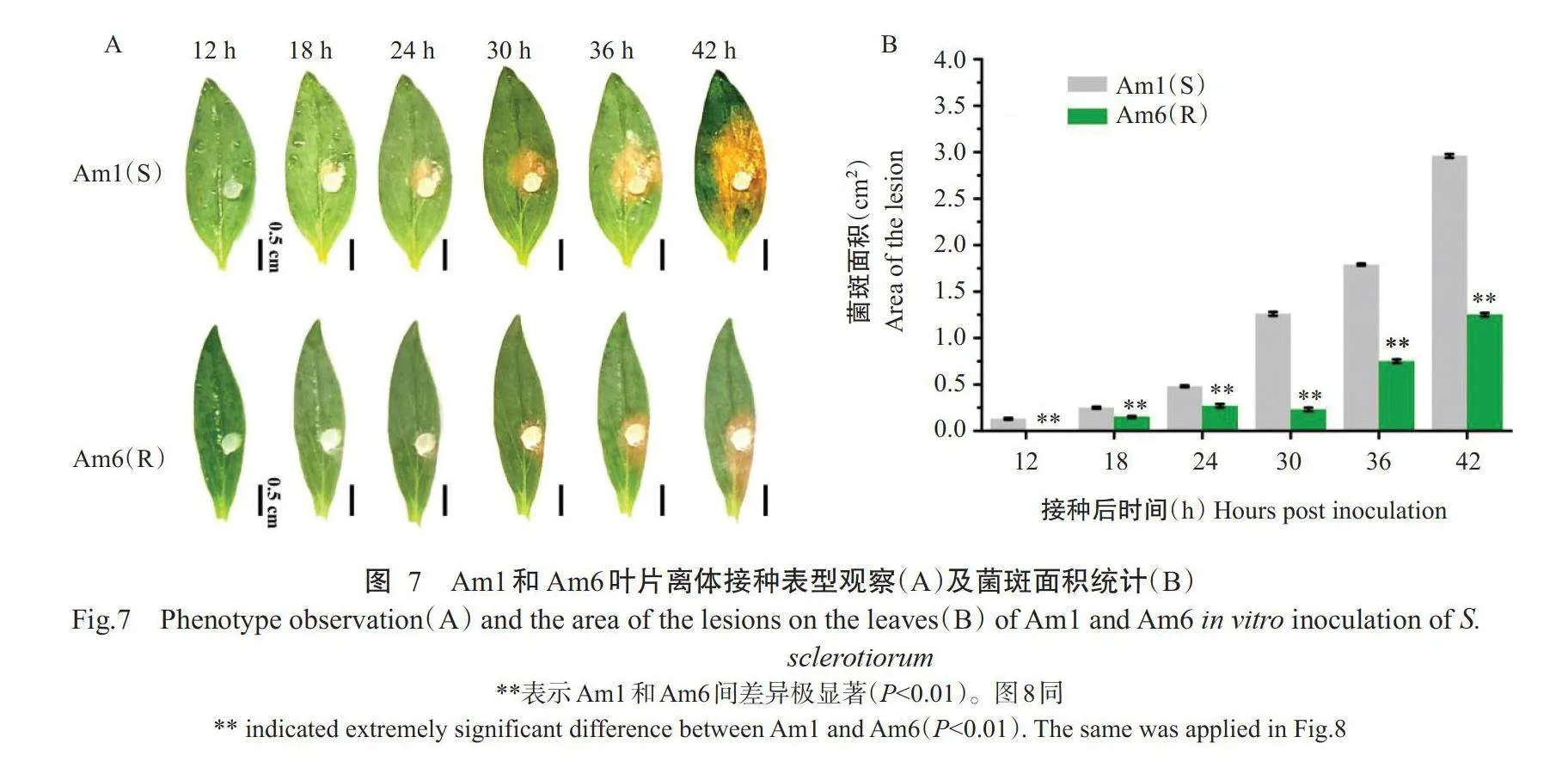
为了验证WAK/WAKL家族基因在金鱼草中对核盘菌的抗性,对7个云南省常见金鱼草切花品种进行叶片离体接种试验,接种36h后观察叶片表型,初步筛选出抗性差异明显的易感病(S)品种Aml和抗病(R)品种Am6(图6)。为进一步明确Aml和Am6的抗性,观察并记录接种后0、6、12、18、24、30、36和42h叶片发病情况,并对菌斑面积进行统计分析,结果如图7-A和图7-B所示。在接种后12h Aml叶片菌斑开始从琼脂块向外扩展,而Am6还未出现明显可见的菌斑;从接种后12~42h,Am6的菌斑面积均极显著小于Aml(Plt;0.01,下同),说明相较于Aml,Am6品种对金鱼草苗腐病表现出更强的抗性。由此筛选出Am6和Aml2个抗性差异明显的材料作为后续研究的抗感材料。
2.7金鱼草抗核盘菌的候选基因表达验证及筛选
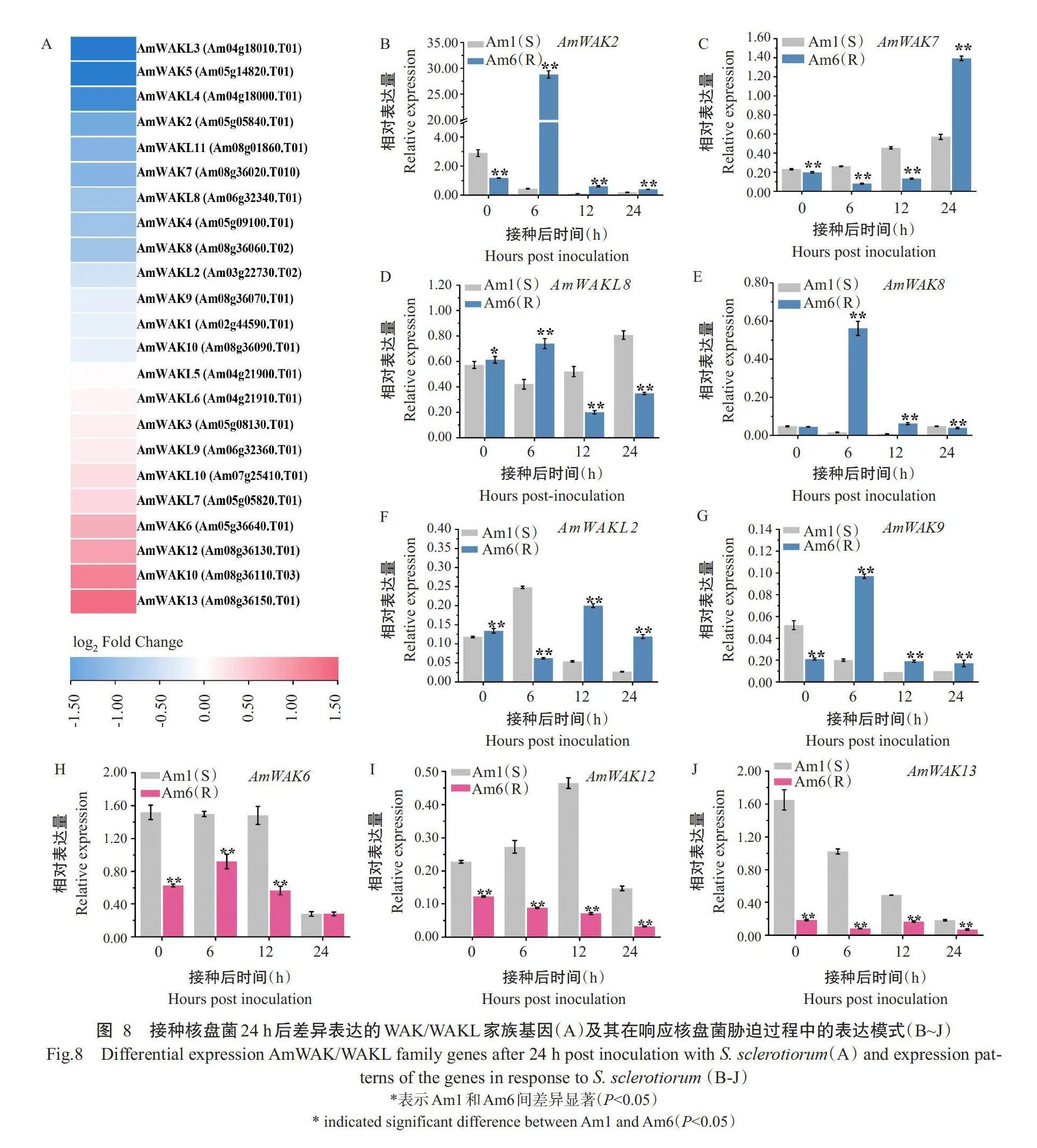
对金鱼草抗感材料Am6和Aml离体接种核盘菌24h后的叶片进行转录组测序,筛选出23个显著(Plt;0.05,下同)差异表达的WAK/WAKL家族基因(图8-A)。为了进一步验证这些基因的表达差异,取接种后0、6、12和24h的叶片进行实时荧光定量PCR检测,结果发现有12个基因在Am6或Aml中被诱导表达,其中AmWAKL2、AmWAKL8、AmWAK2、AmWAK7、AmWAK8、AmWAK9、AmWAKL10和AmWAK4这8个基因在核盘菌侵染早期(0和6h)或中后期(12和24h)的抗病材料Am6中的相对表达量显著或极显著高于感病材料Am1,而AmWAK6、AmWAK12、AmWAK13和AmWAKL3基因表达量在接种后所有时期均表现为Aml显著高于Am6。除AmWAKL10、AmWAK4和AmWAKL3外,其他9个基因表达模式(图8-B~图8-J)与转录组测序结果基本一致。因此,初步筛选AmWAKL2、AmWAKL8、AmWAK2、AmWAK7、AmWAK8、AmWAK9、AmWAK6、AmWAK12和AmWAK13为抗病候选基因。
由于核盘菌侵染金鱼草的根、茎和叶,分别引发根腐病、茎腐病和苗腐病,对27个WAK/WAKL家族基因进行组织表达特异性分析,结果发现上述初步筛选的9个的候选基因中,有5个基因(AmWAK7、AmWAKL2、AmWAKL8、AmWAK6和AmWAK13)在金鱼草的根、茎或叶组织中高表达,而剩余4个基因(AmWAK2、AmWAK8、AmWAK9和AmWAK12)在根、茎和叶中基本不表达(图9)。由于高表达的5个基因中AmWAK7、AmWAKL2、AmWAKL8和AmWAK6基因编码蛋白定位在细胞质膜,AmWAK13编码蛋白预测定位在液泡膜,推测这5个基因编码蛋白具有受体识别DAMPs介导金鱼草抗根腐病、茎腐病和苗腐病的潜力。因此,最终将这5个基因作为金鱼草对核盘菌抗性的关键候选基因,用于后续分子机理研究。
3讨论
WAK/WAKL蛋白家族是一类重要的受体激酶。部分模式植物或作物的研究表明,WAK/WAKL可通过识别DAMPs介导细胞壁抗性,从而增强植物对病原菌的广谱抗性(Decreux and Messiaen.,2005;Cay-rol et al.,2016),但WAK/WAKL家族在金鱼草等观赏性花卉中研究尚不深入。本研究共鉴定出27个WAK/WAKL家族基因,且家族成员间未发生串联重复的事件。在不同物种中WAK/WAKL家族成员数量差异明显,如从拟南芥(He et al.,1999)、马铃薯(余慧芳,2022;Chen et al.,2022)和山荆子(冒霞等,2022))中分别鉴定出27、26和27个WAK/WAKL基因家族成员,与本研究金鱼草WAK/WAKL基因家族成员数量相近,而从水稻(Vaid et al.,2012)、大白菜(Zhang et al.,2019)和甘蔗(Wang et al.,2023)中分别鉴定出125、44和68个WAK/WAKL基因家族成员,远远超过了金鱼草WAK/WAKL基因家族成员数量。据此推测,WAK/WAKL基因家族成员在不同物种间存在着广泛的变异和扩展,数量的增加可能与基因重复事件有关,预示着WAK/WAKL基因家族在功能上存在冗余和分化。
植物激素是介导植物抵御病原体的重要信号分子,如JA主要诱导植物对坏死性病原体的免疫应答,SA主要诱导植物对生物营养和半生物营养病原体的免疫应答(Glazebrook,2005)。研究表明,植物主要通过激活JA/乙烯(ET)信号途径来介导对核盘菌的抗性(Hu etal.,2021)。本研究通过金鱼草WAK/WAKL基因家族成员的顺式作用元件分析发现,大部分家族成员均含有MeJA响应元件(TGACG和CGTCA),推测这些WAK/WAKL基因可能通过某种机制激活JA信号途径来介导金鱼草对核盘菌的抗性。
基因结构分布和保守基序是基因家族进化和蛋白功能差异的基础(Bagavathi and Malathi,1996)。WAK/WAKL家族蛋白具有胞外结构域、跨膜结构域和胞内Ser/Thr蛋白激酶结构域,胞外结构域能结合寡聚半乳糖醛酸、损伤诱导的果胶片段等信号分子,通过调节细胞扩张和激活抗病信号通路等多种机制参与植物抗病(Zuo et al.,2015)。Zhang等(2023)在大白菜抗霜霉病的研究中发现,感病自交系91-112中过量表达BrWAK1基因可显著增强其抗病性,而在抗病自交系T12-19中敲除BrWAKI基因能增强其感病性;构建BrWAK1重要结构域的嵌合载体,通过瞬时转化研究发现,BrWAK1的GUB结构域变异是感病自交系91-112丧失抗性的主要原因。本研究鉴定出的金鱼草WAK/WAKL家族基因均含有GUB-WAK结合域和Ser/Thr蛋白激酶结构域,其中WAK还含有EGF或EGF-Ca结构域。深入分析这些特征结构域的差异对进一步揭示金鱼草WAK/WAKL家族基因的生物学功能有着重要的作用。
WAK/WAKL家族基因的功能与其组织特异性表达密切相关。在拟南芥中,AtWAK1、AtWAK2、AtWAK3和AtWAK5基因主要在叶和茎中差异表达(He et al.,1999),能增强植株对灰葡萄球菌(Botrytis cinerea)的抗性。甘蔗SsWAK6b和SsWAK16基因在根、芽和茎表皮中高表达,参与对黑穗病病原体—鞭黑粉菌(Sporisorium scitamineum)的免疫反应(Wang et al.,2023)。马铃薯SWAKL2基因在叶片和根中特异性表达,能提高马铃薯对晚疫病菌(Phytophthora infestans)的抗性(Chen et al.,2022;余慧芳,2022)。本研究通过转录组测序分析和实时荧光定量PCR验证初步筛选出9个抗病候选基因,其中5个正向调控金鱼草对核盘菌的抗性,4个为负向调控金鱼草对核盘菌的抗性。对筛选出的金鱼草WAK/WAKL家族基因进行组织特异性表达分析,结果发现有5个基因在金鱼草的根、茎和叶组织中高效表达。由于金鱼草的根、茎和叶受核盘菌侵染最为严重,分别引发根腐病、茎腐病和苗腐病,推测5个在金鱼草根茎叶中高表达的WAK/WAKL家族基因具有更强的抗病功能。后续需进一步验证WAK/WAKL家族基因的生物学功能,以期为金鱼草抗病新品种的培育提供新的基因资源,同时筛选出WAK/WAKL蛋白的互作蛋白和下游靶标基因,最终解析WAK/WAKL功能基因在植物抗核盘菌中的分子调控网络。
4结论
筛选出的27个金鱼草WAK/WAKL基因家族成员,具有相似的基因结构和蛋白功能结构域,其中AmWAK6、AmWAK7、AmWAK13、AmWAKL2和AmWAKL8为金鱼草抗核盘菌的关键候选基因,具有介导抗病的潜在功能。
参考文献:
韩月泠.2019.人参核盘菌侵染特性及致病机制研究[D].沈阳:沈阳农业大学.[HanYL.2019.Infection characteris-tics and pathogenic mechanism of Sclerotinia ginseng[D]Shenyang:Shenyang Agricultural University.]doi:10.27327/d.cnki.gshnu.2019.000308.
罗维平,陈少萍,龚衍熙.2008.金鱼草的繁殖与病虫害防治[J].中国花卉园艺,(8):23-25.[Luo WP,Chen SP,Gong YX.2008.Reproduction and pest control of Antirrhinum majus[J].China Flowers and Horticulture,(8):23-25.]
冒霞,王超,余宏强,朵虎.2022.山荆子WAK类受体激酶基因家族鉴定与表达分析[J].分子植物育种,20(12):3921-3930.[Mao X,Wang C,Yu HQ,Duo H.2022.Genome wide identification and expression analysis of WAK receptor like kinase in Malus baccata[J].Molecular Plant Breeding,20(12):3921-3930.]doi:10.13271/j.mpb.020.003921.
余慧芳.2022.马铃薯WAK亚家族的鉴定及响应晚疫病菌侵染的功能分析[D].兰州:甘肃农业大学.[Yu HF.2022.Identification ofWAK subfamily in potato and funetional analysis in response to Plytophthora infestans infestation [J].Lanzhou:Gansu Agricultural University.]
赵明,徐鹏飞,张淑珍.2020.大豆细胞壁相关蛋白激酶GmWAK1促进细胞内钙浓度上调,参与大豆疫霉菌的防御反应[C]//中国作物学会.第十九届中国作物学会学术年会论文摘要集:223.[Zhao M,Xu PF,Zhang SZ.2020.
Soybean cell wall associated protein kinase GmWAK1pro-motes upregulation of intracellular calcium concentration and participates in the defense response of Phytophthora sojae[C]//Chinese Crop Society.Collection of Abstracts from the19\"Annual Conference of the Chinese Crop Socie-ty:223.]doi:10.26914/c.cnkihy.2020.047935.
Anderson CM,Wagner TA,Perret M,He ZH,He D,Kohorn BD.2001.WAKs:Cell wall-associated kinases linking the cytoplasm to the extracellular matrix[J].Plant Molecular Biology,47:197-206.
Bagavathi S,Malathi R.1996.Introns and protein revolution—An analysis of the exon/intron organisation of actin genes[J].FEBS Journal,392(1):63-65.doi:10.1016/0014-5793(96)00769-7.
BigeardJ,ColcombetJ,Hirt H.2015.Signaling mechanisms in pattern-triggered immunity(PTI)[J].Molecular Plant,8(4):521-39.doi:10.1016/j.molp.2014.12.022.
Cayrol B,DelteilA,Gobbato E,KrojT,Morel JB.2016.Three wallassociated kinases required for rice basal immunity form protein complexes in the plasma membrane[J].Plant Signaling Behavior,11(4):el149676.doi:10.1080/15592324.2016.1149676.
Chen CJ,Chen H,Zhang Y,Thomas HR,Frank MH,He YH,Xia R.2020.TBtools:An integrative toolkit developed for interactive analyses of big biological data[J].Molecu-lar Plant,13(8):1194-1202.doi:10.1016/j.molp.2020.06.009.
Chen SY,Cui LL,Wang XH.2022.A plant cell wall-associated kinase encoding gene isdramatically downregu-lated during nematode infection of potato[J].Plant Signa-ling and Behavior,17(1):2004026.doi:10.1080/15592324.2021.2004026.
Christensen U,Alonso-Simon A,Scheller HV,Willats WGT,Harholt J.2010.Characterizationof the primary cell walls of seedlings of Brachypodium distachyon:A potential model plant for temperate grasses[J].Phytochemistry,71(1):62-69.doi:10.1016/j.phytochem.2009.09.019.
Decreux A,Messiaen J. 2005.Wall-associated kinase WAK1 interacts with cell wall pectins in acalcium-induced con-formation[J].Plant and Cell Physiology,46(2):268-278.doi:10.1093/pcp/pci026.
Ferrari S,Savatin DV,Sicilia F,Gramegna G,Cervone F,Lorenzo GD.2013.Oligogalacturonides:Plant damage-associated molecular patterns and regulators ogrowth and development[J].Frontiers in Plant Science,4:49.doi:10.3389/fpls.2013.00049.
Glazebrook J.2005.Contrasting mechanisms of defense against biotrophic and necrotrophic pathogens[J].Annual Review ofPhytopathology,43:205-227.doi:10.1146/annurev.phyto.43.040204.135923.
He ZH,Cheesman I,He D,Kohorn BD.1999.A cluster of five cell wall-associatedreceptor kinase genes,WAK1-5,are expressedin specific organs of Arabidopsis[J].Plant Molecular Biology,39(6):1189-1196.doi:10.1023/a:1006197318246.
Hu HZ,Tang YW,Wu J,Chen FZ,Yang YD,Pan XC,Dong X,Jin XD,Liu S,Du XZ.2021.Brassica napus mediator subunit16induces BnMED25-andBnWRKY33-activated defense signaling to conferSclerotiniasclerotiorum resis-tance[J].Frontiers in Plant Science,12:663536.doi:10.3389/fpls.2021.663536.
Kohorn BD.2016.Cell wall-associated kinases and pectin per-ception[J].Journal of Experimental Botany,67,489-494.doi:10.1093/jxb/erv467.
Lescot M,Dehais P,Thijs G,Marchal K,Moreau Y,Van de Peer Y,Rouzé P,Rombauts S.2002.PlantCARE,a data-base of plant cis-acting regulatory elements and aportal to tools for in silico analysis of promoter sequences[J].Nu-cleic Acids Research,30(1):325-327.doi:10.1093/nar/30.1.325.
Lipka V,Dittgen J,Bednarek P,Bhat R,Wiermer M,Stein M,Landtag J,Brandt W,Rosahl S,Scheel D,Llorente F,Molina A,Parker J,Somerville S,Schulze-Lefert P.2005.Pre-and postinvasion defensesboth contribute to nonhost resistance in Arabidopsis[J].Science,310(5751):1180-1183.doi:10.1126/science.1119409.
Meier S,Ruzvidzo O,Morse M,Donaldson L,Kwezi L,Geh-ring C.2010.TheArabidopsis wall associated kinase-like10gene encodes afunctional guanylyl cyclase and is co-expressed with pathogen defense related genes[J].Public Library of Science,5(1):e8904.doi:10.1371/journal.pone.0008904.
Tamura K,Stecher G,Kumar S.2021.MEGAl1:Molecular evolutionary genetics analysis version1[J].Molecular Biology and Evolution,38(7):3022-3027.doi:10.1093/molbev/msab120.
Vaid N,Pandey PK,Tuteja N.2012.Genome-wide analysis of lectin receptor-like kanase family from Arabidopsis and rice[J].Plant Molecular Biology,80(4-5):365-388.doi 10.1007/s11103-012-9952-8.
Wang DJ,Qin LQ,Wu MX,Zou WH,Zang SJ,Zhao ZN,Lin PX,Guo JL,Wang HB,Que YX.2023.Identifica-tion and characterization of WAK gene family in Saccha-ram and the negative roles of ScWAK1under the pathogen stress[J].International Journal of Biological Macromole-cules,224:1-19.doi:10.1016j.ijbiomac.2022.11.300.
Wang P,Zhou L,JamiesonP,Zhang L,Zhao ZX,Babilonia K, Shao WY,Wu LZ,Mustafa R,Amin I,Diomaiuti A,Pon-tiggia D,Ferrari S,HouYX,He P,Shan LB.2020.The cotton wall-associated kinase GhWAK7A mediates respon-ses to fungal wilt pathogens by complexing with the chitin sensory receptors[J].The Plant Cell,32(12):3978-4001.doi:10.1105/tpc.19.00950.
Wang YT,Fan CF,Hu HZ,LiY,Sun D,Wang YM,PengL C.2016.Genetic modification of plant cell walls to enhance biomass yield and biofuel production in bioenergy crops[J].Biotechnology Advances,34(5):997-1017.doi:10.1016/j.biotechadv.2016.06.001.
Zhang B,LiP,Su T,LiPR,XiXY,Wang WH,Zhao XY,Yu Y J,Zhang DS,Yu SC,Zhang FL.2019.Comprehensive" analysis owall-associated kinase genes and their expres-""" sion unde abiotic andbiotic stress in chinese cabbage(Bras-" sica rapa ssp.pekinensis)[J].Journal of Plant Growth Re-""" gulation,39(1):72-86.doi:10.1007/s00344-019-09964-3.Zhang B,Su TB,Xin XY,LiPR,Wang J,WangWH,Yu YJ,Zhao XY,Zhang DS,LiDY,Zhang FL,Yu SC.2023.
Wall-associated kinase BrWAK1confers resistance to downy mildew in Brassica rapa[J].Plant Biotechnology Journal,21(10):2125-2139.doi:10.1111/pbi.14118.
Zhang N,Pombo MA,Rosli HG,Martin GB.2020.Tomato wall-associated kinase SIWak1depends on Fls2/Fls3to promoe apoplastic immune responses to Pseudomonas syringae[J].Plant Physiology,183(4):1869-1882.doi:10.1104/pp.20.00144.
Zhang SB,Chen C,Li L,Meng L,Singh J,Jiang N,Deng XW,He ZH,Lemaux PG.2005.Evolutionary expansion gene structure,and expression of the rice wall-associated kinase gene family[J].Plant Physiology,139(3):1107-1124.doi:10.1104/pp.105.069005.
Zuo WL,Chao Q,Zhang N,Ye JR,Tan GQ,LiB L,Xing YX,Zhang BQ,Liu HJ,Fengler KA,Zhao J,Zhao XR,Chen YS,LaiJS,Yan JB,Xu ML.2015.A maize wall-associatedkinase confers quantitative resistance to head smut[J].Nature Genetics,47(2):151-157.doi:10.1038/ng.3170.
(责任编辑 陈燕)

