叉角厉蝽不同发育阶段肠道细菌群落组成、多样性及功能预测



朱国渊(1989-),副研究员,云南省科技特派员,云南省天然橡胶产业 技术体系病虫害岗位核心成员,云南省天然橡胶可持续利用研究重点实 验室(筹)成员,主要从事热带作物害虫防控技术及天敌昆虫资源发掘利 用研究工作。主持省部级项目2项,作为主要成员参与国家重点研发计 划项目、省级科研项目10余项,在《Mitochondrial DNAPart B:Resources》 《Plant Disease》《南方农业学报》等国内外核心期刊上发表学术论文20余 篇;作为主要发明人获授权发明专利5项、实用新型专利2项;作为主要起 草人制定云南省地方标准2项、西双版纳州地方标准3项;作为完成人获 得云南省科学技术进步奖三等奖1项,西双版纳州科学技术进步奖三 等奖1项;参编技术手册1本。
摘要:【目的】分析天敌昆虫叉角厉蝽[Eocanthecona fircellata(Wolff)]不同发育阶段肠道细菌群落组成及多样 性,并预测其功能,为深入了解肠道细菌对叉角厉蝽生长发育和营养获取方式的影响及开发新的害虫生物防治策略 提供理论依据。【方法】选取叉角厉蝽1龄、2龄、5龄若虫和7日龄雌、雄成虫,分别提取其肠道细菌基因组DNA。利 用 单分子实时测序技术对肠道细菌16S rRNA序列全长进行测序,统计操作分类单元(OTU) 数量,分析肠道细菌群落组 成结构与多样性,并采用PICRUSt 预测肠道细菌功能。【结果】从叉角厉蝽15个肠道样品中共得到202401条有效序 列,聚类为222个OTUs,其中共有OTUs为5个。共注释到19门32纲62目103科154属188种细菌,优势门、纲、目、科、属、种分别为变形菌门(Proteobacteria,72.22% )、y-变形菌纲(Gammaproteobacteria,72.21%)、肠杆菌目(Enterobacterales, 72.11%)、肠杆菌科(Enterobacteriaceae,49.39%)、西地西菌属(Cedecea,49.24%) 和奈氏西地西菌(C.neteri,49.24%)。多样性和差异分析结果显示,肠道细菌菌群组成在叉角厉蝽不同发育阶段存在显著差异(Plt;0.05, 下同)。线性判 别分析结果显示,1龄、2龄若虫和7日龄雌、雄成虫肠道具有显著优势的菌群,而5龄若虫肠道不存在显著优势菌群(Pgt;0.05), 且不同发育阶段肠道的优势菌群在科、属、种3级分类阶元水平上亦不同。KEGG代谢途径分析发现,叉角 厉蝽不同发育阶段肠道菌群的功能相似,主要涉及新陈代谢(74.1 7%~75.59%)和环境信息处理(10.53%~11.03%),二级代谢功能通路主要为全局和概述图谱、糖类代谢和氨基酸代谢等。【结论】叉角厉蝽不同发育阶段肠道细菌群落组 成和多样性存在显著差异,优势菌分布呈动态变化。
关键词:叉角厉蝽;肠道微生物;细菌多样性;单分子实时测序
中图分类号:S476.2;Q965 文献标志码:A 文章编号:2095-1191(2024)01-0013-11
Composition,diversity and function prediction of the gut bacterial community in different developmental stages of Eocanthecona furcellata(Wolff)
ZHU Guo-yuan'2,LIU Bing-shun³,ZHANG Man' ,SHI Chun-lan',TANG Yong-yu¹,LAN Ming-xian',WU Guo-xing',Ci-na-you-ruo',GAO Xil°
('Plant Protection College,Yunnan Agricultural University,Kunming,Yunnan 650201,China;²Yunnan Institute of Tropical Crops,Jinghong,Yunnan 666100,China;'Lufeng Agricultural Technical Extension Center, Chuxiong,Yunnan 651200,China)
Abstract :[Objective]The purpose of the study was to analyze the composition and diversity of gut bacterial commu- nities in different developmental stages of the natural enemy insect Eocanthecona furcellata(Wolff),and to predict their functions,in order to provide a theoretical basis for a deeper understanding of the influenceof gut bacteria on the growth, development and nutrient acquisition patterns of E.furcellata,as well as for the development of a novel biocontrol strate- gies for the pests.【Method]The gut bacterial genomic DNA was extracted from the first instar nymphs,second instar nymphs,fifth instar nymphs,7-day-old female and male adults of E.furcellata,respectively.The full-length of 16S rRNA sequence of E.fucellata gut bacteria was sequenced using the single-molecule real-time sequencing technique.The number of operational taxonomic unit(OTU)was counted,the composition and diversity of gut bacterial communities were analyzed,and the functions of gut bacteria were predicted by PICRUSt.【Result]Atotal of 202401 effective se- quences were obtained from 15 gut samples ofE.fiurcellata,and clustered into 222 OTUs,of which 5OTUs were shared by them.A total of 19 phyla,32 classes,62 orders,103 families,154 genera and 188 species bacteria were annotated.The dominant phylum,class,order,family,genus and species of the bacteria wereProteobacteria(72.22%),Gammaproteo- bacteria(72.21%),Enterobacterales(72.11%),Enterobacteriaceae(49.39%),Cedecea(49.24%),and C.neteri(49.24%), respectively.The results of the diversity and variance analysis revealed significant differences in the composition of the gut bacterial flora in different developmental stages of E.fuacellata(Plt;0.05,thesame below).The linear discriminant analysis results showed that significantly dominant flora existed in the guts of first instar nymphs,second instar nymphs and 7-day-old female and male adults,while no significantly dominant flora existed in the gut of fifth instar nymphs(P gt;0.05),and the dominant flora in the gut ofdifferent developmental stages varied at the level of 3 taxonomic catego- ries,namely,family,genus and species.KEGG metabolic pathway analysis revealed that the functions of the gut flora of E.fiurcellata were similar in different developmental stages,mainly involving metabolism(74. 17%-75.59%)and environ- mental information processing(10.53%-11.03%).The secondary metabolic pathways were mainly global and overview mapping,sugar metabolism,and amino acid metabolism,etc.【Conclusion]Significant differences in the composition and diversity of gut bacterial community are observed in different developmental stages of E.fiucellata,and the distribu- tion of dominant bacteria shows dynamic changes.
Key words:Eocanthecona furcellata(Wolff);gut microorganism;bacterial diversity;single-molecule real-time se-quencing
Foundation items:Yunnan Agricultural Basic Research Joint Special Project(202101BD070001-050,202301BD 070001-137);Reserve Talents Project for Young and Middle-aged Academic and Technical Leaders of Yunnan(202205AC160077);Science and Technology Plan Project of Yunnan Tobacco Company(2023530000241012)
0 引言
【研究意义】叉角厉蝽[Eocanthecona furcellata(Wolff)] 隶属于半翅 目(Hemiptera) 蝽 科(Pentatomi- dae) 益蝽亚科(Asopinae) 厉蝽属(Eocanthecona), 可捕食草地贪夜蛾(Spodoptera frugiperda)、斜纹夜蛾(S.litura) 和柑桔尺蛾(Hyposidra talaca)等40多种 农林害虫的幼虫,是一种在生物防治方面具有重要作用和应用潜力的天敌昆虫(范悦莉等,2019;宫靖 垚等,2019;Keerthi et al.,2020;Sarkar et al.,2021)。叉角厉蝽1龄若虫仅刺吸嫩枝梢、嫩叶汁液,2~5龄 若虫及成虫均能捕食害虫,若虫龄期越大捕食能力 越强(姚明勇,2019;张曼等,2022)。昆虫肠道作为 一种特殊生境,栖息于此的大量微生物对昆虫的物 种形成、营养代谢、生殖代谢及免疫等具有重要意义(王四宝和曲爽,2017;张振宇等,2017;Song et al.,2022)。同时,昆虫肠道微生物物种多样性和特异性 受宿主的系统发育、不同发育时期、食物和营养等的 影响(Colman et al.,2012;Yun et al.,2014)。鉴 于 此,利用高通量测序技术研究昆虫肠道微生物的结 构组成和多样性,已成为研究热点(Fernandes et al., 2014)。然而截至目前,关于叉角厉蝽肠道细菌与其 不同发育阶段间的关联鲜有报道。因此,研究叉角 厉蝽不同发育阶段肠道细菌的组成、多样性 及显著 差异菌群,并分析肠道细菌对其生长发育的影响,对 该天敌昆虫人工饲料中微生物添加剂的开发与应用 以及大规模人工扩繁和利用具有重要意义。【前人研 究进展】目前关于昆虫肠道微生物的研究主要涉 及鳞翅目(Lepidoptera)、双翅目(Diptera)、膜翅目(Hymenoptera)、蜚蛾目(Blattaria)、鞘翅目(Coleop- tera)、直翅目(Orthoptera) 和半翅目等昆虫(郑林宇 等,2022),其中对半翅目蝽类的大多数研究集中于 蝽次目(Infraorder Pentatomomorpha)的植食性 蝽及 与异翅亚目(Heteropteran) 昆虫谱系相关的肠道微 生物区系(Shan et al.,2021;Lietal.,2022),如斑腹刺益蝽(Podisus maculiventris)、中黑盲蝽(Adelphoco-ris suturalis)、荔枝蝽(Tessaratoma papillosa)和绿盲 蝽(Apolygus lucorum)等(Ahsaei et al.,2020;Hu et al.,2020;Xue et al.,2021;Liu et al.,2022;Xue et al., 2023) 。Xue 等(2021)基于Illumina HiSeq高通量测 序平台分析了中黑盲蝽1~5龄若虫和1、6、9日龄雌、雄成虫肠道细菌组成及多样性,发现上述发育阶段 中黑盲蝽肠道内的葡萄球菌属(Staphylococcus)、不 动杆菌属(Acinetobacter)、假单胞菌属(Pseudomo- nas)和棒杆菌属(Corynebacterium)等微生物的相对 丰度呈显著动态变化。安哲等(2022)通过相似方法 研究了棉田绿盲蝽若虫和雌、雄成虫体内共生菌的 群落组成与多样性,结果显示,绿盲蝽不同发育时期 体内共生菌的相对丰度和多样性指数不同,且成虫 期的物种丰富度与群落多样性均大于若虫期。韩顺 财等(2022)亦采用该方法分析了采自云南、福建、广 东、广西、海南和台湾的荔枝蝽成虫和若虫体内细菌 组成及多样性,发现6省(自治区)荔枝蝽成虫间细 菌多样性差异不显著,但1龄若虫间细菌组成及其 占比差异显著;成虫体内优势菌为肠杆菌,而多数 1龄若虫体内优势菌为链霉菌。Kuang 等(2022)利用高通量测序技术分析3种饲料饲养的叉角厉蝽雌 成虫中肠肠道细菌 16S rRNA 序列V3~V4区域,结 果发现变形菌门(Proteobacteria) 和厚壁菌门(Fir-micutes)为优势菌门,沙雷氏菌属(Serratia)(人工饲料处理的相对丰度较低)、肠球菌属(Enterococcus)和肠杆菌科(Enterobacteriaceae)的一个未培养细菌 属为优势菌属,且不同饲料饲养的叉角厉蝽雌成虫 中肠肠道微生物区系组成存在显著差异。Liu 等 (2022)利用依赖培养(Culture-dependent)和第三代测 序技术评估了荔枝蝽肠道细菌群落多样性和动态变 化,结果表明,7个发育阶段中存在5个细菌门类,变 形菌门为优势菌门,泛菌属(Pantoea)为优势菌属; 卵阶段的细菌群落最复杂;细菌群落在卵期、1~3龄 若虫期、4~5龄若虫期和成虫期发挥着不同的作用。【本研究切入点】目前,有关叉角厉蝽的研究报道主 要集中在生物学特性、捕食功能反应、控害能力、触 角转录组及嗅觉相关基因分析、唾液腺转录组及差 异分析、实时荧光定量PCR内参基因筛选与验证、不同食物对雌成虫中肠细菌群落及多样性影响等 方面(高平等,2021;张曼等,2022;赵航等,2022; Kuang et al.,2022;Pan et al.,2022),尚未涉及其不同 龄期若虫和成虫肠道细菌群落组成及多样性。【拟解 决的关键问题】基于PacBio测序平台,使用单分子实 时(Single-molecule real-time,SMRT)测序技术对叉 角厉蝽1龄、2龄、5龄若虫和7日龄雌、雄成虫肠道 细菌16S rRNA序列全长进行测序,并采用PICRUSt 预测其肠道细菌功能,旨在探明该虫不同发育阶段 肠道细菌群落组成及多样性差异,为深入了解肠道 细菌对叉角厉蝽生长发育和营养获取方式的影响及 开发新的害虫生物防治策略提供理论依据。
1 材料与方法
1.1 供试昆虫
叉角厉蝽采自云南省玉溪市元江县滨江大道小 燕村。在云南省昆明市北郊云南农业大学植物保护 学院养虫室内用黄粉虫蛹饲养,建立稳定种群。养 虫室内温度(26±1)℃、相对湿度(65±10)%、光周期 14L:10D。
1.2 叉角厉蝽肠道解剖
根据食性、捕食量及产卵前期,分别挑选健康、生长发育一致且已饥饿处理24 h 的叉角厉蝽1龄、2龄、5龄若虫和7日龄雌、雄成虫,解剖肠道。每组 3次重复,每重复20头。解剖前将试虫于-20℃冰 箱 中冷冻3~5 min, 使其麻痹后置于超净工作台中,先 用75%酒精进行虫体体表消毒20 s, 再用无菌水清 洗3~5次,后转至盛有无菌磷酸盐缓冲液(PBS, pH 7.2~7.5)的培养皿中,置于体视显微镜下解剖。
为便于解剖叉角厉蝽肠道,可先剪去试虫胸足 和成虫双翅。解剖时,将试虫正放,先用普通镊子夹 住其头、胸部,后用尖头镊子轻轻刺入背部,向后慢慢拉开表皮层,露出内容物,再用镊子夹住嗦囊处, 向后拉出食道,剔除唾液腺、马氏管、肛门等组织,取 出完整肠道。用无菌水冲洗后,置于1.5 mL离心管 中,盖上盖子并用封口膜包封,将其置于液氮中速冻 3 h后取出,转至-80℃冰箱保存备用。
1.3 叉角厉蝽肠道细菌基因组DNA提取
采用磁珠法并按基因组DNA提取试剂盒 [DP812,天根生化科技(北京)有限公司]说明书操 作步骤提取肠道细菌基因组DNA。用NanoDrop 2000型超微量分光光度计(赛默飞世尔科技有限公 司)检测基因组DNA浓度和纯度。
1.416S rRNA序列PCR扩增选取27F(5'-AGRGTTTGATYNTGGCTCAG-3') 和1492R(5'-TASGGHTACCTTGTTASGACTT-3')引 物,用Veriti 96-Well型梯度基因扩增仪(Applied Biosystems公司)扩增16SrRNA 序列全长,PCR反 应体系30.0 μL:KOD OnePCR Master Mix 15.0μL, DNA模板1.5 μL,正、反向引物各1.5 μL, 无核酸酶 水10.5μL。扩增程序:95℃预变性2 min;98℃10s, 55℃30s,72℃1 min 30s,进行25个循环;72℃延 伸2 min。
经Qubit 4.0 Q33216型荧光定量仪(赛默飞世尔 科技有限公司)和1.8%琼脂糖凝胶电泳分别对扩增 产物的浓度和条带进行检测后,送至北京百迈客 生物科技有限公司使用三代测序平台PacBic Sequel Ⅱ进行测序。
1.5 统计分析
对 PacBio原始下机 subreads 进行校正,得到 cCS(Circular consensus sequencing)序列;利用lima v1.7.0, 通过barcode对CCS序列进行识别,得到原始 序列数(Raw CCS);利用cutadapt v2.7识别正、反向 引物,丢弃不包含引物的CCS序列,对CCS长度进 行过滤,丢弃不满足长度阈值(1200~1650 bp) 的 序列,得到去除引物后序列(Clean CCS);利用 UCHIME v8.1去除嵌合体序列,得到最终有效序 列数(Effective CCS)。使用USEARCH v10.0(http:// drive5.com/uparse/)(Edgar,2013) 在相似性97%的 水平上对序列进行聚类并得到操作分类单元(Opera- tional taxonomic unit,OTU)。
使用Ribosomal Database Project Classifier的朴 素贝叶斯算法对97%相似水平的OTU 代表序列进 行分类学分析(Wanget al.,2007),与Silva v138数据 库(https://www.arb-silva.de/)进行比对,在各分类阶 元上统计物种组成。使用QIIME 2分析菌群丰富度(ACE 、Chao指数)和多样性(Simpson、Shannon指数 )(Bolyen et al.,2019)。利 用Metastats(White et al.,2009) 分析组间丰度差异显著的菌群。基于Bray- Curtis距离算法,用非度量多维标度(Non-metric multidimensional scaling,NMDS)分析比较不同组 间群落组成的相似性,并用置换多元方差分析(Permutational multivariate analysis of variance, PERMANOVA)检验差异显著性。
通过PICRUSt2 v2.3.0(Langille et al.,2013)预 测叉角厉蝽不同发育阶段肠道菌群KEGG代谢通 路,使用STAMP v2.0.8(Parks et al.,2014)分析样品 间肠道菌群功能的差异。利用R 语言vegan v2.3 作图。
2 结果与分析
2.1 叉角厉蝽不同发育阶段肠道细菌测序结果
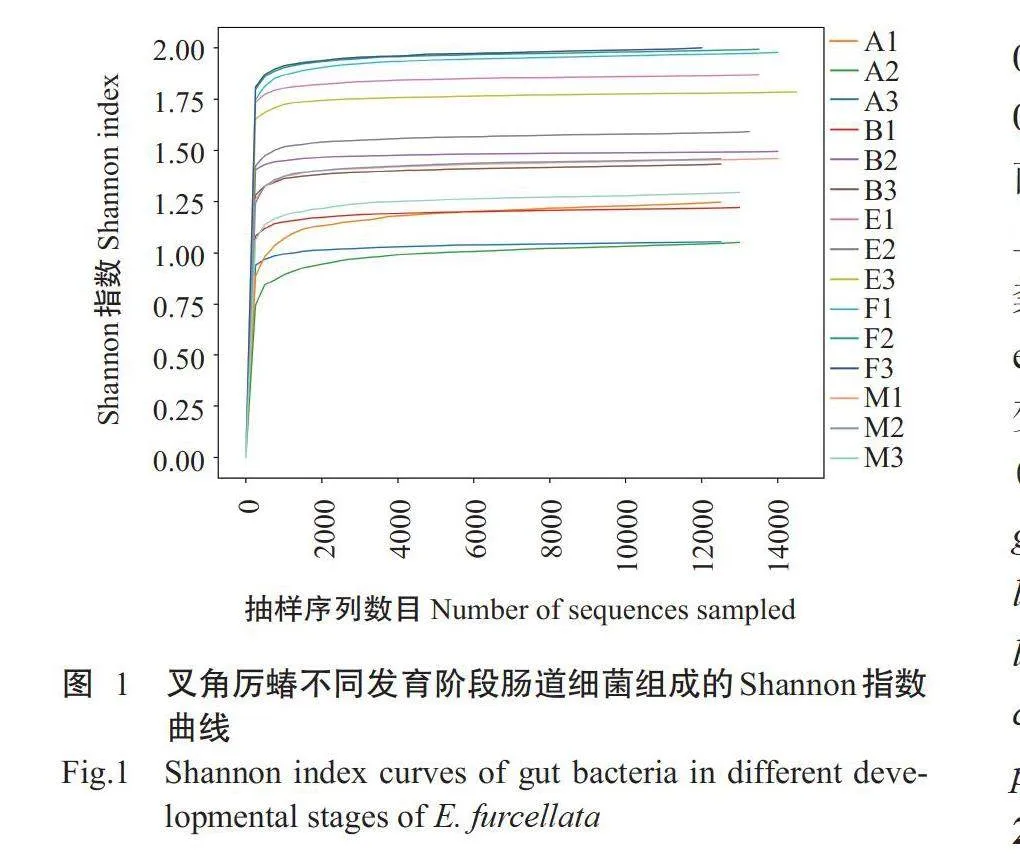
基于PacBio 测序平台,采用SMRT测序技术分 析叉角厉蝽1龄、2龄、5龄若虫和7日龄雌、雄成虫 肠道细菌16S rRNA序列全长,结果从15个样品中 共获得203678条Raw CCS,平均每样品13579条 CCS; 经质量过滤、嵌合体去除,得到202401条 Effective CCS,平均长度为1469.2 bp(表1)。基于 Effective CCS进行聚类分析,15个样品共得到222个 OTUs, 其中共有OTUs为5个,说明各样品细菌群 落组成存在差异。Shannon指数曲线显示,随着测 序数量的增加,曲线趋于平缓(图1),说明本研究测序数据量充足。此外,所有样品的覆盖度指数均在 0.9970以上,表明具备足够的测序深度和可靠的数 据质量。
2.2 叉角厉蝽肠道主要细菌群落组成
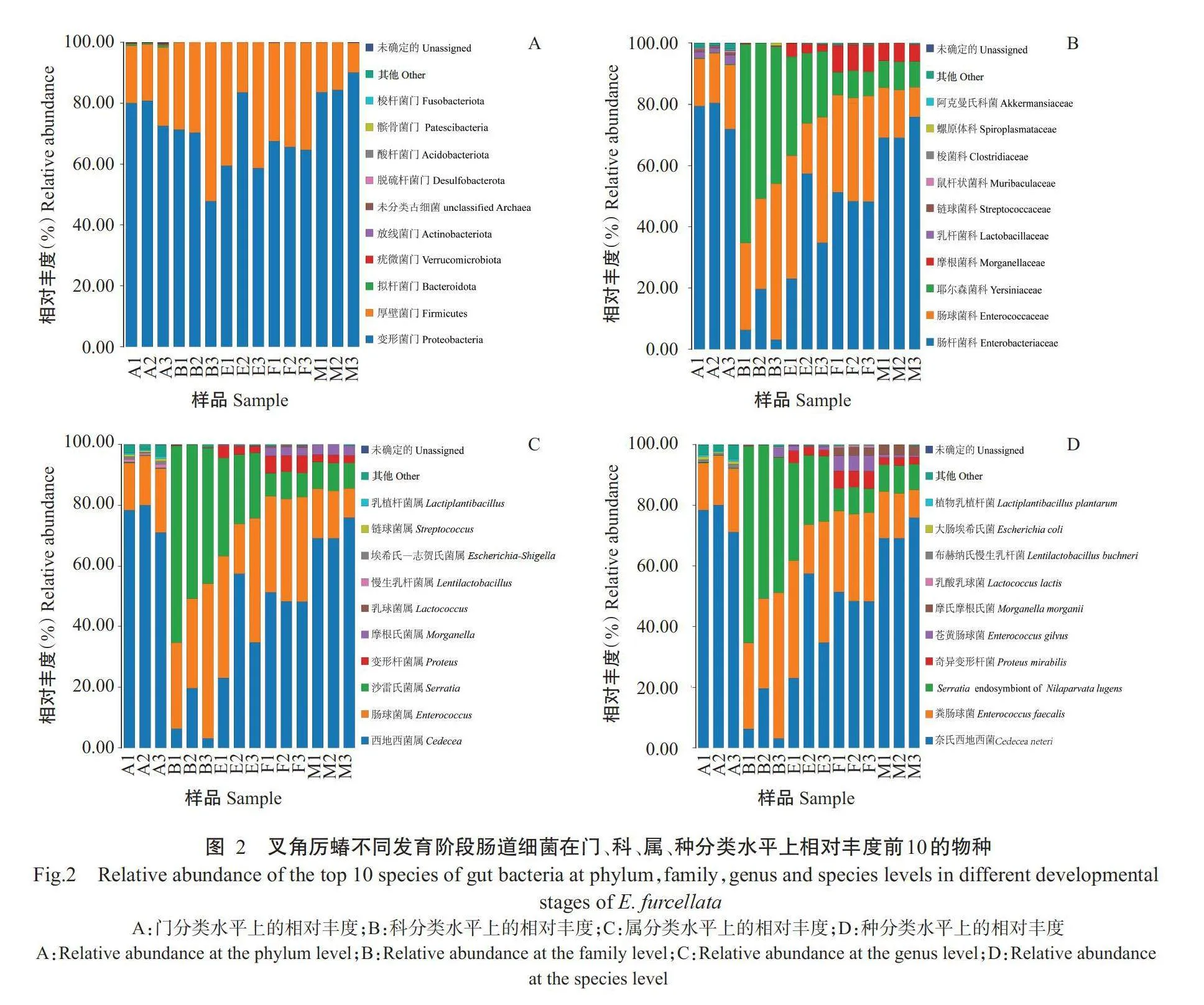
对特征序列进行分类学注释,共得到19门32纲 62目103科154属188种细菌。在门分类水平上,主 要菌群有变形菌门(72.22%)、厚壁菌门(27.52%)、拟杆菌门(Bacteroidetes,0.13%)、疣微菌门(Verruco- microbiota,0.04%) 和放线菌门(Actinobacteriota, 0.02%);在纲分类水平上,主要有γ-变形菌纲(Gam- maproteobacteria,72.21%)、芽孢杆菌纲(Bacilli, 27.41%)、拟杆菌纲(Bacteroidia,0.13%)、梭菌纲(Clostridia,0.11%)、疣微菌纲(Verrucomicrobiae, 0.04%)、阿尔法变形菌纲(Alphaproteobacteria,0.02%) 和放线杆菌纲(Actinobacteria,0.02%)等;在目分类 水平上,主要有肠杆菌目(Enterobacterales,72.11%)、乳杆菌目(Lactobacillales,27.32%)、拟杆菌目(Bacte- roidales,0.11%)、伯克氏菌目(Burkholderiales,0.06%)、梭菌目(Clostridiales,0.05%)、虫原体目(Entomo- plasmatales,0.05%)、假单胞菌目(Pseudomonadales, 0.04%)和疣微菌目(Verrucomicrobiales,0.04%)等; 在科分类水平上,主要有肠杆菌科(49.39%)、肠球菌 科(Enterococcaceae,26.60%)、耶尔森菌科(Yersi- niaceae,19.20%) 、摩根菌科(Morganellaceae,3.49%)、乳杆菌科(Lactobacillaceae,0.40%)、链球菌科(Strep- tococcaceae,0.31%)、鼠杆状菌科(Muribaculaceae, 0.06%)、螺原体科(Spiroplasmataceae,0.05%)、梭菌 科(Clostridiaceae,0.05%)和阿克曼氏菌科(Akker- mansiaceae,0.03%) 等;在属分类水平上,主要有西地 西菌属(Cedecea,49.24%) 、肠球菌属(26.60%)、沙雷氏菌属(19.20%)、变形杆菌属(Proteus,2.24%)、摩根氏菌属(Morganella,1.24%)、乳球菌属(Lacto-coccus,0.19%)、慢生乳杆菌属(Lentilactobacillus, 0.17%)、埃希氏一志贺氏菌属(Escherichia-Shigella, 0.15%)、链球菌属(Streptococcus,0.12%)和乳植杆菌属(Lactiplantibacillus,0.10%)等;在种分类水平上,主要有奈氏西地西菌(Cedecea neteri,49.24%)、粪肠球菌(Enterococcus faecalis,25.03%) 、Serratia endosymbiont of Nilaparvata lugens(19.20%) 、奇 异 变形杆菌(Proteus mirabilis,2.24%)、苍黄肠球菌(Enterococcus gilvus,1.56%)、摩氏摩根氏菌(Mor-ganella morganii,1.24%)、乳酸乳球菌(Lactococcus lactis,0. 18%)、布赫纳氏慢生乳杆菌(Lentilactobacil- lus buchneri,0.17%)、大肠埃希氏菌(Escherichia coli,0.15%)和植物乳植杆菌(Lactiplantibacillus plantarum,0.10%)等(图2)。
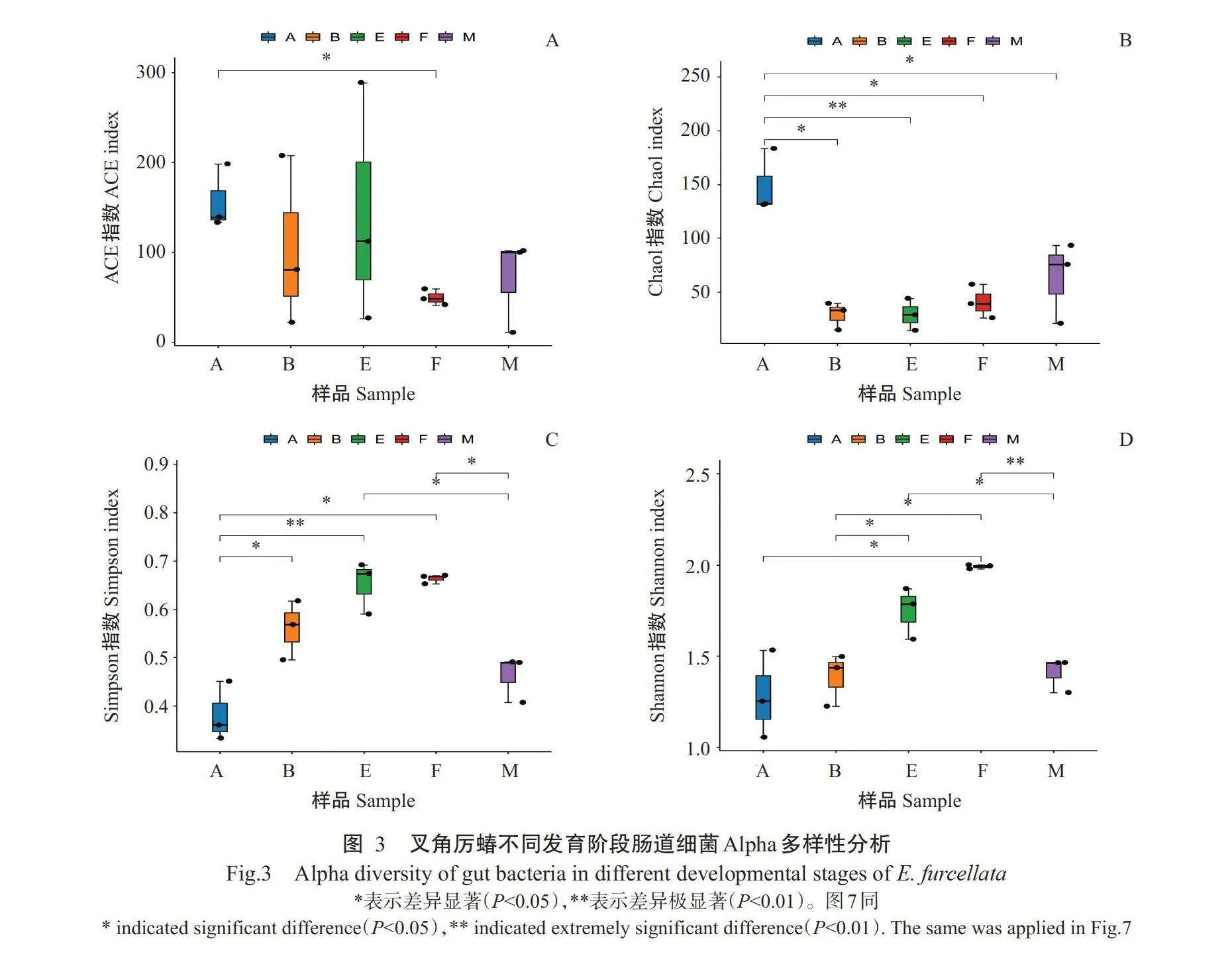
2.3 叉角厉蝽不同发育阶段肠道细菌多样性分析结果
2.3.1 肠道细菌Alpha 多样性分析 由图3可知,叉 角厉蝽从低龄若虫到高龄若虫及成虫的发育过程 中,其肠道细菌丰富度指数(ACE指数和Chaol指 数)减小,多样性指数(Simpson指数和 Shannon指 数)逐渐增大。ACE 指数在1龄若虫与雌成虫之间 存在显著差异(Plt;0.05, 下同)。Chaol 指数在1龄 若虫和其他发育阶段之间均存在显著差异,即1龄 若虫的Chaol 指数显著高于2龄和成虫,极显著高于5龄若虫(Plt;0.01, 下同)。1龄若虫的Simpson 指 数 显著低于2龄和雌成虫,极显著低于5龄若虫;5龄 若虫的Simpson指数显著高于雄成虫;雌、雄成虫间 Simpson 指数差异显著。雌成虫的Shannon 指数显著高于1龄和2龄若虫,极显著高于雄成虫;5龄若虫的 Shannon指数显著高于2龄若虫和雄成虫。
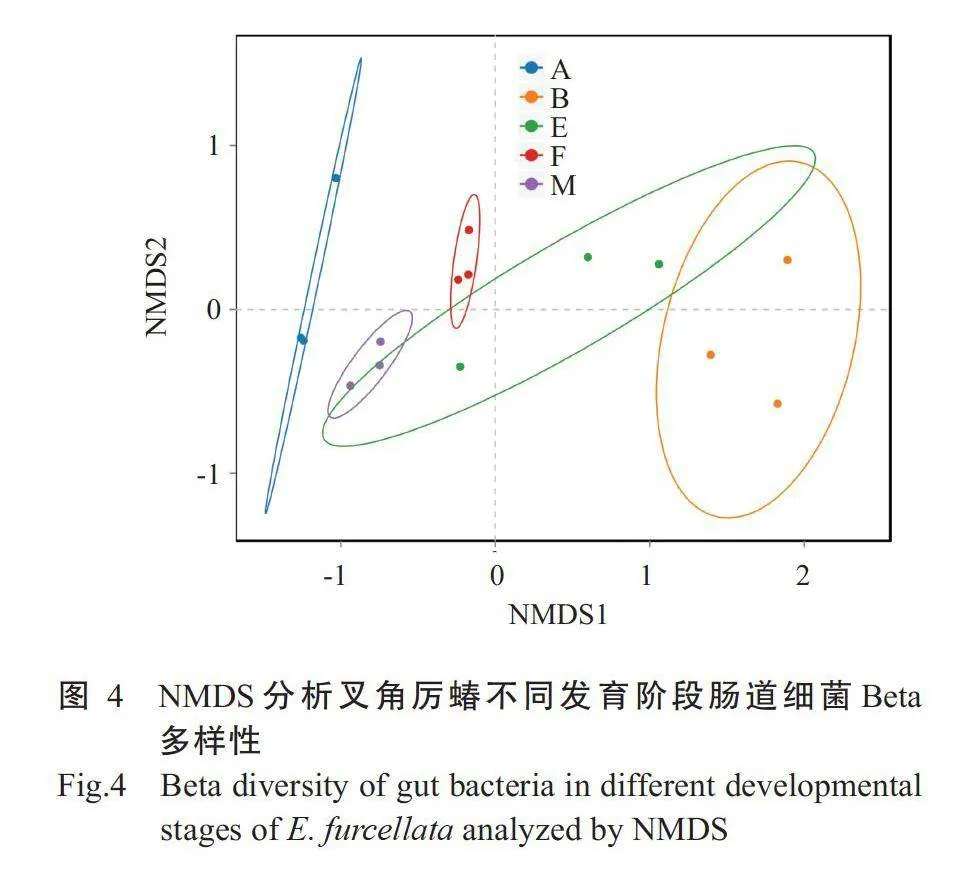
2.3.2 肠道细菌Beta多样性分析 NMDS分析结 果(图4)显示,不同样品按照不同发育阶段聚集,且 1龄若虫与2龄、5龄若虫及雌、雄成虫距离存在明显 分离,Stress=0.0448(lt;0.05),说明NMDS分析具有 很好的代表性。PERMANOVA分析结果(图5)显 示,叉角厉蝽不同发育阶段肠道细菌菌群结构差异 极 显 著(F=16.627,R²=0.869,P=0.001)。
2.4 叉角厉蝽不同发育阶段肠道显著差异菌群 分析结果
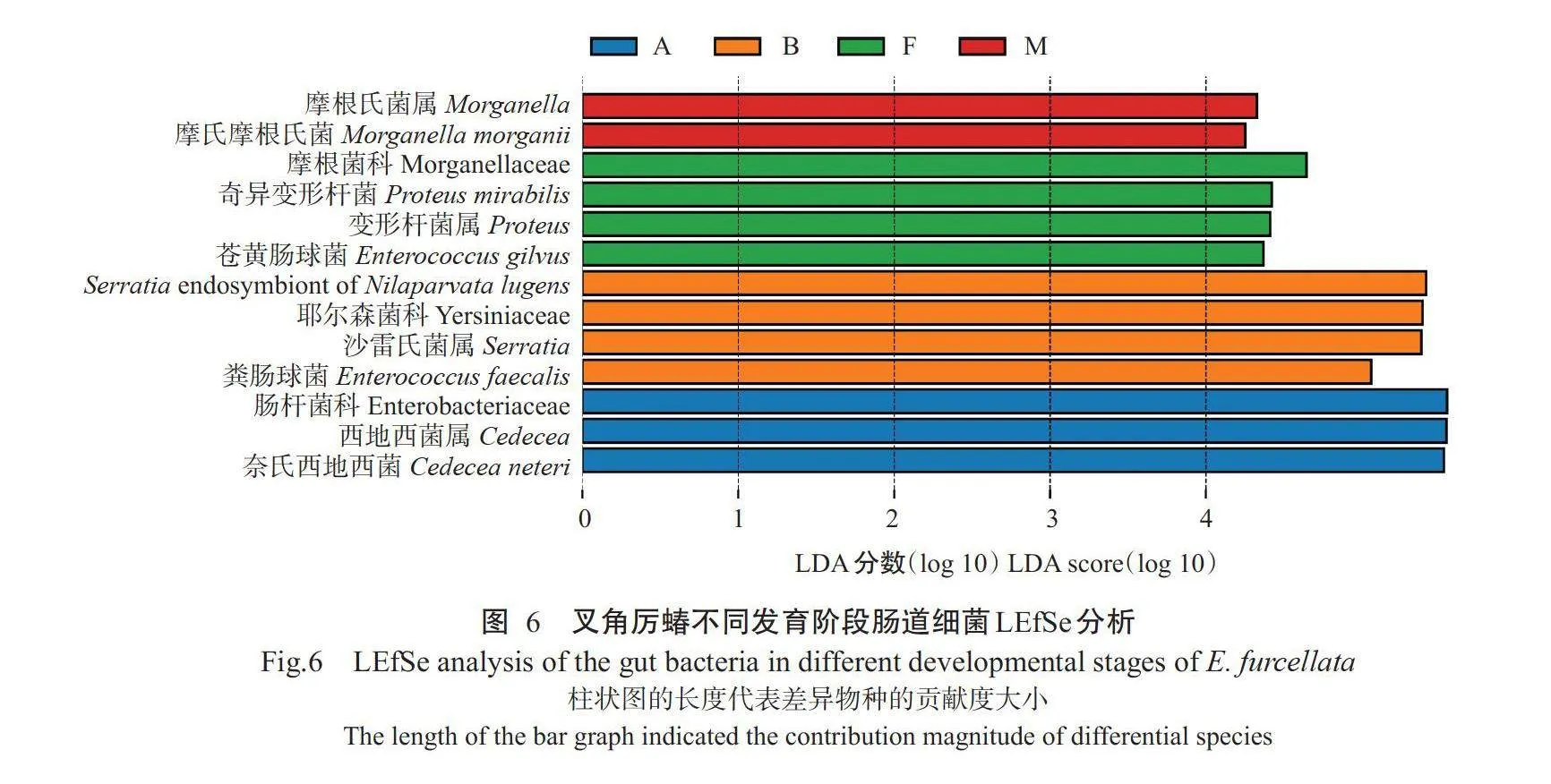
采 用LEFSe(Linear discriminant analysis effect size)分析叉角厉蝽不同发育阶段肠道菌群差异(LDAgt;4.0),结果(图6)显示,1龄、2龄若虫和雌、雄 成虫肠道存在显著优势的菌群,而5龄若虫肠道不 存在显著优势的菌群(Pgt;0.05,下同),且不同发育 阶段肠道的优势菌群在科、属、种3级分类水平上亦 不 同 。在 科 分 类 水 平 , 肠杆 菌 科 显 著 存 在 于 1 龄若虫阶段,耶尔森菌科显著存在于2龄若虫阶段,摩 根菌科显著存在于雌成虫阶段。在属分类水平,西 地西菌属显著存在于1龄若虫阶段,沙雷氏菌属显 著存在于2龄若虫阶段,摩根菌属显著存在于雄成 虫阶段,变形杆菌属显著存在于雌成虫阶段。在种 分类水平,粪肠球菌、奈氏西地西菌、奇异变形杆 菌 、苍黄肠球菌、Serratia endosymbiont of Nilaparvata lugens 5个菌为所有发育阶段肠道共有菌;奈氏西地 西菌显著存在于1龄若虫阶段,粪肠球菌和Serratia endosymbiont of Nilaparvatalugens显著存在2龄若虫阶段,苍黄肠球菌和奇异变形杆菌显著存在于雌 成虫阶段,摩氏摩根氏菌显著存在于雄成虫阶段。
2.5 叉角厉蝽不同发育阶段肠道菌群功能基因 预测结果
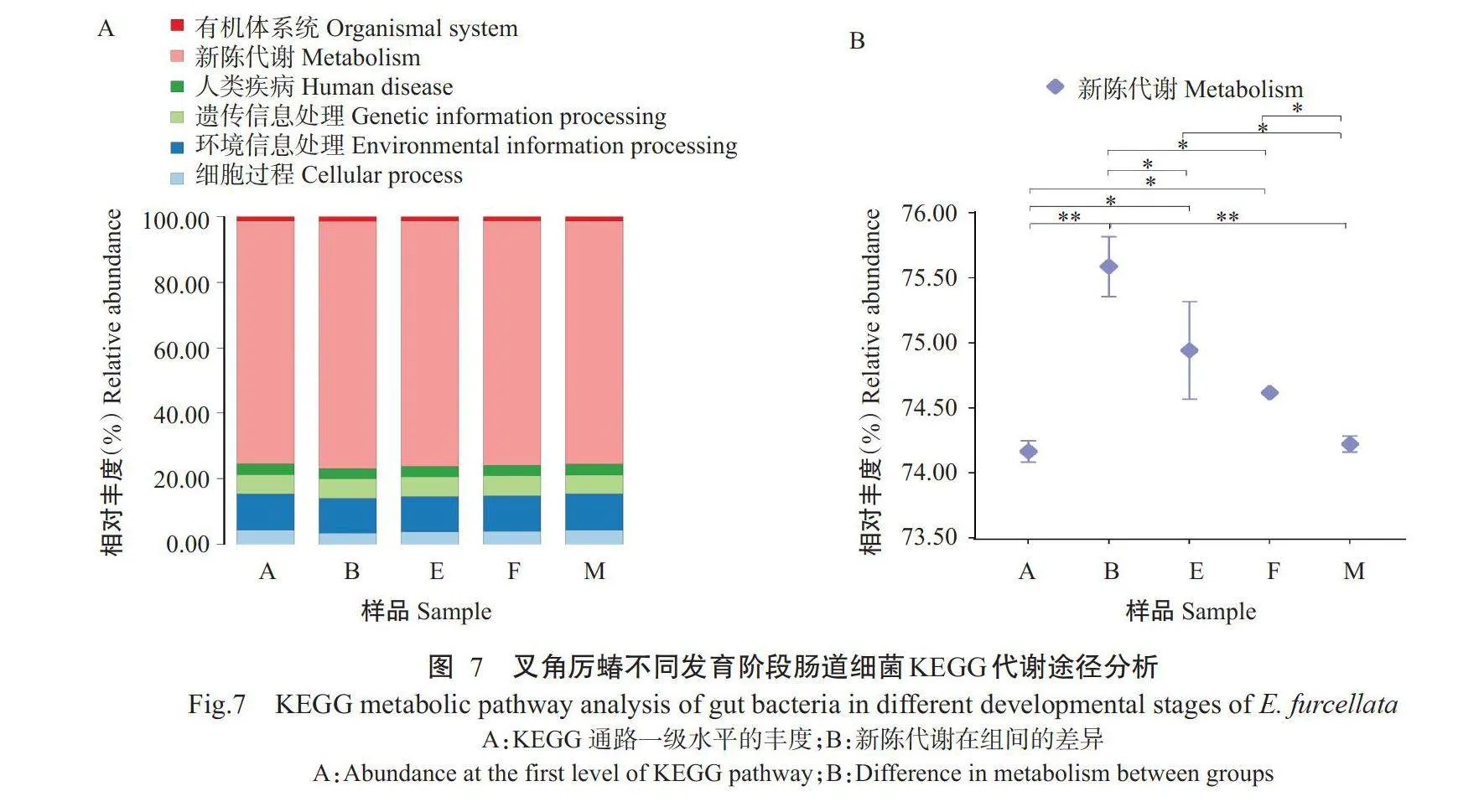
KEGG代谢途径分析结果显示,叉角厉蝽不同 发育阶段肠道菌群的功能相似,主要涉及新陈代谢(74.17%~75.59%)、环境信息处理(10.53%~11.03%)、遗传信息处理(5.71%~6.11%)、细胞过程(3.78%~4. 3 2 % ) 、人 类 疾 病(3 . 0 7 % ~ 3 . 3 5 % ) 和 有 机 体 系 统(1.32%~1.39%)(图7-A) 。进 一 步利用单因素方差 分析发现,不同发育阶段肠道新陈代谢通路在功能 丰度上存在显著差异,即2龄若虫的代谢功能显著 高于5龄若虫和雌成虫,极显著高于雄成虫和1龄若 虫(图7-B)。
二级水平上功能通路预测结果有43种,其中二""""" 级代谢功能通路12种,依次为全局和概述图谱(38.87%~39.29%)、糖类代谢(9.82%~10.86%)、氨基 酸代谢(6.29%~6.76%)、能量代谢(3.57%~3.86%)、辅助因子和维生素代谢(3.69%~3.81%)、核苷酸代 谢(3.13%~3.57%)、脂质代谢(1.85%~2.37%)、其他氨基酸代谢(1.71%~1.88%)、外源化学物质生物 降解与代谢(1.50%~1.63%)、聚糖生物合成与代谢(1.26%~1.34%)、萜类和聚酮类化合物代谢(0.87%~ 1 . 0 2 % ) 及 其 他 次 生 代 谢 产 物 生 物 合 成(0.70%~ 0.74%)。
3 讨论
叉角厉蝽具有繁殖力强、捕食范围广和捕食能 力强等优势,已成为生物防治领域应用前景广阔的 一种天敌昆虫。本研究基于PacBio测序平台,利用 SMRT 测序技术分析了叉角厉蝽不同发育阶段的肠 道细菌多样性及其组成,并探索了该虫与其肠道细 菌的协同进化关系,结果共获得222个用于物种分 类的OTUs,涵盖了19门32纲62目103科154属188种,其中优势菌门为变形菌门和厚壁菌门,优势菌属 为西地西菌属、肠球菌属和沙雷氏菌属。本研究结 果与Kuang等(2022)对叉角厉蝽雌成虫中肠细菌组 成的研究结论相似,但优势菌群的相对丰度和优势 种有一定差异,可能与饲养代数、雌成虫日龄、取样 部位以及取样方式等有关。Xue 等(2023)报道绿盲 蝽6和9日龄雌成虫的优势属为乳球菌属,而雌成虫 的变形菌门相对丰度从1日龄开始显著下降且9日 龄最低。本研究中叉角厉蝽雌成虫肠道细菌的样本 取自7日龄已交配且饥饿处理24 h的整个肠道,而 交配及饥饿处理对其肠道细菌组成及丰富度的影响 机制有待进一步研究。
Xue等(2021)报道中黑盲蝽1龄和2龄若虫肠 道细菌群落多样性指数最高,而从3龄若虫开始下降。绿盲蝽1龄和2龄若虫体内细菌群落多样性和 丰富度亦最高,且显著高于其他发育阶段(Xue et al.,2023); 但安哲等(2022)发现绿盲蝽若虫期体内 微生物的物种丰富度和群落多样性小于成虫期。本 研究发现叉角厉蝽从1龄若虫到成虫性成熟的生长 发育过程中,其肠道细菌丰富度指数逐渐降低,而其 多样性指数逐渐升高,与前人研究结果(Luo et al., 2021;Li et al.,2022)存在一定差异,可能与天敌昆虫 体内微生物群落受其取食习性和食物类型的影响有 关。中黑盲蝽和绿盲蝽具有相近的习性和生态功 能,不仅具有植食性,还兼具肉食性(Liet al.,2020), 但相比于捕食猎物,它们更偏爱取食植物(李文静等,2015),而叉角厉蝽除1龄若虫仅刺吸植物汁液, 2龄若虫处于植食和捕食的过渡期,其他龄期的若虫 和成虫均为捕食性。据报道,肠道微生物菌群对食 物变化引起的肠道环境变化需要代谢适应过程(Tilocca et al.,2017)。因此,本研究中叉角厉蝽肠 道菌群的变化亦可能是为了逐步适应新的肠道 环境。
本研究发现叉角厉蝽不同发育阶段肠道优势菌 群不同,而某些菌仅存在于特定的发育时期,如奈氏 西地西菌主要存在于1龄若虫阶段、摩氏摩根氏菌 存在于5龄若虫和雌、雄成虫中。这些细菌的存在 和显著变化可能与叉角厉蝽的生理代谢有关,从而 帮助不同发育阶段的叉角厉蝽适应不同的食物源和 生态环境(Engel and Moran,2013)。已有研究表明, 变形菌门细菌与宿主的捕食、生长发育和适合度等 有关(Nishiwaki et al.,2007;Kuang et al.,2022)。沙 雷氏菌属能为宿主提供维生素和氨基酸,帮助其降 解纤维素、单萜或双萜等物质(Boone et al.,2013;胡霞等,2018),摩氏摩根氏菌在一定程度上能促进猎 物死亡(Nishiwaki et al.,2007),变形杆菌属有助于 吸引雌成虫产卵(Chaudhury et al.,2010),而西地西 菌属可分泌有机酸、降低环境pH 。在其他昆虫的研 究中也有类似发现,如杂食或肉食中黑盲蝽的肠道 菌群中沙雷氏菌 属、西地西菌属和泛菌属的丰度 较高,而植食中黑盲蝽中其他属的丰度则较高(成 艳霞,2022)。与 植食性蝽相比,猎蝽科有一个特 有的肠道微生物区系,主要由肠球菌属和不同种 类的变形杆菌组成(Li et al.,2022)。中华通草蛉(Chrysoperla sinica)卵、初孵幼虫和成虫都有相似 的微生物,其中假单胞菌属在1龄幼虫(初孵和1日 龄)、2龄幼虫、3龄幼虫和蛹期出现,在成虫期未出 现;柠檬酸杆菌属(Citrobacter) 、醋酸杆菌属(Aceto-bacter)、朝井杆菌(Asaia sp.)和Rosenbergiella sp.仅见于雄虫,而Cosenzaea myxofaciens仅见于雌虫(赵 辉,2018;Zhao et al.,2019)。
肠道细菌对宿主代谢和健康具有重要的调节作 用(李青晏等,2020)。本研究通过对叉角厉蝽不同 发育阶段肠道菌群功能注释,发现新陈代谢为主要 功能且在不同发育阶段存在显著差异,其中2龄 若虫的代谢功能丰度最高,5龄若虫次之,可能归因 于叉角厉蝽2龄若虫处于食性转换期且2龄和5龄 若虫均处于不断进食的生长期,新陈代谢功能发挥 主要作用,则有助于该虫利用食物营养并促进其生 长发育。然而,基因功能预测并不能完全反映叉角 厉蝽肠道菌群的实际功能,预测到的这些功能有待 进一步解析和验证。
本研究虽然明确了叉角厉蝽不同发育阶段肠道 细菌组成和多样性,但不同细菌谱系在宿主间的传 播方式和对宿主食物差异的响应机制及其对宿主适 合度的影响等方面均有待深入研究。
4 结论
叉角厉蝽肠道菌群组成和多样性在其不同发育 阶段均存在显著差异,优势菌分布呈动态变化。肠 道菌群中新陈代谢功能的丰度最高,二级代谢功能 通路主要为全局和概述图谱、糖类代谢和氨基酸代 谢等。
参考文献:
安哲,薛汇,高雪珂,朱香镇,雒 瑜,崔金杰,马德英.2022. 棉田绿盲蝽微生物多样性研究[J]. 环境昆虫学报,44(5):1063-1070.[AnZ,Xue H,Gao XK,Zhu XZ,Luo J Y,Cui JJ,Ma DY.2022.Microbial diversity of Apolygus lucorumin cotton field[J].Journal of Environmental Ento- mology,44(5):1063-1070.]doi:10.3969/j.issn.1674-0858 2022.05.2.
成艳霞.2022.食物差异导致中黑盲蝽肠道菌群紊乱并致死 宿主昆虫的机制研究[D]. 武汉:湖北大学.[Chen YX 2022.Variation of gut microbiota caused by an imbalance diet is detrimental to bugs survival[D].Wuhan:Hubei University.]
范悦莉,谷星慧,洗继东,陈雪梅,陆永跃,张立猛,周文兵. 2019.叉角厉蝽对草地贪夜蛾的捕食功能反应[J].环境 昆虫学报,41(6):1175-1180.[Fan Y L,Gu XH,Xian J"D,ChenXM,Lu YY,Zhang LM,Zhou WB.2019.Func-tional response of Eocanthecona furcellata(Hemiptera: Pentatomidae)to Spodoptera frugiperda(Lepidoptera:"Noctuidae)[J].Journal of Environmental Entomology,41(6):1175-1180.]doi:10.3969/j.issn.1674-0858.2019.06.06.
高平,廖贤斌,李丽芳,兰明先,赵航,陈斌,吴国星,高熹. 2021.叉角厉蝽唾液腺转录组及差异分析[J]. 云南农业大学学报(自然科学),36(1):29-38.[GaoP,Liao XB, LiLF,Lan MX,Zhao H,Chen B,Wu GX,Gao X.2021. Transcriptome and difference analysis of Eocanthecona"furcellata(Wolff)[J].Journal of Yunnan Agricultural Uni- versity(Natural Science),36(1):29-38.]doi:10.12101/j.issn.1004-390X(n).201911011.
宫靖垚,陈科伟,温健,刘杰,朱永基.2019.人工饲料饲养的 叉角厉蝽对昆虫的捕食能力评价[J]. 环境昆虫学报,41(3):47 1-478.[Gong JY,Chen KW,Wen J,Liu J,Zhu Y"J.2019.Predatory capacity of Eocanthecona fucellate"(Wolff)reared with artificial diets[J].Journal of Environ mental Entomology,41(3):471-478.]doi:10.3969/j.issn. 1674-0858.2019.03.6.
韩顺财,蒋敬涛,程林,刘家生,李彤,彭凌飞.2022.中国六省 区荔枝蝽体内细菌组成及多样性分析[J]. 植物保护学 报,49(3):749-757.[Han SC,Jiang JT,Cheng L,Liu J S,Li T,Peng LF.2022.Bacterial composition and diver-sity in the litchi stink bug,Tessaratoma papillosa(Hemip-tera:Tessaratomidae)from six provincesof China[J].Jour- nal of Plant Protection,49(3):749-757.]doi:10.13802j. cnki.zwbhxb.2022.2020233.
胡霞,傅慧静,李俊楠,林中平,张飞萍.2018.松墨天牛幼虫 肠道纤维素降解细菌的分离与鉴定[J]. 福建农林大学学 报(自然科学版),47(3):322-328.[Hu X,FuHJ,LiJN, Lin Z P,Zhang F P.2018.lsolation and identification of cellulolytic bacteria associated with the gut of Monocha- mus alternatus larvae[J].Journal of Fujian Agriculture and Forestry University(Natural Science Edition),47(3):322- 328.]doi:10.13323/ j.cnki.j.fafu(nat.sci.).2018.03.009.
李青晏,唐运林,蒋睿轩,张永红,朱峰,白兴荣,顾偌钺,吴燕 燕,吴玉娇,陈洁,李田,李春峰,韦俊宏,潘国庆,周泽 扬.2020.云南地区草地贪夜蛾肠道细菌的分离及鉴定 [J].西南大学学报(自然科学版),42(1):1-8.[LiQY,
Tan YL,Jiang RX,Zhang YH,Zhu F,BaiXR,Gu RC WuYY,Wu YJ,Chen J,LiT,LiCF,Wei JH,Pan GQ, Zhou ZY.2020.Isolation and identification of gut bacteria"of Spodoptera frugiperda feeding on maize in Yunnan"China[J].Journal of Southwest University(Natural Scien- ce),42(1 ): 1-8.]doi:10.13718/j.cnki.xdzk.2020.01.00 1.
李文静,苑鹤,陆宴辉,李强,吴孔明.2015.中黑盲蝽对四季 豆豆荚和棉铃虫卵的取食选择性[J]. 植物保护,41(4):29-34.[LiWJ,Yuan H,Lu Y H,LiQ,Wu K M.2015.
Diet selection of Adelphocoris suturalis on Phaseolus vul- garis pods and Helicoverpa armigera eggs[J].Plant Pro-tection,41(4):29-34.]doi:10.3969/j.issn.0529-1542.2015. 04.005.
王四宝,曲爽.2017.昆虫共生 菌及其在病虫害防控中的应用 前 景[J]. 中 国科学 院院刊,32(8):863-872.[Wang SB, Qu S.2017.Insect symbionts and their potential applica- tion in pest and vector-borne disease control[J].Bulletin ofChinese Academy of Sciences,32(8):863-872.]doi: 10.16418/j.issn.1000-3045.2017.08.008.
姚明 勇.2019.叉角厉蝽生物学及捕食作用研究[D]. 贵阳: 贵州大学.[Yao MY.2019.Studies on biology and preda cious function of Eocanthecona fiurcellata(Wolff)[D]. Guiyang:Guizhou University.]doi:10.27047/d.cnki.ggu- du.2019.000066.
张曼,高平,赵航,周辰彦,梁晨,汤永玉,邢孔政,吴国星,高 熹.2022.捕食性天敌叉角厉蝽生长发育、繁殖及各虫态 形态特征观察[J]. 南方农业学报,53(4):1078-1087. [Zhang M,Gao P,Zhao H,Zhou CY,Liang C,TangYY, Xing K Z,Wu G X,Gao X.2022.Development,fecundity and morphological characteristics of the predatory Eocan-thecona fiucellata(Wolff)[J].Journal of Southern Agri-culture,53(4):1078-1087.]doi:10.3969 .issn.2095-1191.2022.04.021.
张振宇,圣平,黄胜威,赵永顺,张宏宇.2017.昆虫肠道微生 物的多样性、功能及应用[J]. 生物资源,39(4):231-239. [Zhang ZY,Sheng P,HuangS W,Zhao YS,Zhang HY. 2017.Diversity,function and application of insect gut microbiota[J].Biotic Resources,39(4):231-239.]doi:10. 14188/j.ajsh.2017.04.001.
赵辉.2018.中华通草蛉内生菌多样性研究[D]. 石河子:石 河子大学.[Zhao H.2018.The studyon endophytic bacte-ria diversity of the Chrysoperla sinica(Tjeder)[D].Shi-hezi:Shihezi University.]
赵航,吴国星,汤永玉,张曼,梁晨,邢孔政,兰明先,高熹. 2022. 叉角厉蝽触角转录组及嗅觉相关基因分析[J]. 环 境昆虫学报,44(5):1205-1217.[Zhao H,Wu GX,Tang Y Y,Zhang M,Liang C,Xing K Z,Lan M X,Gao X. 2022.Analysis of the antennal transcriptome and olfaction-related genes of Eocanthecona fucellata[J].Journal of"Environmental Entomology,44(5):1205-1217.]doi:10. 3969/j.issn.1674-0858.2021.05.15.
郑林宇,伦才智,柳丽君,李志红.2022.昆虫共生菌调控宿主 生长发育和生殖的研究进展[J]. 植物保护学报,49(1): 207-219.[Zheng L Y,Lun C Z,Liu L J,Li Z H.2022. Influencesof insect symbionts on host growth,develop- ment andreproduction:A review[J].Journal of Plant Pro- tection,49(1):207-219.]doi:10.13802/j.cnki.zwbhxb.2022."2022824.
Ahsaei S M,Hosseininaveh V,Talaei-Hassanloui R,Zamani M.2020.Contribution of bacterial gut symbionts to diges- tion and development in Podisus maculivenris(Hemip- tera:Pentatomidae)[J].The Proceedings of the National Academy of Sciences,India Section B:Biological Scien- ces,90:959-967.doi:10.1007/s400 11-020-01165-3.
Bolyen E,Rideout JR,Dillon MR,Bokulich NA,Abnet CC, Al-Ghalith G A,Alexander H,Alm E J,Arumugam M, Asnicar F,Bai Y,Bisanz JE,Bittinger K,Brejnrod A,Bri- slawn CJ,BrownCT,Callahan B J,Caraballo-Rodriguez AM,Chase J,Cope EK,Silva R D,Diener C,Dorrestein PC,Douglas G M,Caporaso J G.2019.Reproducible, interactive,scalableand extensible microbiome data science using QIIME 2[J].Nature Bioechnology,37:852-857. doi:10.1038/s41587-019-0209-9.
Boone CK,Keefover-Ring K,Mapes A C,Adams A S,Bohl- mann J,Raffa K F.2013.Bacteria associated with a tree- killing insect reduce concentrations of plant defense com- pounds[J].Journal of Chemical Ecology,39:1003-1006.doi: 10.1007/s10886-013-0313-0.
Chaudhury M F,Skoda S R,Sagel A,Welch J B.2010.Vola- tiles emitted from eight wound-isolated bacteria differen- tially attract gravid screwworms(Diptera:Calliphoridae) to oviposit[J].Journal of Medical Entomology,47(3):349- 354.doi:10.1603/me09235.
Colman DR,Toolson EC,Takacs-Vesbach C D.2012.Do diet and taxonomy influence insect gut bacterial communities? [J].Molecular Ecology,21(20):5124-5137.doi:10.1111/ j.1365-294X.2012.05752.x.
Edgar R C.2013.UPARSE:Highly accurate OTU sequences from microbial amplicon reads[J].Nature Methods,10:996- 998.doi:10.1038/nmeth.2604.
Engel P,Moran N A.2013.The gut microbiota of insects- diversity in structure and function[J].FEMS Microbio- logy Reviews,37(5):699-735.doi:10.1111/1574-6976.12 025.
Fernandes A D,Reid JN,Macklaim JM,McMurrough T A, Edgell D R,Gloor G B.2014.Unifying the analysis of high-throughput sequencing datasets:Characterizing RNA- seq,16S rRNA gene sequencing and selective growth ex- periments by compositional data analysis[J].Microbiome, 2(1):15.doi:10.1186/2049-2618-2-15.
Hu Y,Xie H G,Gao MZ,Huang P,Zhou H L,Ma Y B,Zhou MY,LiangJY,Yang J,Lü ZY.2020.Dynamic of compo- sition and diversity of gut microbiotain Triatoma rubrofas- ciata in different developmental stages and environmenta conditions[J].Frontiers inCellular and Infection Microbio- logy,10:587708.doi:10.3389/fcimb.2020.587708.
Keerthi MC,Sravika A,Mahesha H S,Gupta A,Bhargavi HA, Ahmed S.2020.Performance of the native predatory bug"Eocanthecona furcellata(Wolff)(Hemiptera:Pentatomi-dae ),on the fall armyworm,Spodoptera frugiperda(J.E. Smith)(Lepidoptera:Noctuidae),and its limitation under field condition[J].Egyptian Journal of Biological Pest Con- trol,30:69.doi:10.1 186/s41938-020-00272-7.
Kuang ZL,Wen J,Zhu YJ,He XF,Chen KW.2022.Dietary association with midgut microbiota components of Eocan-thecona furcellata(Wolff)[J].Diversity,14(12):1130.doi"10.3390/d14121130.
Langille M G I, Zaneveld J,Caporaso J G,MeDonald D, Knights D,Reyes J A,Clemente J C,Burkepile D E, Thurber R LV,Knight R,Beiko R G,Huttenhower C. 2013.Predictive functional profiling of microbial commu nities using 16S rRNA marker gene sequences[J].Nature Biotechnology,31(9):814-82 1.doi:10.1038/nbt.2676.
LiGN,Sun JJ,Meng YJ,Yang CF,Chen Z,WuYF,Tian L, Song F,CaiWZ,Zhang X,Li H.2022.The impact of environmental habitats and diets on the gut microbiota diversity of true bugs(Hemiptera:Heteroptera)[J].Biology, 11(7):1039.doi:10.3390 /biology11071039
LiWJ,Wang L L,Jaworsk CC,Yang F,Liu B,Jiang YY,Lu YH,WuKM,Desneux N.2020.Theoutbreaksof nontar- get mirid bugs promote arthropod pest suppression in Bt cotton agroecosystems[J].Plant Biotechnology Journal,18(2):322-324.doi:10.1111/pbi.13233.
Liu ZH,YangZW,Zhang J,LuoJY,Men Y,Wang YH,Xie """"" Q.2022.Stage correlationof symbiotic bacterial commu- "" nity and function in the development of litchi bugs " (Hemiptera:Tessaratomidae )[J].Antonie van Leeuwen- """" hoek,115(1):125-139.doi: 10.1007/s10482-021-01685-6. Luo J,Chen Y X,Guo L B,Wang A,Lu M,XuL T.2021. """" Variation of gut microbiota caused by an imbalance diet is "" detrimentalto bugs'survival[J].Science of the Total Envi- """""" ronment,771:144880.doi:10.1016/j.scitotenv.2020.144880. Nishiwaki H,Ito K,Shimomura M,Nakashima K,Matsuda K.
2007.Insecticidal bacteria isolated from predatory larvae of the antlion species Myrmeleon bore(Neuroptera:Myr- meleontidae)[J].Journal of Invertebrate Pathology,96(1): 80-88.doi:10.1016/j.jip.2007.02.007.
Pan YN,Zhao R N,Fu D,Yu C,Pan C N,ZhouW,Chen WL. 2022.Assessment of suitable reference genes for qRT-PCR"normalization in Eocanthecona fiurcellata(Wolff)[J].In-"sects, 13(9):773.doi:10.3390/insects13090773.
Parks D H,Tyson G W,Hugenholtz P,Beiko R G.2014. STAMP:Statistical analysis of taxonomic and functional profiles [J].Bioinformatics,30(21):3123-3124.doi:10. 1093/bioinformatics/btu494.
Sarkar S,Babu A,Chakraborty K,Deka B,Roy S.2021.Eocan- theconafurcellata(Wolf)(Hemiptera:Pentatomidae),a"potential biocontrol agent of theblack inchworm,Hypasidra talaca Walker(Lepidoptera:Geometridae)infesting tea [J].Phytoparasitica,49(2):363-376.doi:10.1007/s12600-021-00888-x.
Shan HW,Wu W,Sun ZT,Chen J P,LiHJ.2021.The gut microbiota of the insect infraorder Pentatomomorpha(Hemiptera:Heteroptera)for the light of ecology and evo lution[J].Microorganisms,9(2):464.doi: 10.3390/mic- roorganisms9020464.
Song XM,Zhong ZW,Gao L,Weiss B L,Wang JW.2022. Metabolic interactions between disease-transmitting vec- tors and theirmicrobiota[J].Trends in Parasitology,38(8): 697-708.doi:10.1016/ j.pt.2022.05.002
Tilocca B,Burbach K,HeyerC M E,Hoelzle L E,Mosenthin R,Stefanski V,Camarinha-Silva A,Seifert J.2017.
Dietary changes in nutritional studies shape the structural and functional composition of the pigs'fecal microbiome— From days to weeks[J].Microbiome,5:144.doi:10.1186/ s40168-017-0362-7.
Wang Q,Garrity G M,Tiedje J M,Cole J R.2007.Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Applied and Environ- mental Microbiology,73(16):5264-5267.doi:10.1128/ AEM.00062-07.
White J R,Nagarajan N,Pop M.2009.Statistical methods for detecting differentially abundant features in clinical meta- genomic samples[J].PLoS Computational Biology,5(4): e1000352.doi: 10.1371/journal.pcbi.1000352.
Xue H,Zhu XZ,Wang L,Zhang K X,LiDY,Ji JC,NiuL, Gao XK,Luo JY,Cui J J.2023.Dynamics and diversity of symbiotic bacteria in Apolygus lucorum at different developmental stages[J].Journal of Cotton Research,6:5. doi:10.1186/s42397-023-00142-1.
Xue H,Zhu XZ,Wang L,Zhang KX,Li D Y,JiJC,Niu L, Wu CC,Gao XK,Luo JY,Cui JJ.2021.Gut bacterial diversity in different life cycle stages of Adelphocoris suturalis(Hemiptera:Miridae)[J].Frontiers in Microbio- logy,12:670383.doi:10.3389/fmicb.202 1.670383.
Yun JH,Roh SW,Whon TW,Jung M J,Kim M S,Park D S, Yoon C,Nam YD,KimYJ,ChoiJH,KimJY,Shin NR, Kim S H,Lee W Bae JW.2014.Insects gut bacterial diversity deermined by host environmental habitat,diet, developmental stage and phylogeny of host [J].Applied and Environmental Microbiology,80(17):5254-5264.doi:"10.1128/AEM.01226-14.
Zhao CC,Zhao H,Zhang S,LuoJY,Zhu XZ,Wang L,Zhao P,Hua HX,CuiJJ.2019.The developmental stage sym- bionts of the pea aphid-feeding Chrysoperla sinica(Tjeder) [J].Frontiers in Microbiology,10:2454.doi:10.3389/ fmicb.2019.02454.
(责任编辑 麻小燕)

