光交联丝素蛋白生物3D打印墨水的研究进展







摘要: 丝素蛋白具有生物相容性高、生物降解性可控及力学性能可调等优异特性,是一种极具应用潜力的生物3D打印墨水材料。基于光交联反应的生物材料加工技术具有条件温和、高效可控等优点,是当前生物3D打印领域的热点方向。文章以墨水性能要求为主线,先从流变性能出发介绍了适合光交联丝素蛋白生物3D打印的打印方式,再从光交联反应性出发讨论了丝素蛋白的光敏改性方法及光诱导交联机制,然后从生物相容性出发介绍了辐照光源与光引发剂的发展,总结了丝素蛋白及其与合成、天然高分子材料复配墨水在光交联生物3D打印领域的应用,并论述了光交联丝素蛋白生物墨水在制备、发展方向和应用过程中所面临的挑战。
关键词: 生物3D打印;丝素蛋白;光交联;生物墨水;流变性能
中图分类号: TS141.8; TQ340.643
文献标志码: A
文章编号: 10017003(2024)08期数0050起始页码10篇页数
DOI: 10.3969/j.issn.1001-7003.2024.08期数.006(篇序)
收稿日期: 20231110;
修回日期: 20240618
基金项目: 国家自然科学基金项目(52103068);浙江省自然科学基金项目(LY21E030019);苏州大学纺织行业丝绸功能材料与技术重点实验室开放基金项目(SDHY2234)
作者简介: 潘小鹏(1999),男,硕士研究生,研究方向为丝蛋白生物材料。通信作者:黄益,副教授,yihuang@zstu.edu.cn。
生物3D打印基于增材制造原理,通过定位装配含生物材料和细胞单元的生物墨水,以实现仿生功能组织或人工器官的快速成型,在生物医学和组织工程等领域极具应用前景。其中,生物墨水材料的选择是满足生物3D打印仿生结构对生物安全性、精细度及稳定性等要求的关键。理想的生物墨水不仅需要适宜的流变性以保证打印流畅性和结构精细度[1-2],同时需具备快速且充分的交联反应以保证打印结构的稳定性和强度。此外,生物墨水材料良好的生物相容性和可调的生物降解性也是确保细胞增殖分化和组织再生的必要前提[3]。
丝素蛋白(Silk Fibroin,SF)是蚕丝经溶解、透析制得的一种天然蛋白材料,经物理或化学交联可获得不同形态的生物功能材料,具有优异的生物相容性、可调的机械性能等优点,在生物医用材料领域引起了广泛的关注。然而,常规的物理交联(加热、超声等)、化学交联(戊二醛、京尼平等)及生物酶催化交联(酪氨酸酶、过氧化氢酶、辣根过氧化物酶等[4-5])方式,均难以兼顾生物3D打印对SF生物墨水交联成型效率、结构稳定性及成型材料生物安全性等综合要求[6]。
1 光交联丝素蛋白生物墨水的性能要求
光交联SF的凝胶化作用可快速固定其打印结构,同时可避免因细胞沉积而导致的喷嘴堵塞和细胞分布不均等问题[7-9]。用于生物3D打印的光交联SF墨水需满足以下要求:1) 适宜的流变性能以保证细胞在SF墨水打印前、中、后的高存活率及打印流畅性与结构稳定性;2) 高效的光交联反应性以实现SF打印结构的快速成型,并赋予其在体外培养或体内植入的结构强度要求;3) 良好的生物相容性以使细胞在打印结构上实现附着、增殖、分化,同时植入后无先天性或适应性免疫反应。
1.1 挤出式生物3D打印
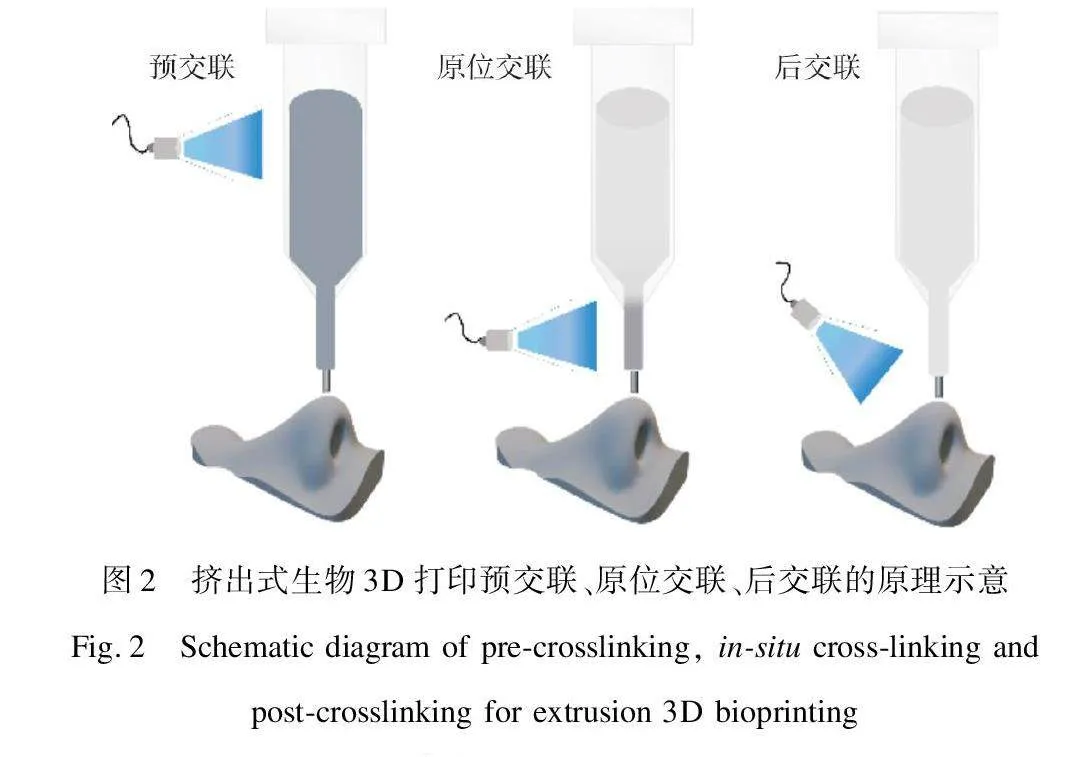
挤出式生物3D打印是利用气压或机械力作用将生物墨水从喷嘴挤出,并在移动过程中层层堆叠进而构建三维结构的一种打印方式,需要对生物墨水的黏度、表面张力、剪切模量、施加压力/剪切力、线性流动速度及喷嘴横截面积等参数进行优化,以确保连续墨水细丝的打印流畅性[10-12]。受丝素蛋白溶液本身流变学特性限制,纯丝素蛋白生物墨水的挤出式生物3D打印极具挑战,如图1所示。当前研究主要通过复配其他组分(明胶、海藻酸钠等)提高SF溶液黏度并赋予其剪切稀化特性和触变性[13]。光交联技术多被用于提高打印后材料的结构强度和稳定性,即后固化交联反应(图2)。经后固化处理的打印材料,其黏弹性能与其力学性能直接相关,并被用于评估打印材料的应用性能特征,如振幅扫描下的线性黏弹区反映了打印材料的结构稳定性和抗形变能力;频率扫描下的黏弹区反映了在不同时间尺度下材料的强度特性。
除此之外,黄益等[14]提出了一种适用于生物3D打印的原位光交联技术,以克服纯丝素蛋白溶液在挤出式打印中的流变学特性限制。该技术通过调控光交联效率和水凝胶细丝挤出速率,使得丝素蛋白前驱液在透明喷嘴内进行原位光交联固化,实现了纯SF水凝胶细丝的连续加工,进而构建了无细胞的纯SF三维结构水凝胶支架。该技术对初始丝素蛋白溶液黏度、触变性等要求较低,且具有连续化加工优势,但对辐照条件、挤出速率与交联反应速率的调控和同步适配性要求较高。
1.2 光固化式生物3D打印
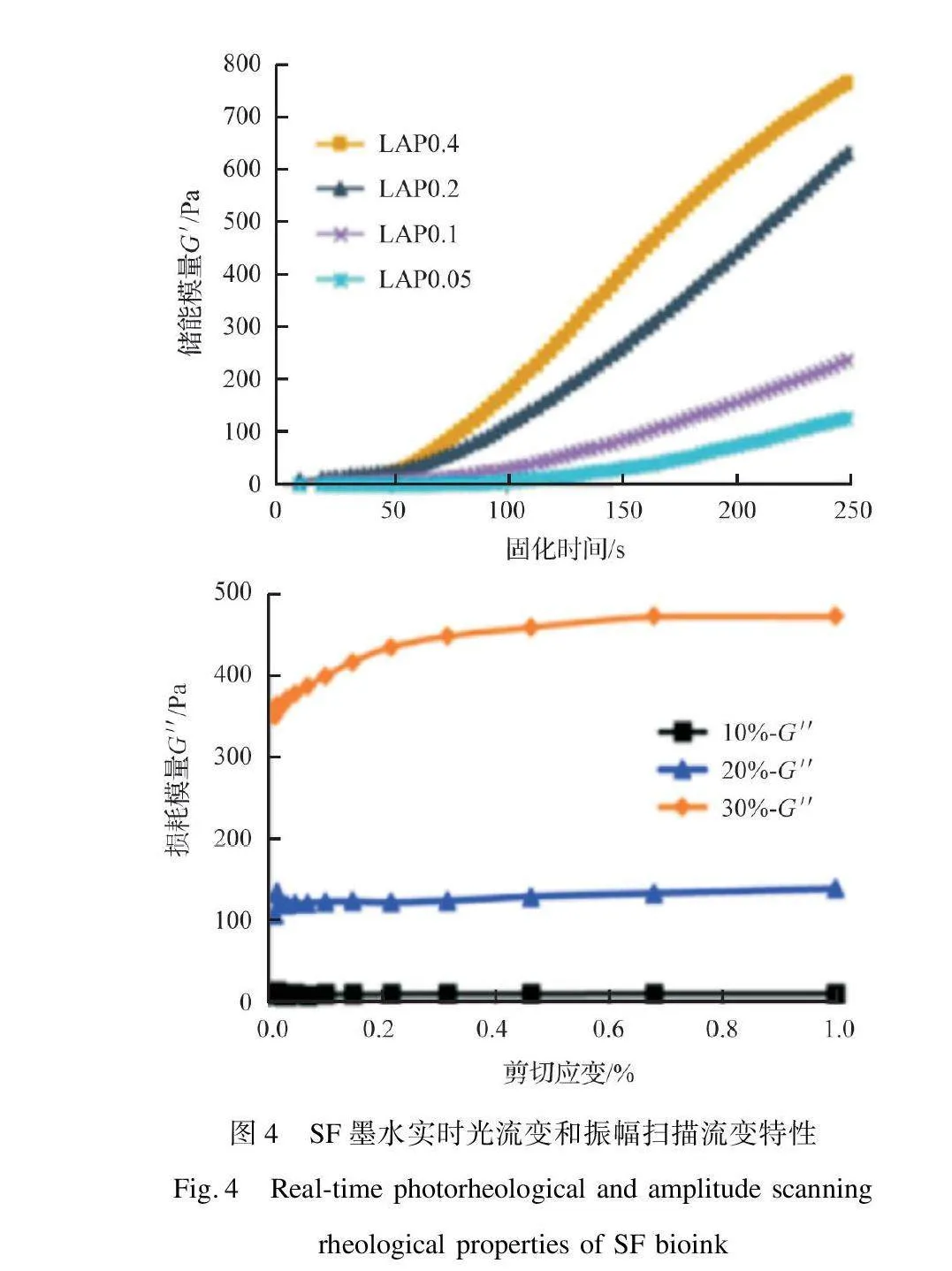
光固化式生物3D打印是以光诱导生物墨水发生光交联反应为基础,通过控制高精度光源的点、线或面投影来实现生物墨水特定单层形状的交联固化,并通过平台移动实现层层累积,主要类型包括:立体光刻(Stereolithography,SLA)技术和数字光处理(Digital Light Processing,DLP)技术,如图3所示。与SLA的激光点光源技术不同,DLP技术使用对细胞生物相容性更好的可见光LED光源,且投影式面光源的应用可显著降低加工时间,有效避免细胞沉降,在丝素蛋白生物光固化3D打印中更具优势。由于光固化式生物3D打印属于无喷嘴、非接触式打印技术,因此生物墨水无需剪切稀化、触变性等流变特性。为保证打印精细度,其墨水需具有较高的流动性,其黏度应控制在较低范围(1~300 mPa·s)[15-16]。对光固化过程中SF墨水流变特性的实时监测可有效评估墨水的光交联反应动力学。在固定频率和振幅的振荡剪切过程中,
甲基丙烯酸酯改性丝素蛋白(Sil-MA)墨水材料的储能模量G′会随引发剂用量、光照强度、Sil-MA浓度等参数的增加而增大,意味着暴露在辐照光下的时间越长,Sil-MA墨水的光交联程度越大,如图4[17]所示。对光固化后SF凝胶材料的流变性能进行测试,有助于了解水凝胶材料的物理性能和结构信息,以评估其应用性能。该测试可通过不同振幅或频率下的振荡试验来检测评估,其中储能模量G′、损耗模量G″和损耗因子tan δ分别表示SF水凝胶的弹性部分、黏性部分及两者相对强弱。通过考察振幅扫描下的模量信息,可确定凝胶材料的线性黏弹区和结构稳定性。通过考察频率扫描下的模量信息,可评估凝胶材料的交联程度和使用寿命。此外,理论上凝胶点处tan δ与频率无关,常用于确定温敏凝胶材料的凝胶点温度。类似地,对不同光固化时间下的凝胶材料进行频率扫描,也将有助于确定SF光固化墨水的凝胶转变点。
1.3 多光子光刻式生物3D打印
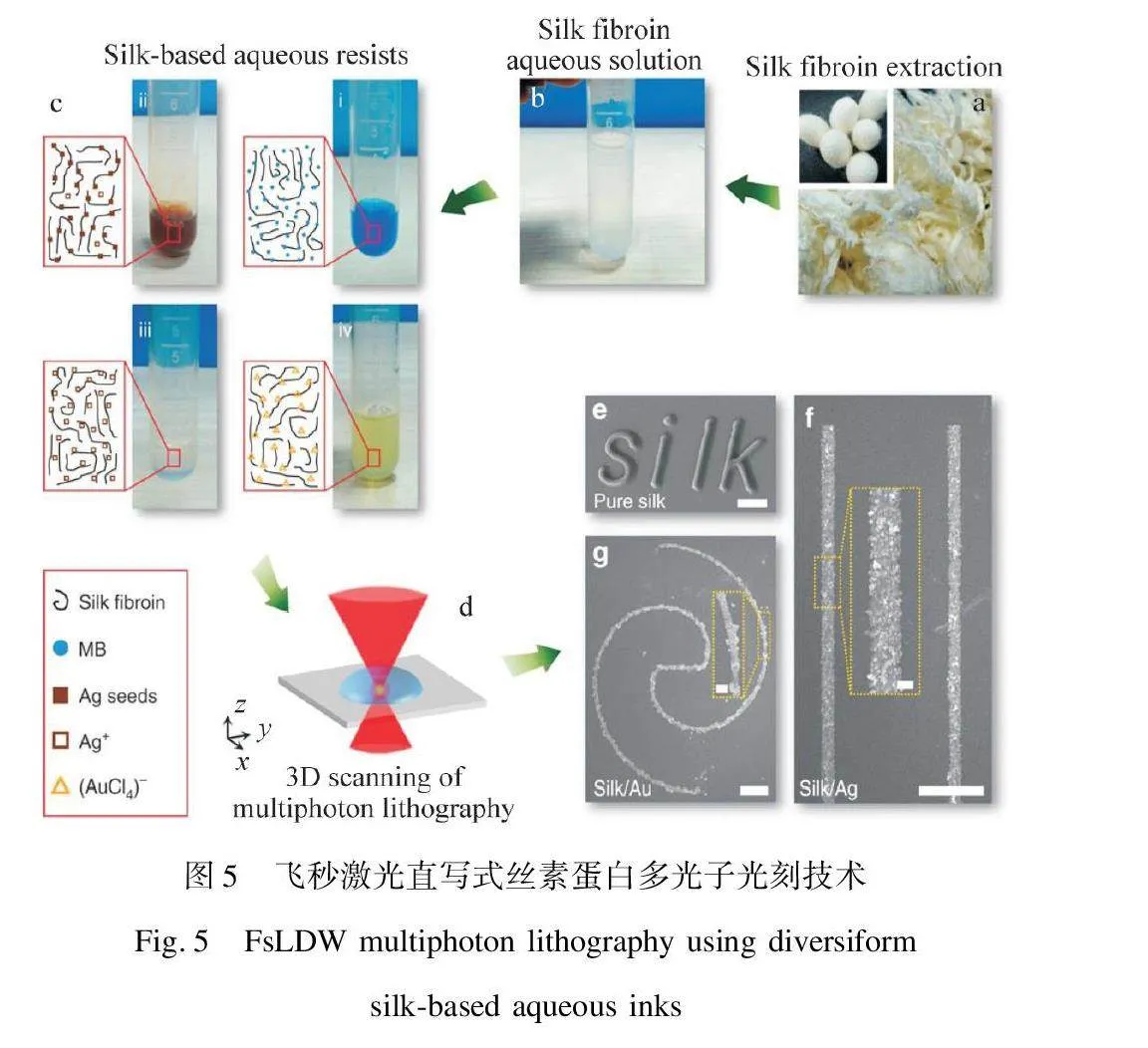
多光子光刻(Multiphoton Lithography,MPL)技术可通过脉冲激光在限域空间中诱导材料的聚合交联反应直接写入高分辨率的复杂3D微结构。脉冲激光通过聚焦到含有光引发剂和光固化组分(即负性光致抗蚀剂)的溶液中,引起光引发剂发生多光子吸收进而诱导光固化组分发生局部聚合或交联。经编程激光移动路径可在空间分辨率低于50 nm情况下制备微小体积的复杂3D结构(组织工程支架、标志性建筑和艺术的微型复制品)[18]。近年来,将这种微纳米级加工技术与天然生物材料(蛋白质、肽和DNA)相结合的研究受到关注。例如,生物相容的合成多功能团单体(PEGDA)和光反应性天然大分子(丝素蛋白)均可通过MPL技术实现高分辨率3D水凝胶微结构的制备。此外,多光子光刻的墨水体系黏度一般较低,且黏度与光刻成型结构厚度相关,通常在7~22 mPa·s[19]。
基于丝素蛋白自身的光耦合交联特性,在优选的光引发剂和激光光源下可通过MPL技术获得具有良好生物相容性、机械强度和光学透明度的丝素蛋白水凝胶微体系结构。Dickerson等[20]以三联吡啶钌Ru(bpy)2+3与过硫酸钾为光引发剂,在配备100 mW飞秒固体激光器(780 nm)的纳米3D打印机上实现了纳米级拱桥结构丝素蛋白光交联水凝胶的3D打印,为微型尺寸丝素基生物传感元件的开发提供了新的可能性。Sun等[21]以亚甲基蓝为光引发剂,40 W白炽灯为辐照光源,通过非接触和无掩模的飞秒激光直写技术(Femtosecond Laser Direct Writing,FsLDW),实现了多种“模块化”家蚕丝素蛋白墨水的多光子光刻(图5)[21]。
2 丝素蛋白墨水的光交联反应及性能
生物墨水的光交联成型是在光诱导条件下墨水由溶胶转变为凝胶的过程,不仅影响生物墨水的流变性,而且决定打印结构的物理机械性能。适当的13457660922d99c8dddf52c0deda67a3光交联成型可以防止打印层坍塌,利于打印后结构的保真度和完整性。若打印结构交联过弱,则打印结构难以维持形状稳定,材料降解速率过快;反之,则会降低其吸液溶胀性和物质交换速率,甚至影响细胞活力。因此,调控适宜的光交联程度是平衡丝素蛋白交联成型结构与应用性能的关键[22]。对于丝素蛋白生物墨水体系而言,通常需对丝素蛋白进行光敏改性、引入光敏高分子材料或利用其自身的光化学反应特性,在高效光源和光引发体系的作用下,诱导产生引发种并完成丝素蛋白大分子间的交联成型。
2.1 丝素蛋白的光敏改性
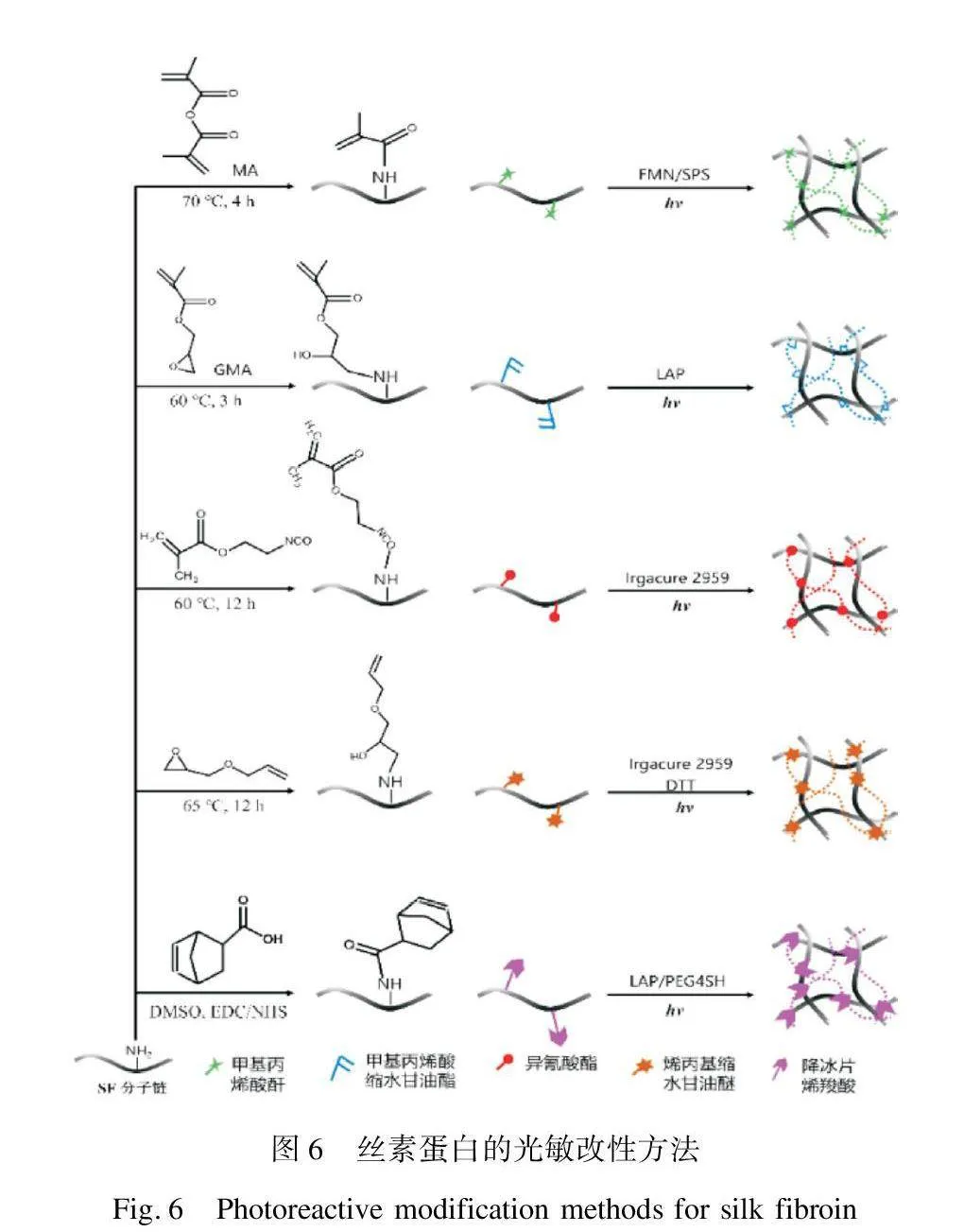
为赋予丝素蛋白光聚合反应能力,国内外研究者主要采用含烯双键光敏改性剂对丝素蛋白侧链上的氨基、羟基或羧基进行接枝改性,后经光引发的自由基聚合反应完成快速的交联成型。适用于丝素蛋白的几种典型光敏改性方法如图6所示。
Bessonov等[23]选用甲基丙烯酸酐(MA)对丝素蛋白侧链上的氨基进行修饰以赋予其光聚合交联性能,相较于乙醇诱导物理交联丝素蛋白,MA修饰后的丝素蛋白在凝胶强度(480 kPa)和成型时间(10~20 min)上均具有显著优势。然而,在SF接枝MA的反应过程中会生成酸性副产物甲基丙烯酸,体系pH值的降低易导致丝素蛋白发生凝胶变性[24]。Kim等[17]选用甲基丙烯酸缩水甘油酯(GMA)作为改性剂,通过GMA的环氧开环机制在丝素蛋白侧链上引入甲基丙烯酰基,避免了酸性副产物的产生。此外,GMA还能与丝素蛋白分子中的羟基和羧基发生反应,通过酯交换机制进一步促
进丝素蛋白的甲基丙烯酰化[25]。改性后的丝素蛋白溶液可作为打印墨水,在紫外光诱导下实现了高分辨、高稳定性的三维结构水凝胶。Zhou等[26]则利用异氰酸酯的亲核加成反应原理,以甲基丙烯酸异氰酸乙酯为改性剂对丝素蛋白侧链上的氨基和羟基进行改性,并与马来酰化壳聚糖在紫外光诱导下共聚交联得到适用于关节软骨的复合凝胶支架材料。上述基于烯双键自由基聚合的反应方式,虽可实现改性丝素蛋白的快速交联,但其自由基聚合交联过程仍存在氧阻及反应可控性问题[27]。为此,Hoorick等[28]将“点击化学”引入改性丝素蛋白的光交联反应,通过降冰片烯结构与巯基化交联剂的迈克尔加成反应实现交联。与常规的自由基聚合方式不同,基于巯基烯的迈克尔加成反应不受氧阻影响,并可实现在温和反应条件下的快速交联。上述光敏改性技术虽可满足丝素蛋白实时交联效率的要求,但仍存在接枝率、接枝分布等反应可控性问题。
2.2 光诱导丝素蛋白的耦合交联
将烯双键等光敏基团接枝于丝素蛋白氨基酸侧基,可赋予丝素蛋白光聚合交联性能。然而,丝素蛋白的光敏改性过程不可避免存在改性剂、催化剂等化学残留,使光敏改性策略存在不同程度的生物相容性风险。丝素蛋白自身结构中虽不具备可直接光聚合的光敏性基团,但某些活性侧基可通过光诱导下的氧化还原或自由基引发等方式原位产生自由基活性位点[29],实现丝素蛋白的自交联反应。作为一种新型的丝素蛋白光诱导自交联技术,其无需对丝素蛋白进行光敏改性,从根本上避免了化学残留和接枝可控性等问题。值得注意的是,由于丝素蛋白氨基酸侧基的反应活性有限,丝素蛋白的自交联反应通常需辅以高能紫外光或者高效光敏引发体系。此外,由于紫外光的辐射危害问题,近年来以可见光作为辐照光源,配合高效光敏引发体系的策略受到关注,如表1所示。
钌(Ⅱ)多吡啶配合物因其激发态寿命长、室温稳定性高等优点被广泛应用于可见光催化领域。其中,将三联吡啶钌Ru(bpy)2+3与过硫酸钾(KPS)、过硫酸钠(SPS)或过硫酸铵(APS)等氧化剂复合,可构建可见光(400~550 nm)引发体系,诱导丝素蛋白的自交联反应。Huang等[37]研究了Ru(bpy)2+3/KPS作用下的丝素蛋白光诱导自交联机理(图7)。蓝光(450 nm)诱导下,Ru(bpy)2+3吸收一定能量的光子跃迁至其激发态Ru(Ⅱ)*,后与过硫酸盐氧化剂发生电子转移反应,生成具有强氧化性的Ru(bpy)3+3、SO-4·等。在上述强氧化性物质的作用下,SF酪氨酸结构的酚氧位、苯环邻、间位可产生活性自由基,经自由基间的耦合反应实现SF大分子间的共价交联。此外,该课题组还发现当Ru(bpy)2+3摩尔浓度(>0.05 mmol/L)过高时会产生“滤镜效应”,导致SF的光交联效率下降[14]。
Cui等[38]将钌(Ⅱ)多吡啶配合物和过硫酸钠(SPS)介导的丝素蛋白光交联与辣根过氧化物酶(HRP)和过氧化氢(H2O2)构成的酶促交联进行了对比,结果表明以Ru(bpy)2+3为引发剂的快速光交联可以控制丝素蛋白中β-折叠的形成,使打印结构的机械性能更加稳定,而酶促交联的丝素蛋白打印结构易发生塌陷。同时,也有研究者指出钌多吡啶配合物/过硫酸盐体系中未完全反应的Ru(bpy)2+3和过硫酸盐具有潜在的细胞毒性,需对其含量加以控制[39]。
核黄素(RF)即维生素B2,是一种广泛存在于动植物中的天然维生素,其中黄素单核苷酸(FMN)和黄素腺嘌呤二核苷酸(FAD)是核黄素的两种生物活性形式。由于FMN具有较高的水溶性,因此常作为水溶性光引发剂用于水凝胶材料的制备[40]。核黄素可作为单组分光引发剂诱导丝素蛋白酪氨酸侧基发生自由基的耦合反应,通过单线态氧氧化和直接氧化两条路径实现丝素蛋白的光诱导自交联,如图8[36]所示。
在单线态氧的氧化路径中,光引发剂(PI)受到特定波长光的激发形成激发态(PI*),后与氧气发生电子转移生成单线态氧(1O2)和基态光引发剂(PI),单线态氧(1O2)和丝素蛋白分子上的酪氨酸残基(TH)发生反应生成酪氨自由基,进而实现二酪氨结构的共价交联;而在直接氧化路径中,激发态光引发剂(PI*)与丝素蛋白分子上的酪氨酸残基(TH)进行电子转移,形成酪氨自由基(T·)和光引发剂自由基(PI-·),进而耦合反应生成二酪氨共价交联结构。虽然核黄素光引发剂具有良好的生物安全性,但由于其引发效率较低,往往需要较长时间(>30 min)才能完成丝素蛋白的凝胶化过程[35],不利于其在生物3D打印中的应用。针对单组分光引发剂引发效率低的问题,孙广东等[36]将光敏增效剂二芳基六氟磷酸碘鎓盐(DPI)分别与核黄素磷酸钠(FMN)、姜黄素(CC)、樟脑醌(CQ)及曙红Y(EY)组建4种双组分高效蓝光引发体系,光敏增效剂DPI的加入,可显著提高二组分体系的光引发效率。这归因于DPI在直接氧化路径中不仅可将光引发剂自由基(PI-·)氧化成基态光引发剂(PI)再次进入引发过程,减少对体系光引发剂的消耗,同时还可新增活性自由基(X·),显著缩短了丝素蛋白的凝胶时间(约97 s)。
3 光交联丝素蛋白墨水的生物相容性
生物相容性是评估打印结构仿生能力的重要标准,要求生物墨水与负载细胞生存微环境尽可能相似,并在打印期间和打印后具有细胞活力,以使细胞在打印结构中增殖、迁移、分化[9,41]。丝素蛋白本身具有良好的生物相容性,可在不引起免疫反应的情况下与生物系统发生良好的信号传递作用。此外,丝素蛋白最终的降解产物是可被生物体吸收的氨基酸和寡肽,其丰富的侧基种类可为细胞的识别、黏附提供位点,并促进细胞的增殖和分化[42]。因此,光交联丝素蛋白墨水体系潜在的生物相容性问题主要涉及辐照光源和光引发剂体系两方面。
早期的光交联技术主要采用紫外光作为辐射光源,虽然其交联效率高,但高强紫外线(<365 nm)存在辐射和臭氧危害,亦可导致打印结构中的细胞失活。随后,研究人员尝试采用近紫外光区(395~405 nm)蓝紫光作为DLP实时光固化或挤出式后固化的辐照光源,在保证交联效率的同时极大改善了细胞损伤风险。目前,更为安全的可见光(>405 nm)辐照光源,如450 nm的蓝光LED、523 nm的绿光LED,成为3D生物打印领域新的发展方向[43]。
选择与辐照光源相匹配的光引发剂是实现高效3D打印的关键因素之一。目前,在生物3D打印领域中较为常用的光引发剂2-羟基-4-(2-羟乙氧基)-2-甲基苯丙酮(I2959)和苯基(2,4,6-三甲基苯甲酰基)磷酸锂盐(LAP)具有较好的水溶性和生物相容性,可适用于烯双键改性丝素蛋白墨水的生物3D打印[9]。然而,这些引发剂的吸收光谱与可见光光源匹配性不佳,限制了其在可见光诱导丝素蛋白耦合交联生物打印中的应用。针对此问题,Xie等[44]开发了基于525 nm光源的旋转投影式体积增材制造(VAM)系统,以Ru(bpy)2+3/SPS为可见光引发体系,实现了全丝绸(丝胶和丝素)和纯丝素蛋白墨水的高效生物3D打印。打印的丝素蛋白螺纹钉支架具有良好的生物相容性、细胞整合和骨形成潜力。此外,尽管相较于Ru(bpy)2+3,RF表现出较低的光引发交联效率,但仍被用作可见光引发剂诱导丝素蛋白光耦合交联,通过DLP打印实现了高精细度(~200 μm)、可药物递送的丝素蛋白微针凝胶的生物3D打印[45]。
4 光交联丝素蛋白生物墨水体系
生物墨水的组分设计是生物3D打印的关键,需要兼顾生物相容性、可打印性、机械性能等要求。然而,丝素蛋白虽具有优异的生物相容性,但由于自身流变性能的限制,单一组分丝素蛋白墨水材料主要适用于投影式和光刻式3D打印。通过对丝素蛋白体系进行改性或复配,可进一步调控其打印流变性、光敏反应性及成型结构强度等性能,以满足更多打印方式的要求。
4.1 单组分丝素蛋白
目前,研究者常采用化学改性方法对丝素蛋白进行光敏接枝,以赋予其光交联性能,进而开发单组分光交联丝素蛋白生物墨水。Hong等[46]选用甲基丙烯酸缩水甘油酯对丝素蛋白大分子中的氨基进行接枝改性,反应制备了适用于DLP生物3D打印的甲基丙烯酸化丝素蛋白(Silk-GMA)生物墨水,并对其在软骨组织工程的应用进行了探索。研究表明,该生物墨水具有良好的生物相容性和机械性能,将负载软骨细胞的Silk-GMA生物墨水通过DLP打印机打印成高精度的仿生气管,并将其植入气管损伤的家兔体内可促进缺损软骨组织的再生。Ajiteru等[47]则将改性的Silk-GMA作为墨水材料开发了适用于DLP生物3D打印的磁性墨水。结果表明该磁性墨水具有较佳的可打印性和机械强度,且由该磁性墨水打印制备的生物反应器可在磁场的作用下诱导小鼠成肌细胞分化。
相较于光敏改性丝素蛋白,光诱导耦合自交联型丝素蛋白墨水多用于微结构/精细结构的生物3D打印。Applegate等[48]选用核黄素作为一种生物相容性良好的蓝光引发剂,采用掩膜光刻法制备了高分辨率(50 μm)图案化丝素蛋白水凝胶。该水凝胶可选择性粘附至角膜上以改变眼球曲率,对于近视、圆锥角膜等眼部疾病具有无风险的视力矫正治疗前景。Shina等[49]则将丝素蛋白溶液与0.5 mmol/L核黄素混合制备了用于DLP生物3D打印的墨水,并对投影图像进行灰度处理以消除打印结构边界处的混叠现象,最后通过可见光投影实现SF微针(~200 μm)的交联成型。此外,通过新荧光峰的产生表征了辐照过程中二酪氨酸结构的形成,且该结构随着丝素蛋白浓度的提高而增加。
4.2 丝素蛋白/合成高分子
丝素蛋白虽具有诸多优良性能,但纯丝素蛋白也存在力学性能差、降解速度快等问题,限制了其在生物医用材料中的应用。合成高分子材料具有种类丰富、机械性能可调、重现性高等优点,将其与丝素蛋白材料复合是改善或解决上述问题的有效策略。已用于光交联丝素蛋白墨水材料的复配改性的合成高分子材料主要包括聚乙二醇(PEG)[50]、聚乙烯醇(PVA)[51]等。
聚乙二醇是由聚环氧乙烷与水通过加聚反应制得,具有水溶性高、无毒、生物相容性好等优点,同时其易于化学修饰,可通过甲基丙烯酸酯、丙烯酸酯进行光敏接枝改性赋予其光交联反应性能。Kwak等[52]将四臂聚乙二醇与丙烯酰氯在室温黑暗环境下进行反应后制得四臂聚乙二醇丙烯酸酯(PEG4A),然后将其与丝素蛋白复合开发了适于DLP生物3D打印的生物墨水,可用于人工皮肤的构建。研究发现,角质细胞和成纤维细胞在该水凝胶结构中显示出很高的代谢活性,同时,该生物墨水在可见光辐照下会引发PEG4A与丝素蛋白形成一种互穿网络结构的水凝胶(图9)。与纯PEG4A水凝胶相比,丝素蛋白的添加不仅提高了SF/PEG4A水凝胶的生物相容性,而且可通过丝素蛋白β-折叠结构的形成进一步提高SF/PEG4A复合水凝胶的机械性能。
4.3 丝素蛋白/天然高分子
天然多糖高分子(透明质酸钠、海藻酸钠、壳聚糖及纤维素等)和天然蛋白质高分子(胶原、明胶和大豆蛋白等)均具有良好的生物相容性、生物降解性及来源广泛等特点,将其与丝素蛋白复配开发生物墨水,一方面可丰富复合生物墨水的交联方式,显著提升其可打印性和结构强度,另一方面也可较大程度地改善其生物相容性(图10)。
天然高分子材料可通过氢键、范德华力等物理作用来调控丝素蛋白生物墨水的打印流变性和结构稳定性[53]。Dorishetty等[54]以Ru(bpy)2+3/APS作为光引发体系,制备了可光交联的纳米纤维素/丝素蛋白复合生物墨水,并对其流变性能和可打印性进行了研究。通过挤出式3D打印和逐层光固化实现了纳米纤维素/丝素蛋白复合水凝胶支架的构建。研究表明,细菌纤维素(BC)、纤维素纳米纤维(CNF)和纤维素纳米晶(CNC)等不同类型纳米纤维素可分别改善丝素蛋白复合结构的机械性能、生物相容性和可打印性,这对纳米纤维素用于软组织和硬组织的潜力提出了新的见解。
为进一步改善丝素蛋白复合墨水的光交联特性,改善打印材料的物理机械性能,研究者还对天然高分子进行光敏改性,经光交联构建双网络结构的复合凝胶体系。Kim等[55]将海藻酸钠和丝素蛋白分别进行酪氨改性和甲基丙烯酸改性,以RF/SPS为光引发体系,制备可光交联的丝素蛋白/海藻酸钠复合改性生物墨水。为调控复合生物墨水的可打印性,采用CaCO3和D-葡萄糖酸-δ-内酯(GDL)作为离子交联剂对复合生物墨水进行预交联。打印完成后,在444 nm可见光下对打印结构进行光交联后固化,可进一步提高打印结构的稳定性。研究表明,改性丝素蛋白用量的增加有利于改善复合生物墨水的细胞亲和力,将负载NIH 3T3成纤维细胞的墨水打印成支架结构培养7 d后,其负载细胞仍可表现出较高的细胞活力和增殖能力。
此外,基于酪氨酸残基间的光诱导耦联反应,研究者开发出了可共价交联的天然高分子/丝素蛋白复合生物墨水。黄益等[56]以天然明胶作为复合组分,一方面通过其增稠性和温敏性调控丝素蛋白复合体系的打印流变性能,另一方面基于丝素蛋白和明胶氨基酸侧基的光化学反应特性,通过蓝光诱导Ru(bpy)2+3/KPS引发丝素蛋白和明胶结构上酪氨酸的耦合交联,形成明胶/丝素蛋白共交联网络结构,以提高支架的稳定性。Dorishetty等[57]制备了大豆蛋白/丝素蛋白复合生物墨水用于挤出式生物3D打印。利用大豆蛋白和丝素蛋白大分子间的光诱导共交联反应,进一步提高了大豆蛋白/丝素蛋白共交联水凝胶网络的结构稳定性。此外,复合体系中丝素蛋白的含量越高,水凝胶中成纤维细胞的活性越高。
5 结 语
光交联技术与丝素蛋白快速成型相结合,显著改善了丝素蛋白材料在生物3D打印应用中的诸多技术瓶颈问题,尤其是近年来在丝素蛋白光诱导自交联理论和技术上的探索和创新,为丝素蛋白在生物医药领域的拓展应用提供新的技术策略。尽管当前对光交联SF生物墨水的开发与应用已经取得了诸多成果,但其临床医学应用仍存在很多挑战。首先,仍需深入研究并开发引发效率高、生物相容性好的新型光引发剂及其增效复配技术;其次,丝素蛋白氨基酸侧基的光化学反应特性与自交联理论仍需进一步明晰,有利于提高光引发交联效率,调控交联结构与性能;第三,开发随时间或环境变化而改变自身结构特性的“智能化”生物医用材料,以满足不同复杂应用领域的多变需求。上述研究工作的开展与深入将为光交联丝素蛋白三维成型提供理论基础和应用指导,并最终推动其在临床医学中的实际应用。
参考文献:
[1]ADHIKARI J, ROY A, DAS A, et al. Effects of processing parameters of 3D bioprinting on the cellular activity of bioinks[J]. Macromolecular Bioscience, 2020, 21(1): 2000179.
[2]FARHAT W, CHATELAIN F, MARRET A, et al. Trends in 3D bioprinting for esophageal tissue repair and reconstruction[J]. Biomaterials, 2021(267): 120465.
[3]GHAVAMINEJAD A, ASHAMMAKHI N, WU X Y, et al. Crosslinking strategies for 3D bioprinting of polymeric hydrogels[J]. Small, 2020, 16(35): 2070195.
[4]刘迪, 许宗溥, 杨明英, 等. 丝素蛋白水凝胶的凝胶机理及改性方法研究进展[J]. 蚕业科学, 2018, 44(1): 166-171.
LIU D, XU Z P, YANG M Y, et al. Research progress on gelling mechanism and modification of silk fibroin hydrogels[J]. Acta Sericologica Sinica, 2018, 44(1): 166-171.
[5]TADDEI P, CHIONO V, ANGHILERI A, et al. Silk fibroin/gelatin blend films crosslinked with enzymes for biomedical applications[J]. Macromolecular Bioscience, 2013, 13(11): 1492-1510.
[6]ZHAO Y, NAKAJIMA T, YANG J J, et al. Proteoglycans and glycosaminoglycans improve toughness of biocompatible double network hydrogels[J]. Advanced Materials, 2014, 26(3): 436-442.
[7]GROLL J, BURDICK J A, CHO D W, et al. A definition of bioinks and their distinction from biomaterial inks[J]. Biofabrication, 2019, 11(1): 013001.
[8]CUI X L, LI J, HARTANTO Y, et al. Advances in extrusion 3D bioprinting: A focus on multicomponent hydrogel-based bioinks[J]. Advanced Healthcare Materials, 2020, 9(15): 1901648.
[9]GU Z M, FU J Z, LIN H, et al. Development of 3D bioprinting: From printing methods to biomedical applications[J]. Asian Journal of Pharmaceutical Sciences, 2019, 15(5): 529-557.
[10]NAGHIEH S, CHEN X B. Printabilitye: A key issue in extrusion-based bioprinting[J]. Journal of Pharmaceutical Analysis, 2021, 11(5): 564-579.
[11]SCHWAB A, LEVATO R, D’ESTE M, et al. Printability and shape fidelity of bioinks in 3D bioprinting[J]. Chemical Reviews, 2020, 120(19): 11028-11055.
[12]DORISHETTY P, DUTTA N K, CHOUDHURY N R. Bioprintable tough hydrogels for tissue engineering applications[J]. Advances in Colloid and Interface Science, 2020(281): 102163.
[13]AMORIM P A, D’VILA M A, ANAND R, et al. Insights on shear rheology of inks for extrusion-based 3D bioprinting[J]. Bioprinting, 2021(22): e00129.
[14]黄益, 吕玲玲, 潘小鹏, 等. 光交联自支撑丝素蛋白水凝胶的三维快速成型[J]. 高等学校化学学报, 2022, 43(4): 187-194.
HUANG Y, L L L, PAN X P, et al. Three-dimensional printing of photocrosslinked self-supporting silk fibroin hydrogels[J]. Chemical Journal of Chinese Universities, 2022, 43(4): 187-194.
[15]KOCH L, KUHN S, SORG H, et al. Laser printing of skin cells and human stem cells[J]. Tissue Engineering Part C: Methods, 2010, 16(5): 847-854.
[16]GRUENE M, DEIWICK A, KOCH L, et al. Laser printing of stem cells for biofabrication of scaffold-free autologous grafts[J]. Tissue Engineering Part C: Methods, 2011, 17(1): 79-87.
[17]KIM S H, YEON Y K, LEE J M, et al. Precisely printable and biocompatible silk fibroin bioink for digital light processing 3D printing[J]. Nature Communications, 2018, 9(1): 1620-1625.
[18]SPIVEY E C, RITSCHDORFF E T, CONNELL J L, et al. Multiphoton lithography of unconstrained three-dimensional protein microstructures[J]. Advanced Functional Materials, 2013, 23(3): 333-339.
[19]GREANT C, DURME B V, HOORICK J V, et al. Multiphoton lithography as a promising tool for biomedical applications[J]. Advanced Functional Materials, 2023, 33(39): 2212641.
[20]DICKERSON M B, DENNIS P B, TONDIGLIA V P, et al. 3D printing of regenerated silk fibroin and antibody-containing microstructures via multi-photon lithography[J]. ACS Biomaterials Science and Engineering, 2017, 3(9): 2064-2075.
[21]SUN Y L, LI Q, SUN S M, et al. Aqueous multiphoton lithography with multifunctional silk-centred bio-resists[J]. Nature Communications, 2015, 6(1): 8612.
[22]ADHIKARI J, ROY A, DAS A, et al. Effects of processing parameters of 3D bioprinting on the celluki0rT61XUHGD9HwkbPOxdzX8c1JOhZ/R9lOpdrg/7mM=lar activity of bioinks[J]. Macromolecular Bioscience, 2021, 21(1): 2000179.
[23]BESSONOV I V, ROCHEV Y A, ARKHIPOVA A Y, et al. Fabrication of hydrogel scaffolds via photocrosslinking of methacrylated silk fibroin[J]. Biomedical Materials, 2019, 14(3): 034102.
[24]MU X, SAHOO J K, CEBE P, et al. Photo-crosslinked silk fibroin for 3D printing[J]. Polymers, 2020, 12(12): 2936.
[25]HONG H, SEO Y B, KIM D Y, et al. Digital light processing 3D printed silk fibroin hydrogel for cartilage tissue engineering[J]. Biomaterials, 2020(232): 119679.
[26]ZHOU Y S, LIANG K, ZHAO S Y. Photopolymerized maleilated chitosan/methacrylated silk fibroin micro/ nanocomposite hydrogels as potential scaffolds for cartilage tissue engineering[J]. International Journal of Biological Macromolecules, 2018(108): 383-390.
[27]BERTLEIN S, BROWN G, LIM K S, et al. Thiol-ene clickable gelatin: A platform bioink for multiple 3D biofabrication technologies[J]. Advanced Materials, 2017, 29(44): 1703404.
[28]VAN HOORICK J, DOBOS A, MARKOVIC M, et al. Thiol-norbornene gelatin hydrogels: Influence of thiolated crosslinker on network properties and high definition 3D printing[J]. Biofabrication, 2021, 13(1): 015017.
[29]POSADAZ A, BIASUTTI A, CASALE C, et al. Rose bengal-sensitized photooxidation of the dipeptides L-tryptophyl-L-phenylalanine, L-tryptophyl-L-tyrosine and L-tryptophyl-L-tryptophan: Kinetics, mechanism and photoproducts[J]. Photochemistry and Photobiology, 2004, 80(1): 132-138.
[30]BALU R, REEDER S, KNOTT R, et al. Tough photocrosslinked silk fibroin/graphene oxide nanocomposite hydrogels[J]. Langmuir: The ACS Journal of Surfaces and Colloids, 2018, 34(31): 9238-9251.
[31]WHITTAKER J L, CHOUDHURY N R, DUTTA N K, et al. Facile and rapid ruthenium mediated photo-crosslinking of Bombyx mori silk fibroin[J]. Journal of Materials Chemistry B, 2014, 2(37): 6259-6270.
[32]BAE S B, JEONG J E, PARK S A, et al. Dual-crosslinked silk fibroin hydrogels with elasticity and cytocompatibility for the regeneration of articular cartilage[J]. Polymer, 2021, 224(15): 123739.
[33]CUI X L, SOLIMAN B G, ALCALA-OROZCO C R, et al. Rapid photocrosslinking of silk hydrogels with high cell density and enhanced shape fidelity[J]. Advanced Healthcare Materials, 2020, 9(4): 1901667.
[34]LEE H, SHIN D, SHIN S, et al. Effect of gelatin on dimensional stability of silk fibroin hydrogel structures fabricated by digital light processing 3D printing[J]. Journal of Industrial and Engineering Chemistry, 2020(89): 119-127.
[35]KUANG D J, JIANG F J, WU F, et al. Highly elastomeric photocurable silk hydrogels[J]. International Journal of Biological Macromolecules, 2019(134): 838-845.
[36]孙广东, 黄益, 邵建中, 等. 光交联丝素蛋白水凝胶的蓝光引发体系[J]. 纺织学报, 2020, 41(4): 64-71.
SUN G D, HUANG Y, SHAO J Z, et al. Blue light initiated system photocrosslinking of silk fibroin hydrogel[J]. Journal of Textile Research, 2020, 41(4): 64-71.
[37]HUANG Y, SUN G D, LYU L L, et al. Dityrosine-inspired photocrosslinking technique for 3D printing of silk fibroin-based composite hydrogel scaffolds[J]. Soft Matter, 2022, 18(19): 3705-3712.
[38]CUI X L, SOLIMAN B G, ALCALA-OROZCO C R, et al. Rapid photocrosslinking of silk hydrogels with high cell density and enhanced shape fidelity[J]. Advanced Healthcare Materials, 2020, 9(4): 1901667.
[39]ANNABI N, ZHANG Y N, ASSMANN A, et al. Engineering a highly elastic human protein-based sealant for surgical applications[J]. Science Translational Medicine, 2017, 9(410): eaai7466.
[40]XU L F, LIANG X, ZHANG S T, et al. Riboflavin: A natural aggregation-induced emission luminogen (AIEgen) with excited-state proton transfer process for bioimaging[J]. Dyes and Pigments, 2020, 182(3): 108642.
[41]GUPTA S, ALRABAIAH H, CHRISTOPHE M, et al. Evaluation of silk-based bioink during pre and post 3D bioprinting: A review[J]. Journal of Biomedical Materials Research Part B, 2021, 109(2): 279-293.
[42]GURU J, MANISHEKHAR K, DIMPLE C, et al. An insight into silk-based biomaterials: From physicochemical attributes to recent biomedical applications[J]. ACS Applied Bio Materials, 2019, 2(12): 5460-5491.
[43]ZHOU D, ITO Y, et al. Visible light-curable polymers for biomedical applications[J]. Science China (Chemistry), 2014, 57(4): 510-521.
[44]XIE M B, LIAN L M, MU X, et al. Volumetric additive manufacturing of pristine silk-based (bio)inks[J]. Nature Communications, 2023, 14(1): 210.
[45]SUN Y L, LI Q, SUN S M, et al. Aqueous multiphoton lithography with multifunctional silk-centred bio-resists[J]. Nature Communications, 2015, 6(1): 8612.
[46]HONG H, SEO Y B, KIM D Y, et al. Digital light processing 3D printed silk fibroin hydrogel for cartilage tissue engineering[J]. Biomaterials, 2020(232): 119679.
[47]AJITERU O, SULTAN M T, LEE Y J, et al. A 3D printable electroconductive biocomposite bioink based on silk fibroin-conjugated graphene oxide[J]. Nano Letters, 2020, 20(9): 6873-6883.
[48]APPLEGATE M B, PARTLOW B P, COBURN J, et al. Photocrosslinking of silk fibroin using riboflavin for ocular prostheses[J]. Advanced Materials, 2016, 28(12): 2464.
[49]SHINA D, HYUN J. Silk fibroin microneedles fabricated by digital light processing 3D printing[J]. Journal of Industrial and Engineering Chemistry, 2020(95): 126-133.
[50]TERZOPOULOU Z, ZAMBOULIS A, KOUMENTAKOU I, et al. Biocompatible synthetic polymers for tissue engineering purposes[J]. Biomacromolecules, 2022, 23(5): 1841-1863.
[51]SUN G D, HUANG Y, LI D P, et al. Blue light induced photopolymerization and cross-linking kinetics of poly(acrylamide) hydrogels[J]. Langmuir: The ACS Journal of Surfaces and Colloids, 2020, 36(39): 11676-11684.
[52]KWAK H, SHIN S, LEE H, et al. Formation of a keratin layer with silk fibroin-polyethylene glycol composite hydrogel fabricated by digital light processing 3D printing[J]. Journal of Industrial and Engineering Chemistry, 2019(72): 232-240.
[53]CHIULAN I, HEGGSET E B, VOICU I S, et al. Photopolymerization of bio-based polymers in a biomedical engineering perspective[J]. Biomacromolecules, 2021, 22(5): 1795-1814.
[54]DORISHETTY P, BALU R, ATHUKORALALAGE S S, et al. Tunable biomimetic hydrogels from silk fibroin and nanocellulose[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(6): 2375-2389.
[55]KIM E, SEOK J M, BAE S B, et al. Silk fibroin enhances cytocompatibilty and dimensional stability of alginate hydrogels for light-based three-dimensional bioprinting[J]. Biomacromolecules, 2021, 22(5): 1921-1931.
[56]黄益, 吕玲玲, 姚菊明, 等. 一种适用于3D打印的光诱导丝素蛋白/明胶共交联水凝胶的制备方法: CN 202110802566.6[P]. 2021-11-16.
HUANG Y, L L L, YAO J M, et al. A preparation method of photoinduced silk fibroin/gelatin co-crosslinked hydrogel suitable for 3D printing: CN 202110802566. 6[P]. 2021-11-16.
[57]DORISHETTY P, BALU R, GELMI A, et al. 3D printable soy/silk hybrid hydrogels for tissue engineering applications[J]. Biomacromolecules, 2021, 22(9): 3668-3678.
Research progress of photo-crosslinked silk fibroin 3D bioprinting ink
ZHANG Chi, WANG Xiangrong
PAN Xiaopeng1, L Lingling1, ZHANG Xu1, SUN Guangdong1,2, SHAO Min1, HUANG Yi1,3, SHAO Jianzhong1
(1a.College of Textile Science and Engineering; 1b.Engineering Research Center for Eco-Dyeing & Finishing of Textiles, Ministry of Education, Zhejiang Sci-Tech University, Hangzhou 310018, China; 2.Sericulture and Tea Research Institute, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China; 3.China National Textile and Apparel Council Key Laboratory for Silk Functional Materials and Technology, Soochow University, Suzhou 215123, China)
Abstract: Based on the principle of additive manufacturing, the innovative technology, 3D bioprinting, can realize the rapid prototyping of bionic functional tissues or artificial organs by accurately positioning and assembling bioinks containing biological materials and cell units, bringing unprecedented opportunities to the medical field. Its application prospect is very broad, and it is expected to solve many medical problems and benefit human health. In the complex process of 3D bioprinting, the choice of bio-ink materials is crucial. It is the key to meeting the strict requirements of bio-safety, fineness and stability of 3D bioprinted bionic structures. Silk fibroin stands out as a potential biological 3D printing material due to its high biocompatibility, controllable biodegradability and adjustable mechanical properties and many other excellent properties. It is obtained by dissolving silk and dialysis, and then products that meet the requirements of different applications, such as hydrogels, films and sponges are prepared through physical or chemical crosslinking. Among the many cross-linking methods, compared with conventional physical cross-linking, thermochemical cross-linking and bioenzyme-catalyzed cross-linking, photocrosslinked fibroin hydrogel technology shows unique advantages. The photocrosslinked fibroin hydrogel technology has the characteristics of fast reaction rate, and can complete the crosslinking process in a short time, which greatly improves the work efficiency. Its conditions are milder and less damaging to biological materials and cells, helping to maintain their biological activity. At the same time, the spatiotemporal controllability makes it possible to precisely control the position and time of the crosslinking, thus achieving more fine and complex structures. In addition, the advantage of fewer by-products also reduces the potential harm to the environment and organisms. In this paper, the optical crosslinking technology of silk fibroin materials is the main line to carry out in-depth research and discussion. Based on rheological properties, the printing method suitable for photocrosslinked silk fibroin 3D printing was introduced. Through the in-depth analysis of the rheological properties of materials, the printing parameters can be optimized and the printing precision and quality can be improved. From the perspective of photocrosslinking reactivity, the photosensitive modification method of fibroin and the photoinduced crosslinking mechanism of fibroin were discussed, which is of great significance for understanding and mastering the photocrosslinking process and further improving and optimizing the technology. From the perspective of biocompatibility, the development of irradiation light source and photoinitiator was introduced. Good biocompatibility is an important prerequisite for the application of biological materials in the medical field, and the selection of appropriate irradiation light source and photoinitiator can guarantee this characteristic. Finally, the application of silk fibroin and its composite inks with synthetic and natural polymer materials in the field of photocrosslinked bioprinting was summarized, and the challenges in the preparation, development and application of photocrosslinked silk protein bioprinting were discussed.
Key words: 3D bioprinting; silk fibroin; photo-crosslinking; bioink; rheological properties

