马铃薯StSuSy4 基因转录调控因子的筛选及互作验证



摘要: 【目的】探究马铃薯块茎高表达基因StSuSy4 的转录调控机制。【方法】克隆StSuSy4 的启动子,构建pAbAi-StSuSy4pro 诱饵载体,并将其转化至酵母细胞Y1HGold 中,获得诱饵酵母菌株;利用诱饵载体筛选马铃薯幼嫩块茎组织酵母文库,并对转录因子进行组织表达模式分析。【结果】经酵母单杂交筛选,获得1 个候选转录因子StBBX25,该基因的开放阅读框为774 bp,编码258 个氨基酸。生物信息分析显示:StBBX25的N 端含有B-box 蛋白的特征结构域B-box1。候选转录因子与启动子点对点的酵母单杂交验证结果显示:在200 ng/mL 金担子素条件下,pGADT7-AD 空载对照组酵母不能正常生长,而pGADT7-StBBX25试验组能正常生长,表明StBBX25 与StSuSy4 基因启动子存在互作。组织表达模式分析显示:StBBX25 和StSuSy4 均为在马铃薯块茎中表达较高的基因。【结论】StBBX25 与StSuSy4 启动子互作,暗示StBBX25 可能在马铃薯叶片和块茎淀粉合成以及产量形成中发挥作用。研究结果为深入理解马铃薯淀粉合成调控网络提供了重要的理论依据。
关键词: 马铃薯;淀粉合成;StSuSy4;转录调控;酵母单杂交;StBBX25
中图分类号: S523.01 文献标志码: A 文章编号: 1004–390X (2024) 03−0017−08
马铃薯(Solanum tuberosum L.) 是茄科(Solanaceae)茄属(Solanum) 一年生草本植物,在中国已有400 多年的栽培历史。因其环境适应能力强、含有丰富的营养物质,马铃薯已成为继小麦、玉米、水稻之后的世界第四大粮食作物。淀粉作为马铃薯干物质的主要成分,不仅提供了人类所需的能量,在工业领域也有广泛的应用。块茎是马铃薯淀粉的主要贮藏器官,块茎中淀粉的合成来源于叶片中合成的蔗糖。当存在尿苷二磷酸(uridine diphos-phate,UDP) 时,蔗糖合酶(sucrosesynthase,SuSy) 将蔗糖分解成果糖和UDP-葡萄糖(uridine diphos-phate glucose,UDPG),在UDPG 焦磷酸化酶、磷酸葡萄糖异构酶、腺苷二磷酸葡萄糖焦磷酸化酶等的作用下,最终产生淀粉合成的直接底物腺苷二磷酸葡萄糖(adenosinediphosphate glucose,ADPG)。作为将光合同化物蔗糖转变为淀粉的关键酶,SuSy 在淀粉合成和库强度代谢调控过程中具有重要作用。研究发现:马铃薯中过表达StSuSy4 可促进UDPG 和ADPG 生成,增加块茎产量和淀粉含量[1]。在玉米中高表达StSuSy4 后,其种子胚乳中的淀粉和ADPG 含量均显著增加[2]。
除了参与淀粉合成,蔗糖合酶基因在植物的生长代谢和抗逆反应中具有重要作用。由于蔗糖合酶能够提供纤维素合成的底物UDPG,因此在纤维素合成过程中起重要作用。使用种子和纤维特异性启动子抑制棉花蔗糖合酶基因SUS 表达,导致棉纤维起始和延伸受到影响,最终产生基本无棉纤维的棉花种子[3]。蔗糖合酶基因GhSusA1的抑制表达导致纤维长度变短,高表达则增加了纤维长度和强度[4]。番茄中沉默蔗糖合酶基因SUS 导致子叶和叶片形态异常,茎尖分生组织中生长素相关基因的表达和生长素的运输均发生了改变[5]。此外,蔗糖合酶基因还可参与氧胁迫、高温等非生物逆境胁迫过程。在黄瓜中,抑制SUS3 表达增强了黄瓜对缺氧压力的敏感性[6];OsSUS3 基因高表达可降低高温胁迫下水稻种子的白垩程度,从而减轻高温对水稻的危害[7]。
SuSy 的表达受转录因子直接或间接调控。在木薯中,AP2/ERF 家族转录因子MeERF72 直接结合MeSus1 启动子,负向调控其表达水平[8];高表达bHLH 家族转录因子ZmPTF1 导致低磷条件下玉米根中蔗糖合酶基因sh1B 和 sus1 表达下降[9];FLO2 基因发生突变的水稻胚乳中,直链淀粉含量降低,支链淀粉结构发生变化,蔗糖合酶等参与淀粉生物合成的基因表达水平显著降低[10]。马铃薯中含有6 个SuSy 基因[11],其中StSuSy4 在块茎中高表达,是参与块茎淀粉合成的主要蔗糖合酶。为了研究StSuSy4 的转录调控机制,本研究利用酵母单杂交筛库技术筛选可直接与StSuSy4启动子结合的转录因子,研究结果将有助于进一步解析淀粉合成调控的分子基础,也可为高品质马铃薯品种选育提供有益参考。
1 材料与方法
1.1 供试材料
二倍体马铃薯C151 从国际马铃薯研究中心引进。
1.2 试验方法
1.2.1 目的启动子扩增
在马铃薯基因组网站(http://spuddb.uga.edu/)搜索StSuSy4 基因启动子序列,并设计引物(表1)StSuSy4-promoter 进行PCR 扩增,以二倍体马铃薯C151 的DNA 为模板,使用KOD One 酶进行PCR 扩增(体系和程序参照KOD 酶说明书),再将目的片段连接至pTOPO 克隆载体上。
1.2.2 pAbAi-StSuSy4pro 重组质粒构建
设计带有BamH Ⅰ和Hind Ⅲ酶切位点以及保护碱基的引物,用1.2.1 节测序正确的pTOPO克隆载体为模板进行PCR 扩增。将pAbAi 载体进行双酶切,构建重组载体,并转化大肠杆菌;挑选单菌落,使用载体引物pAbAi-R 和pAbAi-StSuSy4pro (表1) 进行阳性鉴定,并将测序正确的菌株进行甘油保存,液氮速冻后保存于−80 ℃冰箱,即得到pAbAi-StSuSy4pro 重组质粒。
1.2.3 pAbAi-StSuSy4pro 诱饵载体菌株构建
(1) pAbAi-StSuSy4pro 重组质粒线性化
37 ℃ 条件下用内切酶BstB Ⅰ线性化pAbAi-StSuSy4pro 重组质粒,对产物进行回收,备用;以未酶切的重组质粒为对照,将酶切产物进行琼脂糖凝胶电泳检测。
(2) pAbAi-StSuSy4pro 诱饵载体菌株构建
取提前制备的Y1HGold 感受态细胞100 μL,将线性化的pAbAi-StSuSy4pro 重组质粒2 μg 转化入感受态中,将转化后的酵母菌涂布于预先配制的SD/-Ura 固体培养基中,于30 ℃ 培养。对酵母单菌落进行PCR 鉴定,以验证pAbAi-StSu-Sy4pro 重组质粒是否整合至酵母细胞基因组中。挑选阳性的诱饵克隆并进行甘油保存,液氮速冻后保存于−80 ℃ 冰箱。
1.2.4 酵母单杂交文库筛选
(1) 建库
取二倍体马铃薯C151 幼嫩薯块约1 cm,送至上海欧易生物医学科技有限公司构建酵母杂交cDNA 文库。
(2) 金担子素(aureobasidin A,AbA) 的背景质量浓度筛选
① 制备酵母感受态细胞。吸取pAbAi-StSu-Sy4pro 酵母菌株至YPDA 液体培养基10 mL 中,30 ℃、200 r/min 摇菌至OD600 值为0.600,并将其分为2 份。其中一份用0.9% NaCl 溶液重悬,使OD600 值为0.002,分别涂布菌液100 μL 于含有0、50、100、150、200 和300 ng/mL AbA 的SD/-Ura 固体培养基上;另一份用于制备酵母感受态。
② 酵母转化。吸取酵母感受态细胞100 μL,将pGADT7-AD 空载转入感受态细胞中,并测定转化后的酵母菌OD600 值;用0.9% NaCl 溶液重悬,使OD600 值为0.002。涂布菌液100 μL 于含有0、50、100、150、200 和300 ng/mL AbA 的SD/-Leu 固体培养基上,静置培养3 d 后观察其生长情况,确定后续筛库所需的AbA 质量浓度。
(3) 酵母单杂交文库筛选
① 初筛。取pAbAi-StSuSy4pro 酵母菌株10 μL于YPDA 培养液3 mL 中,30 ℃、220 r/min 摇床培养, 直至OD600 值为0.600。制备酵母感受态,将酵母文库质粒10 μg 转入该感受态中,取菌液100 μL 进行1/10 和1/100 稀释,并涂布于SD/-Leu 平板,用于计算转化效率;其余菌液涂布于SD/-Leu/AbA150 平板,每块平板150 μL,涂布约20 块,于30 ℃ 恒温培养箱培养3~5 d,长出1~2 mm 单克隆,即完成初筛。
② 复筛。将初筛平板上长出的克隆划线于培养基SD/-Leu/AbA150 上,进行二次筛选。
③ 阳性克隆鉴定。复筛培养基上长出单克隆后,加入1×TE 缓冲液50 μL 中重悬菌体,重悬后的菌体置于98 ℃ 金属浴中5 min 进行破壁,后置于冰上冷却,重复操作3 次,高速瞬时离心,保留上清。使用Vazyme Green Taq Mix 体系,以T7 和3′AD 为引物(表1),对插入到pGADT7 载体中的cDNA 片段进行PCR 扩增(体系和程序参照说明书),挑选阳性产物送至擎科生物科技有限公司,利用T7 引物测序。将测序结果在NCBI网站(http://www.ncbi.nlm.nih.gov) 上比对,将未产生移码突变的序列作为候选基因进行酵母单杂点对点验证试验。
④ 点对点验证。利用天根酵母质粒提取试剂盒提取酵母质粒,将酵母质粒转化至大肠杆菌感受态细胞中扩繁,并重新提取质粒。将酵母质粒转化至pAbAi-StSuSy4pro 酵母感受态细胞,并涂布于SD/-Leu-Ura 培养基,将pGADT7-AD 空载转化到pAbAi-StSuSy4pro 酵母细胞中并作为阴性对照,备用。挑取3 个SD/-Leu-Ura培养基中的菌斑为1 个混样,做3 个生物学重复,在SD/-Leu-Ura 液体培养基中培养12 h,测定OD600 值;吸取菌液50 μL,用灭菌水稀释菌液,使其OD600 值为0.100;分别吸取菌液5 μL 涂布于SD/-Leu、SD/-Leu/AbA100 和SD/-Leu/AbA200 平板上,观察菌斑生长情况。在酵母质粒验证互作后,克隆候选基因StBBX25 的全长再次进行验证。在马铃薯基因组网站中获得StBBX25 CDS 序列,以马铃薯块茎的总RNA 为模板,经反转录得到块茎cDNA;设计分别带有EcoRⅠ和BamHⅠ酶切位点以及保护碱基的特异性引物pGADT7-StBBX25-F 和pGADT7-StBBX25-R (表1),以cDNA 为模板进行PCR扩增(体系和程序参照说明书),将产物进行切胶回收并纯化,连接至线性化的pGADT7 载体上,得到pGADT7-StBBX25重组质粒。将测序正确的重组质粒转化至pAbAi-StSuSy4pro 酵母感受态细胞,并涂布于SD/-Leu-Ura 培养基,30 ℃ 条件下静置培养3 d,将pGADT7 空载转化到pAbAi-St-SuSy4pro 酵母感受态中并作为阴性对照,观察菌斑生长情况,方法同上述酵母质粒。
1.2.5 基因表达模式分析
StBBX25 和StSuSy4 在马铃薯富利亚薯 (S.phureja) 双单倍体材料各组织的FPKM 值参考MASSA 等[12]发表的转录组测序数据。
2 结果与分析
2.1 pAbAi-StSuSy4pro 酵母诱饵的表达载体
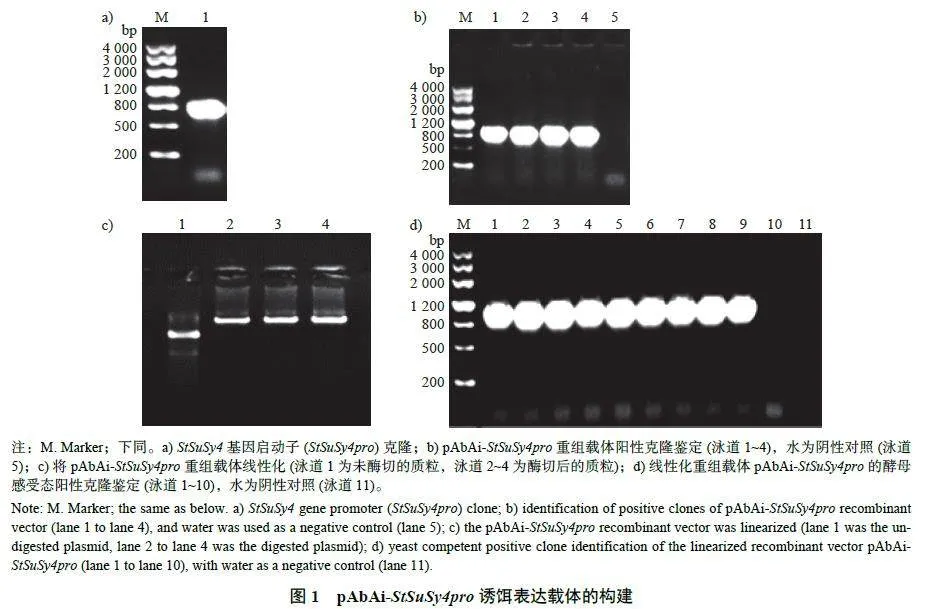
通过PCR 扩增获得800 bp 的启动子条带(图1a)。pAbAi-StSuSy4pro 重组载体阳性菌株鉴定得到大小约为900 bp 的扩增条带(图1b)。将质粒pAbAi-StSuSy4pro 线性化,条带如图1c 所示。携带线性化载体的酵母菌株鉴定得到大小约为1 000 bp 的扩增条带(图1d),表明pAbAi-StSuSy-4pro 酵母诱饵表达载体构建成功。
2.2 AbA 的背景质量浓度
背景质量浓度筛选结果显示:抑制pAbAi-StSuSy4pro 诱饵载体酵母菌株生长的AbA 最小质量浓度为100 ng/mL (图2a);在pGADT7-AD 空载转入的阳性诱饵菌株中发现抑制该酵母生长的AbA 最小质量浓度为150 ng/mL (图2b)。为了充分抑制酵母生长,后续试验采用150 ng/mL AbA。
2.3 酵母单杂交文库筛选结果
复筛后阳性酵母菌株的PCR 鉴定结果显示:条带多集中于500~2 000 bp (图3)。经测序和NCBI预测发现,其中1 个基因为锌指蛋白转录因子,该基因编码StBBX25[13] , 其完整CDS 序列为774 bp,编码258 个氨基酸,N 端含有1 个B-box结构域(图4)。
2.4 酵母单杂点对点互作验证结果
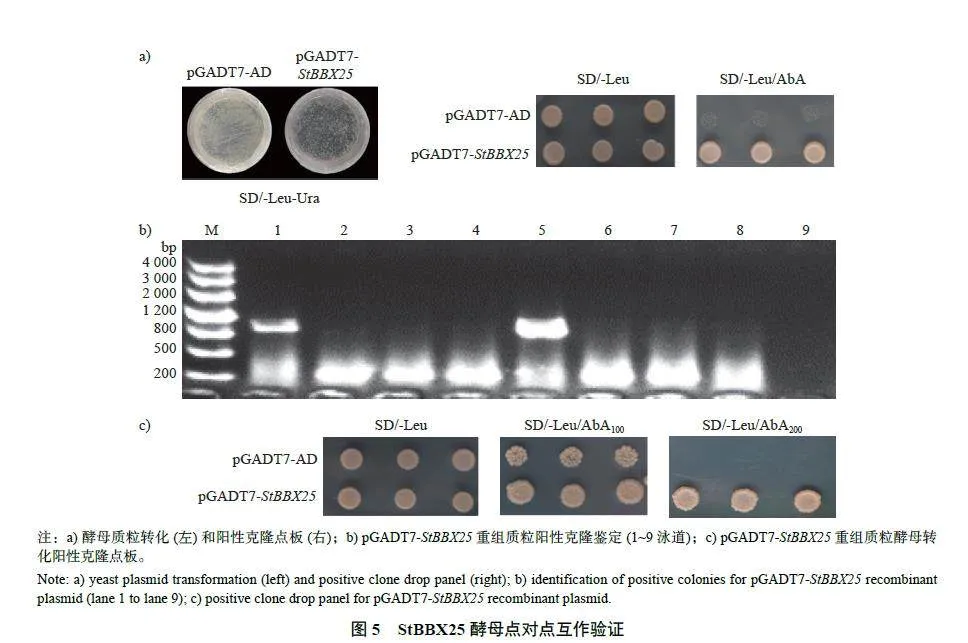
提取到的酵母质粒和pGADT7-AD 空载质粒的诱饵酵母菌株均可在SD/-Leu-Ura 缺陷培养基上正常生长(图5a)。点板验证结果显示:在SD/-Leu/AbA200 培养基上,对照组pGADT7-AD 的酵母无法正常生长,而试验组酵母质粒所对应的酵母细胞可以正常生长,暗示着转录因子StBBX25与StSuSy4 基因启动子之间存在相互作用,从而激活了报告基因AbA 的表达。为进一步验证该基因是否与StSuSy4 启动子有互作关系,克隆候选基因StBBX25 的全长再次进行验证,结果显示重组载体pGADT7-StBBX25 扩增条带约为900 bp(图5b);在SD/-Leu 培养基上,pGADT7-AD 和pGADT7-StBBX25 能正常生长;在SD/-Leu/AbA200培养基上,pGADT7-AD 对应的酵母细胞不能生长,pGADT7-StBBX25 对应的酵母细胞可以正常生长(图5c),由此进一步证明了转录因子StBBX25与StSuSy4 基因启动子存在互作。
2.5 基因的表达模式
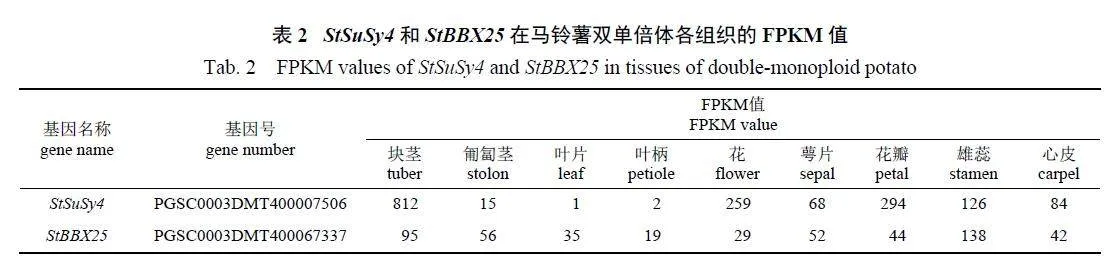
由表2 可知:StSuSy4 在淀粉合成的关键部位块茎中的表达量最高,其次为花瓣和花;StBBX25在雄蕊和块茎中的表达量明显高于其他组织。可见,StBBX25 和StSuSy4 均为在马铃薯块茎中表达量较高的基因,但两者的表达丰度相差约9 倍。
3 讨论
酵母单杂交筛库技术在淀粉合成转录调控因子筛选中的应用报道较少。AJAYO 等[14]以淀粉合成限速酶AGPase 的启动子为诱饵,筛选了玉米胚乳组成的酵母文库,发现ZmTCP7 能够结合AGPase 启动子,并正向调控其表达。本研究通过该技术筛选出与StSuSy4 启动子互作的StBBX25,该蛋白N 端含有1 个B-box 结构域,属于锌指转录因子家族。锌指转录因子是植物中重要的转录因子家族之一,在植物生长发育过程中起着重要的调节作用。B-box 蛋白N 端包含1 个B-box (B-box1) 或2 个B-box 基序(B-box1 和Bbox2),B-box1 的保守序列为CX2CX7-8CX2DXAXLCX2CDX3H,B-box2 的保守序列为CX2CX3PX4CX2CDX3H[15]。BBX 家族在拟南芥中有32 个成员[16],在番茄中有29 个成员[17],在马铃薯中有30 个成员[13]。拟南芥中BBX 蛋白参与控制幼苗光形态发生、光周期调控开花、避荫以及生物和非生物胁迫响应等过程,B-box 基序中的保守残基已被证明在介导蛋白质相互作用和转录调控中至关重要[16]。番茄BBX20 则参与类胡萝卜素的合成,BBX20 与胡萝卜素生物合成途径中的八氢番茄红素合成酶基因PSY1 启动子互作,结合启动子中的G-box,并激活该基因的表达,同时BBX20 与DET1 互作,导致BBX20 受到泛素化降解[18]。在马铃薯中,BBX 家族基因的表达受昼夜节律的调控,同时其表达与黄化、去黄化过程紧密相关[12]。本研究表明:StBBX25 与St-SuSy4 启动子互作,StSuSy4 启动子序列包含典型的G-box 序列CACGTG。结合目前已有对StSuSy4功能的研究,推测StBBX25 可通过与G-box 结合来调控StSuSy4 的表达,进而对马铃薯叶片和块茎中的淀粉合成以及产量形成发挥作用。马铃薯BBX 家族基因的生物学功能知之甚少,因此,StBBX25 的鉴定可为深入理解该家族基因的功能提供思路。
4 结论
本研究构建了淀粉合成关键基因StSuSy4 的启动子载体,筛选了幼嫩块茎组成的酵母文库,发现StBBX25 转录因子结合StSuSy4基因的启动子,并通过酵母单杂点对点试验证明了它们之间存在互作。StBBX25 在马铃薯块茎中的表达量较高,符合其在块茎中发挥转录调控作用的特征。
[ 参考文献 ]
[1]BAROJA-FERNÁNDEZ E, MUÑOZ F J, MONTEROM, et al. Enhancing sucrose synthase activity in transgenicpotato (Solanum tuberosum L.) tubers results in increasedlevels of starch, ADPglucose and UDPglucose and total yield[J]. Plant amp; Cell Physiology, 2009, 50(9):1651. DOI: 10.1093/pcp/pcp108.
[2]LI J, BAROJA-FERNÁNDEZ E, BAHAJI A, et al. Enhancingsucrose synthase activity results in increasedlevels of starch and ADP-glucose in maize (Zea mays L.)seed endosperms[J]. Plant amp; Cell Physiolgy, 2013, 54(2):282. DOI: 10.1093/pcp/pcs180.
[3]RUAN Y L, LLEWELLYN D J, FURBANK R T, et al.Suppression of sucrose synthase gene expression repressescotton fiber cell initiation, elongation, and seeddevelopment[J]. Plant Cell, 2003, 15(4): 952. DOI: 10.1105/tpc.010108.
[4]JIANG Y J, GUO W Z, ZHU H Y, et al. Overexpressionof GhSusA1 increases plant biomass and improves cottonfiber yield and quality[J]. Plant Biotechnology Journal,2012, 10(3): 301. DOI: 10.1111/j.1467-7652.2011.00662.
[5] GOREN S, LUGASSI N, STEIN O, et al. Suppression of sucrose synthase affects auxin signaling and leaf morphologyin tomato[J]. PLoS One, 2017, 12(8): e0182334.DOI: 10.1371/journal.pone.0182334.
[6]WANG H Y, SUI X L, GUO J J, et al. Antisense suppressionof cucumber (Cucumis sativus L.) sucrose synthase3 (CsSUS3) reduces hypoxic stress tolerance[J].Plant, Cell amp; Environment, 2014, 37(3): 795. DOI: 10.1111/pce.12200.
[7]TAKEHARA K, MURATA K, YAMAGUCHI T, et al.Thermo-responsive allele of sucrose synthase 3 (Sus3)provides high-temperature tolerance during the ripeningstage in rice (Oryza sativa L.)[J]. Breeding Science, 2018,68(3): 336. DOI: 10.1270/jsbbs.18007.
[8]LIU C, CHEN X, MA P A, et al. Ethylene responsivefactor MeERF72 negatively regulates sucrose synthase 1gene in cassava[J]. International Journal of MolecularSciences, 2018, 19(5): 1281. DOI: 10.3390/ijms19051281.
[9]LI Z X, GAO Q, LIU Y Z, et al. Overexpression of transcriptionfactor ZmPTF1 improves low phosphate toleranceof maize by regulating carbon metabolism and rootgrowth[J]. Planta, 2011, 233(6): 1129. DOI: 10.1007/s00425-011-1368-1.
[10]SHE K C, KUSANO H, KOIZUMI K, et al. A novelfactor FLOURY ENDOSPERM2 is involved in regulationof rice grain size and starch quality[J]. Plant Cell,2010, 22(10): 3280. DOI: 10.1105/tpc.109.070821.
[11]VAN HARSSELAAR J K, LORENZ J, SENNING M,et al. Genome-wide analysis of starch metabolism genesin potato (Solanum tuberosum L.)[J]. BMC Genomics,2017, 18(1): 37. DOI: 10.1186/s12864-016-3381-z.
[12]MASSA A N, CHILDS K L, LIN H N, et al. The transcriptomeof the reference potato genome Solanum tuberosumGroup Phureja clone DM1-3 516R44[J]. PLoS One, 2011, 6(10): e26801. DOI: 10.1371/journal.pone.0026801.
[13]TALAR U, KIEŁBOWICZ-MATUK A, CZARNECKAJ, et al. Genome-wide survey of B-box proteins in potato(Solanum tuberosum L.): identification, characterizationand expression patterns during diurnal cycle, etiolationand de-etiolation[J]. PLoS One, 2017, 12(5): e0177471.DOI: 10.1371/journal.pone.0177471.
[14]AJAYO B S, LI Y P, WANG Y Y, et al. The novelZmTCP7 transcription factor targets AGPase-encodinggene ZmBt2 to regulate storage starch accumulation inmaize[J]. Frontiers in Plant Science, 2022, 13: 943050.DOI: 10.3389/fpls.2022.943050.
[15]CROCCO C D, BOTTO J F. BBX proteins in greenplants: insights into their evolution, structure, featureand functional diversification[J]. Gene, 2013, 531(10): 44.DOI: 10.1016/j.gene.2013.08.037.
[16]GANGAPPA S N, BOTTO J F. The BBX family of planttranscription factors[J]. Trends in Plant Science, 2014,19(7): 460. DOI: 10.1016/j.tplants.2014.01.010.
[17]CHU Z N, WANG X, LI Y, et al. Genomic organization,phylogenetic and expression analysis of the B-BOX genefamily in tomato[J]. Frontiers in Plant Science, 2016, 7:1552. DOI: 10.3389/fpls.2016.01552.
[18]XIONG C, LUO D, LIN A H, et al. A tomato B-box proteinSlBBX20 modulates carotenoid biosynthesis bydirectly activating PHYTOENE SYNTHASE 1, and istargeted for 26S proteasome-mediated degradation tomato[J]. New Phytologist, 2019, 221(1): 279. DOI: 10.1111/nph.15373.
责任编辑:何謦成
基金项目:国家自然科学基金地区科学基金(32360756);云南省院士工作站(202105AF150028)。

