葡萄褐纹病菌侵染过程的细胞学特性研究
李杰 陈浩宇 郝敬喆 钟海霞 张付春 伍新宇 范咏梅
doi:10.7606/j.issn.1004-1389.2024.07.021
https://doi.org/10.7606/j.issn.1004-1389.2024.07.021
收稿日期:2022-12-12 修回日期:2023-03-13
基金项目:中央财政林草科技推广示范项目(新[2024]TG14号);新疆维吾尔自治区科技支疆计划(2022E02073);新疆维吾尔自治区公益性科研院所基本科研业务经费(KY2022041)。
第一作者:李 杰,女,博士,从事果树病虫害及防控技术研究。E-mail:278392684@qq.com
通信作者:郝敬喆,男,研究员,从事果树病虫害及防控技术研究。E-mail:urmqhjz@qq.com
范咏梅,女,教授,从事农药环境毒理学与害虫生物防治研究。E-mail:1013310970@qq.com
摘 要 为明确褐纹病菌侵染葡萄叶片的过程,采用光学显微镜、扫描电镜和透射电镜等技术手段,系统研究了葡萄褐纹病菌在‘无核白和‘克瑞森无核葡萄叶片上的侵染过程。结果表明:葡萄褐纹菌分生孢子在‘无核白‘克瑞森无核葡萄叶片接种1 d后均可萌发;后期发育过程,‘克瑞森无核葡萄叶片上菌丝细长,生长停滞;‘无核白葡萄叶片表面初生菌丝密布,持续在寄主体表生长扩展;接种3 d,‘无核白葡萄叶片的表面形成了密集的菌丝网,同时观察到菌丝从气孔或直接入侵方式进入叶片表皮组织内部,随后,菌丝以胞间和胞内生长的方式扩展;接种6 d,菌丝达到上表皮,随菌丝在叶片组织内不断地生长扩展,使得寄主细胞坏死、解体。可见:‘无核白是亲和葡萄褐纹病菌品种,而‘克瑞森无核葡萄非亲和褐纹病菌。
关键词 葡萄褐纹菌;‘无核白;克瑞森无核;侵染过程;细胞学研究
葡萄(Vitis vinifera L.)属于葡萄科(Vitaceae)多年生温带水果之一,因其独特的风味和营养价值而享誉世界[1]。据报道,中国、意大利、美国、法国和西班牙是栽培葡萄最多的国家[2]。
葡萄褐纹病Scolecotrichum vitiphyllum (Spesch.) Varak.et Vassil.(=Coryneum vitiphyllum Spesch.)是中国葡萄上发生的一种新病害,该病菌属于半知菌类,暗梗孢科双孢亚科,束梗单隔霉属,菌丝体在寄主细胞间蔓延,直至长满整个寄主,引起寄主生长停滞,进而导致产量和品质下降,对经济效益产生影响。Спешнев于1901年首次报道了葡萄褐纹病致病菌,1950年Вacилъeвcкий和Kapaкyлин记载了该病原菌的形态,到1953年和1958年κазенасу和Бызова报道该病原菌在哈萨克斯坦和乌兹别克斯坦危害葡萄[3]。新疆最早于2007年记载此病在吐鲁番地区发生,此后其在新疆阿克苏、喀什及和田等传统葡萄栽培区被发现[4]。
葡萄褐纹病主要危害葡萄叶片,在叶片正面初期为黄色不明显的病斑,后形成褐色斑点,周围有褪绿的淡绿色至黄色晕圈,后期呈褐色圆形或近圆形斑点。叶背面形成褐色至黒褐色圆形病斑,病斑边缘明显,周围有黄色晕圈,病斑表面有许多颗粒物,呈明显突起状,为病原菌成簇的分生孢子梗,病斑直径0.3~1.1 cm,病斑散生或多斑愈合,严重时可造成叶片枯黄脱落[4]。
目前,葡萄褐纹病病原菌侵染过程的显微观察尚缺乏报道。为此,本研究通过光学显微镜和扫描电镜、透射电镜技术对葡萄褐纹病菌侵染‘无核白和‘克瑞森无核葡萄叶片的过程进行观察,旨在明确其在葡萄叶片表面上的发生、发展过程,为研究病原菌与无核葡萄感病和抗病品种间互作关系,为葡萄抗病品种选育提供参考。
1 材料与方法
1.1 试验材料
试验材料采自新疆吐鲁番葡萄研究所实验基地葡萄园,品种选取‘无核白和‘克瑞森无核,试验材料为‘无核白和‘克瑞森无核葡萄上无病虫害的新叶。
1.2 病原接种与组织取样
选取葡萄1 a生枝条上尚未完全展开的新叶,用自封口保鲜袋将其套入袋内。用无菌水将发病叶片上的单菌落孢子洗脱,配制成数量浓度为108 mL-1的孢子悬浮液。用液滴法取配好的悬浮液接种于新鲜葡萄叶片背面,分别于接种后1 d、2 d、3 d、4 d、5 d、6 d取样,无菌水为空白对照,3个生物学重复。
1.3 葡萄褐纹病菌丝及分生孢子形态观测
参照朱书生等[5]介绍的曲利苯兰染色法进行,观察时以水为浮载剂,将叶盘背面朝上放置在载玻片上,在光学显微镜下观察葡萄褐纹病菌各生长发育阶段菌丝及分生孢子形态。参照朱红惠等[6]的方法测量菌丝长度和宽度。每次分别测定30个孢子,求其平均值。
1.4 扫描电镜样品制备
参照刘佳[7]的方法进行样品制备与观察。每个时间点取3片葡萄新叶,将叶片剪成0.5 cm×0.5 cm小块,浸泡在4%戊二醛溶液中4 ℃保存过夜,经梯度脱水后,叔丁醇置换3次。经真空镀膜后,扫描电镜观察孢子侵入前的行为,并拍照 记录。
1.5 透射电镜样品制备
参照张啸等[8]的方法进行样品的制备与观察。每个时间点取3片葡萄新叶,将叶片剪成 0.1 cm×0.2 cm小块,戊二醛溶液固定及磷酸缓冲液清洗,清洗之后用1%锇酸溶液固定,再经乙醇梯度脱水处理,然后用LR-White树脂胶包埋。样品超薄切片经醋酸铀和柠檬酸铅染色后进行透射电镜观察并拍照记录。
1.6 数据处理
采用IBM SPSS 21.0对数据进行统计分析,数据以“平均数±标准差”表示,采用LSD检验和Duncan氏检验进行差异显著性分析。
2 结果与分析
2.1 不同接种时间葡萄褐纹病菌丝及分生孢子形态观察
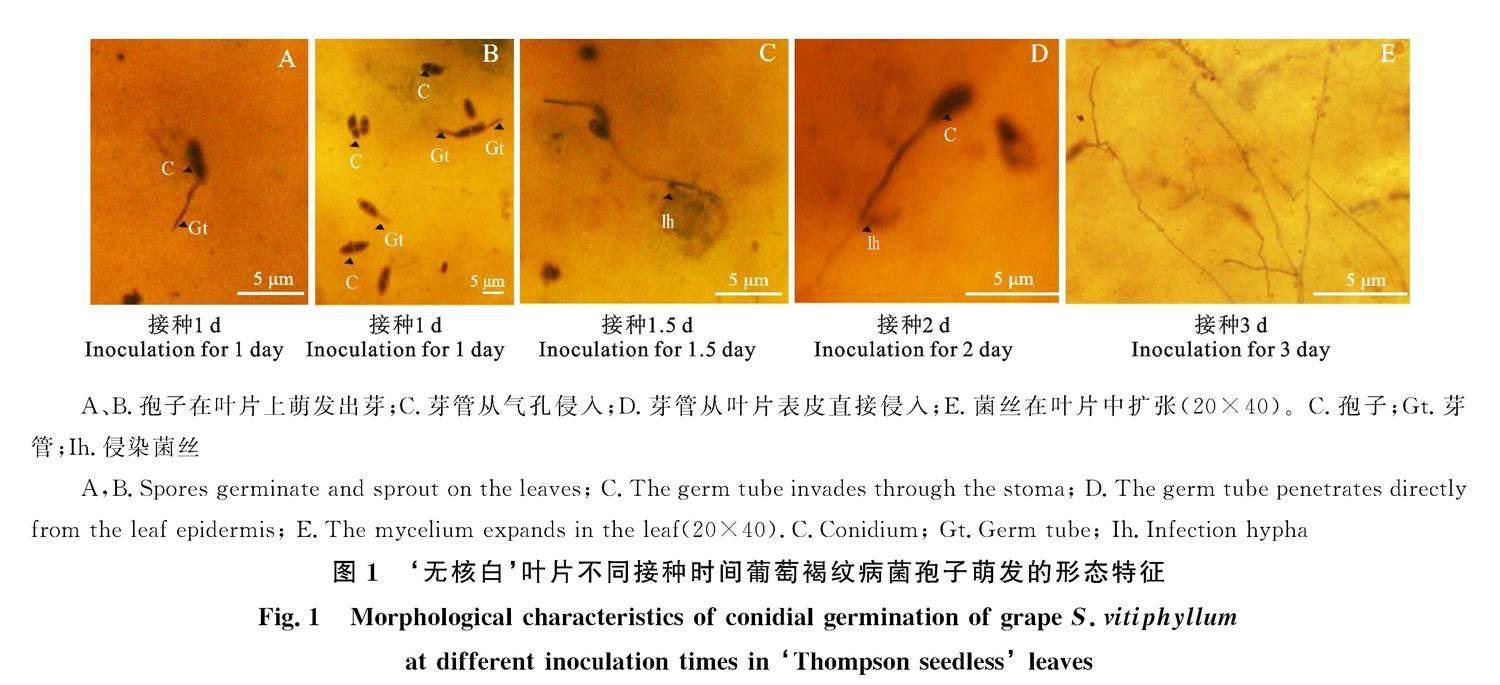
从显微结构观察可以看出,接种后1 d,分生孢子在‘无核白葡萄叶片上开始萌发,出芽,并且从分生孢子的一端产生芽管,一般1个孢子萌发后只产生1个芽管(图1-A),但也有少数孢子萌发后产生2个芽管(图1-B)。随着接种时间的延长,芽管继续伸长并在叶表面自由伸展,遇到合适的气孔,即从气孔侵入(图1-C)。接种后2 d,多数芽管侵入后,初生菌丝向叶肉细胞生长,侵染菌丝在细胞间发生分枝,产生次生侵染菌(图1-D),芽管从叶片表皮直接侵入或者从气孔侵入。接种3 d后,叶片表面的菌丝分化产生出特异性侵染菌丝。侵染菌丝入侵发生在寄主表皮细胞交界处,并且病菌菌丝沿相邻2个表皮细胞间的中胶层向内生长扩展(图1-E)。
2.2 不同寄主叶片上菌丝芽管长度和宽度的 比较
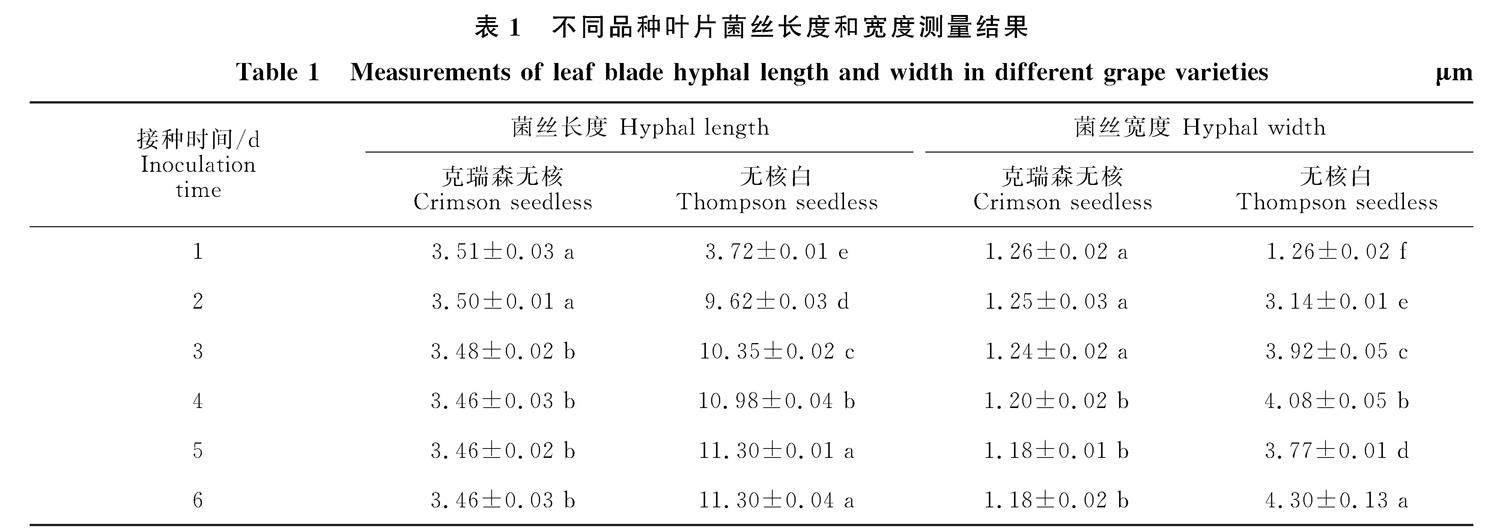
接种1 d后,病原菌在‘克瑞森无核和‘无核白葡萄叶片上均能萌发,形成初生菌丝,基本无次生菌丝产生,两种葡萄上菌丝的长度和宽度差异不显著。随着菌丝在不同寄主上生长,接种2 d后,‘无核白葡萄叶片上产生的菌丝长度和宽度开始快速增长,增长率分别为61.33%和 59.87%,与接种第1天具有显著性差异;‘克瑞森无核叶片上菌丝变细、变短,低于接种第1天观测到的结果,生长出现停滞现象。接种3 d和4 d后,观测到‘无核白叶片上菌丝长度分别是接种第1天的2.78倍和2.95倍,菌丝宽度分别是接种第1天的3.11倍和3.23倍;‘克瑞森无核叶片上菌丝的长度和宽度持续萎缩。接种5 d后,‘无核白叶片上菌丝长度达到11.30 μm,宽度为3.77 μm,与接种第1天均具有显著性差异。接种6 d后,‘无核白葡萄叶片上菌丝长度和宽度分别比接种第1天增加67.08%和70.70%,具有显著性差异(表1);而‘克瑞森无核菌丝变得稀疏,部分菌丝脱落,在后期没有显著性差异。由此可知,‘克瑞森无核与葡萄褐纹病菌孢子亲和性低,表现抗侵染特性,‘无核白与褐纹病原菌亲和性显著,表现易感葡萄褐纹病。
2.3 葡萄褐纹病菌侵染途径的扫描电镜观察
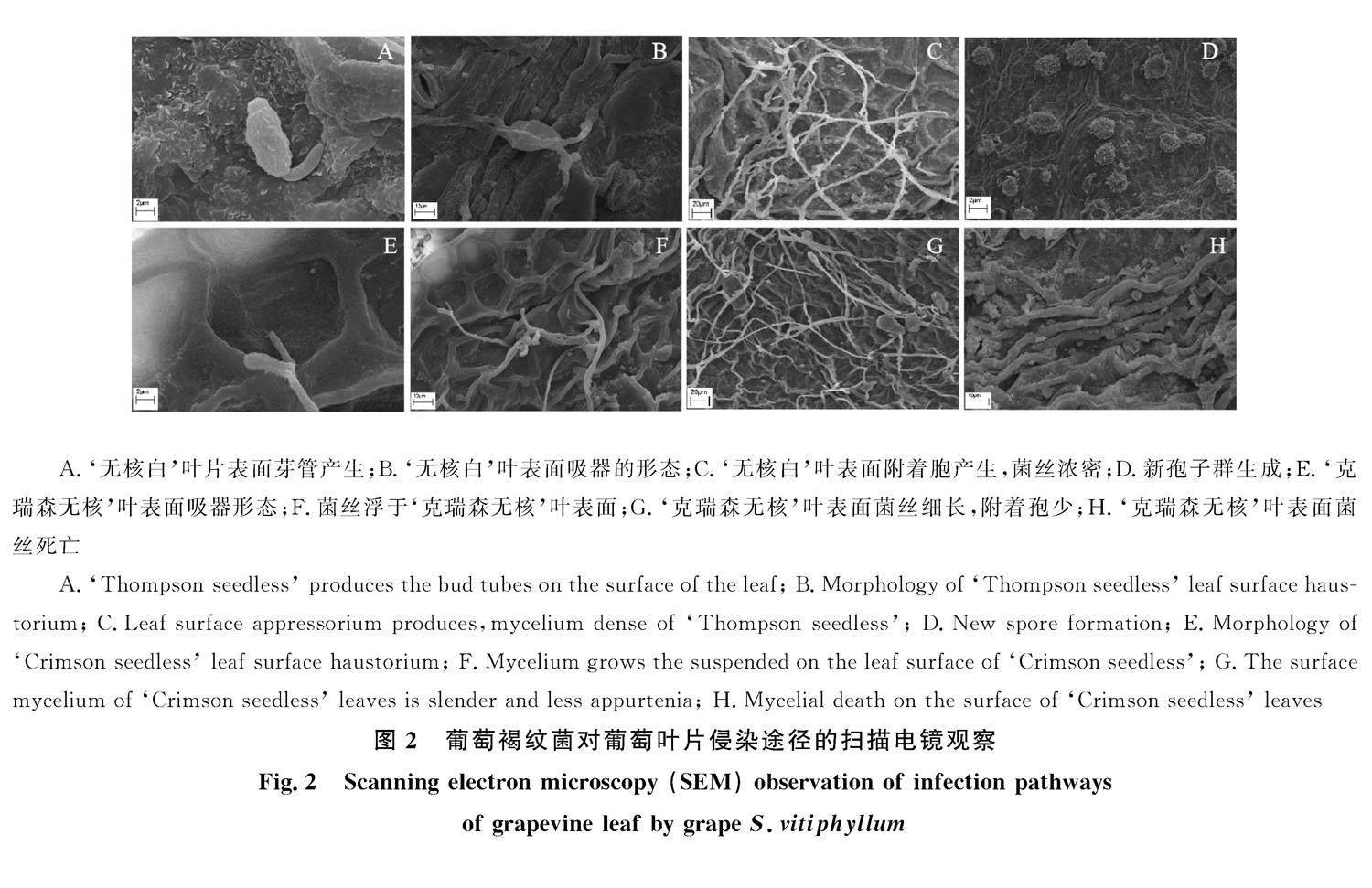
继光学显微检测后开展扫描电镜观测接种叶片表面病原菌分生孢子侵染发育情况。发现接种1 d后,在‘克瑞森无核和‘无核白叶片上病原菌分生孢子均能萌发,每个分生孢子产生1~2个芽管,新形成的芽管并不直接侵入而在寄主叶片表面扩展,‘无核白叶片上病菌分生孢子的生长强壮,‘克瑞森无核接种孢子芽管弱小纤细,发育表现出明显的差异(图2-A、2-E)。
葡萄褐纹病菌孢子在‘无核白葡萄叶片表面萌发,产生芽管,芽管在葡萄叶片表面扩张,直接由芽管顶端侵入叶片角质层,或趋向气孔,并在其上方形成膨大的附着胞从气孔伸入叶片组织内(图2-B)。葡萄褐纹病菌菌丝在寄主‘无核白叶片表面扩张,菌丝厚密,菌丝表面的附着胞宽大紧密附着于叶片表面(图2-C)。随着病菌的生长、繁殖,形成新的产孢机构—子座,子座突破寄主—‘无核白表面,形成新的分生孢子梗和分生孢子,新孢子不断生成,完成病原菌孢子的一个世代(图2-D)。
从图2-F可以看到,葡萄褐纹病菌侵染‘克瑞森无核后,吸器在叶片表面呈菌丝状分布,瘦弱、细长,菌丝浮于‘克瑞森无核叶片表面。随着接种时间的延长,病菌在寄主‘克瑞森无核叶片表面扩张的菌丝细小、稀疏,菌丝表面附着胞数量少(图2-G)。病原菌菌丝不能成功侵入叶片组织,菌丝体脱落(图2-H)。
2.4 葡萄褐纹病菌侵染‘无核白葡萄叶片的透射电镜观察
通过扫描电镜观察到葡萄褐纹病菌在葡萄叶片表面的侵染动态,为了进一步明确此病菌侵染叶片内部导致叶片枯黄脱落的过程,对此病菌侵染‘无核白葡萄叶片的过程进行了透射电镜观察。通过透射电镜观察,葡萄褐纹病菌在‘无核白葡萄叶片上生长(图3-A,3-a),此时,菌丝主要分布在寄主的细胞间隙,寄主细胞保持完整。随着病原菌菌丝的生长,黑色的菌丝在叶片组织细胞间、细胞壁和液泡等细胞器之间扩展(图3-B,3-b)。随着病原菌的持续生长与侵入,病菌菌丝自胞间穿透细胞壁和细胞膜,菌丝在叶片组织中从胞间向胞内扩展(图3-C,3-c),菌丝进入细胞器。葡萄褐纹病菌在‘无核白葡萄叶片上持续侵染,细胞内菌丝生长、扩展,菌丝布满细胞,导致‘无核白叶片正面细胞消解,背面细胞器崩溃(图3-D,3-d)。
3 讨论与结论
本研究通过光学和扫描电子显微镜观察葡萄褐纹病原菌侵染‘无核白葡萄叶片可以看到,病原菌孢子在寄主‘无核白葡萄叶片表面萌发后形成芽管和附着胞,菌丝在叶片匍匐生长,最终病原菌从气孔或角质层直接侵入叶片内部。
而‘克瑞森无核在接种初期孢子虽然能萌发,随即菌丝变得细长、稀疏,不能正常侵入叶片组织中。透射电镜观察葡萄褐纹病菌在‘无核白葡萄叶片中的扩展途径,开始菌丝游走细胞间隙,寄主细胞保持完整,黑色的菌丝在叶片组织细胞间和细胞壁之间扩展。随时间推移,病菌菌丝自胞间穿透细胞壁和细胞膜,进入细胞器。最后菌丝布满细胞,导致‘无核白叶片正面细胞消解,背面细胞器崩溃。前人研究发现不同发育阶段的表达存在不同侵染路线[9-13]。
葡萄褐纹病原菌侵染‘无核白葡萄叶片表现在萌发后形成芽管和附着胞等,菌丝在叶片匍匐生长,而后病原菌从气孔或角质层直接侵入叶片内部。
与高启帆等[14]报道的黄瓜接种白粉菌孢子3 d后产生宽大的入侵菌丝以直接侵入或通过气孔侵入寄主组织体内一致。另外研究白粉病菌在抗病和感病葡萄叶片上的侵染过程,表现出菌丝和分生孢子能成功附着在感病和抗病植株的叶片表面,并且随着接种后时间的延长,感病葡萄叶片表现出白粉症状,抗病葡萄叶片不表现白粉症状[15]。相比较,张晓林等[16]认为胶孢炭疽病侵染过程中孢子分别在4 h和8 h开始出现萌发并形成附着胞, 12 h成熟后形成侵染钉。周扬[17]研究了桃疮痂病菌侵染桃叶片,直接形成侵入钉、附着胞等,促进定殖,但很少观察到通过气孔侵入。本研究与上述两种病原菌侵入方式均不相同,可能是由于胶孢炭疽菌和桃疮痂病菌是半活体营养型真菌,葡萄褐纹病菌为活体营养型真菌,存在不同的侵染类型涉及不同的侵染过程和侵染机制所致。郝雅琼等[18]认为栗疫病菌进入枝条内部是通过伤口进入,健康无伤口的枝条并不被病菌侵染。本研究中未观察到伤口侵染现象。
寄生菌侵入过程表现出亲和性[19]。病原菌菌丝在‘无核白葡萄叶片上任意延长扩展、繁殖,而‘克瑞森无核在接种初期孢子虽然能萌发,随即菌丝变得细长、稀疏,不能正常侵入叶片组织中。说明‘无核白对葡萄褐纹病菌亲和,‘克瑞森无核对葡萄褐纹病菌不亲和的差异性。叶片表面的蜡质层是植物叶片抵御生物危害的第一道屏障[20],‘克瑞森无核葡萄叶片的外表面有较厚的蜡质层,蜡质的存在可能对菌丝的生长扩展具有抑制作用。‘无核白葡萄叶片外表面蜡质层较薄,这也可能是‘无核白葡萄叶片更容易被侵染的原因之一。
通过对葡萄褐纹病菌侵染过程的细胞学观察,明确了该病菌在抗、感病葡萄叶片中的侵染方式与扩展途径,填补了现有文献关于葡萄褐纹病研究的空缺。还需进一步研究环境因子、营养物质等对病菌菌丝生长及产孢的影响,结合生理指标与表型性状观测,完善该病的侵染过程,明确亲和侵染依据。此外,葡萄褐纹病菌在侵染葡萄叶片的过程中,葡萄叶片组织内发生了一系列病理变化,包括寄主细胞器的肿胀解体和细胞壁的坍塌破裂等,这些寄主细胞病理变化可能与病菌在侵染扩展过程中产生的酶和毒素有关,关于这一方面的工作将作进一步研究。
本研究从组织学和细胞学水平观察鉴定出葡萄褐纹病亲和、非亲和品种,为葡萄褐纹病抗病品种选育提供了理论依据。
参考文献 Reference:
[1]
CHEN Y,LI Y,WEI H,et al.Inhibition efficiency of wood vinegar on grey mould of table grapes [J].Food Bioscience,2020,38:100755.
[2]CUI H,ABDEL SAMIE M A S,LIN L.Novel packaging systems in grape storage—A review [J].Journal of Food Process Engineering,2019,42(6):e13162.
[3] ШВΑРЦМАН СР,ВΑСЯΓИНΑ М Π,БЫЗОΒΑЗ М,et al.ΒИНОГРΑДОΒЫЕ-VI TACEAE ΒИНОГРΑД-VI TIS L 1753[M].ФЛОРΑ СΠΟРΟΒЫХ РΑСТЕΗИЙ ΚΑЗΑΧСТΑНΑ,ТОМ Ⅷ,ΑЛМΑ-ΑΤΑ.1975.
[4]范咏梅,郝敬哲,张明智,等.新疆葡萄褐纹病病原鉴定及症状识别[J].植物保护,2007,33(3):140-142.
FAN Y M,HAO J ZH,ZHANG M ZH,et al.Identification of pathogen causing grape Phomopsis vexans and its symptoms [J].Plant Protection.2007,33(3):140-142.
[5]朱书生,刘西莉,刘鹏飞,等.6种染色方法对黄瓜霜霉病菌不同发育阶段的染色效果比较[J].植物病理学报,2006,36(1):86-90.
ZHU SH SH,LIU X L,LIU P F,et al.Comparison of six staining techniques for studying life cycle of Pseudoperonospora cubensis[J].Acta Phytopathologica Sinica,2006,36(1):86-90.
[6]朱红惠,姚 青,龙良坤,等.不同氮形态对AM真菌孢子萌发和菌丝生长的影响[J].菌物学报,2004,23(4):590-595.
ZHU H H,YAO Q,LONG L K,et al.Influence of different N forms on spore germination and hyphal growth of AM fungus [J].Mycosystema,2004,23(4):590-595.
[7]刘 佳.棉盲蝽抗药性监测及白僵菌和绿僵菌对其的毒杀作用[D].南京:南京农业大学,2015.
LIU J.Resistance monitoring of mirid bugs and pathogenicity of Beauveria bassiana and Metarhizium anisopliae to mirid bugs [D].Nanjing:Nanjing Agricultural University,2015.
[8]张 啸,刘 佳,杨亦桦,等.球孢白僵菌侵染中黑盲蝽致病过程的电镜观察[J].应用昆虫学报,2021,58(5):1190-1198.
ZHANG X,LIU J,YANG Y H,et al.Electron microscopic observation of infection of Adelphocoris suturalis by Beauveria bassiana [J].Chinese Journal of Applied Entomology,2021,58(5):1190-1198.
[9] 陈姗姗,宋述尧,赵春波,等.茄子褐纹病抗性与果皮超微结构的关系[J].西北农林科技大学学报(自然科学版),2016,44(9):143-150.
CHEN SH SH,SONG SH Y,ZHAO CH B,et al.Relationship between Phomopsis vexans resistance and pericarp ultra-structure of eggplant [J].Journal of Northwest A&F University(Natural Science Edition),2016,44(9):143-150.
[10] 田 凯,张连宽,熊美东,等.基于叶片病斑特征的茄子褐纹病识别方法[J].农业工程学报,2016,32(S1):184-189.
TIAN K,ZHANG L K,XIONG M D,et al.Recognition of Phomopsis vexans in Solanum melongena based on leaf disease spot features [J].Transactions of the Chinese Society of Agricultural Engineering,2016,32(S1):184-189.
[11]王 杰,沈雪梅,刘 丹,等.四川省红叶石楠炭疽病病原菌鉴定及其潜在侵染源测定[J].植物保护学报,2020,47(3):637-646.
WANG J,SHEN X M,LIU D,et al. Identification of the pathogens causing anthracnose and determination of the potential infection source of Photinia fraseri in Sichuan province [J].Journal of Plant Protection,2020,47(3):637-646.
[12]陈孝仁,程保平,王新乐,等.利用绿色荧光蛋白研究大豆疫霉与大豆的互作[J].科学通报,2009,54(13):1894-1901.
CHEN X R,CHENG B P,WANG X L,et al. Green fluorescent protein (GFP) as a vital marker for studying the interaction of Phytophthora sojae and soybean [J].Chinese Science Bulletin,2009,54(13):1894-1901.
[13]刘劲哲,樊永强,王彦辉,等.豌豆褐纹病基腐病枯萎病芽枯病研究[J].青海农林科技,2021,123(3):94-96.
LIU J ZH,FAN Y Q,WANG Y H,et al.Study on brown stripe,basal rot,Fusarium wilt and bud blight of pea [J].Science and Technology of Qinghai Agriculture,2021,123(3):94-96.
[14]高启帆,孙敬贤,王 刚,等.黄瓜白粉病菌在不同抗性黄瓜材料上的侵染过程[J].植物保护,2021,47(2):28-36.
GAO Q F,SUN J X,WANG G,et al.The infection process of Sphaerotheca fuliginea on different resistant cucumber materials [J].Plant Protection,2021,47(2):28-36.
[15]张军科,罗世杏,李小伟,等.白粉菌在不同抗病性葡萄叶片上的侵染过程比较[J].西北农林科技大学学报(自然科学版),2008,36(3):161-165,170.
ZHANG J K,LUO SH X,LI X W,et al.Comparisons on the Uncinula necator invasion procedureof resistant and susceptible grapes [J].Journal of Northwest A&F University(Natural Science Edition),2008,36(3):161-165,170.
[16]张晓林,张俊娥,贺璞慧中,等.胶孢炭疽菌侵染杨树叶片的组织病理学研究[J].北京林业大学学报,2018,40(3):101-109.
ZHANG X L,ZHANG J E,HE-PU H ZH,et al.Histopathology study of poplar leaves infected by Colletotrichum gloeosporioides [J].Journal of Beijing Forestry University,2018,40(3):101-109.
[17]周 扬.中国桃疮痂病菌遗传多样性、侵染过程、抗药性及早期检测技术研究[D].武汉.华中农业大学,2021.
ZHOU Y.Studies on genetic diversity,infection process,fungicide resistance and early detection of Venturia carpophila in China [D].Wuhan:Huazhong Agricultural University,2021.
[18]郝雅琼,刘红星,王泽华,等.栗疫病菌侵染板栗枝条的显微观察[J].植物保护,2022,48(1):179-184,203.
HAO Y Q,LIU H X,WANG Z H,et al.Microscopic observation on infection process of chestnut branches by Cryphonectria parasitica [J].Plant Protection,2022, 48(1):179-184,203.
[19]徐 燃,贺 红,邓素坚,等.青枯菌侵染广藿香的组织病理学研究[J].广州中医药大学学报,2013,30(2):236-239,287-288.
XU R,HE H,DENG S J,et al.Histopathological study of Pogostemon cablin (Blanco) Benth. infected with Ralstonia solanacearum [J].Journal of Guangzhou University of Traditional Chinese Medicine,2013,30(2):236-239,287-288.
[20]杨贵兵,韩 健,李文星,等.柑橘溃疡病菌的侵染过程及噻森铜对溃疡病的防治效果[J].植物保护学报,2021,48(2):322-331.
YANG G B,HAN J,LI W X,et al.Infection process of Xanthomonas citri subsp.citri and the control effects of thiosen copper to citrus canker [J].Journal of Plant Protection,2021,48(2):322-331.
Immune and Pathogenesis Responses of Grape to Scolecotrichum vitiphyllum Infection
LI Jie1,CHEN Haoyu1,HAO Jingzhe1,ZHONG Haixia2,
ZHANG Fuchun2,WU Xinyu2 and FAN Yongmei3
(1.Institute of Plant Protection,Xinjiang Academy of Agricultural Sciences,Urumqi 830091,China;
2.Institute of Horticultural Crops,Xinjiang Academy of Agricultural Sciences,Urumqi 830091,China;
3.College of Plant Protection,Hainan University,Haikou 570228,China)
Abstract To understand the process by which grape brown stripe disease infects grape leaves,a combination of optical microscope,scanning electron microscopy,and transmission electron microscopy was used to systematically explore the grape Scolecotrichum vitiphyllum in the infection process of ‘Thompson seedless and ‘Crimson seedless grape leaves.The results showed that after one-day inoculation,conidia could germinate both on ‘Thompson seedless and ‘Crimson seedless grape leaves.In the later stage of development,the hyphae on the leaves of ‘Crisson seedless grape were slender and stagnant.Primary mycelia on ‘Thompson seedless grape leaves began to show symptoms and continued to grow and expand on the host surface.After three days of inoculation,a dense mycelium network was formed on the surface of ‘Thompson seedless grape leaves,and it was observed that primary mycelia produced invading mycelia,which entered into the lower epidermal tissue of the leaves from the stomata or in a direct invasion way.Subsequently,mycelia expanded in a way of intercellular and endocellular growth.After six days of inoculation,the mycelia reached the upper epidermis and continued to grow and expand with the mycelia in the leaf tissue,resulting in necrosis and disintegration of the host cells.These results indicated that ‘Thompson seedless grape was susceptible to grape brown stripe disease,whereas the ‘Crimson seedless grapes exhibit incompatibility.
Key words Grape Scolecotrichum vitiphyllum; Thompson seedless; Crimson seedless; Infection process; Cytological studies
Received 2022-12-12 Returned 2023-03-13
Foundation item Central Finance Forest and Grass Science and Technology Demonstration Project(No.Xin[2024]TG14);Autonomous Region Science and Technology Branch Xinjiang Project(No.2022E02073);the Basic Research Business Funding Support Project for Autonomous Region Public Welfare Research Institutes (No.KY2022041).
First author LI Jie,female,Ph.D.Research area:fruit diseases and insect pests and control.E-mail:278392684@qq.com
Corresponding author HAO Jingzhe,male,research fellow.Research area:fruit diseases and insect pests and control.E-mail:urmqhjz@qq.com
FAN Yongmei,female,professor.Research area:environmental oxicology of pesticides and biological pest control.E-mail:1013310970@qq.com
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)

