参苓健脾胃颗粒对利血平诱导的脾虚型大鼠消化、吸收的影响
宋玲 李晗 高云航 陈腾飞 侯红平 彭博 叶祖光 张广平


*基金项目:中国中医科学院中药研究所中药药理创新团队项目(CI2021B015);中国中医科学院科技创新工程重大攻关项目(CI2021A04615)
第一作者简介:宋玲(1987-),女,助理研究员,硕士,研究方向:中药药理。
△通信作者:张广平,E-mail:gpzhang@sina.com
摘要:目的 探讨参苓健脾胃颗粒对利血平诱导的脾虚型大鼠消化、吸收、葡萄糖转运、能量代谢及蛋白激酶的影响。方法 采用利血平复制脾虚大鼠模型,将60只大鼠随机分为空白组、模型组、参苓健脾胃颗粒低(0.45 g/kg)、中(0.9 g/kg)和高剂量组(1.8 g/kg),每组12只,大鼠造模14 d后连续灌胃给药14 d,实验期间观察并记录一般状态及体重,通过观察大鼠小肠黏膜组织显微结构,检测尿D-木糖排泄率、血清生化指标、胰蛋白酶、脂肪酶与淀粉酶活性及葡萄糖吸收量,考察小肠黏膜SGLT1和GLUT2、Na+-K+-ATPase和PKC-β-II的mRNA转录水平。结果 与空白组大鼠相比,利血平诱导的脾虚型组大鼠出现行动迟缓、倦怠、体重增长缓慢、便溏等现象,实验7d、13d均出现体重显著性降低(P<0.05),给药期体重也显著低于空白组(P<0.01);小肠黏膜固有层结构紊乱,D-木糖排泄率下降,血清蛋白含量均明显下降,胰蛋白酶、脂肪酶及淀粉酶活性均显著下降(P<0.01或P<0.001),小肠黏膜SGLT1和GLUT2以及Na+-K+-ATPase和PKC-β-II的mRNA转录水平均明显下降(P<0.01或P<0.001)。参苓健脾胃颗粒组相较于模型组大鼠一般状况有所改善,实验22 d及28 d后,高剂量组体重有所增加(P<0.05),实验28 d时,高剂量组大鼠小肠黏膜固有层结构清晰,D-木糖排泄率显著升高(P<0.05),血清TP、ALB、GLB和GLU含量均显著性上升(P<0.05或P<0.001)。参苓健脾胃颗粒低、中和高剂量组的蛋白酶含量均有增加(P<0.05或P<0.01),中和高剂量组脂肪酶和淀粉酶含量显著性增加(P<0.001或P<0.05),高剂量组SGLT1和PKC-β-II mRNA转录水平均有显著增加(P<0.05或P<0.05)。结论 参苓健脾胃颗粒通过提高D-木糖排泄率、促进小肠黏膜的修复、调节生化指标、提高胰蛋白酶、脂肪酶和淀粉酶活性、改善葡萄糖吸收障碍及增强肠黏膜上皮屏障功能修复等途径提高脾虚证大鼠消化、吸收能力。
关键词:参苓健脾胃颗粒;利血平;脾虚模型;葡萄糖吸收;消化;吸收
中图分类号:R285.5 文献标志码:B 文章编号:1007-2349(2024)06-0080-08
脾虚证,泛指因脾气虚损引起的一系列脾生理功能失常的病理现象及病症。脾主运化、统血,因此脾虚患者容易消化不良、痰湿、胃肠蠕动功能减退、食后腹胀以及消化不良[1]。在现代医学中脾虚对应的是消化吸收、水盐代谢、能量转化、血液、神经、内分泌、免疫等多系统多器官系统功能降低的综合表现,其中以消化道的病理改变和功能障碍为主。其中对症的西药如莫沙必利、奥美拉唑、泮托拉唑等均有一定副作用,可能会出现腹痛、恶心、呕吐等情况,还可能会引起心电图的改变甚至出现心慢等。在我国传统医学中,很多中药可以调理脾胃进而产生治疗脾虚的作用[2-3]。中医在运用中药治疗胃肠功能紊乱方面积累了大量经验,其中参苓健脾胃颗粒由北沙参、茯苓、白术、山药(炒)、扁豆(炒)、莲子、砂仁(盐炙)、陈皮、薏苡仁(炒)和甘草组方而成,具有补脾健胃、利湿止泻的功效[4],用于改善患者脾胃虚弱,饮食不消,或泻或吐,形瘦色萎,神疲乏力等症状。临床研究结果显示,参苓健脾胃颗粒对于脾胃虚弱导致的腹泻、食后腹胀、食欲不振、倦怠乏力等具有较好疗效。笔者前期的实验结果证实,参苓健脾胃颗粒能够通过增强胃肠运动、增加胃肠激素分泌、抑制湿阻所致的消化道炎症以及促进水分从肠腔的吸收来治疗大鼠脾虚证。本实验继续挖掘参苓健脾胃颗粒对脾虚证的作用机制,采用符合中医证候特点的脾虚模型,选择以“血清蛋白、消化酶和转运蛋白”为代表的消化、吸收方面的指标探讨参苓健脾胃颗粒治疗脾虚模型大鼠的药效作用和可能调控机制,为其临床应用提供实验依据。
1 材料与仪器
1.1 实验动物、材料与试剂 SPF级健康Sprague Dawley大鼠,60只,雄性,鼠龄8~10周,体重(200±20)g,由北京维通利华实验动物技术有限公司购进,许可证号:No.110011221106112947。动物饲养于中国中医科学院中药研究所SPF级动物房,其使用许可证号:SCXK(京)2021-0011。饲养条件为12 h明暗交替,温度(23±1)℃,湿度(50±15)%,自主饮水及进食。
参苓健脾胃颗粒由昆明中药厂有限公司提供,批号:512398;利血平注射液:广东邦民制药厂有限公司,批号:210516;脂肪酶测试盒:南京建成生物工程研究所,批号:20220827;胰蛋白酶测试盒:南京建成生物工程研究所,批号:20220830;β-淀粉酶检测试剂盒:南京建成生物工程研究所,批号:20221008;D-cDNA反转录试剂盒:北京全式金生物技术有限公司,批号:P20329;Real time PCR试剂盒:北京全式金生物技术有限公司,批号:M51219;氯化钠注射液:石家庄四药有限公司,批号:2111251904;三氯乙醛水合物:上海麦克林生化科技有限公司,批号:C10636049;甲醛:福晨(天津)化学试剂有限公司,批号:L20190920。
1.2 仪器与设备 电子分析天平(德国Sartorius公司);电子天平(瑞士METTLER公司);高速离心机(美国Beckman公司);SpectraMax i3X型多标记酶标仪(德国Simens公司);NANODROP ONE核酸浓度测定仪(美国Thermo公司);CFX MaestroTM PCR仪(美国Perkin Elmer公司产品);Step one plus型Real time PCR仪(美国Applied Biosystem公司产品)。
2 实验方法
2.1 给药量计算 参苓健脾胃颗粒大鼠灌胃溶液:参照《医用实验动物学》,成人以60 kg为标准体质量计算,等效剂量为0.9 g·kg-1,即低剂量组给药剂量为0.45 g·kg-1,中剂量组给药剂量为0.9 g·kg-1和高剂量组给药剂量为1.8 g·kg-1,取1 g颗粒溶于10 mL纯净水中,即制成0.1 g·mL-1混悬液。
2.2 动物分组 脾虚模型制备及分组:60只SD大鼠适应性饲养1周后,按照体重随机分为空白组、模型组、参苓健脾胃颗粒低、中和高三个剂量组,每组12只。
2.3 造模与给药 除空白对照组,其余大鼠每天颈部皮下注射利血平注射液(0.5 mg·kg-1),空白组注射等量生理盐水,连续 14 d。然后参苓健脾胃颗粒每日灌胃给药,连续给药14 d。各组给药剂量为参苓健脾胃颗粒低剂量组0.45 g·kg-1、参苓健脾胃颗粒中剂量组0.9 g·kg-1以及参苓健脾胃颗粒高剂量组1.8 g·kg-1,正常组和模型组分别灌胃等体积的动物用水。
2.4 一般状态观察 每天观察动物精神、活动、皮毛、大便小便等一般状况。每3天测定动物体重。
2.5 尿D-木糖排泄率的测定 尿液收集:分别于造模结束和给药结束后,对大鼠禁食不禁水12 h,每只大鼠灌胃4 mL的3% D-木糖溶液,实验14 d后收集尿液5 h,实验28 d后收集尿液3 h。排泄率测定:采用硫酸苯酚法。计算公式:尿D-木糖排泄率(%)=(尿液D-木糖浓度×尿液体积×稀释倍数)/(灌胃D-木糖体积×灌胃D-木糖浓度)×100%。
2.6 血清生化的测定 灌胃给药结束后,大鼠麻醉,腹主动脉采血,取血于离心管中,室温下静置30 min,离心3000 r·min-1,5 min后取上清液,测定总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)和血糖(GLU)指标。
2.7 小肠黏膜组织显微结构观察 取血完毕后,用冰生理盐水冲洗小肠3次,置于冰上,小肠组织块的直径小于7 mm,放入4%的中性多聚甲醛溶液中固定,乙醇梯度脱水,二甲苯透明后常规石蜡包埋,切片,片厚4 μm。用于HE染色后行光镜观察。
2.8 消化酶活性检测 分别于实验第21 d和第28 d,每组随机选取6只大鼠处死解剖,取下胰腺于-20℃冰箱中保存待测。在室温下对胰腺进行解冻,取0.2~0.3 g样品,用9倍体积的生理盐水稀释后在冰浴中匀浆,4℃离心20 min,3000 r·min-1,取上清液分装,分别测定胰腺中的淀粉酶、胰蛋白酶和脂肪酶活性。
2.8.1 淀粉酶活性测定 采用南京建成生物工程研究所提供的淀粉酶活性试剂盒进行测定。淀粉酶单位定义为:在37℃下,每g组织及食糜(或每mg蛋白)与底物作用30 min钟,水解10 mg淀粉定义为1个淀粉酶活力单位。
2.8.2 胰蛋白酶活性测定 采用南京建成生物工程研究所提供的胰蛋白酶活性试剂盒进行测定。胰蛋白酶单位定义为,每g组织及食糜(或每mg蛋白)在PH 8.0、37 ℃条件下,胰蛋白酶每分钟使吸光度变化0.003为1个酶活力单位。
2.8.3 脂肪酶活性测定 采用南京建成生物工程研宄所提供的脂肪酶活性试剂盒进行测定。脂肪酶单位定义为:在37 ℃条件下,每g组织及食糜(或每mg蛋白)与底物反应1 min,每消耗1 μmoL底物为1个脂肪酶活力单位。
2.9 小肠黏膜SGLT1、GLUT2、Na+-K+-ATPase、以及PKC-β-II mRNA转录水平的考察 ① 小肠黏膜mRNA 提取:将50~100 mg大鼠空肠组织放入液氮预冷的研钵中研磨,利用RNA提取试剂盒,按照说明书提取肠总RNA,紫外分光光度计检测RNA浓度和纯度(A260/A280的值为1.8~2.0)。② 转录水平测定:取总RNA 1 μg逆转录成cDNA后进行Real time PCR检测,PCR反应条件为预变性94℃ 20 s,循环时94℃ 5 s,60℃ 15 s,72℃ 10 s,共40个循环,以各目标基因2-△△Ct值表示各目标基因mRNA相对表达水平,特异性引物序列见表1。
2.10 统计学方法 实验数据以均数±标准差(x±s)的形式表示,采用SPSS Statistics 20统计软件对各组数据进行统计分析,采用单因素方差分析(One-way ANOVA),P<0.05为差异具有统计学意义。
3 结果
3.1 参苓健脾胃颗粒对脾虚型大鼠一般状态与体重的影响 空白组大鼠活动自如,毛色光泽柔顺,大便正常质软。大鼠在实验4 d时出现行动迟缓、倦怠、体重增长缓慢、毛色无光泽、便溏等现象;在实验7 d显著低于空白对照组(P<0.05);实验14 d后大鼠体质量缓慢增长,与正常组比较有差异统计学意义(P<0.01)。给药各组整体的状况要好于模型组;实验22 d及28 d后,高剂量组大鼠体重增加明显(P<0.05,P<0.05)。体重变化曲线见图1。
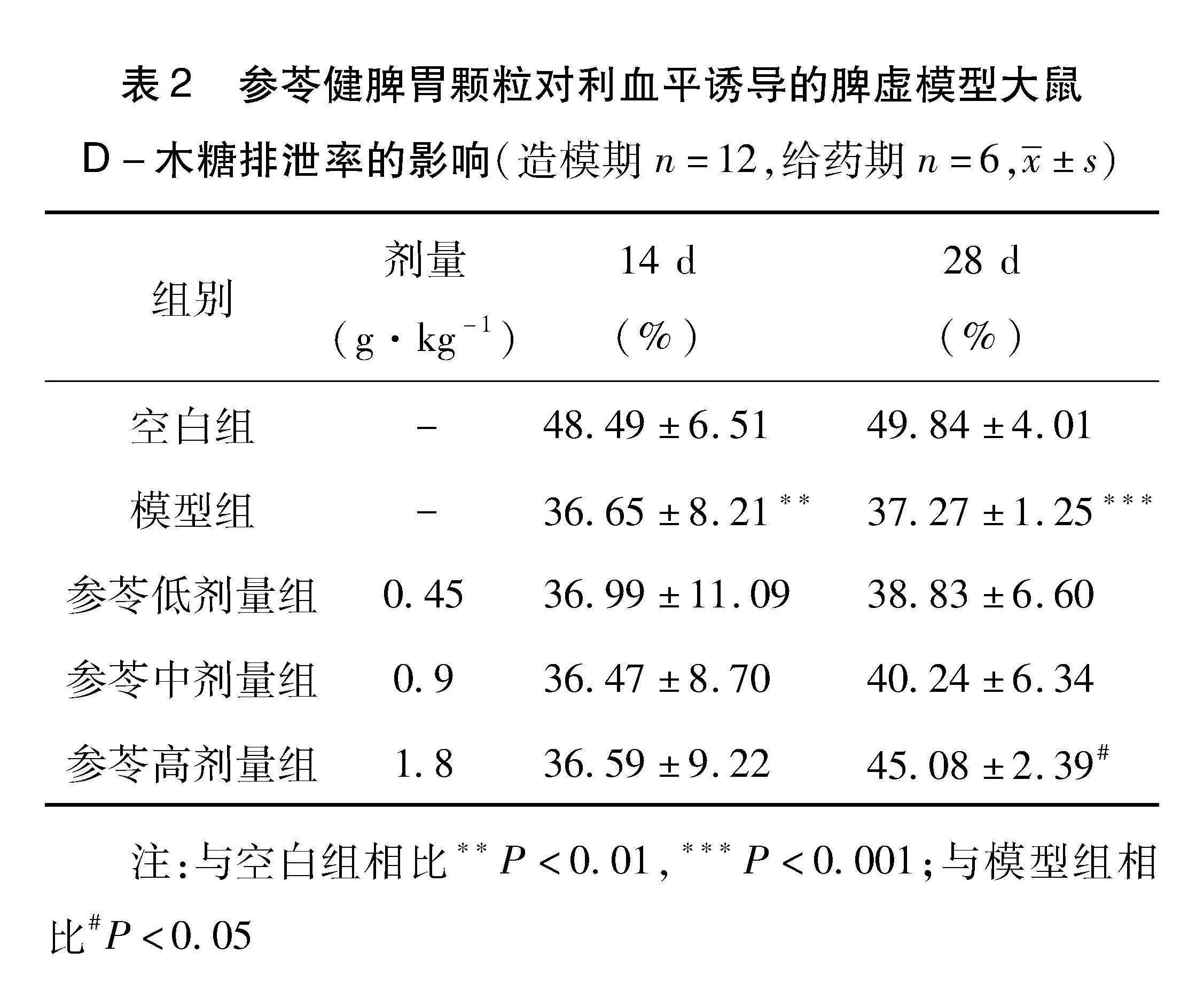
3.2 参苓健脾胃颗粒对脾虚型大鼠尿D-木糖排泄率的影响 结果如表2所示,与空白组相比,模型组在实验14 d时D-木糖排泄率均明显降低(P<0.01)表明脾虚证大鼠模型复制成功。实验
28 d时,模型组大鼠的D-木糖排泄率经过自然恢复后与正常组相比,仍有明显差距(P<0.001);与模型相比,参苓健脾胃颗粒低、中和高剂量组D-木糖排泄率均升高,其中高剂量组D-木糖排泄率出现显著性差异(P<0.05)。
3.3 参苓健脾胃颗粒对脾虚型大鼠血清生化的影响 如表3所示,与空白组相比,模型组大鼠的TP、ALB、GLB和GLU含量明显下降(P<0.05、P<0.01、P<0.01和P<0.01);与模型组相比,参苓健脾胃颗粒高剂量组大鼠的TP、ALB、GLB和GLU含量均显著性上升(P<0.05、P<0.001、P<0.05和P<0.05)。
3.4 参苓健脾胃颗粒对脾虚型大鼠小肠黏膜组织显微结构的影响 空白组大鼠小肠各层组织结构清晰,未见显著异常,模型组大鼠小肠局灶性小肠黏膜固有层结构紊乱,黏膜上皮细胞脱落。低剂量组大鼠小肠从内向外依次为黏膜层、黏膜下层、肌层和外膜,各层结构清晰。中剂量组与高剂量组大鼠小肠黏膜由上皮、固有层和黏膜肌层三部分构成,黏膜肌层为薄层平滑肌,固有层为少许结缔组织,淋巴组织及大量粘液腺体,肌层由平滑肌组成,可分内环和外纵三层,浆膜为疏松结缔组织,外表面覆盖间皮,黏膜内腺体形态规则,腺体间质未见明显异常。具体见图2。
3.5 参苓健脾胃颗粒对脾虚型大鼠胰蛋白酶的影响 如表4所示,与空白组相比,模型组大鼠在实验21 d和28 d时,胰腺中胰蛋白酶含量均显著性下降(P<0.01和P<0.001);与模型组相比,实验21 d时,参苓健脾胃颗粒低、中和高剂量组的胰蛋白酶含量均有增加;实验28 d时,参苓健脾胃颗粒低、中和高剂量组的胰蛋白酶含量均有增加,差异具有统计学意义(P<0.05、P<0.05和P<0.01)。
3.6 参苓健脾胃颗粒对脾虚型大鼠脂肪酶的影响 如表5所示,与空白组相比,模型组大鼠在实验21 d和28 d的胰腺中的胰蛋白酶含量均明显减少(P<0.001和P<0.001);与模型组相比,实验21 d时,参苓健脾胃颗粒低、中和高剂量组胰腺中的胰蛋白酶含量均有增加,其中高剂量组胰蛋白酶含量出现显著性上升(P<0.05),实验28 d时,参苓健脾胃颗粒低、中和高剂量组胰腺中的胰蛋白酶含量均有增加,其中中和高剂量组胰蛋白酶含量出现显著性上升(P<0.001和P<0.001)。
3.7 参苓健脾胃颗粒对脾虚型大鼠淀粉酶的影响 如表6所示,与空白组相比,模型组大鼠在实验21 d和28 d的胰腺中的淀粉酶含量均明显减少(P<0.001和P<0.001);与模型组相比,实验21 d时,参苓健脾胃颗粒中和高剂量组胰腺中的淀粉酶含量均有显著增加(P<0.05和P<0.05),实验28 d时,参苓健脾胃颗粒中和高剂量组胰腺中的淀粉酶含量均有显著增加(P<0.05和P<0.05)。
3.8 参苓健脾胃颗粒对脾虚型大鼠小肠SGLT1、GLUT2、Na+-K+-ATPase和PKC-β-II的mRNA转录水平的影响 与空白组相比,模型组大鼠的SGLT1 mRNA、GLUT2 mRNA、Na+-K+-ATPase和PKC-β-II的mRNA转录水平明显降低(P<0.01);与模型组相比,实验28 d时,参苓健脾胃颗粒高剂量组SGLT1 mRNA和PKC-β-II mRNA转录水平有显著增加(P<0.05)。具体见图3。
4 讨论
参苓健脾胃颗粒源自于宋代《太平惠民和剂局方》参苓白术散的中成药[5],具有补脾健胃,利湿止泻的功效。参苓健脾胃颗粒保留了参苓白术散的绝大多数成分,以补胃阴和肺阴见长的北沙参代替人参;
并因更换为北沙参之后,温燥之患已除,因此去掉桔梗,增加了“理胸中之气,又能助阳气上升,以散滞气助诸脾胃为用”的陈皮[6-7]。全方具有补脾健胃,利湿止泻功效,临床用于脾胃虚弱,饮食不消,或泻或吐,形瘦色萎,神疲乏力。
“脾主运化”与机体的消化功能密切相关,主要对事物进行消化吸收。脾虚证是脾主运化的功能减退,泛指因脾水谷运化功能失调,进而导致的一系列胃肠道生理功能失常的病理现象及病症[8]。现代研究表明,脾虚往往表现为胃肠运动消化、吸收功能的减弱等。临床常见治疗脾虚用药有莫沙必利、奥美拉唑、泮托拉唑等。作为临床常见证型,动物脾虚的造模方法较为成熟,本研究采用目前最常见的动物模型之一利血平诱导脾虚模型来研究参苓健脾胃颗粒的药效作用[9-10]。
利血平通过降低机体的单胺类递质和儿茶酚胺的含量,使交感神经功能低下、副交感神经功能增强,使大鼠出现脾虚患者常见的体重减轻和消瘦等症状,类似于临床脾虚的效果[11-12]。研究表明,利血平诱导的脾虚证大鼠的小肠黏膜会发生形态学改变与尿D-木糖排泄率降低等病理改变[13-14]。本研究中,在实验7 d后大鼠陆续出现活动减少、倦卧少动、眯眼、反应迟钝、皮毛干枯欠光泽,捉拿时反抗无力等现象,并出现体型瘦弱、软便或便溏,同时造模后的大鼠体重增长缓慢。除胃肠功能异常,吸收失常也是脾虚证的主要表现,脾虚时小肠吸收功能明显低下,检测尿液中D-木糖排泄量可反应小肠的功能强弱,脾虚症状越重,尿D-木糖排泄率越低。实验14 d后大鼠的D-木糖排泄率明显降低,表明模型组大鼠肠道吸收糖类物质的功能出现了障碍。结合大鼠的一般状态观察表明脾虚模型造模成功。本研究中,与空白组比较,给药后大鼠一般状况有所改善,实验28 d时,高剂量组大鼠的D-木糖排泄率明显升高。结果表明参苓健脾胃颗粒可以明显改善脾虚证大鼠尿D-木糖排泄率降低的症状。
组织病理结果显示,空白组大鼠小肠各层组织结构清晰,未见显著异常,模型组大鼠小肠局灶性小肠黏膜固有层结构紊乱,黏膜上皮细胞脱落。参苓健脾胃颗粒中剂量组与高剂量组大鼠小肠黏膜由上皮、固有层和黏膜肌层三部分构成,结构清晰未见异常。提示参苓健脾胃颗粒可促进小肠黏膜的修复。
中医认为,脾虚表现为运化失司,精微物质来源不足、肌无所养,从而出现乏力、消瘦等,这些症状是由于蛋白质合成受阻或摄取不足引起的[15]。本实验中脾虚造模导致大鼠便溏且食少纳呆,从而导致血液中TP、ALB、GLB和GLU含量不同程度降低。给予参苓健脾胃颗粒后,其指标相较于模型组均有明显上升,表明机体消化吸收功能得到改善。
脾主运化,参与物质的消化、吸收、转运和代谢等过程,脾虚时大量器官会出现基因、分子和细胞水平的变化,从而引起组织结构和功能的改变,其中消化酶的变化更为突出[16]。胰蛋白酶主要由胰腺分泌,对蛋白质、脂肪具有消化、分解作用,可以协助机体吸收氨基酸、脂肪乳等[17]。脂肪酶主要负责消化食物中脂肪,其能够将甘油三酯分解成机体可吸收的甘油和脂肪酸[18]。淀粉酶主要是将淀粉水解成较小的二三糖和低聚糖,如葡萄糖、麦芽糖和麦芽糖[19]。本研究观察了模型动物中胰腺中胰蛋白酶、脂肪酶以及淀粉酶的活性。本实验模型组的胰蛋白酶活性、脂肪酶活性和淀粉酶活性均显著低于空白组,实验21 d,参苓健脾胃颗粒高剂量组大鼠胰腺中的胰蛋白酶活性、脂肪酶活性和淀粉酶活性有所升高。实验28 d,参苓健脾胃颗粒中剂量和高剂量大鼠组胰腺中的胰蛋白酶活性、脂肪酶活性和淀粉酶活性均有升高。表明给予参苓健脾胃颗粒能够提高胰腺的胰蛋白酶、脂肪酶和淀粉酶活性,进一步说明参苓健脾胃颗粒可提高脾虚证大鼠消化吸收能力。
糖是人体所需基本营养物质之一。葡萄糖在小肠黏膜的吸收整个过程由2个家族的跨膜转运载体蛋白—钠葡萄糖共转运载体系统(sodium/glucose co-transporters,SGLTs)及葡萄糖协助扩散转运载体系统(facilitative glucose transporters,GLUTs)来完成的[20-22],因此小肠中SGLT1和GLUT2载体数量的多少,可反映葡萄糖在机体的吸收效率[23-24]。本实验脾虚证组的SGLT1和GLUT2的mRNA水平均显著低于空白组,高剂量的参苓健脾胃颗粒可以显著提高脾虚大鼠SGLT1 mRNA表达,表明参苓健脾胃颗粒可以通过升高SGLT1的表达来提高脾虚证大鼠对葡萄糖及水液的吸收。
ATP酶(ATPase)是一种载体蛋白,参与细胞的物质代谢和能量转换过程[25-26]。其中Na+-K+-ATPase可将细胞内外的电离子、营养物和代谢物等逆电化学梯度跨膜转运[27-28],本实验脾虚证模型组大鼠小肠组织中的Na+-K+-ATPase较空白组大鼠表达下降,会导致结肠黏膜组织的能量代谢异常、Na+泵出细胞外障碍。本实验结果显示,参苓健脾胃颗粒可以上调Na+-K+-ATPase 转录水平,但并未出现显著性差异,因此推测此酶并非为药物治疗靶点。
PKC-β-II为蛋白激酶C(protein kinase C,PKC)经典型中的一个亚型,在细胞内信号转导中起重要作用[29-30]。PKC激活导致肠黏膜occludin蛋白和最重要的跨膜蛋白家族claudin表达下降,导致肠黏膜上皮屏障功能损伤[31]。本实验脾虚证组的PKC-β-II的mRNA水平均显著低于空白组,而高剂量的参苓健脾胃颗粒可以显著提高脾虚大鼠PKC-β-II mRNA表达,说明参苓健脾胃颗粒可以增强脾虚证大鼠肠黏膜上皮屏障功能的修复。
综上,本研究初步明确了参苓健脾胃颗粒能够通过增加血清蛋白浓度、胰蛋白酶、脂肪酶和淀粉酶的活性以及增加SGLT1和PKC-β-II的mRNA转录水平、改善脾虚大鼠的葡萄糖吸收障碍、促进小肠黏膜修复以及增强肠黏膜上皮屏障功能修复对脾虚模型大鼠产生治疗作用,为临床上应用参苓健脾胃颗粒治疗脾虚提供了一定的实验依据。
参考文献:
[1]朱春梅,杨德才,曹阳,等.脾系疾病及不同证型四诊症状特征研究[J].世界科学技术-中医药现代化,2019,21(6):1238.
[2]张洪源,任广振,黄建政,等.健脾类中药多糖对脾虚相关病症肠道菌群影响研究现状[J].中国中医药信息杂志,2022,29(2):147.
[3]刘慧敏,刘莉,肖炜,等.中药胃肠动力学研究概况[J].时珍国医国药,2013,24(12):2983.
[4]刘岩,刘志洋.参苓健脾胃颗粒中7种成分的HPLC-波长切换法测定[J].中国医药工业杂志,2016,47(12):1564.
[5]杨祝庆.参苓健脾胃颗粒用北沙参和陈皮考[J].云南中医中药杂志,2018,39(5):62.
[6]汪昂.医方集解[M].北京:人民卫生出版社,2006:22.
[7]古今医鉴/中医古籍[DB/OL].中医世家http://www.zysj.com.cn/ lilunshuji/gujinyijian/613-11-4.html.2017-6-23.
[8]朱春梅,杨德才,曹阳,等.脾系疾病及不同证型四诊症状特征研究[J].世界科学技术——中医药现代化,2019,21(6):1238.
[9]谢婧,周祎青,郑锋玲,等.温病湿热证动物模型中炎症因子与水通道蛋白表达的实验研究[J].中华中医药学刊,2018,36(9):2163.
[10]吴天石,张会永,张哲,等.脾虚证动物模型造模方法述评[J].中医杂志,2015,56(11):978.
[11]李晓红,杨力强.中医证候动物模型研究述评[J].广西中医学院,2012,15(1):78.
[12]何劲,周莉,陈家旭,等.中医脾虚证实质研究进展[J].吉林中医药,2015,35(1):103.
[13]张根水,王汝俊.脾虚大鼠壁细胞胃泌素受体研究及黄芪作用观察[J].中国中医基础医学杂志,2002,8(6):44.
[14]郭文峰,高小玲,李茹柳,等.利血平致大鼠脾虚模型尿D-木糖排泄率与肠黏膜三磷酸腺苷水平的研究[J].中国中西医结合消化杂志,2008,16(4):211.
[15]石达友,李盛强,朱华君,等.四君子汤对脾虚犬体重及部分血清生化指标的影响[J].动物医学进展,2010,31(9):29.
[16]李效冰,尹会方,王钰辉,等.银杏叶复方和四君子汤对脾虚证小鼠血清消化酶活性的影响[J].黑龙江畜牧兽医,2016,6(下):151.
[17]Contesini FJ,Melo RR,Sato HH.An overview of Bacillus proteases:from production to application[J].Crit Rev Biotechnol,2018,38(3):321.
[18]Assan D,Kuebutornye FKA,Hlordzi V,Chen H,et al.Effects of probiotics on digestive enzymes of fish(finfish and shellfish);status and prospects:a mini review[J].Comp Biochem Physiol B Biochem Mol Biol,2022,257:110653.
[19]Mardani T,Khiabani MS,Mokarram RR,et al.Immobilization of α-amylase on chitosan-montmorillonite nanocomposite beads[J].Int J Biol Macromol,2018,120(Pt A):354.
[20]Rieg T,Vallon V.Development of SGLT1 and SGLT2 inhibitors[J].Diabetologia,2018,61(10):2079-2086.
[21]Thorens B.GLUT2,glucose sensing and glucose homeostasis[J].Diabetologia,2015,58(2):221-32.
[22]施旭光,施家希,刘海涛,等.补中益气汤对脾虚泄泻大鼠SGLT1/NHE3通路的影响[J].中药新药与临床药理,2018,29(1):8.
[23]刘海涛,施家希,黄张杰,等.补中益气汤不同配伍对脾虚大鼠免疫器官及小肠黏膜转运体蛋白表达的影响[J].中药材,2017,40(2):466.
[24]Lehmann A,Hornby PJ.Intestinal SGLT1 in metabolic health and disease[J].Am J Physiol Gastrointest Liver Physiol,2016310(11):G887.
[25]Shan SO.ATPase and GTPase Tangos Drive Intracellular Protein Transport.Trends Biochem Sci,2016,41(12):1050.
[26]许云姣,吴文笛,蔡悦青,等.基于补土伏火法的四逆汤及其拆方对肾阳虚证模型大鼠肝脏组织Na+-K+-ATP酶及Ca2+-Mg2+-ATP酶表达影响的研究[J].时珍国医国药,2020,31(11):2620.
[27]王海燕,刘億,葛巍,等.四神丸对慢性复发型结肠炎大鼠结肠组织LDH、SDH、Na+-K+-ATPase和Ca2+-Mg2+-ATPase活力的影响[J].中国中医基础医学杂志,2019,25(7):928.
[28]李家立,王亮,白艳香,等.功能性腹泻脾虚证模型大鼠肠组织钠离子通道蛋白的变化[J].中国医药导报,2020,17(16):8.
[29]Kawano T,Inokuchi J,Eto M,et al.Activators and Inhibitors of Protein Kinase C(PKC):Their Applications in Clinical Trials[J].Pharmaceutics,2021,13(11):1748.
[30]Nishizuka Y.Intracellular signaling by hydrolysis of phospholipids and activation of protein kinase C[J].Science,1992,258(5082):607.
[31]王欢,朱莹,娄余.穴位埋线对实验性结肠炎大鼠肠黏膜上皮屏障的影响[J].针刺研究,2021,46(3):201.
(收稿日期:2023-10-22)

