茶树GATA基因家族的全基因组鉴定及表达分析
青亚林 侯炳豪 张宇航 曾珊珊 高婷 叶乃兴

摘要:植物转录因子GATA与靶基因启动子上的WGATAR序列结合,改变下游靶基因的转录,从而调控植物的生长发育。对茶树GATA转录因子的生物学信息特征进行鉴定与分析,为后续茶树栽培育种等相关研究提供理论依据。利用生物信息学方法及实时荧光定量PCR技术,对茶树GATA家族基因进行全基因组鉴定与表达分析。结果表明,(1)鉴定出的35个茶树GATA基因分布于13条染色体上,亚细胞定位预测主要在细胞核上。(2)系统进化分析将茶树GATA基因家族成员分为4个亚族。(3)茶树GATA启动子顺式作用元件分析显示,茶树GATA启动子上有许多光响应、激素信号响应与环境胁迫响应相关的元件。(4)组织特异性分析显示,GATA基因在茶树不同组织中的表达模式有显著差异,多数基因在芽上具有较高的表达。(5)实时荧光定量PCR分析结果显示,在不同处理下,茶树GATA家族基因表达量总体呈下调趋势,其中CsGATA1表达量下调最显著。CsGATA对逆境胁迫响应敏感,说明CsGATA可能参与调控茶树不同生长发育过程,其中CsGATA1可能参与茶树生长发育及逆境胁迫响应的调控。
关键词:茶树;GATA基因家族;生物信息学;基因表达;全基因组鉴定
中图分类号:S571.101 文献标志码:A
文章编号:1002-1302(2024)09-0042-09
GATA基因是真核生物中普遍存在的调控因子之一,锌指结构是它的显著特征,可以特异性地结合靶基因序列,起到调控相关基因表达的作用。GATA基因家族最先在动物体中发现,之后陆续在真菌和植物体中发现[1]。GATA基因家族在植物的应激信号转导和逆境胁迫响应等环节起着关键作用,是广泛存在于植物体中的重要调节因子之一[2]。
植物中GATA家族基因与靶基因启动子上的 W-GATA-R 序列结合,通过改变转录过程来调控植物的生长发育[3],包括调控细胞生长和花朵发育[4],调节叶绿体的形成[5],调节干旱、冷害、盐害等逆境胁迫响应过程[6-7]和植物叶片衰老[8]等生物学过程。
测序技术的不断提高,推动生物信息学快速发展,有益于探究GATA基因家族在基因表达调控过程中发挥的作用,进而发挥其功能提高植物的抗逆性促进植物生长发育[9]。茶树是重要的叶用类经济作物,茶树GATA基因家族的鉴定分析对研究茶树生长发育和逆境防御反应等有一定意义,可为茶树栽培和优良品种选育提供相关参考[10],也能提升茶叶的产量和品质,增加经济效益。近年来有部分茶树基因家族如MYC[11]、YIFY[12]、U-box[13]等也逐渐被鉴定分析报道出来,为茶树基因家族的研究提供了资源,但关于茶树GATA基因家族的分析尚未见报道。本研究通过对茶树GATA基因家族进行鉴定分析,了解该基因在茶树环境胁迫时的表达特点与响应机制等,以期为之后的茶树栽培与育种等工作提供一些参考信息。
1 材料与方法
1.1 供试材料
于2023年2月在福建农林大学茶学福建省重点实验室进行试验。选取全国优良茶树品种——铁观音 (编号:GS13007—1985)为试验原料。原料参照陈丹等的方法[14]进行以下处理。
逆境胁迫处理:4 ℃低温处理:将在正常环境下生长的茶树植株转移到4 ℃人工气候箱中培养以及干旱处理(10%PEG-6000溶液);激素处理:用 100 μmol/L 的GA、MeJA和ABA处理不同株的铁观音茶树。分别处理0、3、6、12、24 h后取茶树春梢顶芽下第2叶。每个处理取3次生物学重复,后用锡纸包裹并标记,再用液氮速冻后储存在-80 ℃冰箱中[15]。
1.2 茶树GATA基因家族的鉴定
从NCBI数据库中下载茶树GATA基因家族的基因组序列。利用SMART软件和HMMER软件(http://www.ebi.ac.uk/Tools/hmmer/)对茶树GATA基因家族成员进行鉴定,最终筛选得到35个基因。
1.3 茶树GATA基因的序列特征
利用TBtools(https://github.com/CJ-Chen/TBtools)软件制作茶树GATA基因在染色体上的位置图,通过Expasy(http://www.expasy.org/proteomics)预测CsGATA蛋白的氨基酸个数、分子量以及等电点等。在数据库中下载并提取每个茶树GATA基因启动子上游2 kb的序列,利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare)预测启动子顺式作用元件。下载模式植物拟南芥的GATA基因家族成员蛋白序列,使用MEGA 7.0软件与铁观音茶树GATA基因家族成员共同构建系统进化树,使用邻接法(neighbor-joining,NJ),设置Bootstrap参数为1 000[16]。
1.4 茶树GATA基因结构、蛋白保守基序分析
在GSDS 2.0(http://gsds.cbi.pku.edu.cn/)上分析CsGATA基因家族成员的基因结构。在SMART(http://smart.embl-heidelberg.de/)上下载各CsGATA家族基因编码区氨基酸序列。用MEME(http://meme.nbcr.net/meme/cgi-bin/meme.cgi)分析CsGATA基因家族成员的保守基序,再用TBtools软件绘制保守基序图。
1.5 茶树GATA基因组织特异性表达分析
下载铁观音茶树的转录组数据,参照前人方法[17]计算获得CsGATA基因在茶树芽、茎、嫩叶、老叶、花和根中的FPKM值,再用TBtools软件绘制茶树GATA基因的表达热图。
1.6 实时荧光定量PCR分析
根据茶树GATA基因组织特异性表达分析结果,筛选出在铁观音茶树顶芽中表达量高的6个茶树GATA基因,用Primer3Plus(http://www.bioinformatics.nl/cgi-bin/primer3plus/primer3plus.cgi)设计引物(表1)。内参基因选择CsGAPDH(登记号GE651107)[18]。采用植物总RNA提取试剂盒对收集的样品提取总RNA,使用全式金Easyscript One-step gDNA Removal and cDNA synthesis superMix试剂盒合成cDNA用于后续基因表达水平的检测。根据全式金Transstart Tip Green qPCR superMix试剂盒的操作步骤,在CFX96 Touch荧光定量PCR仪进行qRT-PCR反应:94 ℃ 30 s;94 ℃ 5 s,60 ℃ 30 s,40个循环,设置3次重复,反应结束后分析荧光值变化曲线及熔解曲线[16]。用相对定量法(2-ΔΔCT)[19]计算基因表达水平,用SPSS 20软件进行显著性分析,用Prism 8软件制作柱状图。
2 结果与分析
2.1 茶树GATA基因家族的鉴定与理化性质分析
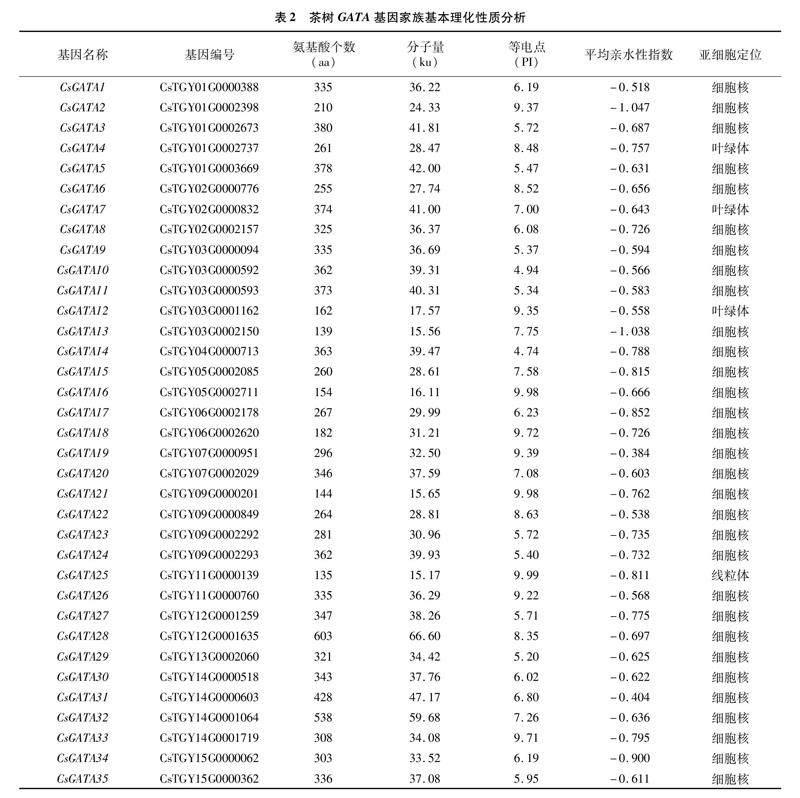
从茶树中共鉴定出35个CsGATA基因,根据基因在染色体上的位置将其分别命名为CsGATA1~
CsGATA35(表2)。通过ProParamran网站对CsGATA蛋白的理化特性进行分析,35个CsGATA基因编码的蛋白长度在135~603 aa 之间,蛋白分子量大小在15.17~66.60 ku之间,理论等电点在4.74~9.99之间。亚细胞定位预测发现,该家族基因主要定位在细胞核(31个CsGATA)、叶绿体(3个CsGATA)、线粒体(1个CsGATA)中,推测茶树GATA基因主要在细胞核中表达。全部基因的平均亲水性指数都是负数(-1.047~-0.384),说明茶树GATA蛋白皆为亲水蛋白。
用从铁观音茶树基因组中筛选获得的35个GATA基因家族成员,制作茶树GATA基因在染色体上的位置分布,结果(图1)表明,茶树GATA基因分布在13条染色体上,其中①、③号染色体上各分布有5个基因,⑧号和B12号染色体上各分布有4个基因,②号染色体上分布有3个基因,⑤、⑥、⑦、⑨、⑩、B13号染色体上各分布有2个基因,其他染色体上都只分布了1个基因。依据染色体上CsGATA基因不同的位置分布顺序,把基因依次命名为CsGATA1~CsGATA35。
2.2 茶树GATA基因家族进化
将铁观音茶树和拟南芥的GATA家族基因放置在一起构建系统进化树(图2),便于观察茶树GATA基因家族的进化关系。由系统进化树可知,茶树GATA分为4个亚族。拟南芥作为模式植物其功能研究的比较清楚,因此和拟南芥GATA基因位于同一分支上的茶树GATA基因属于同一亚族,说明同一亚族成员之间的基因结构与功能具有相似性。
2.3 茶树GATA基因家族的启动子顺式元件
对茶树GATA基因家族成员启动子上游2 000 bp
进行顺式作用元件分析(图3)。这其中包括有和环境胁迫响应相关的元件, 如ARE(厌氧诱导)、 MBS(干旱)、TC-rich repeats(防卫与应激)、LTR(低温);和激素响应相关的元件,如ABRE(脱落酸)、P-box (赤霉素)、TCA-element(水杨酸)、TGA-element(生长素)、CGTCA-motif(茉莉酸甲酯)等;和植物生长相关的元件O2-site(玉米醇溶蛋白代谢)等,以及许多光响应相关的元件。由此可知,茶树GATA基因中含有许多响应非生物胁迫、生物胁迫、生长发育调控及光响应等的作用元件,说明CsGATA可能是茶树生长发育与逆境胁迫响应的调控基因之一。
2.4 茶树GATA的基因结构和Motif序列分析
利用GSDS网站绘制茶树GATA基因结构图。由图4可知,茶树GATA基因家族成员的内含子和外显子情况。亚族Ⅰ中的CsGATA5、CsGATA31有8个内含子,其他基因有2~3个内含子。亚族Ⅱ中的CsGATA13没有内含子,其余基因含有1~3个内含子。亚族Ⅲ中的基因内含子数在6~10个之间。亚族Ⅳ中的基因内含子数在4~9个之间。同一亚族具有相似的基因结构,且内含子数量与长度总体相似;但是第Ⅰ亚族中的CsGATA26的基因结构与同亚族中的其他成员有较大差异,也许是进化时发生了内含子插入的原因;第Ⅰ亚族和第Ⅱ亚族中的基因内含子长度较短,个数相对较少;第Ⅲ亚族和第Ⅳ亚族中的基因内含子长度较长,个数较多。
茶树GATA基因家族成员保守基序分析显示,进化上同源关系较近的成员一般具有相似的保守基序(图4)。亚族Ⅰ中的基因都有Motif1元件,排列方式多为 Motif1~Motif6。亚族Ⅱ中的CsGATA13只含有Motif1、Motif2元件,CsGATA2只含有Motif4、Motif1元件,其余的基因都含有Motif1、Motif2和其他元件,并且排列方式多为 Motif8-Motif4-Motif7-Motif1-Motif2。亚族Ⅲ中的蛋白含有4个相同的Motif元件,并且排列方式都为Motif5-Motif6-Motif1-Motif9。亚族Ⅳ基因中除CsGATA19只含有1个Motif1元件外,其余的都含有Motif1、Motif10元件,并且排列方式都为 Motif1-Motif10。亚族Ⅲ中的蛋白保守基序是完全相同的,亚族Ⅱ中的蛋白间存在保守基序差异,说明该基因可能在进化过程中发生了变化。不过绝大部分的茶树GATA基因还是遵守系统进化树的分族规律。
2.5 茶树GATA家族基因组织特异性分析
为进一步探究GATA基因在茶树生长发育中的作用,筛选出35个CsGATA基因(FPKM≥10)绘制表达量热图。茶树6个组织部位(芽、茎、嫩叶、老叶、花、根)中均有CsGATA基因表达,说明不同CsGATA可能参与调控了茶树不同生长发育过程(图 5)。茶树GATA基因在幼嫩芽叶中表达量较高,老叶、花、根中表达量较低。在芽中表达量较高的基因有CsGATA17、CsGATA7、CsGATA8、CsGATA3、CsGATA21、 CsGATA20、 CsGATA4、CsGATA30,在茎中表达量较高的基因有CsGATA27、CsGATA6、CsGATA35,在嫩叶中表达量较高的基因有CsGATA11、CsGATA5,在老叶中表达量较高的基因有CsGATA24、CsGATA31、CsGATA33,在花中表达量较高的基因有CsGATA9、CsGATA28、CsGATA11,[JP3]在根中表达量较高的基因有CsGATA32、CsGATA12、CsGATA14、CsGATA25。
2.6 茶树GATA基因在逆境胁迫下的表达分析
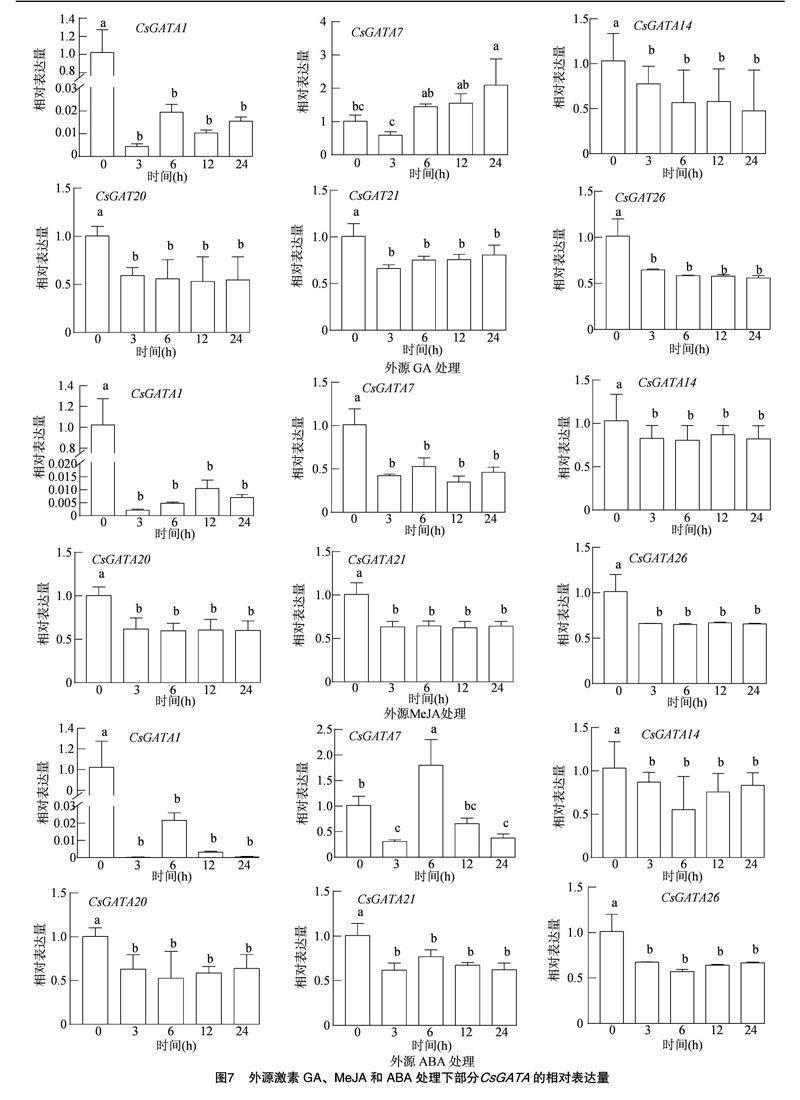
为进一步研究茶树GATA基因的潜在功能和在逆境胁迫下的表达模式,用4 ℃的低温、100 μmol/L的GA、MeJA、ABA激素溶液和10% PEG-6000溶液对茶树进行处理,并对6个茶树GATA基因的表达进行 qRT-PCR分析。结果表明,经4 ℃低温处理3、6、12 h后全部基因表达量下调(图6)。处理时间达到24 h后,仅CsGATA7基因表达量上调,其余基因表达量都下调,CsGATA7表达量最高。经PEG干旱处理后,全部基因在处理3、12、24 h后表达量都下调。在处理6 h后,除CsGATA7基因表达量上调外,其他基因表达量都下调。经GA处理后,全部基因在处理3 h后表达量都下调(图7),在处理6、12、24 h后,除基因CsGATA7表达量都上调外,其他的基因表达量都下调;经MeJA处理后,全部基因表达量都下调;经ABA处理后,全部基因在处理3、12、24 h后表达量都下调。在处理6 h后,除CsGATA7基因表达量上调外,其他基因表达量都下调。由图6、图7可知,茶树GATA基因家族成员在不同处理下有特异性和多样性的表达水平。
3 讨论与结论
3.1 讨论
本研究对铁观音茶树全基因组进行鉴定,获取了35个茶树GATA基因家族成员,并对这35个成员进行相关理化性质分析。分析得知,35个茶树GATA 基因分布在13条染色体上,茶树GATA编码蛋白长度处于135~603 aa之间,蛋白分子量介于15.17~66.60 ku之间,PI在4.74~9.99之间,茶树GATA蛋白都是亲水性蛋白。亚细胞定位预测分析发现茶树GATA基因家族成员主要定位于细胞核,说明茶树GATA可能主要在细胞核中发挥作用。茶树GATA家族基因的锌指结构域皆有良好的保守性,与已报道的拟南芥[1]、谷子[20]、水稻[21]及玉米[22]等的研究基本一致。启动子顺式作用元件分析表明,茶树GATA基因中含有很多的光响应、激素响应和逆境胁迫响应等顺式作用元件。说明GATA是茶树生长发育及逆境胁迫响应重要的调控基因之一,这与前人研究的GATA基因广泛参与了色素代谢调节、逆境胁迫响应以及质体发育调控[23]相一致。
根据茶树与拟南芥共同构建的进化树分析显示,茶树GATA基因家族分为4个亚族。同时,结合茶树GATA成员基因结构和蛋白保守基序分析结果可知,同一亚族上的成员具有类似的基因结构和蛋白保守基序,说明位于同一亚族上的基因保守性更高,可能具有相似功能[24],这与枣[25]和高粱[26]的结果一致;由茶树GATA基因组织特异性表达分析结果可知,大部分茶树GATA基因在芽和嫩叶中的表达量比老叶、花和根部高很多,分析得出GATA基因家族在茶树不同组织中的表达特异性较强,这与桑树[24]、高粱[26]等研究结果相同。
此外,在不同的逆境胁迫条件下,茶树GATA基因家族成员表达量基本呈下调趋势,其中经ABA处理3 h后的CsGATA1表达量下降的最多,接近下降了3 374倍,说明茶树GATA基因家族成员对逆境响应敏感,这与王娟等得出的结论[3]相同。此外,茶树GATA基因家族成员在应对不同胁迫时,基因表达量上调、下调程度皆有不同,说明茶树GATA基因家族在进化过程中功能产生了分化,不同基因对不同逆境胁迫响应程度有所不同[27]。茶树等植物在生长发育过程中难免会遇到多种生物和非生物胁迫,造成产量、质量下降等不良影响产生经济损失,因此研究茶树逆境胁迫响应机制对提升茶树等植物抗逆性具有重大意义。
3.2 结论
本研究扩充了GATA基因家族信息,可为后续研究茶树GATA基因家族成员的生物学功能提供参考。通过实时荧光定量PCR分析,发现CsGATA是调控茶树生长发育与逆境胁迫响应的重要基因,茶树GATA基因家族成员基因的表达对茶树的抗逆境胁迫及生长发育过程起着重要的作用。
参考文献:
[1]Reyes J C,Muro-Pastor M I,Florencio F J. The GATA family of transcription factors in Arabidopsis and rice[J]. Plant Physiology,2004,134(4):1718-1732.
[2]张全琪,朱家红,倪燕妹,等. 植物bHLH转录因子的结构特点及其生物学功能[J]. 热带亚热带植物学报,2011,19(1):84-90.
[3]王 娟,兰海燕. GATA转录因子对植物发育和胁迫响应调控的研究进展[J]. 植物生理学报,2016,52(12):1785-1794.
[4]Zhao Y X,Medrano L,Ohashi K,et al. HANABA TARANU is a GATA transcription factor that regulates shoot apical meristem and flower development in Arabidopsis[J]. The Plant Cell,2004,16(10):2586-2600.
[5]Chiang Y H,Zubo Y O,Tapken W,et al. Functional characterization of the GATA transcription factors GNC and CGA1 reveals their key role in chloroplast development,growth,and division in Arabidopsis[J]. Plant Physiology,2012,160(1):332-348.
[6]史军娜,刘美芹,师 静,等. 沙冬青GATA型锌指蛋白基因序列及表达分析[J]. 北京林业大学学报,2011,33(3):21-25.
[7]陈鸿飞. 苹果CCO和GATA基因家族的鉴定、系统进化和非生物胁迫的表达分析[D]. 杨凌:西北农林科技大学,2018:3-4.
[8]Richter R,Behringer C,Zourelidou M,et al. Convergence of auxin and gibberellin signaling on the regulation of the GATA transcription factors GNC and GNL in Arabidopsis thaliana[J]. Proceedings of the National Academy of Sciences of the United States of America,2013,110(32):13192-13197.
[9]易雨憧,廖文海,孙 进,等. 杨梅全基因组的GATA转录因子鉴定、功能及进化分析[J]. 福建农林大学学报(自然科学版),2022,51(5):644-653.
[10]周棋赢,韩月华,祝 悦,等. 茶树TCP家族的全基因组鉴定及其表达分析[J]. 园艺学报,2019,46(10):2021-2036.
[11]曹 丹,刘艳丽,马林龙,等. 茶树MYC基因家族生物信息学及其表达特性[J]. 湖南农业大学学报(自然科学版),2021,47(3):291-298.
[12]谢思艺,周承哲,朱 晨,等. 茶树CsTIFY家族全基因组鉴定及非生物胁迫和激素处理中主要基因表达分析[J]. 园艺学报,2022,49(1):100-116.
[13]李时雨. 茶树U-box基因家族的鉴定与功能分析[D]. 贵阳:贵州大学,2022:30-54.
[14]陈 丹,俞 滢,岳 川,等. 茶树△12-脂肪酸去饱和酶基因FAD2和FAD6的克隆与表达分析[J]. 茶叶科学,2017,37(6):541-550.
[15]晏美红,郑玉成,侯炳豪,等. 茶树乙烯受体ETR基因家族的鉴定与表达分析[J]. 福建农业学报,2021,36(10):1160-1168.
[16]侯炳豪,王鹏杰,郭永春,等. 茶树GRF转录因子的比较基因组学和杂种优势[J]. 应用与环境生物学报,2022,28(6):1477-1484.
[17]谷梦雅,王鹏杰,金 珊,等. 不同强度红光对茶树苯丙烷类代谢影响的转录组分析[J]. 应用与环境生物学报,2021,27(3):1-14.
[18]陈潇敏,王鹏杰,王淑燕,等. 基于转录组挖掘蕉城苦茶苦茶碱合成相关基因的挖掘[J]. 应用与环境生物学报,2021,27(5):1382-1389.
[19]Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods,2001,25(4):402-408.
[20]卢成达,李 阳,孙 迪,等. 谷子GATA基因家族的鉴定及表达分析[J]. 西北农业学报,2021,30(5):645-654.
[21]骆 鹰,王有成,王伟平,等. 水稻GATA基因家族生物信息学分析[J]. 分子植物育种,2018,16(17):5514-5522.
[22]王延召,周 波,韩小花,等. 玉米GATA基因家族的全基因组鉴定及热胁迫下的表达分析[J]. 河南农业科学,2020,49(11):19-25. [HJ2mm]
[23]薛彦斌. 红苞凤梨AbDVR基因功能分析及其转录调控研究[D]. 成都:四川农业大学,2022:8-9.
[24]刘 江,刘 刚,曾益春,等. 桑树GATA基因家族的全基因组鉴定与分析[J]. 西南农业学报,2022,35(12):2724-2731.
[25]陈国梁,祖欢欢,张 昊,等. 枣GATA转录因子家族生物信息学分析[J]. 分子植物育种,2018,16(15):4863-4871.
[26]宋迎辉,朱灿灿,代书桃,等. 高粱GATA基因家族的全基因组鉴定及表达分析[J]. 山东农业科学,2022,54(8):14-23.
[27]杨玄松,谢雯榕,顾 钢,等. 普通烟草GATA转录因子家族鉴定及基因表达分析[J]. 烟草科技,2023,56(1):11-23.
收稿日期:2023-06-13
基金项目:安溪茶叶重大科技创新专项(编号:AX2021001);福建张天福茶叶发展基金会科技创新基金(编号:FJZTF01)。
作者简介:青亚林(1999—),女,四川南充人,从事茶树栽培育种研究。E-mail:1635272062@qq.com。
通信作者:叶乃兴,硕士,教授,从事茶树栽培育种与品质化学研究。E-mail:ynxtea@126.com。

