天津市售海产贝类腹泻性毒素污染状况分析
马丹 白明 于洁 李艳
摘 要:为掌握天津市售海产贝类腹泻性贝类毒素(diarrhetic shellfish poison, DSP)的污染状况,保障消费者的食用安全。2019—2023 年每年4—8月在天津市大型水产批发农贸市场采集10种共354个海产贝类样品,采用酶联免疫(ELISA)法进行检测,并对检测结果进行数据分析。检测结果共有253个样品检出阳性,检出率为71%,检出样品DSP的含量范围为10.40~154.47 μg/kg,均值为51.44 μg/kg,并未有超过食用安全限量值160 μg/kg的样品。研究表明,在每年4—8月染毒高发期间,天津市售海产贝类DSP毒素含量整体较低,在采集的10种贝类中,牡蛎、扇贝、毛蚶的检出率、检出平均含量均位于前列,DSP含量5月最低,8月最高。通过本次研究发现,至2023年4—8月高发期,天津市售海产贝类腹泻性贝类毒素的检出率已达到100%,说明养殖环境中已存在产毒藻类繁殖,尽管含量普遍较低,应坚持在高发期对染毒情况进行监测,并建议河北省、山东省、辽宁省等天津周边养殖区域持续对养殖环境进行监测。
关键词:天津;贝类; 腹泻性贝类毒素(DSP)
腹泻性贝类毒素(diarrhetic shellfish poison, DSP)中毒是一种非致死性急性胃肠道综合征。主要症状包括腹泻、恶心、呕吐和腹痛。根据毒素浓度和摄入量,发病时间可能在摄入后半小时至几小时,一般在3 d内可恢复[1]。1976 年,Yasumoto等[2]首次从多种贝类的肝胰腺中分离出DSP,从而确定了食用贝类导致腹泻的原因并非致泻菌微生物所为,而是DSP中毒,此后大量学者投入到贝毒及相关科学的探索和研究之中[3-6]。DSP由有毒甲藻类鳍藻属(Dinophysis)[7]和原甲藻属(Prorocentrum)[8-9]产生,可通过摄入海水中鱼、虾、贝等传递至人体。已有学者在黄道蟹(Cancer pagurus)[10]、巴西南部死亡绿海龟(Chelonia mydas)消化道中检测出DSP毒素[11]。2007年丹麦和瑞典发生了海洋哺乳动物(海豹和海豚)大规模死亡事件,学者从尸体样本中检测出鳍藻毒素[12]。
DSP在全球沿岸海域均有分布,是世界范围内具有最严重健康威胁的赤潮藻毒素之一,不仅能造成急性中毒[13],也能引起潜在的慢性中毒,并可诱发消化系统癌变,欧洲及美国已将DSP纳入其常规生物毒素监测计划,在意大利14年的监测数据中发现DSP是海产贝类主要的污染物[14]。2011年,宁波市和宁德市报道了中毒人数超过两百人的贻贝中毒事件,是国内首次大规模DSP中毒事件[15],随着我国沿海工业、养殖业规模不断扩大,近岸水体富营养化严重造成赤潮频发,引起人们对海产贝类食用安全的高度关注。
我国渤海海域位于暖温带,特别是天津港经贸航运遍布全球,往来频繁,十分有利于有毒藻类的引入和扩散。李静等[16]对国内外已公开发表的船舶压载舱沉积物相关文献和资料进行统计,发现船舶压载舱沉积物携带有外来浮游植物共计106 种。而渤海湾发现通过压载水传播的外来浮游植物有17种,16种均属于赤潮生物,其中包含产DSP的有毒藻类[17]。2009—2019年间,渤海共发生赤潮92次,主要发生在每年的5—9月份,其中,6—8月份赤潮发生的频率最高[18]。渤海海域在1999年和2004年分别发生过鳍藻属和原甲藻属引发的赤潮。在渤海湾中,以天津市北部的汉沽大神堂近岸海域赤潮出现最为频繁,其次为天津市与河北省南部交界的大港—黄骅近岸海域和天津市天津港近岸海域[19]。近几年京津冀区域的河北省沿海城市频频发生食用贝类中毒事件,特别是在夏季,天津市场对贝类需求量极大,基本都是从临近的山东省、河北省、辽宁省等批发而来,对本地食用贝类安全监测预警能力提出了更高的要求。
本文研究了天津市售海产贝类的腹泻性贝类毒素含量,对结果进行分析,同时通过实时监测保障市民食用安全,防止食用贝类中毒事件在本区域发生。
1 材料与方法
1.1 实验材料
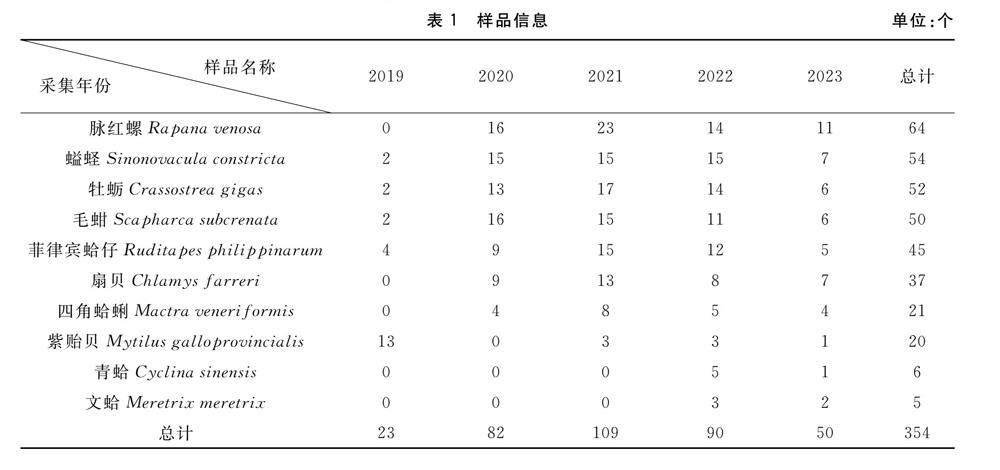
1.1.1 样品采集及处理 2019—2023年,采集10种贝类样品共354个,样品主要采集于天津市大型水产批发农贸市场(滨海新区金元宝农贸批发市场、津南区阿米玛何庄子农贸批发市场、滨海新区古林农贸市场和万源星城菜市场、东丽区金钟农产品批发市场、博疆菜市场)以及渤海湾天津海域(汉沽海域、大港海域)。采集的样品主要为当地主要经济贝类,见表1。按照GB 5009.212-2016《食品安全国家标准贝类中腹泻性贝类毒素的测定》[20]中5.2试样制备的要求进行样品的处理:用清水彻底洗净贝类样品外表,切断闭壳肌,开壳,用清水淋洗内部去除泥沙及其他异物,取出贝肉,沥水,均质。若样品不能及时检测,需保存至-18 ℃以下备用。
1.1.2 仪器与材料 Multiskan FC 酶标仪(Thermo);SQP电子天平(Sartorius); VORTEX-GENIE2 旋涡混合器(Scientific Industries); 3-18KS离心机(SIGMA); 腹泻性贝类毒素酶联免疫(ELISA)试剂盒(Abraxis)。
1.2 检测方法
样品的前处理:向玻璃瓶中加入1 g均质后的贝肉和6 mL 80%甲醇,4 ℃下3 500 r/min离心10 min,收集上清液;在残留的贝肉中加入2 mL 80%甲醇,4 ℃下3 500 r/min离心10 min,收集上清液;用80%甲醇将收集的上清液总体积补至10 mL,用0.45 μm的滤膜过滤。取100 μL滤液,稀释至1 mL,待测。按照ELISA试剂盒使用说明书的检测步骤进行上机检测。每个浓度的标准溶液及每个样品均做平行样,在酶标仪450 nm处测量吸光度(OD)取平均值。以标准品的浓度为x轴,标准品的%B/B0值(标准品平均吸光值与零标准品平均吸光值之比)为y轴,构建标准曲线。计算样品的%B/B0值,从曲线上读取浓度结果(ppb),再乘以稀释倍数得出最终结果。所用试剂盒均放置于4~8 ℃冰箱中保存备用。
1.3 结果判定
根据GB 5009.212—2016《食品安全国家标准 贝类中腹泻性贝类毒素的测定》[20]中标注“任何腹泻性贝类毒素含量值大于16 μg/100 g的样品即被认为是有害的,对人类食用不安全”。方法的定量限为10 μg/kg,以结果160 μg/kg为限量,进行结果判定。
2 结果与分析
2.1 贝类污染基本状况
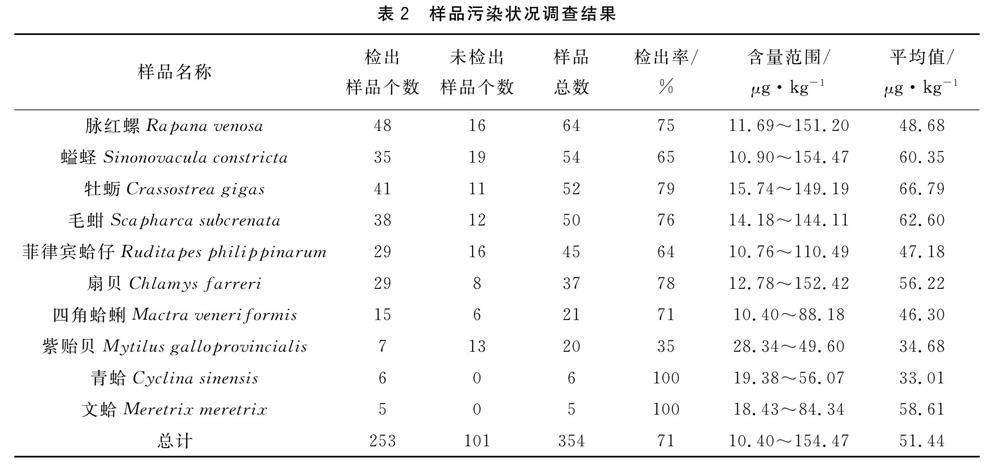
腹泻性贝毒污染状况调查结果显示(表2),在采集的10种354份贝类样本中,共有253个样品检出,检出率为71%,检出样品的含量范围为10.40~154.47 μg/kg,均值为51.44 μg/kg,检测结果均未超标。所有样品中,检出率由高到低依次为青蛤、文蛤、牡蛎、扇贝、毛蚶、脉红螺、四角蛤蜊、螠蛏、菲律宾蛤仔、紫贻贝。青蛤、文蛤的样品量较少,但均有低浓度检出,牡蛎的检出率较高,检出平均含量最高,扇贝、毛蚶的检出率及平均值在采集的贝类品种中均为较高水平,经常发生食用中毒事件的主角紫贻贝检出率及平均值处于较低水平。
2.2 不同贝类DSP污染状况
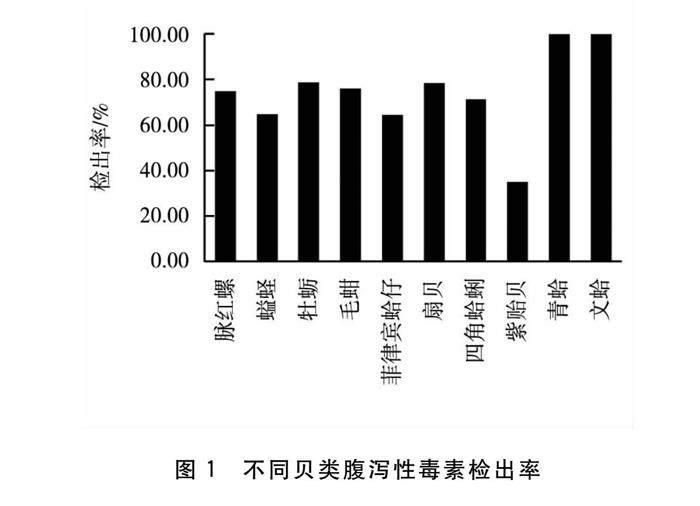
采集的10种354个贝类样品中DSP检出率最高的是青蛤、文蛤,青蛤共有6个样品,文蛤共有5个样品,大部分采集自2022年,样品量较少,采集年份较集中,对检出率有一定影响。紫贻贝共采集样品数20个,大部分为2019年采集,检出率为35%,且浓度较低,可能是由于周边城市出现食用贝类中毒事件后,管理部门对紫贻贝的食用进行预警,导致销售紫贻贝商户减少,并且流通速度变慢,为毒素进一步代谢提供时间。其他种类由高到低分别为牡蛎>扇贝>毛蚶>脉红螺>四角蛤蜊>螠蛏>菲律宾蛤仔,检出率最高79%,最低64% (图1)。DSP含量检测均值最高的是牡蛎,达到66.79 μg/kg,由高到低分别为牡蛎>毛蚶>螠蛏>文蛤>扇贝>脉红螺>菲律宾蛤仔>四角蛤蜊>紫贻贝>青蛤(图2)。
2.3 不同时间DSP污染分布状况
2019年共采集样品23份,包含13份紫贻贝样品和10份其他品种,其中2份紫贻贝样品检测阳性,其他样品均为阴性,检出率为8.7%,检测均值为31.80 μg/kg。2019-2023年样品检出率呈逐年升高的趋势,检测结果显示DSP浓度含量并不高,最高值出现在2022年,其他年份总体含量相对较低,远低于限量值160 μg/kg(表3)。
在阳性样品的检测结果中,2019年采集样品较少,且只有两份紫贻贝样品呈阳性。2020年DSP含量最高的是扇贝,其次为四角蛤蜊、毛蚶。2021年DSP含量最高的是毛蚶,其次为牡蛎、螠蛏,2021年各种贝类样品浓度均相对较低。2022年DSP含量最高的是牡蛎,浓度达到107.63 μg/kg, 其次为脉红螺、 文蛤, 2022年的检测浓度最高。2023年DSP含量最高的是青蛤,浓度为56.07 μg/kg,其次为毛蚶55.45 μg/kg、扇贝53.66 μg/kg,2023年的检测含量普遍不高(图3)。
由表4可以看出,在DSP高发期的4—8月期间,各月检出率均在60%以上,8月检出率最高,为89%,并且DSP含量也最高。8月采集的样品中螠蛏的检测浓度最高,为84.22 μg/kg;其次为四角蛤蜊63.25 μg/kg、毛蚶55.64 μg/kg。7月检出率最低,为61%,但DSP含量仅次于8月, 位列第二。7月采集的样品中牡蛎的检测浓度最高为69.97 μg/kg;其次为扇贝67.14 μg/kg、螠蛏62.54 μg/kg。5月检出率较低,为64%,且DSP含量最低,为41.05 μg/kg。5月采集的样品中毛蚶的检测浓度最高,为120.11 μg/kg;其次为牡蛎42.37 μg/kg、菲律宾蛤仔35.53 μg/kg。
从图4中可以看出,10种贝类样品DSP含量普遍不高,除5月份的毛蚶样品超过100 μg/kg,其它均在20~90 μg/kg之间,均未超过限量值160 μg/kg。4月、6月各种贝类DSP含量值较为分散,5月份含量普遍较低,7月份DSP含量值相对集中,8月含量普遍升高。可能是由于不同贝类的摄食习性与代谢速度不同,导致不同月份DSP毒素含量不同。有学者在实验室中对贻贝代谢DSP进行净化试验,结果表明16 d内能降低到约初始毒素含量的50%[21]。
3 结论与讨论
目前发现能够产生腹泻性贝毒的藻类有渐尖鳍藻(D.acuminate)、具尾鳍藻(D.caudate)、尖锐鳍藻(D.cauta)、倒卵形鳍藻(D.fortii)、挪威鳍藻(D.norvegica)、球囊鳍藻(D.saccullus)、三角鳍藻(D.tripos)、帽状秃顶藻(D.mitra)及利玛原甲藻(P.lima)、凹形原甲藻(P.concavum)、P.hoffmannianumt、P.maculosumt、P.faustiae等[22]。无论是在渤海湾[19]还是在秦皇岛近海[23]、山东近海[24]、大连海域[25]等区域均有发现产DSP的有毒藻类,虽然不是能够直接引起赤潮的优势种群,但作为营养藻种经常伴随着赤潮的发生[26]。
随着各地沿海人工养殖贝类规模的不断发展壮大,近岸海域水体富营养化程度不断增加,加上海上建设、海运贸易等经济发展模式,对海水环境丝毫没有改善作用。养殖区域又大都处于半封闭状态,与外界水体交换速度缓慢,大量贝类摄食消耗初级生产力有助于有毒藻类稳定繁殖,根据日照和温度的变化,使不同贝类体内保持各自不同的稳定的毒素浓度。
本研究对2019—2023年4—8月高发期间天津市售海产贝类中腹泻性贝类毒素进行了调查监测。结果表明,所有样品均未超过食用安全标准,并处于较低水平。其中青蛤、文蛤、牡蛎、扇贝、毛蚶等主要经济贝类染毒概率相对较大。与杨辉等[27]调查的河北省市售贝类结果相近。由于食用预警,采样期间紫贻贝市售样品较少且流通速度较慢,导致检出率及含量均处于较低水平。DSP含量5月最低,8月最高,在采集的10种贝类中牡蛎、扇贝、毛蚶的检出率、检出平均含量均处于前列。有研究表明DSP来源不仅限于营养型游动藻细胞,也可来自孢囊。在条件不宜时(如冬季),单胞藻常以孢囊的形式存在于基底中[28],海底或滩涂上生长的贝类例如泥蚶、缢蛏和青蛤等,有可能摄食这些有毒孢囊,DSP就会转移到其体内,这可能是青蛤DSP检出率高的原因。
贝类含有丰富的营养物质,如蛋白质、无机盐和多种维生素,并含有大量的肝糖,易被消化和吸收,口感鲜美。以贝类为主的海鲜烧烤更是让消费者无法抗拒。由于我国贝类安全监控机制不健全等问题,贝类出口一直受到欧盟的禁止,基本以内销为主。通过本次研究发现,至2023年4—8月高发期,天津市售海产贝类腹泻性贝类毒素的检出率已达到100%,说明养殖环境中已存在产毒藻类繁殖,尽管含量普遍较低,为保证消费者食用安全适时发布预警,应坚持在高发期对染毒情况进行监测,并建议河北、山东、辽宁等天津周边养殖区持续对养殖环境进行监测。
参考文献:
[1] MOHAMMADREZA P,ALIREZA A,YAZDAN H N,et al.A review of poisoning with various types of biotoxins and its common clinical symptoms[J].Toxicon,2024,240:107629.
[2] YASUMOTO T,OSHIMA Y,YAMAGUCHI M.Occurrence of a new type of shellfish poisoning in the Tohoku district[J].Bulletin of the Japanese Society of Scientific Fisheries,1978,44 (11):1249-1255.
[3] COSTAS C,LOUZAO M C,RAPOSO-GARCIA S,et al.Intestinal secretory mechanisms in okadaic acid induced diarrhoea[J].Food and Chemical Toxicology, 2022,169 (11):113449.
[4] LIU Y,LIU Z Y,QIAO F.Identification of Perna viridis contaminated with diarrhetic shellfish poisoning toxins in vitro using NIRS and a discriminative non-negative representation-based classifier[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2023,294 (6): 122514.
[5] NIEVES M G,DIAZ P A,ARAYA M,et al.Effects of the toxic dinoflagellate Protoceratium reticulatum and its yessotoxins on the survival and feed ingestion of Argopecten purpuratus veliger larvae[J]. Marine Pollution Bulletin, 2024,199:116022.
[6] YANG Y M,LI A F,QIU J B,et al.Responses of the intestinal microbiota to exposure of okadaic acid in marine medaka Oryzias melastigma[J].Journal of Hazardous Materials,2024,465: 133087.
[7] YASUMOTO T,MURATA M,OSHIMA Y,et al.Diarrhetic shellfish toxins[J].Tetrahedron, 1985, 41(6):1019-1025.
[8] ROBERT W D,STEVEN C B,FAULKNER D J,et al.Identification of okadaic acid from a Caribbean dinoflagellate, Prorocentrum concavum[J].Toxicon,1990,28(4):371-377.
[9] REGUERA B,RIOBO P,RODRIGUEZ F,et al.Dinophysis toxins: causative organisms, distribution and fate in shellfish[J]. Marine Drugs, 2014,12(1): 394–461.
[10] TORGERSEN T,AASEN J,AUNE T.Diarrhetic shellfish poisoning by okadaic acid esters from Brown crabs (Cancer pagurus) in Norway[J].Toxicon, 2005,46(5): 572-578.
[11] MOREIRA-GONZLEZ A R,DOMIT C,ROSA K M S, et al.Occurrence of potentially toxic microalgae and diarrhetic shellfish toxins in the digestive tracts of green sea turtles (Chelonia mydas) from southern Brazil[J].Harmful Algae, 2023,128 (10):102498.
[12] MOLLERUP I M,BJRNESET J,KROCK B,et al.Did algal toxin and Klebsiella infections cause the unexplained 2007 mass mortality event in Danish and Swedish marine mammals?[J]. Science of The Total Environment, 2024,914:169817.
[13] KOIKE K,SATO S,YAMAJI M,et al.Occurrence of okadaic acid-producing Prorocentrum lima on the Sanriku coast, Northern Japan[J].Toxicon,1998,36 (12):2039-2042.
[14] ACCORONI S,CANGINI M,ANGELETTI R,et al.Marine phycotoxin levels in shellfish—14 years of data gathered along the Italian coast[J].Harmful Algae,2024,131:102560.
[15] LI A,MA J,CAO J,et al.Toxins in mussels (Mytilus galloprovincialis) associated with diarrhetic shellfish poisoning episodes in China [J].Toxicon,2012, 60(3):420-425.
[16] 李静, 朱磊, 沈浩,等.进境船舶压载舱沉积物中耐受藻类群落结构研究[J].交通节能与环保, 2021, 17(2) :39-43.
[17] 蒲阿敏,张贝贝,贾鹏,等. 渤海湾外来浮游植物物种及其入侵途径分析[J].农业资源与环境学报, 2020, 37(4): 477-483.
[18] 程玉,张圣佳,李金宇,等.基于GOCI的渤海海域赤潮信息遥感监测与分析[J].山东科技大学学报(自然科学版),2021,40(4):11-20.
[19] 王彬,崔健,李玲,等.渤海湾赤潮特征研究[J].海洋环境科学,2021,40(2):200-206.
[20] 国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准:贝类中腹泻性贝类毒素的测定: GB 5009.212-2016 [S].北京:中国标准出版社.2016:3-5.
[21] SVENSSON S.Depuration of Okadaic acid (Diarrhetic Shellfish Toxin) in mussels, Mytilus edulis (Linnaeus), feeding on different quantities of nontoxic algae[J].Aquaculture,2003,218(1-4): 277-291.
[22] LAWRENCE J E,CEMBELLA A D.An immunolabeling technique for the detection of diarrhetic shellfish toxins in individual dinoflagellate cells[J].Phycologia,1999,38(1):60-65.
[23] 孙洪潇,唐文娇,刘超,等.秦皇岛近岸海域脂溶性藻毒素污染状况与来源分析[J]. 海洋科学, 2023,47(3):41-48.
[24] 陈楠生,丁翔翔,崔宗梅.山东近海赤潮物种多样性研究进展[J].海洋与湖沼,2023,54(5):1258-1273.
[25] 宫长宝,冯志权,王 丽,等.獐子岛海域浮游甲藻及有毒微藻的年际变化研究[J].海洋与湖沼,2019,50(3):672-683.
[26] 刘仁沿,刘磊,梁玉波,等.我国近海有毒微藻及其毒素的分布危害和风险评估[J].海洋环境科学,2016,35(5):787-800.
[27] 杨辉,刘斌,赵慧琴,等.河北省市售贝类中脂溶性毒素的调查研究[J].食品安全质量检测学报,2021,12(5):1741-1745.
[28] 邵魁双,巩宁,杨青,等.甲藻孢囊在长山群岛海域表层沉积物中的分布[J].生态学报,2011,31(10):2854-2862.
Analysis on pollution status of diarrhetic shellfish poisons in retail marine shellfish of Tianjin
MA Dan1,2,BAI Ming1,2,YU Jie1,2,LI Yan1
(1.Tianjin Agricultural Ecological Environment Monitoring and Agricultural Product Quality Testing Center, Tianjin 300221, China;
2. Fisheries Environment and Aquatic Product Quality Testing Center of the Ministry of Agriculture and Rural Affairs (Tianjin), Tianjin 300221, China)
Abstract:To investigate the pollution status of diarrhetic shellfish poison (DSP) in commercial marine shellfish of Tianjin. From every April to August in 2019 to 2023, totally 354 samples of 10 kinds of marine shellfish from Tianjin markets were analyzed with ELISA detective. The results showed that, among 354 samples, there were 253 samples positive with DSP, the detection rate was 71%, the contents range of DSP were 10.40~154.47 μg/kg, average value was 51.44 μg/kg, there was no sample above the 160 μg/kg safety limit. Research has shown that during the high incidence of DSP from April to August every year, there was a low level of DSP in commercial marine shellfish of Tianjin. Among the 10 collected shellfish, Crassostrea gigas,Chlamys farreri,Scapharca subcrenata ranked among the top in terms of detection rate and average detection content, there was the lowest DSP content in May and the highest in August. Through this study, it was found that the
detection rate of DSP in commercial marine shellfish of Tianjin during the high incidence period from April to August each year has reached 100%. Although the content is generally low, in order to ensure the safety of public consumption, it is necessary to adhere to monitoring during the high incidence period. It is recommended that all culture areas continue to monitor the environment.
Key words:Tianjin; shellfish; diarrhetic shellfish poison (DSP)
(收稿日期:2024-05-07)

