抗菌肽PAJE 对金黄色葡萄球菌及其SCVs 的杀菌作用机制研究
高思琦 杨新建 朱德琪 关明玮 寇云婷 满程 焦健


摘要:金黄色葡萄球菌(Staphylococcus aureus)及其小菌落突变体(small colony variants,SCVs)感染是影响畜禽健康的主要问题。然而,传统抗生素治疗面临持续和复发性感染以及耐药性等许多挑战。抗菌肽PAJE具有广谱抗菌性,为深入探究抗菌肽PAJE的生物学特性及其对S. aureus 和SCVs杀菌作用机制,对其抗菌活性、稳定性、生物学特性进行测定。结果表明,抗菌肽PAJE对S. aureus 和SCVs细胞膜渗透力达54.7%和62.9%,同时通过上调Agr调控系统、下调SigB调控系统及生物膜相关基因的表达,从而极大程度地抑制生物膜形成。此外,较高温度及pH稳定性为抗菌肽PAJE提供了更好的加工、存储和环境耐受性。综上所述,抗菌肽PAJE可作为治疗S. aureus和SCVs及其生物膜感染的潜在候选肽之一,为替抗减抗类产品研发提供理论支撑。
关键词:金黄色葡萄球菌;小菌落突变体;抗菌肽PAJE;生物膜
doi:10.13304/j.nykjdb.2023.0878
中图分类号:S182 文献标志码:A 文章编号:10080864(2024)05015611
金黄色葡萄球菌(Staphylococcus aureus)是一种常见的人畜共患菌,在畜牧业中可引发奶牛乳房炎[12]、禽类腹膜炎等疾病[3],降低牛奶产量和质量,影响乳制品生产[4],造成禽类胃肠穿孔[5],给畜牧业造成了极大的经济损失。目前,该菌感染以万古霉素(vancomycin,Van)和阿莫西林等抗生素治疗为主[67],但在抗生素使用过程中,S. aureus 形成生物膜的能力增强,促进其定殖于上皮细胞,免疫防御逃避能力增加,致使复发或持续感染[8]。部分逃逸的S. aureus 还会发生代谢途径的改变,生成更难清除的小菌落突变体(small colonyvariants,SCVs)[9]。与S. aureus 相比,SCVs形成生物膜的能力增强[6],增加了免疫耐受能力[10]。多种抗生素联合用药治疗S. aureus 及SCVs感染[11],极大程度上加重了生物膜的形成,致使多种耐药性菌株出现,诱发持续性、复发性感染[12],给畜牧业带来巨大的损失。
生物膜由胞外聚合物组成,有生物膜包裹的细菌对传统抗生素的耐受性是相应浮游细胞的100~1 000倍[13]。庆大霉素诱导产生的SCVs形成生物膜的能力是S. aureus 的2倍[6]。持续使用抗生素或低抗生素剂量下,除出现抗生素修饰酶、细胞结合位点的改变和外排泵等经典的耐药性机制外[14],还可诱导SigB及Agr调控系统相关基因的表达发生变化,进而增强其生物膜形成能力。SigB调控系统中相关基因上调,在转录水平上诱导应激反应,增强了S. aureus 及SCVs产生物膜的能力[15]。Agr调控系统作为群体感应(quorum sensing,QS)系统中极具代表性的调控因子,主要对生物膜的解离与分散进行调控,当Agr调控系统表达水平降低或agr基因缺失时更易出现局部慢性感染[16]。但由于调控方式多样,不同的过程会出现相互矛盾的情况[17],使生物膜出现多种变型,但都与生物膜形成能力的增强有关。因此,利用传统抗生素对生物膜治疗仍存在许多挑战,亟需开发新型有效药物来治疗S. aureus及SCVs生物膜感染。
抗菌肽(antimicrobial peptides,AMPs)是一种具有多种作用模式的生物活性药物,作为新型抗生物膜制剂应用于感染治疗,是非常有前途的抗菌候选药物之一[1819]。抗菌肽不仅能在细菌生物膜形成早期进行干扰,防止细菌最初的粘附,还能通过促使微生物细胞脱离或杀死微生物细胞来破坏成熟的生物膜[20-22]。其杀菌模式是通过膜活性机制来抑制或消除病原微生物,而不是通过特异性位点结合或干扰细菌代谢[23],极大程度上克服了传统抗菌药物的耐药性问题,成为一种有前途的抗生素替代品[24]。PAJE作为一种杂合肽,是将凤蝶毒素的7 个氨基酸(RWKIFKK-NH2)与蜂王浆抗菌肽Jelleine-1 的8 个氨基酸(PFKISIHLNH2)进行合成,杂合抗菌肽PAJE 对S. aureusKACC 10196 显示出较强的抑菌活性,最小抑菌浓度(minimal inhibitory concentration,MIC)为4 μmol·L?1[25],本研究室通过抑菌试验初步验证其对S.aureus 及SCVs具有较好的抑菌活性,但作用机理尚不明确。为探究抗菌肽PAJE对S. aureus及SCVs的杀菌作用机理,本研究对其抗菌活性、稳定性、生物学特性和作用机理进行探讨,为进一步探究高效、安全、稳定可抑制S. aureus 及SCVs的抗菌肽提供研究思路并奠定理论基础。
1 材料与方法
1.1 试验材料
试验使用的菌株为S. aureus ATCC43300 与SCVs,其中S. aureus ATCC43300购于美国菌种保藏中心(American Type Culture Collection);SCVs由本实验室筛选并保存。
TSA(tryptic soy agar)与TSB(tryptic soy broth)培养基(青岛高科技工业园海博生物技术有限公司)用于S. aureus 和SCVs 生长的基本培养基,121 ℃灭菌20 min。
抗菌肽PAJE由上海强耀生物科技有限公司合成,序列为RWKIFKKPFKISIHL-NH2。
1.2 试验方法
1.2.1 试验菌株的培养与制备
将活化后的S. aureus 和SCVs按1%(体积分数)接种量转接至10 mL TSB培养基中,SCVs组需加入500 μL的庆大霉素(终质量浓度5 μg·mL?1),置于37 ℃恒温摇床振荡(300 r·min?1)培养至对数生长期(5×108CFU·mL?1)。
1.2.2 溶血性测定
参照文献[26]的方法,静脉取血后收集于肝素钠抗凝管,用0.9%生理盐水洗涤红细胞3次,至上清液无色透明,制成8%(体积分数)的红细胞悬浮液。利用二倍梯度稀释法将PAJE 稀释至64、32、16、8、4、2 μg·mL?1。分别取50 μL 8%的红细胞悬浮液和50 μL不同质量浓度(64、32、16、8、4、2 μg·mL?1)的抗菌肽溶液至1.5 mL 离心管中,设置3组平行,并置于37 ℃恒温培养箱静置孵育1 h,2 000 r·min?1 离心5 min,取100 μL上层清液置于96孔板中,使用酶标仪在540 nm 处测量紫外吸光值。并以生理盐水和0.1% Triton X-100紫外吸光值分别为0%和100%溶血对照。按照如下公式计算溶血度(%)。
1.2.3 最小抑菌浓度和最小杀菌浓度测定
参照文献[6]的方法测定S. aureus 和SCVs的最小抑菌浓度(MIC)。首先,采用96孔板进行试验,利用二倍梯度稀释法将抗菌肽PAJE用生理盐水稀释至8、16、32、64 μg·mL?1;分别加入90 μL用TSB培养基稀释至1×105 CFU·mL?1的S. aureus 和SCVs,置于37 ℃恒温培养箱静置培养12 h,测定PAJE 对S. aureus 和SCVs的MIC。阴性对照组(万古霉素)和空白对照组(ddH2O)做相同处理,每组3 次重复。基于MIC试验结果,从上述有抑菌效果的孔中取100 μL培养物涂布于TSA平板上,37 ℃过夜培养,进一步测定S. aureus 和SCVs的最小杀菌浓度(minimum bactericidal concentration, MBC)。
1.2.4 抗菌肽PAJE稳定性测定
抗菌肽PAJE稳定性测定方法参考文献[27]。活化SCVs至对数期(OD600=0.37)、S. aureus 至对数期(OD600=1)后将菌液稀释至1×105 CFU·mL?1。
将1 280 μg·mL?1的抗菌肽PAJE在不同温度(40、60、80、100 ℃)孵育1 h、不同pH(pH=2、4、7、8、10)孵育4 h、3 000 U·mg?1胃蛋白酶和250 U·mg?1胰蛋白酶条件下分别孵育4 h,用生理盐水将处理好的抗菌肽分别稀释至128、64、32、16、8、4、2、1、0.5 μg·mL?1。取不同试验组抗菌肽10和90 μL稀释菌液混匀,置于37 ℃恒温培养箱中过夜培养,利用酶标仪在600 nm 处测定抗菌肽PAJE 稳定性。对照组为菌液、未处理组和各缓冲液(pH 2的甘氨酸-盐酸缓冲液、pH 4 的醋酸钠缓冲液、pH 6的磷酸钠缓冲液、pH 8的Tris-盐酸缓冲液、pH 10的甘氨酸-氢氧化钠缓冲液、250 U·mg?1胰蛋白酶溶液、3 000 U·mg?1 胃蛋白酶溶液和生理盐水)。
1.2.5 抗菌肽PAJE 杀菌动力学测定
抗菌肽PAJE 杀菌动力学测定方法参照文献[28]。将S. aureus 和SCVs稀释至1×105 CFU·mL?1。分别加入1×MIC、2×MIC、4×MIC、8×MIC 的抗菌肽PAJE作为试验组,加入2×MIC 的万古霉素为阳性对照,未处理组为空白对照。将上述菌液置于37 ℃恒温摇床中培养,于0.0、0.5、1.0、2.0、4.0、6.0、8.0、10.0、12.0和24.0 h分别取样,10倍梯度稀释后取10 μL菌液,利用流泪法将菌液滴至TSA固体培养基上。37 ℃过夜培养12 h,统计单菌落数,绘制时间-杀菌曲线。
1.2.6 抗菌肽PAJE对S. aureus 和SCVs生物膜抑制能力测定
利用结晶紫染色法[29]测定生物膜。将培养至对数期的S. aureus 和SCVs用TSB梯度稀释至1×108 CFU·mL?1,每孔180 μL菌液和20 μL的1×MIC、2×MIC、4×MIC、8×MIC抗菌肽PAJE接种于96孔板中,作为试验组。TSB培养基加水为空白对照,菌液加水为阴性对照,37 ℃培养24 h。将每孔的上清液用移液枪小心吸弃,PBS溶液将剩余菌液清洗3次,自然晾干后向每孔中加入100 μL的2.5%(体积分数)戊二醛固定,90 min后吸弃固定液,PBS清洗2次;再向每孔中加入100 μL 0.1%的结晶紫溶液染色15 min,用蒸馏水冲洗掉多余染液,置于室温干燥;最后向每孔中加入200 μL 95%乙醇溶解30 min,用酶标仪在502 nm处测量吸光值。
1.2.7 抗菌肽PAJE对S. aureus 与SCVs相关基因表达
S. aureus 与SCVs 相关特性基因表达的测定方法参考文献[30]。挑取活化后的S. aureus 和SCVs 单菌落于TSB 及含5 μg·mL-1 庆大霉素的TSB培养基中过夜培养,1%转接培养至对数期,并稀释到1×108 CFU·mL?1,与2×MIC抗菌肽PAJE共培养2 h后,按RNAprep Pure细菌总 RNA 提取试剂盒(DP430)说明书提取RNA,再将RNA反转录成cDNA 作为荧光定量的模板,按ChamQUniversal SYBR qPCR Master Mix试剂盒说明书进行操作。采用2-△△ CT法[31],以PAJE处理组与未处理S. aureus 和SCVs作比较,对Agr及SigB调控系统及生物膜相关基因转录水平进行分析,>1为上调,<1为下调。引物如表1所示。
1.2.8 扫描电镜观察
扫描电镜观察方法参考文献[33]。用0.01 mol·L?1 PBS(pH 7.4)将培养至对数生长期的S. aureus 和SCVs稀释至1×108 CFU·mL?1,加入抗菌肽至菌悬液终质量浓度为4×MIC,37 ℃静置孵育2 h。置于室温下4 000 r·min?1 离心5 min,用PBS清洗菌体3次,于2.5%的戊二醛缓冲液(用0.01 mol·L?1 PBS 配置)、4 ℃过夜固定。用PBS洗涤菌体5次,每次7 min,加入1%的锇酸缓冲液固定1 h。再用PBS洗涤菌体3次,用乙醇(50%?70%?85%?95%×2?100%×2)梯度脱水,每次15 min,使用临界点干燥仪对样品进行干燥,用离子溅射仪使样品表面形成一层金属膜后,用扫描电子显微镜进行观察。
1.2.9 抗菌肽PAJE对S. aureus 和SCVs细胞膜的作用
抗菌肽PAJE对S. aureus 和SCVs细胞膜的作用的测定参照文献[34]。取S. aureus 和SCVs单菌落于培养基中过夜活化后转接培养至对数期,4 000 r·min?1 离心5 min,弃上清,用0.01 mol·L?1PBS(pH 7.4)洗涤3 次,并用相同溶液稀释成1×108 CFU·mL?1的菌悬液。取450 μL上述菌悬液加入50 μL 10×MIC 抗菌肽,使其终质量浓度为1×MIC。置于37 ℃ 恒温培养箱分别孵育30 和120 min,孵育结束后4 000 r·min?1 离心5 min,用0.01 mol·L?1 PBS缓冲液洗涤2次。上机前再加入0.5 mg·mL?1 PI(propidium iodide)染液至终质量浓度为50 μg·mL?1,室温下静置孵育15 min,上流式细胞仪FACS-Calibur 记录被PI 着染的阳性细菌数,阴性对照组(无抗菌肽,0.01 mol·L?1 PBS缓冲液)做相同处理。
2 结果与分析
2.1 抗菌肽PAJE 生物学特性分析
2.1.1 溶血性
溶血性和细胞毒性主要用来评价抗菌肽是否适宜静脉注射以及对哺乳动物正常细胞的损伤。由图1可知,溶血度随抗菌肽PAJE质量浓度的降低而下降,且当抗菌肽PAJE为32 μg·mL?1及以下时,溶血度低于5%,此时,抗菌肽PAJE的安全性较好。
2.1.2 抗菌肽PAJE对SCVs的MIC和MBC
如表2所示,抗菌肽PAJE对S. aureus 的MIC为8 μg·mL?1,MBC为16 μg·mL?1;对SCVs的MIC为16 μg·mL?1,MBC为32 μg·mL?1。
2.1.3 抗菌肽PAJE 稳定性
通过测定温度、pH和酶的稳定性,研究抗菌肽PAJE在不同环境中的耐受性,结果(图2)表明,胃蛋白酶及胰蛋白酶对抗菌肽PAJE的抑菌能力影响较大,经胃蛋白酶处理后对S. aureus 和SCVs 的抗菌活性分别下降93.75%和87.50%,经胰蛋白酶处理后对S. aureus和SCVs的抗菌活性均下降75.00%;pH对抗菌肽PAJE抑菌能力影响较小,仅在pH 2时对S.aureus的抗菌活性降低50.00%;温度对抗菌肽PAJE 抑菌能力影响也较小,仅在100 ℃时对S. aureus 和SCVs的抗菌活性降至80%。由此表明,当温度≥100 ℃及在胰蛋白酶和胃蛋白酶的作用下会影响抗菌肽PAJE的抑菌活性;或pH≤2时会影响抗菌肽PAJE对S.aureus 的抑菌活性。
2.2 抗菌肽PAJE 杀菌动力学分析
通过体外杀菌-时间曲线检测不同质量浓度抗菌肽PAJE的杀菌能力,结果(图3)表明,经过2×MIC、4×MIC 和8×MIC PAJE 处理后S. aureus 和SCVs在2.0 h内均呈现下降趋势,具有时间和浓度依赖性,且效果均优于CK 和2×MIC 万古霉素(2×MIC Van)。S. aureus 和SCVs 均在8×MICPAJE处理0.5 h后完全被抑制生长。
2.3 抗菌肽PAJE 对S. aureus 和SCVs 抑制生物膜形成能力分析
在生物膜形成初期添加抗菌肽PAJE和万古霉素,观察生物膜的形成情况。由图4可知,抗菌肽PAJE能够抑制金黄色葡萄球菌生物膜的形成。经1×至8×MIC PAJE处理2 h后,抑制S. aureus 及SCVs生物膜形成的效果优于万古霉素,其抑制能力约为万古霉素的2倍。
不同质量浓度PAJE抑制S. aureus 生物膜形成能力无显著差异,由此表明,1×MIC即可达到较好的抑制效果;不同质量浓度PAJE抑制SCVs生物膜形成能力存在显著差异,其中2×MIC 和4×MIC处理的抑菌效果较好,又以2×MIC抑制能力最强(图4)。
2.4 抗菌肽PAJE 对S. aureus 和SCVs 相关特性基因表达分析
由图5 可知,抗菌肽PAJE 处理S. aureus 与SCVs后,Agr调控系统相关基因的表达呈上调趋势,与未处理S. aureus 相比上调0.19~18.80倍,其中agrA、agrB、agrC、agrD 极显著上调(图5A),与未处理SCVs 相比,上调0.02~2.58 倍,其中RNAIII、agrB、agrD 均极显著上调(图5B);SigB调控系统中相关基因的表达量呈下调趋势,与未处理组S. aureus 和SCVs 相比,分别下调87.33%~92.81%和87.95%~67.55%,且与未处理组具有极显著差异(图5C、D);生物膜相关基因的表达呈下调趋势,与未处理组相比分别下降45.82%~91.92% 和6.00%~95.97%,其中relQ、relP、rsh、codY、clfA 在S. aureus 和SCVs 中均极显著下调(图5E、F)。
2.5 扫描电镜分析
利用扫描电子显微镜直接观察未处理组和抗菌肽PAJE处理后的S. aureus 和SCVs细胞的形态和完整性,结果(图6)显示,未处理的S. aureus 和SCVs细胞形态完整,表面光滑;经抗菌肽PAJE处理后,S. aureus 细胞的外面可观察到一些丝状粘附物质;SCVs细胞表面呈现出小泡状突起,细胞内出现空洞或破裂现象。
2.6 抗菌肽PAJE 对S. aureus 细胞膜的作用分析
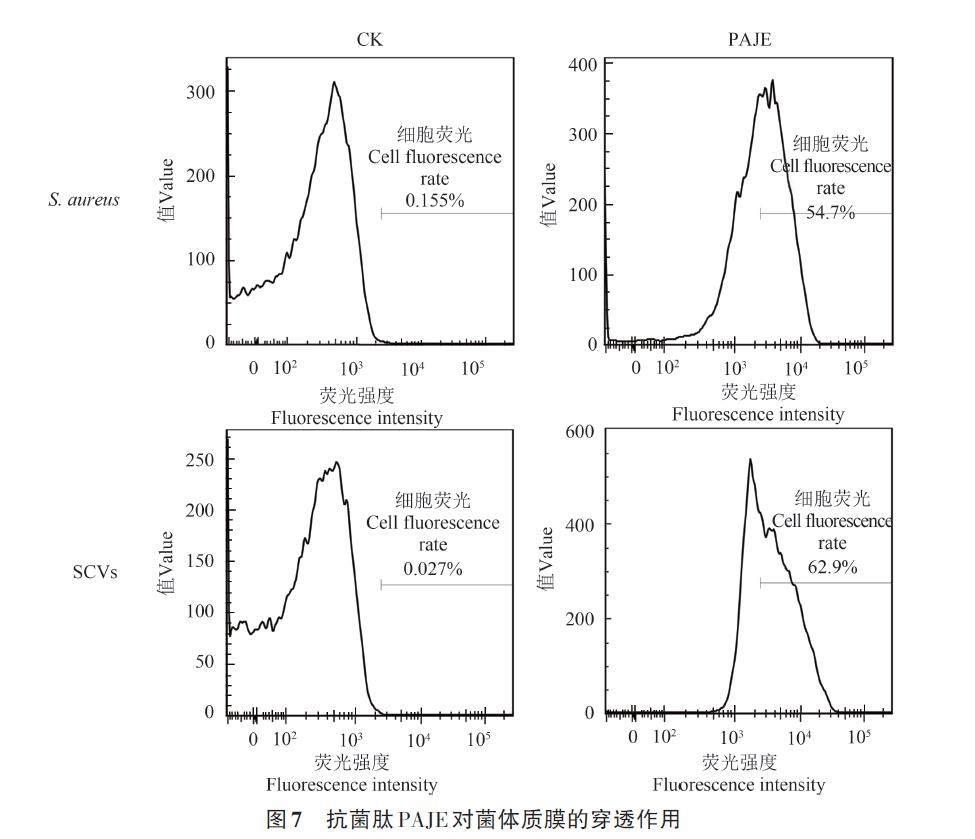
通过流式细胞仪检测抗菌肽PAJE 对S. aureus 和SCVs质膜的影响,结果(图7)表明,未处理组中,PI染色的S. aureus 和SCVs细胞荧光率分别为0.155%和0.027%,细胞有完整的细胞膜;经抗菌肽PAJE处理后,S. aureus 和SCVs细胞膜受损,PI对细胞的穿透率分别为54.7%和62.9%。
3 讨论
S. aureus 感染是影响畜牧生产的主要问题之一,在抗菌药物作用等应激环境下形成SCVs具有持续及复发性感染,同时加重细菌耐药性,而一线有效类抗生素替代品缺乏,使其治疗变得更为复杂[35]。此外,较难清除的生物膜是持续性感染的主要原因[19],且SCVs产生物膜的能力更强[6]。基于抗菌肽PAJE具有广谱抑菌活性[25],本研究进一步分析其生物学特性,并研究其对S. aureus 和SCVs的抑菌活性及其抗菌机制,为其后期的应用提供理论基础。
本研究利用温度、pH及蛋白稳定性对抗菌肽PAJE的稳定性进行分析,结果表明,其温度及pH稳定性较高,但耐酶解能力较低,因此可考虑注射治疗;但由于畜禽静脉注射不方便等问题,可通过改变肽链中氨基酸或个别氨基酸的构型方式[3637],也可通过替换为疏水氨基酸的方式[19,38],增加其耐酶解能力,进而达到方便口服或作为饲料添加剂用于防治 S. aureus 及其SCVs感染。
对抗菌肽PAJE抗生物膜能力及其生物膜相关基因的转录水平进行分析表明,抗菌肽PAJE处理后,S.aureus 及其SCVs 中Agr 调控系统相关基因表达上调,SigB调控系统相关基因表达下调,同时生物膜相关基因表达下调。Agr及SigB调控系统相关基因与生物膜形成相关基因有着密切的关系,且在S. aureus 转换为SCVs过程中也发挥着重要的作用[3940]。其中,sigB 是S. aureus 生物群落成熟的重要调节基因。缺乏sigB 导致agr 基因表达量增加,从而提高细胞外蛋白酶水平,改变蛋白水解酶活性,高水平的agr 基因表达具有抗菌作用[41]。sigB 是受生物膜形成相关基因CodY 直接调控的[40],RsbU 可正向调控sigB[42],与本研究结果一致。除此之外,clfB 等基因表达上调可增加生物膜的黏附作用[43],进一步增强感染能力。
利用扫描电镜及流式细胞仪分析表明,经抗菌肽PAJE处理后,S. aureus 的细胞壁皱缩,细胞膜破裂,PI可进入受损的菌体,表明抗菌肽PAJE通过与细菌细胞壁和细胞质膜相互作用致使细胞膜破裂,导致内容物泄漏,最终导致细胞死亡,这在其他抗菌肽中也有发现[4445]。
综上所述,抗菌肽PAJE对温度及pH的稳定性较高,且抑菌效果较高,能抑制生物膜相关基因转录,通过破坏细胞壁和细胞膜使其内容物释放,达到较为理想的抑菌杀菌效果。以上研究结果为开发S. aureus 和SCVs及其生物膜相关畜禽感染中的新肽药物及其添加剂的研发提供了新思路。
参 考 文 献
[1] ROLLIN E, DHUYVETTER K C, OVERTON M W. The costof clinical mastitis in the first 30 days of lactation: an economicmodeling tool [J]. Prev. Vet. Med., 2015, 122(3):257-264.
[2] BOBBO T, RUEGG P L, STOCCO G, et al .. Associationsbetween pathogen-specific cases of subclinical mastitis andmilk yield, quality, protein composition, and cheese-makingtraits in dairy cows [J]. J. Dairy Sci., 2017, 100(6):4868-4883.
[3] ZHENG X, YANG N, MAO R, et al .. Pharmacokinetics andpharmacodynamics of fungal defensin NZX againstStaphylococcus aureus-induced mouse peritonitis model [J/OL].Front. Microbiol., 2022, 13:865774 [2023-10-28]. https://doi.org/10.3389/fmicb.2022.865774.
[4] HOGEVEEN H, VAN DER VOORT M. Assessing theeconomic impact of an endemic disease: the case of mastitis[J]. Rev. Sci. Technol., 2017, 36(1):217-226.
[5] JIANG X, HE D, GAO L, et al .. Synergistic pathogenicity ofavian orthoreovirus and Staphylococcus aureus on SPFchickens [J/OL]. Poult. Sci., 2023, 102(10):102996 [2023-10-28]. https://doi.org/10.1016/j.psj.2023.102996.
[6] 周宇,李佳玉,王乐,等.金黄色葡萄球菌小菌落突变体诱导筛选及特性研究[J].中国农业科技导报,2023,25(5):147-157.
ZHOU Y, LI J Y, WANG L, et al .. Induction screening andcharacteristics of Staphylococcus aureus small colony variants[J]. J. Agric. Sci. Technol., 2023, 25(5):147-157.
[7] 冯春香.鸡葡萄球菌病的预防与治疗[J].兽医导刊,2021(13):27-28.
FENG C X. The prevention and treatment of Staphylococcusaureus disease in chickens [J]. Vet. Orient., 2021(13):27-28.
[8] P?REZ V K C, COSTA G M D, GUIMARES A S, et al ..Relationship between virulence factors and antimicrobialresistance in Staphylococcus aureus from bovine mastitis [J]. J.Glob. Antimicrob. Resist., 2020, 22:792-802.
[9] MARTIN V, WILHELM P, BINGFENG L, et al .. Novelpathways for ameliorating the fitness cost of gentamicinresistant small colony variants [J/OL]. Front. Microbiol., 2016,7:1866 [2023-10-28]. https://doi.org/10.3389/fmicb.2016.01866.
[10] PROCTOR R A, VAN LANGEVELDE P, KRISTJANSSON M,et al .. Persistent and relapsing infections associated with smallcolonyvariants of Staphylococcus aureus [J]. Clin. Infect. Dis.,1995, 20(1):95-102.
[11] BISCHOFF M, ENTENZA J M, GIACHINO P. Influence of afunctional sigB operon on the global regulators sar and agr inStaphylococcus aureus [J]. J. Bacteriol., 2001, 183(17): 5171-5179.
[12] 李冠楠,夏雪娟,隆耀航,等.抗菌肽的研究进展及其应用[J].动物营养学报,2014,26(1):17-25.
LI G N, XIA X J, LONG Y H, et al .. Research progress and applications of antimicrobial peptides [J]. Chin. J. Anim. Nutr.,2014, 26(1):17-25.
[13] FLEMMING H C, WINGENDER J. The biofilm matrix [J]. Nat.Rev. Microbiol., 2010, 8(9):623-633.
[14] TRAN N N, MORRISETTE T, JORGENSEN S C J, et al ..Current therapies and challenges for the treatment ofStaphylococcus aureus biofilm-related infections [J]. Pharmacotherapy,2023, 43(8):816-832.
[15] SCHILCHER K, ANDREONI F, DENGLER HAUNREITERV, et al .. Modulation of Staphylococcus aureus biofilm matrix bysubinhibitory concentrations of clindamycin [J]. Antimicrobiol.Agents Chemother., 2016, 60(10):5957-5967.
[16] TAN X, QIN N, WU C, et al .. Transcriptome analysis of thebiofilm formed by methicillin-susceptible Staphylococcusaureus [J/OL]. Sci. Rep., 2015, 5:11997 [2023-10-28]. https://doi.org/10.1038/srep11997.
[17] XIE X, LIU X, LI Y, et al .. Advanced glycation end productsenhance biofilm formation by promoting extracellular DNArelease through sigB upregulation in Staphylococcus aureus [J/OL].Front. Microbiol., 2020, 11:1479 [2023-10-28]. https://doi.org/10.3389/fmicb.2020.01479.
[18] MHLONGO J T, WADDAD A Y, ALBERICIO F, et al ..Antimicrobial peptide synergies for fighting infectious diseases[J/OL]. Adv. Sci., 2023, 10(26):e2300472 [2023-10-28]. https://doi.org/10.1002/advs.202300472.
[19] JIALE Z, JIAN J, XINYI T, et al .. Design of a novelantimicrobial peptide 1018M targeted ppGpp to inhibit MRSAbiofilm formation [J/OL]. AMB Express, 2021, 11(1):49 [2023-10-28]. https://doi.org/10.1186/s13568-021-01208-6.
[20] KANG M Y, JEONG H W, KIM J, et al .. Removal of biofilmsusing carbon dioxide aerosols [J]. J. Aerosol Sci., 2010, 41(11):1044-1051.
[21] SON J S, LEE S J, JUN S Y, et al .. Antibacterial and biofilmremoval activity of a podoviridae Staphylococcus aureusbacteriophage SAP-2 and a derived recombinant cell-walldegradingenzyme [J]. Appl. Microbiol. Biotechnol., 2010,86(5):1439-1449.
[22] NA D H, FARAJ J, CAPAN Y, et al .. Chewing gum ofantimicrobial decapeptide (KSL) as a sustained antiplaqueagent: preformulation study [J]. J. Control Release, 2005,107(1):122-130.
[23] ZASLOFF M. Antimicrbial peptides of multicellularorganisms: my perspective [J]. Adv. Exp. Med. Biol., 2019,1117:3-6.
[24] SHAZELY B E, YU G Z, JOHNSTON P R, et al .. Resistanceevolution against antimicrobial peptides in Staphylococcusaureus alters pharmacodynamics beyond the MIC [J/OL]. Front.Microbiol., 2020, 11:103 [2023-10-28]. https://doi.org/10.3389/fmicb.2020.00103.
[25] KIM S R, CHOI K H, KIM K Y, et al .. Development of a novelshort synthetic antibacterial peptide derived from theswallowtail butterfly Papilio xuthus larvae [J]. J. Microbiol.Biotechnol., 2020, 30(9):1305-1309.
[26] 练家惠,陈向东,汪辉,等.人工合成抗菌肽生物信息学分析及其抑菌活性研究[J].药学与临床研究,2020,28(4):251-254.
LIAN J H, CHEN X D, WANG H, et al .. Bioinformatics andantimicrobial activity of a remoulded antimicrobial peptide [J].Pharm. Clin. Res., 2020, 28(4):251-254.
[27] 于佳民,赵倩,张志焱,等.多黏类芽孢杆菌抗菌肽的分离纯化及特性研究[J].中国畜牧兽医,2021,48(8):2830-2837.
YU J M, ZHAO Q, ZHANG Z Y, et al .. Separation, purificationand characteristics analysis of antibacterial peptides fromPaenibacillus polymyxa [J]. China Anim. Husb. Vet. Med.,2021, 48(8):2830-2837.
[28] 张炜,杭柏林,司素锦,等.抗菌肽BSN-37的抑菌活性及其稳定性分析[J].中国畜牧兽医,2019,46(1):287-295.
ZHANG W, HANG B L, SI S J, et al .. Bacteriostatic activityand stability analysis of antimicrobial peptide BSN-37 [J].China Anim. Husb. Vet. Med., 2019, 46(1):287-295.
[29] 戴雨芸,李超,袁中伟,等.香芹酚抑制金黄色葡萄球菌生物被膜的形成[J].微生物学通报,2020,47(3):813-820.
DAI Y Y, LI C, YUAN Z W, et al .. Inhibition of Staphylococcusaureus biofilm by carvacrol [J]. Microbiol. China, 2020, 47(3):813-820.
[30] 郭梦冉,董兵,李聪,等.荧光定量PCR检测金黄色葡萄球菌方法的建立及应用[J]. 河北农业大学学报,2018,41(3):72-76,83.
GUO M R, DONG B, LI C, et al .. Establishment andapplication of the real-time fluorescence-based quantitativePCR method for detection of Staphylococcus aureus [J]. J.Hebei Agric. Univ., 2018, 41(3):72-76,83.
[31] LIVAK K J, SCHMITTGEN T D. Analysis of relative geneexpression data using real-time quantitative PCR and the 2-ΔΔCTmethod [J]. Methods, 2001, 25(4):402-408.
[32] WU S, QIN B, DENG S, et al .. CodY is modulated by YycFand affects biofilm formation in Staphylococcus aureus [J/OL].Front. Microbiol., 2022, 13:967567 [2023-10-28]. https://doi.org/10.3389/fmicb.2022.967567.
[33] 单玉雪,杨娜,滕达,等.抗菌肽NZ2114对来源于奶牛乳房炎的无乳链球菌及其生物膜的消杀作用[J]. 中国畜牧兽医,2020,47(7):2284-2294.
SHAN Y X, YANG N, TENG D, et al .. The disinfection effectof antimicrobial peptide NZ2114 on Streptococcus agalactiaeisolated from bovine mastitis and its biofilm [J]. China Anim.Husb. Vet. Med., 2020, 47(7):2284-2294.
[34] 杨昆,王欢,高洁,等.抗菌肽BCp12对大肠杆菌壁膜及DNA损伤的作用机制[J].食品科学,2021,42(19):114-121.
YANG K, WANG H, GAO J, et al .. Mechanism by whichantimicrobial peptide BCp12 acts on the cell wall andmembrane of Escherichia coli cells and induces DNA damage[J]. Food Sci., 2021, 42(19):114-121.
[35] HASSOUN A, LINDEN P K, FRIEDMAN B. Incidenceprevalence, and management of MRSA bacteremia acrosspatient populations—a review of recent developments inMRSA management and treatment [J/OL]. Crit. Care., 2017,21(1): 211 [2023-10-28]. https://doi. org/10.1186/s13054-017-1801-3.
[36] DOMHAN C, UHL P, KLEIST C, et al .. Replacement ofl-amino acids by d-amino acids in the antimicrobial peptideranalexin and its consequences for antimicrobial activity and 28]. https://doi.org/10.3390/molecules24162987.
[37] GRAZIA A D, CAPPIELLO F, COHEN H, et al .. D-aminoacids incorporation in the frog skin-derived peptide esculentin-1a(1-21)NH2 is beneficial for its multiple functions [J]. AminoAcids, 2015, 47(12):2505-2519.
[38] HANEY E F, BRITO-S?NCHEZ Y, TRIMBLE M J, et al ..Computer-aided discovery of peptides that specifically attackbacterial biofilms [J/OL]. Sci. Rep., 2018, 8(1):1871 [2023-10-28]. https://doi.org/10.1038/s41598-018-19669-4.
[39] MITCHELL G, BROUILLETTE E, S?GUIN D L, et al .. A rolefor sigma factor B in the emergence of Staphylococcus aureussmall-colony variants and elevated biofilm production resultingfrom an exposure to aminoglycosides [J]. Microbiol. Pathog.,2010, 48(1):18-27.
[40] PROCTOR R A, VON EIFF C, KAHL B C, et al .. Small colonyvariants: a pathogenic form of bacteria that facilitatespersistent and recurrent infections [J]. Nat. Rev. Microbiol.,2006, 4(4):295-305.
[41] LAUDERDALE K J, BOLES B R, CHEUNG A L, et al ..Interconnections between sigma B, agr, and proteolytic activityin Staphylococcus aureus biofilm maturation [J]. Infect.Immun., 2009, 77(4):1623-1635.
[42] LEE J, ZILM P S, KIDD S P. Novel research models forStaphylococcus aureus small colony variants (SCV)development: co-pathogenesis and growth rate [J/OL]. Front.Microbiol., 2020, 11:321 [2023-10-28]. https://doi.org/10.3389/fmicb.2020.00321.
[43] ABRAHAM N M, LAMLERTTHON S, FOWLER V G, et al ..Chelating agents exert distinct effects on biofilm formation inStaphylococcus aureus depending on strain background: role forclumping factor B [J]. J. Med. Microbiol., 2012, 61(Pt8):1062-1070.
[44] YANG N, LIU X, TENG D, et al .. Antibacterial and detoxifyingactivity of NZ17074 analogues with multi-layers of selectiveantimicrobial actions against Escherichia coli and Salmonellaenteritidis [J/OL]. Sci. Rep., 2017, 7(1): 3392 [2023-10-28].https://doi.org/10.1038/s41598-017-03664-2.
[45] YANG N, TENG D, MAO R, et al .. A recombinant fungaldefensin-like peptide-P2 combats multidrug-resistant Staphylococcusaureus and biofilms [J]. Appl. Microbiol. Biotechnol., 2019,103(13):5193-5213.
(责任编辑:张冬玲)
基金项目:北京城市学院种子基金项目(KYZZ202005)。

