水稻RR 基因家族生物信息学及表达模式分析
陈明迪 胡桂花 张海文 王旺田
摘 要:水稻反应调节因子( response regulators,RR)家族在植物生长发育中扮演着重要角色,探究RR基因在水稻中的进化及生物学特征具有重要意义。水稻RR 基因家族共有22个成员,包含15个A型和7个B型基因。分析发现,水稻RR蛋白的理化性质存在差异,其中B型均为亲水蛋白(GRAVY<0);水稻RR 基因有5个旁系基因对,分别为OsRR8 和OsRR15、OsRR5 和OsRR11、OsRR9 和OsRR10、OsRR1 和OsRR2、OsRR20 与OsRR18,预测其与已知功能基因具有相似的功能;保守基序Motif 1与Motif 3均属于REC超级家族,作为响应调节器接收来自双组分磷酸转移系统中的信号传导,在22个OsRR蛋白中均有分布。调控元件与表达模式分析表明,RR 基因具有调控脱落酸、水杨酸、茉莉酸、赤霉素与生长素等多种信号转导的潜能,参与植物防御低温、干旱等胁迫及光和厌氧等信号响应过程,同时也具有调控水稻不同组织生长发育的功能。通过对水稻RR 基因进行生物信息学分析,为后续深入研究水稻RR家族成员的功能提供理论依据,也为进一步揭示植物生长发育及信号传导机制奠定了基础。
关键词:水稻;RR家族;生物信息学;表达模式分析
doi:10.13304/j.nykjdb.2024.0190
中图分类号:S511,Q78 文献标志码:A 文章编号:10080864(2024)05002010
水稻是世界上重要的谷类粮食作物之一,其生长发育与产量和品质息息相关[1]。细胞分裂素(cytokinin, CK)在调控水稻株型与穗部性状(如分蘖数、节间数、节间长度、枝梗、穗长和穗粒数等)方面发挥重要作用。细胞分裂素信号转导主要通过双组分磷酸转移系统(two-component systems,TCS)进行[2]。反应调节因子(response regulators,RR)家族作为CK信号转导的重要组分,参与植物生长发育和胁迫适应等过程,是细胞分裂素信号的初级响应基因。
基于水稻基因组数据库(RGAP,http://rice.plantbiology.msu.edu/index.shtml),在水稻中发现22个反应调节因子基因(OsRRs),其中,15个为A型RR 基因(A 型RRs,OsRR1~15),7 个为B 型RR基因(B 型RRs,OsRR16~22),它们编码的蛋白存在标志性残基D-D-K[3]。A 型RRs 被称为细胞分裂素信号转导的负调节因子,包含1个接收结构域和1个短的可变延伸(少于90个氨基酸),该结构域行使转录激活功能;B型RRs是细胞分裂素信号的正调节因子[4],具有1个接收器域和1个扩展的C端输出域,该输出域包含1个GARP、1个C端反式激活域和1个可变扩展,Myb基序在所有B型RRs中都是高度保守的。水稻、拟南芥和玉米中RRs的氨基酸序列比对结果表明,大多数A型和所有B 型OsRRs 都含有高度保守的赖氨酸(Lys)[4]。
A 型RRs 中,过表达OsRR1 导致开花延迟;生长素诱导的水稻突变体(CRL5)通过正向调控OsRR1 来抑制细胞分裂素信号通路,从而促进冠根发育的起始[5]。OsRR1 与 Ehd1 发生物理相互作用以形成异二聚体,OsRR1 过表达的植物表现出晚花表型[6]。OsRR3 和OsRR5 主要作为细胞分裂素信号通路的负调控因子,它们的过表达导致外源性细胞分裂素的敏感性降低[7]。OsRR6 在花药中表达量高,在芽顶端分生组织中表达量低,过表达OsRR6 转基因水稻表现出矮化、根系和圆锥花序发育不良[8]。OsRR6 转基因拟南芥植株在红光、远红光和蓝光环境下,下胚轴生长显著减缓;在单色光和白光的照射下,其下胚轴生长则无显著变化,植株的叶片保持绿色的时间更长,花青素含量增加,且不定根生成数量也有所提升[9],过表达OsRR6 对干旱和盐碱胁迫的耐受性更强。转录组分析显示,与防御反应和花青素代谢相关的基因在OsRR6-OE 材料中上调[10]。OsRR9 和OsRR10 基因会影响与光合作用、转录和植物激素信号传导相关的多个基因的表达,能够在不同生长阶段的叶片中检测到,并在孕穗期达到峰值,OsRR9 和OsRR10 在枝条中比根或花序的表达量更高,且负向调控水稻幼苗的耐盐性[11]。
B 型RRs 的主要作用是调控细胞分裂素反应的转录,在水稻生长、发育和细胞分裂素信号传导中发挥作用[12]。OsRR22 定位于细胞核中,OsRR22-OE材料对细胞分裂素反应增强、株高下降、分蘖数增加、开花时间延迟,影响水稻花序的发育,减少分枝与结实率,负调节水稻的盐胁迫耐受性[13]。
本研究利用最新的水稻基因组数据库获得RR 家族基因,从理化性质、系统进化关系、基因结构、保守结构域、启动子顺式作用元件、表达模式等方面进行系统分析,为进一步探讨水稻RR 基因家族的功能提供依据。
1 材料与方法
1.1 数据来源
用于生物信息学分析的水稻全蛋白序列与全基因组序列下载自http://asia.ensembl.og/index.html。
1.2 水稻RR 蛋白理化性质分析
利用EXPASy(https: lweb.expasy.org/protparam/)在线工具分析水稻RR蛋白的物理和化学性质,包括氨基酸数目、分子量大小、等电点与亲水性。
1.3 水稻RR 基因家族系统发育树的构建
运用MEGA11.0软件及其内置的ClustalW对水稻的RR 蛋白序列进行多重比对,并采用Neighbor-Joining 法构建系统发育树,设定Bootstrap值为1 000。
1.4 水稻RR 蛋白保守基序预测
利用MEME Suite5.3.3 (https: //meme-suite.org/meme/)预测水稻RR 蛋白保守基序,借助TBtools软件对该基因家族的保守基序进行可视化。
1.5 水稻RR 基因启动子区域的顺式调控元件预测
用TBtools软件提取水稻RR 基因CDS(codingsequence)上游2 000 bp序列,通过PlantCare (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对水稻RR 基因的顺式调节元件进行分析。
1.6 水稻RR 基因在不同组织中的表达模式
从BAR数据库(https://www.bar.utoronto.ca/)进入ePlant Rice数据库,检索水稻不同发育阶段的表达数据,并对RR 基因的表达模式进行分析,包括基因在不同组织器官中的表达量、表达时空特性等,并构建热图。
2 结果与分析
2.1 水稻RR 蛋白理化性质分析
OsRR 基因编码氨基酸数量为121(OsRR8)~696(OsRR20),分子量为13 561.68(OsRR14)~76 623.66(OsRR21) Da,等电点为4.21(OsRR7)~8.82(OsRR11),亲水性为-0.602(OsRR17)~0.212(OsRR11),其中B型RRs均为亲水蛋白(GRAVY<0),氨基酸数量远多于A型RRs。水稻RRs的理化性质存在差异,说明这些成员在水稻生长发育过程中发挥不同的调控作用。
2.2 OsRRs 同源序列分析
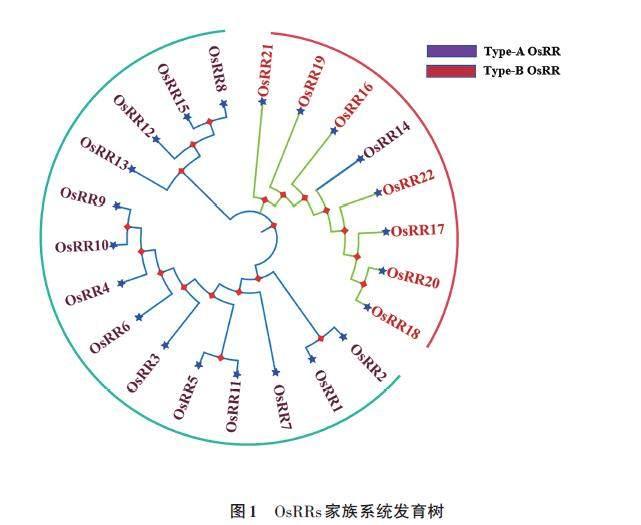
水稻RR家族蛋白的系统进化树如图1所示。可以看出,水稻RR 基因中有5个旁系基因对,分别为OsRR8 和OsRR15、OsRR5 和OsRR11、OsRR9和OsRR10、OsRR1 和OsRR2、OsRR20 与OsRR18,旁系基因对往往共同参与某些复杂的生物过程,如信号转导、代谢、发育调控等,从而影响这些过程的效率、精确性和稳健性。
A型与B型RR蛋白在进化树的分布也表明了它们的功能可能存在一定差异,前期研究表明,A型与B型响应调节因子在功能上可能发挥不同作用,OsRR1可能通过与Ehd1结合形成无活性的复合物,从而抑制Ehd1的活性,影响水稻的开花过程[6]。这种相互作用和调控机制在水稻的生长和发育中起着关键作用。OsRR22 是个负调控基因,编码B 型反应调节蛋白转录因子,参与细胞分裂素信号转导和代谢,其功能缺失可以显著提高水稻的耐盐性,这表明其在应对盐胁迫等环境压力中具有重要的作用[12]。A型和B型调节因子基因在表达模式和调控机制上也存在不同,单子叶模式植物水稻中,A 型调节因子基因(如OsRR1~10)显示出组织特异表达和光响应表达模式的重叠或者不同,这可能与它们在不同生理过程中的特定作用有关,而B型调节因子基因的表达模式和调控机制需要进一步研究,这与水稻OsRR家族蛋白同源序列分析的结果也具有高度的相似性。
过表达CRL5 材料在冠根启动过程中表现出细胞分裂素抗性表型,并上调细胞分裂素信号的2个负调控基因OsRR1 和OsRR2 的表达,而这2个基因又在crl5 突变体中下调表达,这与其作为旁系基因对也存在一定的联系[5],OsRR5 过表达会降低植株对外源细胞分裂素的敏感性,细胞分裂素处理后,过表达植株主根与侧根更长;大多数A型RR 基因的表达被OsRR3 和OsRR5 抑制[7],预测OsRR11 也具有类似的功能;同时,旁系基因对的研究也有助于发现水稻RR 家族基因新的药物靶点和改良农作物的性状。水稻RR 家族中的A型和B型基因在功能、表达模式和调控机制等方面存在明显的差异,这些差异使得它们在水稻的生长、发育和应对环境压力等方面发挥着不同的作用。
2.3 水稻RR 家族蛋白保守基序的分析
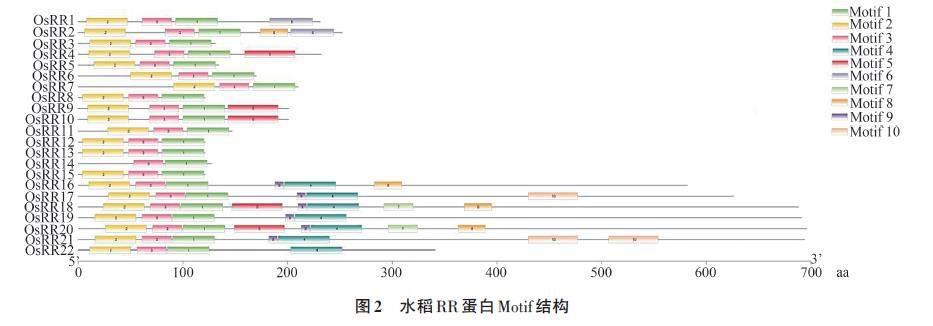
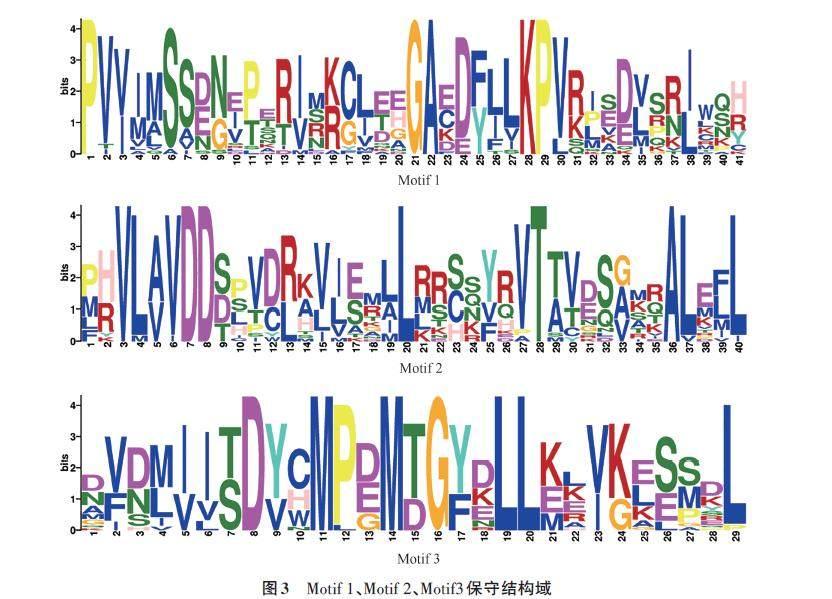
基于水稻全蛋白数据库,对水稻RR 蛋白基序进行分析,结果(图2)表明,OsRRs 的Motif 数量及排列均存在一定的差异,其中Motif 1 与Motif 3在22个OsRR蛋白中均有分布;而Motif 2在除OsRR14外的其他蛋白序列中有分布,且主要分布在蛋白质的N端;Motif 4主要位于蛋白质的C 端,Motif 6 只存在于A 型OsRRs,Motif 4、Motif 7、Motif 9、Motif 10只存在于B型OsRRs;此外还有一些氨基酸具有高度的保守性,如天冬氨酸(D)、亮氨酸(L)、精氨酸(R)、赖氨酸(K)、半胱氨酸(C)、甘氨酸(G)、天冬酰胺(N)、甲硫氨酸(M)(图3)。对于出现较多的Motif 1、Motif 2 与Motif 3基序,利用CDD网站探究其基序特征,发现Motif 1、Motif 2 均属于REC 超级家族(图4),作为响应调节器接收来自双组分磷酸转移系统中的信号进行传导。Motif 4、Motif 7、Motif 9、Motif 10 基序只在B 型OsRRs 中出现,而B 型OsRRs是细胞分裂素信号的正调节因子,这或许与其独有的保守基序有一定关联;Motif 4基序作为PLN03162 超级家庭的一员,拥有稳定遗传的保守基序。氨基酸的保守性使水稻RR 家族的D-D-K结构域形成了相对保守的空间结构,不同的保守基序对应不同的功能,结构域的保守性及功能域多变性与复杂性预示着水稻RR 基因功能的多样性和重要性。
2.4 水稻RR 基因启动子区域的顺式调控元件分析
利用Plantcare分析水稻RR 基因的启动子元件,共得到3 634个元件,其中667个与基因功能相关。按照功能进行分类,在OsRR 基因启动子中共检测到42种顺式作用元件,主要包括4种类型:光响应型、激素响应型、环境响应型和生长发育响应型(表2)。其中,OsRR11 启动子含有的顺势元件数量最多,OsRR17、OsRR18 启动子含有的元件数最少。光响应型元件数量最多,共281个,占比42.13%,其中G-box、Box 4 与GT1-Motif元件数量较多;其次是激素响应型元件,共236 个,占比(TCA-element)、茉莉酸响应(CGTCA-motif、TGACG-motif)、赤霉素响应(P-box、GARE-motif、TATC-box)与生长素响应(AuxRR-core、TGAelement)等元件;胁迫响应元件97个(ARE、MBS、GC-motif、LTR、TC-rich repeats),占比14.54%;生长发育响应元件有53 个,占比7.95%,其中包含种子特异调控(RY-element)、分生组织表达(CATbox、NON-box)、昼夜节律控制(circadian)、细胞周期调控(MSA-like)等元件。研究表明,6-BA会诱导OsRR1 基因上调表达[6],这或许与OsRR1 启动子中含有赤霉素反应元件(GARE-motif)有关;OsRR6 在脱水和低温胁迫下的水稻幼苗中的表达增强[8],这可能与其启动子中含有胁迫响应元件GC-motif、LTR与ARE有关。激素响应中,A型RR 类的OsRR11、OsRR12 与OsRR15 的启动子含有响应元件最多,集中于ABRE与CGTCA-motif,预测可能在水稻雄蕊发育、根伸长、侧根形成以及表皮毛起始等生理过程中扮演重要角色,并在植物应对干旱、高温、臭氧和紫外线等环境胁迫时发挥一定的功能;胁迫响应中,B型的OsRR19基因含有元件数最多,以GC-motif(缺氧特异性诱导的增强子元件)最为突出,暗示了OsRR19 可能对于抗涝、抗旱发挥一定的生理机能。整体来看,水稻RR 基因家族存在响应脱落酸、水杨酸、茉莉酸、赤霉素与生长素等多种激素信号调控的潜能,参与到植物防御低温、干旱等胁迫反应及光和厌氧信号响应过程中,同时也参与了水稻不同生长发育的调控等功能。
2.5 水稻RR 基因特异性表达规律
用TBtools软件计算基因在嫩叶、成熟叶、花序、茎尖分生组织(shoot apical merist, SAM)、根、种子中的表达量,分析植物器官特异性基因表达模式(图5)。由于B型RR 基因含有D-D-K接受结构域与能够结合A型RR 基因启动子的Myb元件,而MYB家族转录因子广泛参与植物的各种生物过程,B型RRs 的表达量整体高于A型RRs,或与之有一定关联;嫩叶基因表达整体上要高于老叶,可能是因为嫩叶处于快速生长期,基因活跃,需要完成气孔开合、光合作用、养分输送等基本功能,故而基因表达量相对较高。在水稻不同组织中,表达量较高的基因有OsRR6、OsRR17、OsRR18、OsRR19 与OsRR20;RR 基因茎尖分生组织(SAM)的表达量要低于其他组织,分析原因是因为水稻SAM决定着株高、穗长、分蘖数等重要农艺性状,这些农艺性状表现于水稻抽穗期与成熟期,而在水稻营养生长的过程中,这些基因在SAM的表达量相对较少。综上,不同水稻RR基因在组织中表达各异,具有特定的表达模式。
3 讨论
通过对水稻RR家族成员的结构和Motif分析发现,水稻RR 蛋白含有10种Motif,其中所有成员均拥有Motif 1与Motif 3,其可作为鉴定水稻RR家族成员的重要依据[14]。在10个Motif中,Motif 1、Motif 2与Motif 3基序出现较多,Motif 1、Motif 2均属于REC超级家族,作为响应调节器通过接收来自双组分磷酸转移系统中的信号进行传导,Motif 4作为PLN03162 超级家庭的一员,拥有稳定遗传的保守基序,这也为后续区分与鉴定水稻A、B型RR 基因提供依据。
植物在其生命周期中经常遭受多种生物和非生物胁迫,但也进化出了一系列保护机制,主要体现在胁迫反应基因的表达调控上[15]。本研究深入分析了水稻RR 基因上游2 000 bp启动子区的顺式作用元件,发现光响应元件最为丰富,其次是激素类响应元件,如脱落酸、茉莉酸和水杨酸,这些激素在植物应对胁迫和信号转导中起关键作用[16-17]。其中茉莉酸甲酯及其衍生物在植物应对生物和非生物胁迫中扮演重要角色[18]。茉莉酸也参与调控植物的根系生长、种子萌发等发育过程[19]。水稻RR 基因启动子区域中脱落酸和茉莉酸甲酯响应元件尤为丰富,暗示了其与ABA的潜在交互作用[20]。此外,除了核心启动子元件外,水稻RR 基因启动子还包含许多与胁迫和生长发育相关的元件,如OsRR3、OsRR8 与OsRR13 启动子具有参与胚乳表达的顺势元件GCN4_motif,预测其可能与水稻的生长发育高度相关;OsRR5 启动子包含Motif I元件,该元件同向作用调控根特异性,水稻根能够合成氨基酸与细胞分裂素, OsRR5主要作为细胞分裂素信号通路的负调控因子,细胞分裂素处理后过表达主根与侧根相对于野生型更长,说明OsRR5 对水稻根的生长具有促进作用。目前,B型RR 基因只对OsRR22 的生理生化性状进行了研究,证实其与水稻株高、分蘖数、开花时间、花序发育、分枝与结实率存在关联,并在盐胁迫响应过程中具有负调节作用[12]。其他基因的相关功能有待验证,如与OsRR22 相邻的OsRR17 是否也具有相似的功能。
水稻RR 家族基因在表达模式方面呈现出多样性和复杂性。一些RR 基因在水稻花序和根中的表达量较高,这可能与它们在这些组织中的特定功能有关[21]。花序作为水稻产量形成的关键部位,其形态结构的发育直接决定了最终产量[22]。因此,OsRR6、OsRR17 和OsRR19 等在水稻花序上表达突出的基因可能与产量形成密切相关。同时,根作为水稻吸收水分和养分的主要器官,其发育状况对水稻的生长发育和产量也有重要影响,OsRR6、OsRR8、OsRR9 等在水稻根中表达量高的基因可能参与了根的调控,从而影响水稻的生长发育。
本研究通过生物信息学和表达模式分析,深入探讨了水稻RR 基因家族的生物学功能,为后续深入研究RR 基因家族的生理生化功能奠定了理论基础。未来研究可通过基因敲除、过表达等手段进一步分析特定RR 基因的功能,有望揭示其在水稻生长发育及逆境响应中的关键作用,为水稻育种和产量提升提供新的策略和途径。
参考文献
[1] 李恩宇,陈光辉,方希林,等.不同种植模式对水稻生长发育与产量品质的影响[J].湖南农业科学,2023(11):14-18,29.
LI E Y, CHEN G H, FANG X L, et al .. Effects of differentcropping patterns on growth, development and yield quality ofrice [J]. Hunan Agric. Sci., 2023(11):14-18,29.
[2] HWANG I, CHEN H C, SHEEN J. Two-component signaltransduction pathways in Arabidopsis [J]. Plant Physiol., 2002,129(2):500-515.
[3] DU L M, JIAO F C, CHU J, et al .. The two-component signalsystem in rice (Oryza sativa L.): a genome-wide study ofcytokinin signal perception and transduction [J]. Genomics,2007,89(6):697-707.
[4] KIM H J, KIEBER J J, SCHALLER G E. Overlapping andlineage-specific roles for the type-B response regulators ofmonocots and dicots [J].Plant Signal Behav., 2012,7(9):1110-1113.
[5] KITOMI Y, ITO H, HOBO T, et al .. The auxin responsive AP2/ERF transcription factor CROWN ROOTLESS5 is involved incrown root initiation in rice through the induction of OsRR1, atype-A response regulator of cytokinin signaling [J]. Plant J.,2011,67(3):472-484.
[6] CHO L H, YOON J, PASRIGA R, et al . Homodimerization ofEhd1 is required to induce flowering in rice [J]. Plant Physiol.,2016 , 170(4):2159-71.
[7] CHENG X, JIANG H, ZHANG J, et al .. Overexpression of type-A rice response regulators, OsRR3 and OsRR5, results in lowersensitivity to cytokinins [J]. Genet Mol. Res., 2010, 9(1):348-359.
[8] HIROSE N, MAKITA N, KOJIMA M, et al .. Overexpression ofa type-A response regulator alters rice morphology andcytokinin metabolism [J]. Plant Cell Physiol., 2007, 48(3):523-539.
[9] BHASKA R A, PAUL L K, SHARMA E, et al .. OsRR6, a type-A response regulator in rice, mediates cytokinin, light andstress responses when over-expressed in Arabidopsis [J]. PlantPhysiol. Biochem., 2021,161:98-112.
[10] JAIN M, TYAGI A K, KHURANA J P. Molecular characterizationand differential expression of cytokinin-responsive type-A responseregulators in rice (Oryza sativa) [J]. BMC Plant Biol. 2006 Feb13;6:1.
[11] WANG W C, LIN T C, KIEBER J, et al .. Response regulators 9and 10 negatively regulate salinity tolerance in rice [J]. PlantCell Physiol., 2019, 60(11):2549-2563.
[12] YAMBURENKO M V, WORTHEN J M, ZEENAT A, et al ..Functional analysis of the rice type-B response regulator RR22[J/OL]. Front. Plant Sci., 2020,11:577676 [2024-04-01]. https://doi.org/ 10.3389/fpls.2020.577676.
[13] LIU Y, PENG X, MA A , et al .. Type-B response regulatorOsRR22 forms a transcriptional activation complex with OsSLR1 tomodulate OsHKT2; 1 expression in rice [J]. Sci. China Life Sci.,2023,66(12):2922-2934.
[14] 郝爱平,韩雪杨,薛巨坤,等.水稻RR基因家族的生物信息学分析[J].西南农业学报,2023,36(10):2135-2143.
HAO A P,HAN X Y,XUE J K, et al .. Bioinformatics analysis ofDBB gene family in rice [J]. Southwest China J. Agric. Sci.,2023,36(10):2135-2143.
[15] 赵晶晶,詹万龙,周浓.非生物胁迫下植物体内活性氧和丙酮醛代谢的研究进展[J].南方农业学报,2022,53(8):2099-2113.
ZHAO J J, ZHAN W L, ZHOU N. Research progress on themetabolisms of reactive oxygen species and methylglyoxal inplants under abiotic stresses [J]. J. Southern Agric., 2022,53(8):2099-2113.
[16] 王新永,蔺祯,王鹏程.植物激素脱落酸受体偶联途径研究进展[J].植物生理学报,2023,59(4):741-758.
WANG X Y, LIN Z, WANG P C. Recent advances inphytohormone abscisic acid receptor-coupled pathway [J]. PlantPhysiol. J., 2023,59(4):741-758.
[17] 焦龙,陈勋,谭荣荣,等.植物茉莉酸与水杨酸信号途径互作研究进展[J].植物生理报,2023,59(8):1489-1504.
JIAO L, CHEN X, TAN R R, et al .. Research progress on theinteraction between jasmonic acid and salicylic acid signalingpathways in plants [J]. Plant Physiol. J., 2023,59(8):1489-1504.
[18] 王小菁,萧浪涛,董爱武,等.2016年中国植物科学若干领域重要研究进展[J].植物学报,2017,52(4):394-452.
WANG X J, XIAO L T, DONG A W, et al .. Research sdvancesin plant science in china in 2016 [J]. Chin. Bull. Bot., 2017,52(4):394-452.
[19] 赵曼如,胡文忠,于皎雪,等.茉莉酸甲酯对果蔬抗性、抗氧化活性及品质影响的研究进展[J]. 食品工业科技,2020,41(4):328-332.
ZHAO M R, HU W Z,YU J X, et al .. Research progress oneffects of Methyl jasmonate on resistance,antioxidant activityand quality of fruits and vegetables [J]. Sci. Technol. Food Ind.,2020,41(4):328-332.
[20] 徐金龙,张文静,向凤宁.植盐胁迫诱导启动子及其顺式作用元件研究进展[J].植物生理学报,2021,57(4):759-766.
XU J L, ZHANG W J, XIANG F N. Advances in stressinducible promoter and cis-acting elements in higher plants [J].Plant Physiol. J., 2021,57(4):759-766.
[21] 李泓阳,刘震,曾钰婷,等.马铃薯StCytb5 基因家族的全基因组鉴定及表达分析[J/OL]. 甘肃农业大学学报,2024, 1-18[2024-01-07].
LI H Y,LIU Z,ZENG Y T, et al .. Genome-wide identificationand expression analysis of StCytb5 gene family in potato(Solanum tuberosum L.) [J/OL]. J. Gansu Agric. Univ., 2024,1-18[2024-01-07].
[22] 李堂,曹华盛,熊亮,等.水稻粒型调控基因功能研究进展[J].广东农业科学, 2023,50(12):12-28.
LI T, CAO H S, XIONG L,et al .. Research progress on thefunction of rice grain type genes [J]. Guangdong Agric. Sci.,2023,50(12):12-28.
(责任编辑:温小杰)
基金项目:中国农业科学院科技创新工程项目;三亚中国农业科学院国家南繁研究院南繁专项(YBXM15)。

