质量守恒定律的理解与考查
何秀珍
一、正确理解质量守恒定律
认识化学反应中的各物质间存在定量关系,化学反应遵守质量守恒定律;理解质量守恒定律的微观本质:在一个具体的化学反应中,存在5个不变,宏观理解为:1.反应物和生成物总质量不变,2.元素种类和质量不变;微观理解:3.原子种类不变,4.原子数目不变,5.原子质量不变。2个改变:1.从宏观上物质的种类一定改变,2.从微观上分子的种类一定改变。1个可能改变:分子总数可能改变。
二、有关质量守恒定律的考查
例题1 (2023宜昌)下列现象能用质量守恒定律解释的是( )。
A.蔗糖溶于水后总质量不变
B.浓硫酸敞口放置质量增加
C.饱和硝酸钾溶液升温,溶液质量不变
D.硫酸铜溶液和氢氧化钠溶液混合,溶液质量减小
解析 A.蔗糖溶于水,没有发生化学变化,不能用质量守恒定律来解释,A错误;B.浓硫酸敞口放置质量增加是浓硫酸具有吸水性,不能用质量守恒定律来解释,B错误;C饱和硝酸钾溶液升温,溶液的状态会从饱和变成不饱和,此过程中没有新物质生成,虽然溶液质量不变,但不能用质量守恒定律来解释,C错误;D硫酸铜溶液和氢氧化钠溶液混合会反应生成氢氧化铜沉淀和硫酸钠溶液,溶液质量减小,但反应前后物质的总质量不变,可用质量守恒定律来解释,D正确。应选D。
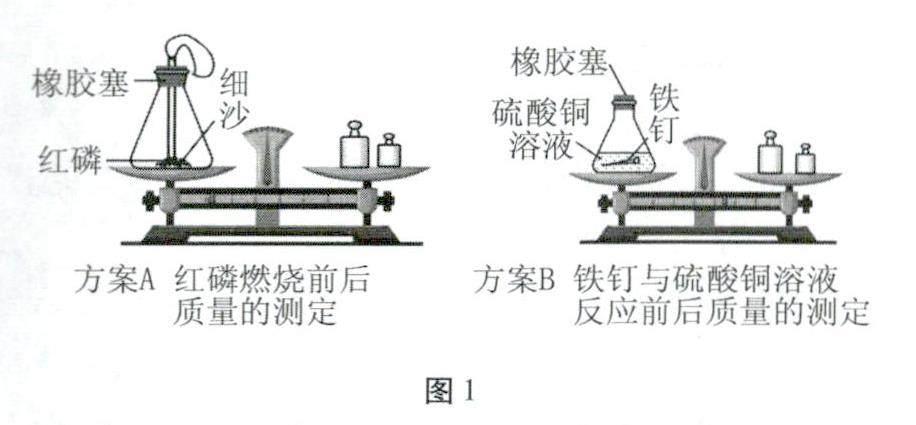
例题2 (2023年江西)某兴趣小组对“化学反应前后物质的质量关系”进行探究,实验方案如图1所示。
[分析交流](1)方案A中红磷燃烧的现象为____,方案B中铁与硫酸铜反应的化学方程式为____。2个方案反应前后天平均保持平衡,说明上述2个化学反应前后物质的总质量不变。
[发现问题]方案A中因有氧气参加反应,故采用密闭装置。但方案B中铁与硫酸铜反应,反应物和生成物都没有气体,为什么也要用密闭装置呢?
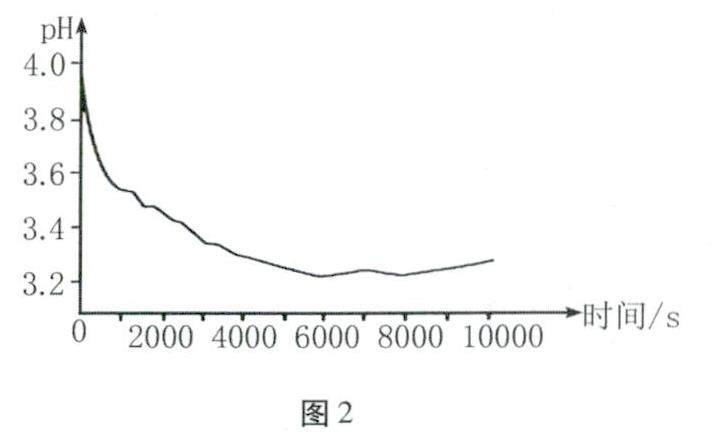
(2)于是在老师的指导下,小组同学再次实验,并使用pH传感器测定锥形瓶内溶液pH,其数据如图2所示。分析图像可知,反应开始阶段溶液的酸性逐渐____(填“增强”或“减弱”),那么导致这一现象出现的原因又是什么?
[提出猜想]
猜想甲:硫酸铜溶液和铁作用所致;
猜想乙:硫酸铜溶液和空气作用所致;
猜想丙:硫酸铜溶液、铁及空气共同作用所致。
[进行实验]
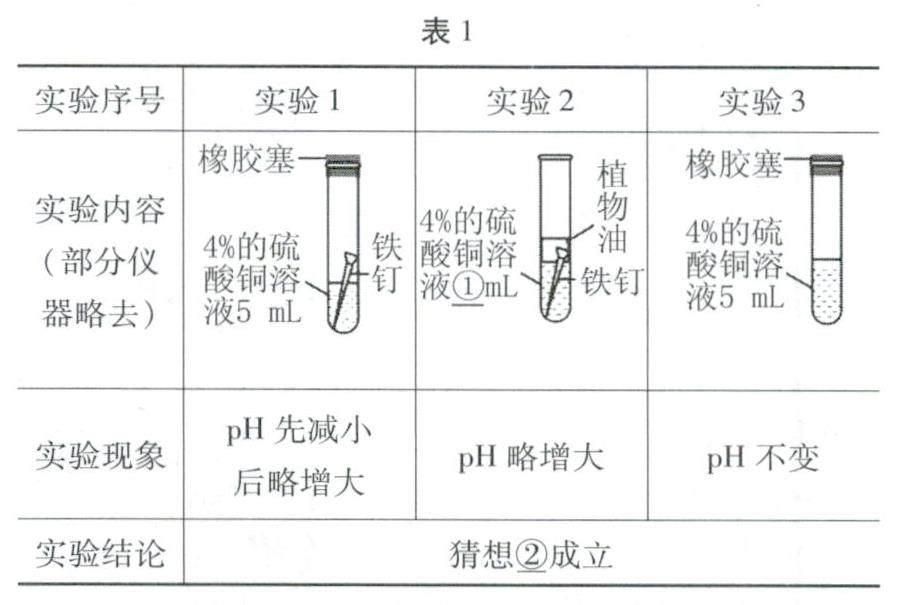
(3)为验证上述猜想,现提供如下用品:用煮沸并迅速冷却的蒸馏水配成4%的硫酸铜溶液、洁净的铁钉、pH传感器等,实验过程见表1,请完成表格中①、②两处填空。
[反思拓展]
(4)通过以上探究活动,请分析方案B中用橡胶塞形成密闭装置的原因可能是____。
(5)蜡烛燃烧后固体质量减小,请设计实验验证该反应是否遵守质量守恒定律。写出你的简明方案:____。
解答(1)红磷燃烧会产生大量白烟,放出热量,故填:剧烈燃烧,产生大量白烟,放出热量;铁和硫酸铜会生成硫酸亚铁和铜;(2)图2中pH下降,说明溶液的酸性增强;(3)实验1中硫酸铜溶液和铁、空气接触;实验2中硫酸铜和铁接触,需要控制其他变量相同,加入5mL硫酸铜溶液;实验3硫酸铜接触到空气;实验1、2对比说明pH减小与空气有关,实验1、3对比说明pH减小与铁有关,则pH减小是硫酸铜与铁和空气共同作用所致;(4)装置B中硫酸铜与铁和氧气接触,可能会导致溶液酸性增强与铁反应产生氢气,如果在敞口容器中,氢气会逸出,导致装置质量减小,无法验证质量守恒定律;(5)蜡烛燃烧会产生二氧化碳和水,需要在密闭容器中验证,可以将蜡烛在密闭的集气瓶中燃烧测定反应前后的质量不变来验证质量守恒定律。
答案:(1)剧烈燃烧,产生大量白烟,放出热量Fe+CuSO4=FeSO4+Cu (2)增强 (3)
5 丙 (4)防止溶液酸性增大与铁钉反应产生氢气使装置质量减小,无法验证质量守恒定律;(5)取一套装置气密性良好的集气瓶和带有燃烧匙的橡皮塞,将蜡烛固定在燃烧匙上,将蜡烛、橡皮塞、燃烧匙和集气瓶放在天平上称量后,放置在桌面上,点燃蜡烛迅速将蜡烛伸入集气瓶并塞紧橡皮塞,待蜡烛熄灭并冷却至室温后将装置整体放在天平上称量,若质量不变,则遵循适量守恒定律。
(收稿日期:2023-12-18)
——以硫酸铜饱和溶液析出晶体的计算为例

