珠江八大口门冬季浮游植物优势种生态位及其种间联结性
何瑞 李青峰 彭松耀

摘 要:为了解珠江口门区冬季浮游植物优势种生态位及其种间联结性,选取珠江河口八大口门为研究地点,于2019年12月对珠江口八大口门区浮游植物以及环境因子进行了检测,结合生态位宽度、生态位重叠值、生态响应速率、总体联结性、χ2检验以及 CCA 等方法,分析优势种生态位、种间联结性及其与环境因子关系。结果表明:①共鉴定到浮游植物54种,隶属6门30属,其中有7个优势种;②优势种生态位宽度及种对间生态位重叠值差异较大,颗粒直链藻(Aulacoseira granulata)对水环境适应能力较强,具有广泛的生态适应幅度,中肋骨条藻(Skeletonema costatum)生态位重叠值低,种间竞争比较弱;③珠江口门区浮游植物群落总体处于演替的初期阶段且存在正向演替的趋势,物种间联结性不强,种间关系较为松散,浮游植物优势种之间以及它们和环境之间的动态平衡尚未达到,目前正处于优势种的发展阶段;④氨氮、总有机碳和浊度是影响珠江八大口门浮游植物优势种分布和生态位的主要环境因子。
关键词:浮游植物;优势种;生态位;种间联结;环境因子;珠江口
中图分类号:TV1 文献标识码:A 文章编号:1001-9235(2024)05-0046-09
Niche and Interspecific Association of Dominant Phytoplankton Species during Winter in Eight Estuaries of Pearl River
HE Rui1,2, LI Qingfeng1, PENG Songyao1
(1. Key Laboratory of Water Security Guarantee in Guangdong-Hong Kong-Marco Greater Bay Area of Ministry of Water ResourcesGuangzhou 510611, China;2. Pearl River Water Resources Research Institute, Pearl River Water Resources Commission of the Ministry of Water Resources, Guangzhou 510611, China)
Abstract: To understand the niche and interspecific association of the dominant phytoplankton species during winter in the Pearl River estuaries, this paper selects eight Pearl River estuaries as the study area. Phytoplankton and environmental factors were detected in eight Pearl River estuaries in December 2019. The dominance value, niche width, niche overlap, variance ratio method, chi-squared test (χ2), and CCA are utilized to analyze the niche and interspecific association with respect to the dominant phytoplankton species. The results are as follows.①54 species belonging to 6 phyla are identified, of which 7 species from 30 genera are the dominant species.② The niche width of the dominant species and the niche overlap values vary greatly among species pairs. Aulacoseira granulata has strong adaptability to the aquatic environment and exhibits a wide range of ecological adaptability. The niche overlap value of Skeletonema costatum is low, and interspecific competition is weak.③ The phytoplankton of the Pearl River Estuary is generally in an early stage of succession and there is a trend of positive succession. The linkage community in the Pearl between species is not strong and the interspecific relationship is loose. The dominant phytoplankton species have not yet reached a relative dynamic equilibrium among themselves and between the dominant species and the environment, and the dominant species are in the stage of development.④Ammonia nitrogen, total organic carbon (TOC), and turbidity are the main environmental factors affecting the distribution and ecological position of the dominant phytoplankton species in the eight Pearl River estuaries.
Keywords: phytoplankton; dominant species; niche; interspecific association; environmental factor; Pearl River estuary
生态位理论作为物种共存的基本机制之一,在预测物种沿环境梯度分布、比较不同物种对环境的适应性及不同物种之间资源竞争等方面具有重要意义[1-2]。生态位理论主要是通过生态位宽度和与其他物种的重叠来表征物种在特定生境中的竞争能力,进而解释物种的丰富度和分布[3-4]。种间关系,特别是竞争和捕食,是群落结构变化的重要驱动因素[3]。物种生态位与种间关联关系密切,种间相互作用会形成物种间特有的环境生态位[5]。因此,群落稳定性、种间关联性和生态位理论的结合在反映群落特征方面更有效,同时也有助于了解浮游植物群落的生态习性和优势种在资源利用中的关系[6]。通常根据生态位宽度可以将物种分为广生态位和狭生态位两类,其中广生态位类物种利用不同的资源能力较强,可在不同的生境中繁殖,在生态适应能力方面表现出很强的优势,从而在种间资源竞争中处于优势地位[7-8],而狭生态位类物种则恰好相反。
浮游植物是水生态系统最主要的初级生产者,在维持水生态系统能量流动、物种循环和信息传递等方面发挥着至关重要的作用[9-10]。由于其个体小、细胞结构简单和生命周期短,对环境的变化反应敏感,是水生态健康的重要指示物种[11]。相对于浮游植物其他种群,优势种是研究从个体到生态系统的生态过程的关键[12],对群落结构和群落环境的形成有重要影响[13]。
珠江河口处于海洋、淡水、陆地之间的过渡区域,对水环境变异的响应十分敏感和脆弱。河口口门区滩槽格局和采砂、岸线及滩涂开发利用等高强度人类活动在影响到洪水的宣泄的同时,也在影响口门区水生态系统中水生物与水环境之间的物质循环、能量流动和发育演化平衡,对生态系统的可持续发展构成严重威胁[14]。由于珠江口门区独特的地理环境,研究口门区浮游植物群落结构、种间关系尤为重要。众多学者对珠江口浮游植物开展过大量研究,但研究区域主要是针对河口区或某几个口门区[15-16],主要集中在分布及生态特征研究[17-19],八大口门区同步的浮游植物及其生态位和种间联结性研究还未见报道。
本文以冬季珠江八大口门浮游植物为研究对象,旨在了解珠江口门区生态系统中浮游植物优势种生态位、种间联结性及其与环境因子之间的关系,揭示珠江八大口门浮游植物优势种在的生态适应性、功能地位及资源利用状况等相关信息,以期为进一步研究珠江口门区浮游植物群落的稳定性和空间分布格局提供基础数据,为口门区生态系统治理与修复提供技术支撑。
1材料与方法
1.1研究区域概况
珠江是西江、北江、东江和珠江三角洲诸河4个水系的总称,是长度位列全国第三、流量第二的大河。珠江各水系在汇于三角洲后经八大口门注入南海。按照地理位置分为东四口门和西四口门。其中东四口门注入伶仃洋,从东至西顺序为虎门、蕉门、洪奇门和横门。西四口门中磨刀门和鸡啼门注入三灶岛和横琴岛之间的海域,虎跳门和崖门则注入黄茅海[20]。
1.2样点设置与取样方法
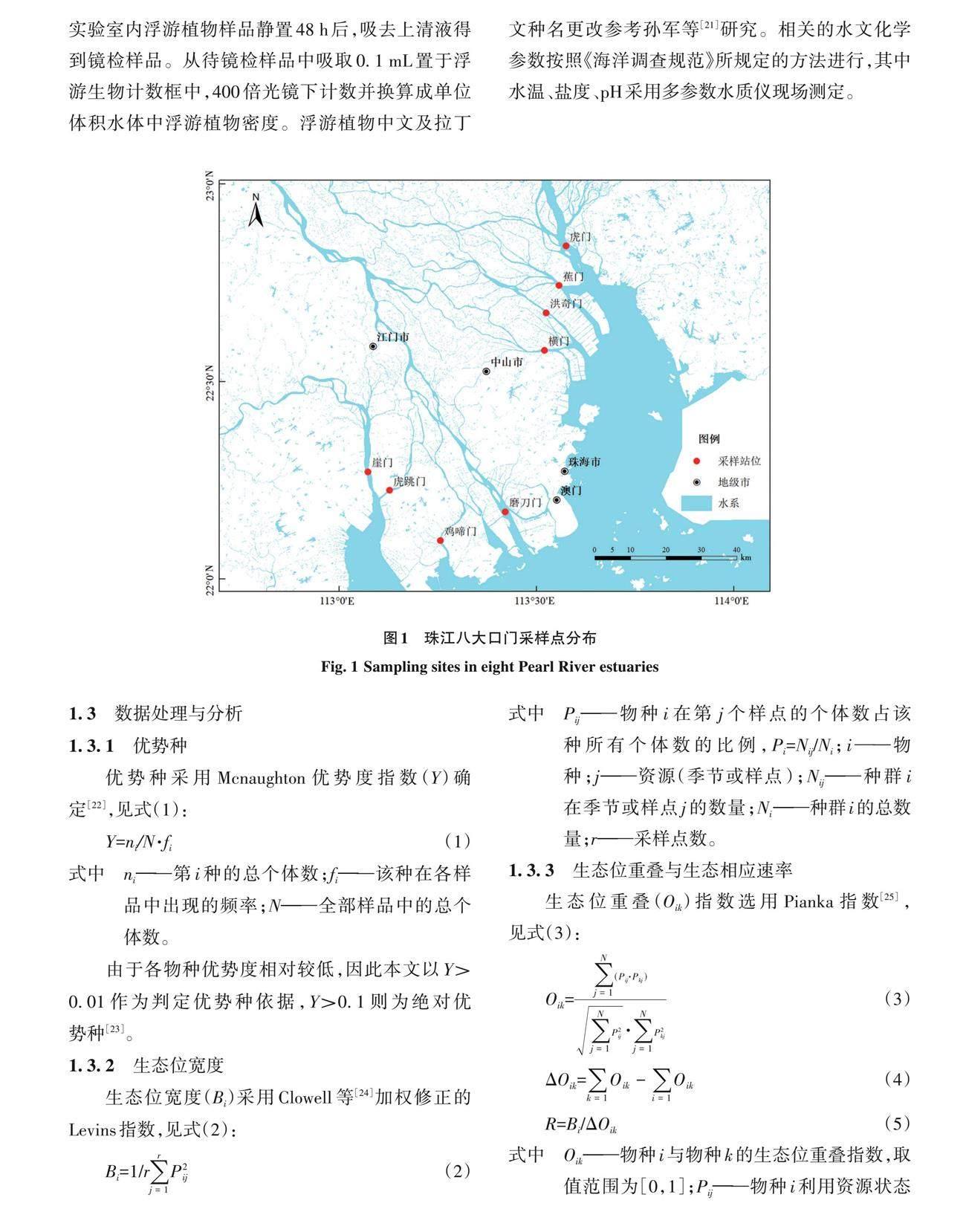
该研究于2019年12月30日至2020年1月1日在珠江八个口门区分别设置采样点(图1)。浮游植物采样严格按照 GB/T 12763—2007《海洋调查规 范》使用浅水 III 型浮游生物网在每个站位自底层至表层垂直拖网1次。样品用鲁戈试剂固定和保存。实验室内浮游植物样品静置48 h后,吸去上清液得到镜检样品。从待镜检样品中吸取0.1 mL 置于浮游生物计数框中,400倍光镜下计数并换算成单位体积水体中浮游植物密度。浮游植物中文及拉丁文种名更改参考孙军等[21]研究。相关的水文化学参数按照《海洋调查规范》所规定的方法进行,其中水温、盐度、pH采用多参数水质仪现场测定。
1.3数据处理与分析
1.3.1优势种
优势种采用 Mcnaughton 优势度指数( Y)确定[22],见式(1):
Y=ni/N ·fi (1)
式中 ni——第 i 种的总个体数;fi——该种在各样品中出现的频率;N——全部样品中的总个体数。
由于各物种优势度相对较低,因此本文以 Y>0.01作为判定优势种依据,Y>0.1则为绝对优势种[23]。
1.3.2生态位宽度
生态位宽度(Bi)采用 Clowell 等[24]加权修正的 Levins指数,见式(2):
Bi=1/rj Pij(2)
式中 Pij——物种 i 在第 j 个样点的个体数占该种所有个体数的比例,Pi=Nij/Ni;i ——物种;j——资源(季节或样点);Nij——种群 i 在季节或样点j 的数量;Ni——种群 i 的总数量;r——采样点数。
1.3.3生态位重叠与生态相应速率
生态位重叠(Oik)指数选用 Pianka 指数[25],见式(3):
式中 Oik——物种 i 与物种 k 的生态位重叠指数,取值范围为[0,1];Pij——物种 i 利用资源状态j(站位)的个体数占该种个体总数的比例; Pk——物种 k 利用资源状态 j(站位)的个体数占该种个体总数的比例;Oik >0.3时,种对之间生态位的重叠有意义;Oik >0.6时,种对有显著的生态位重叠[26];ΔOik——相对占有资源量,当 i=k 时,ΔOik>0,说明该种正处于发展期,ΔOik<0,表明该种正处于衰退期,ΔOik =0,则表明该种为中性;R——生态响应速率。
1.3.4种间联结性
本研究采用方差比率法(Variance ratio,VR)对群落总体关联性进行测定,结合χ2检验定性判定种间联结性。总体关联性用方差比率法[27]计算,见式(6)-(9):
式中 S——浮游植物优势种总种数;N——站位总数;ni——物种 i 出现的站位数;Tj——样方j内出现的浮游植物优势种种数;t——站位中物种数的平均数;σT(2)——所有采样点物种数的方差;ST(2)——总种数出现频度的方差,当VR=1时,符合所有物种无关联的零假设;当 VR<1时,物种间总体为负协变关系;当 VR>1时,物种间总体为正协变关系。
采用统计量 W=VR× N 检验 VR 值偏离1的显著程度。应用 Yates 连续校正法进行χ2卡方检验,若χ2<3.84(P>0.05),表示物种间关联性不显著;若3.841≤χ2≤6.635(0.01≤P≤0.05),表示物种间关联显著;若χ2>6.635(P<0.01),则表示物种间关联极显著。
1.3.5数据统计和处理分析
采用 ArcGIS10.8软件绘制样点图,其余分析均在 R语言中完成。
2结果与分析
2.1环境因子
调查期间环境因子见表1。珠江八大口门主要环境因子浊度、氨氮和总有机碳差异较大。由表可知,调查期间八大口门水深范围在4.70~11.00 m;盐度范围在0~5.95单位;浊度在2.50~12.40 NTU;氨氮浓度范围在29.19~63.75μg/L,均值为48.69μg/L;总有机碳浓度在4.02~7.09 mg/L,均值为4.77 mg/L。
2.2浮游植物优势种
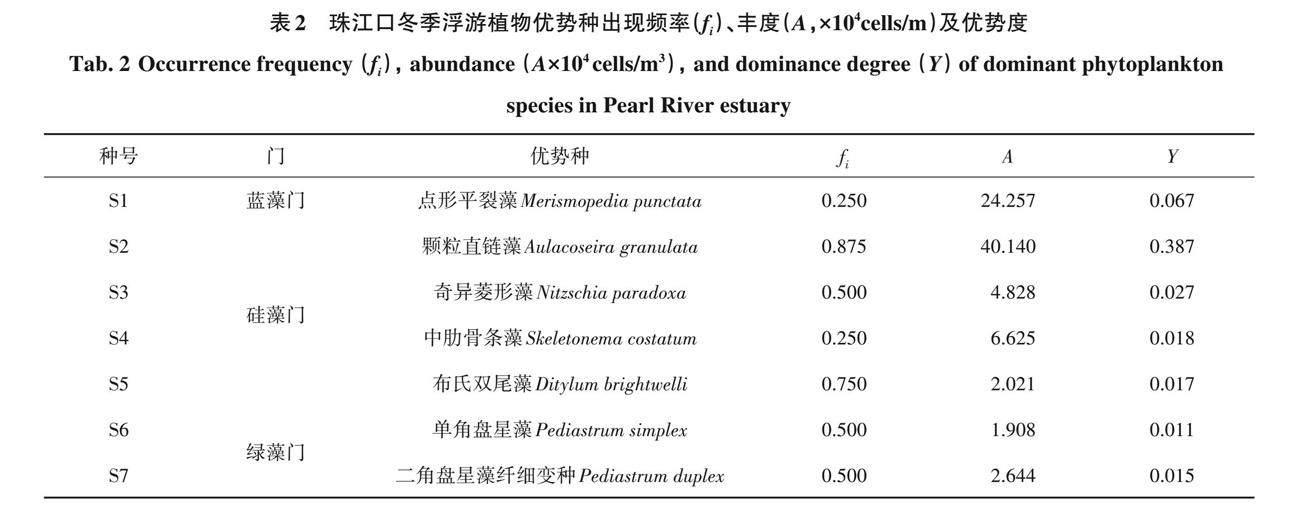
珠江八口门8个定量样品中,共鉴定浮游植物6门30属54种。其中优势种7个,颗粒直链藻(Aulacoseira granulata)为绝对优势种,平均密度达到40.14×104cells/m(表2)。优势种丰度百分比(图2)结果显示布氏双尾藻(Ditylum brightwelli)在虎门所占比例最大,点形平裂藻在虎跳门和蕉门所占比例最大,颗粒直链藻则在鸡啼门、磨刀门、横门和洪奇门中占比最大。
2.3珠江口浮游植物优势种生态位
2.3.1优势种生态位宽度
在空间维度上,珠江八大口门浮游植物优势种生态位于0.13~0.64(图3),生态位变化幅度较大,其中生态位宽度对大的是颗粒直链藻,生态位宽度为0.64,具有较广的生态位适应幅度。而生态位宽度最小的是中肋骨条藻,生态位宽度为0.13,表明对环境具有较强的选择性,需要在适宜的条件下才能利用资源。
2.3.2优势种生态位重叠值
在空间维度上,珠江八大口门浮游植物优势种生态位重叠值介于0~0.83(图4),生态位重叠值最低的是中肋骨条藻和单角盘星藻、二角盘星藻纤细变种,而最高的是单角盘星藻和二角盘星藻纤细变种。浮游植物7个优势种的21对生态位重叠值中有7对生态位重叠值较高(Oik>0.6),占总对数的33.33%;1对生态位重叠值低(0.3 2.3.3优势种生态响应速率 珠江八大口门浮游植物优势种相对资源占用量(ΔOik)和相应速率(R)结果显示(表3),中肋骨条藻的相对资源占用量的变化幅度(绝对值)最大,而二角盘星藻纤细变种的相对资源占用量的变化幅度(绝对值)最小。中肋骨条藻有最大的负ΔOik,生长空间缩小,呈衰退状态。颗粒直链藻有最大的正ΔOik,表明其发展的空间较大,与其他优势种空间资源利用竞争较强烈,在竞争中处于优势位置。生态响应速率结果可反映空间维度上优势种对生态环境的生态响应状况,点形平裂藻、中肋骨条藻和布氏双尾藻呈现衰退趋势,但均相对较弱。颗粒直链藻、奇异菱形藻、单角盘星藻和二角盘星藻纤细变种呈发展趋势,二角盘星藻发展的趋势最为强烈(R=7.90)。 2.4优势种种间联结性 珠江八大口门浮游植物优势种的种间总体关联性见表4。在珠江口的8个样点中,χ20.95=1.64,χ20.05=12.59,VR 大于1,统计量 W 为9.758在χ2临界值1.64~12.59范围内,表明珠江八大口门冬季浮游植物优势种之间呈不显著正关联。在21个种对内,联结性不显著(χ2<3.841(P>0.05))的种有21对,占比为100%。 2.5优势种与环境因子相关性 环境因子可影响浮游植物生态位分化,通过排序来解释物种与环境因子之间的关系,可补充说明生态位特征。对珠江八大口门冬季浮游植物优势种进行去趋势分析,表明浮游植物与环境排序适用于单峰模型的冗余分析。为进一步探讨浮游植物优势种与环境因子的关系,采用方差膨胀因子(Variance Inflation Factor,VIF)对水深、盐度、pH、浊度、悬浮物、化学需氧量、硝酸盐、亚硝酸盐、氨氮、无机氮、活性磷酸盐和总有机碳等12个环境因子进行筛选,结果表明氨氮(VIF=1.99)、总有机碳(VIF=1.43)和浊度(VIF=1.89)是影响冬季珠江口浮游植物优势种的主要因素。CCA 排序轴第一轴和第二轴累计变异百分率解释了物种数据的96.38%(图5)。第1排序轴与总有机碳呈负相关,第2排序轴与氨氮呈正相关,与浊度呈负相关。总有机碳与中肋骨条藻和布氏双尾藻与呈正相关,与奇异菱形藻呈负相关。氨氮与颗粒直链藻、单角盘星藻、双角盘星藻纤细变种呈正相关,浊度与点形平裂藻与呈正相关。 3讨论 3.1优势种生态位 生态位宽度反映物种占有空间资源的多少、空间分布范围和状况以及均匀程度,是衡量物种对其所在环境的利用程度。本研究发现生态位宽度最大是颗粒直链藻,说明其数量较多,且在各样点中出现的频率高,表明其利用空间资源能力强,对环境适应能力强,有较强的生态适应能力。生态位宽度最小的是中肋骨条藻,其数量相对较少,分布范围较小,占用空间资源较少,对环境的选择具有一定依赖性,空间资源利用能力较差。颗粒直链藻在世界范围内广泛分布,是江河、湖泊和水库等各种内陆淡水水体中的常见优势种类,其在河口半咸水水域同样能占据优势地位[28]。Wang 等[29]在珠江八大入海口水域的研究发现,颗粒直链藻是重要优势种之一,本研究结果从生态位宽度角度验证了这一观点。中肋骨条藻是一种典型的广温广盐型浮游硅藻,分布从北极到赤道,从高盐水团到沿岸低盐甚至半咸水中皆有[30],在全球近岸海域极广。研究结果显示,中肋骨条藻主要在鸡啼门样点检出较高密度,究其原因,可能是由于鸡啼门位于八个口门的最南端,受南海海域海水混合影响相对较大,海水在鸡啼门与淡水在口门区混合更加充分。因此,中肋骨条藻丰度较高。 生态位重叠值,是一种生态性指标,揭示了物种之间对资源的利用或环境适应能力的相似度以及它们之间的竞争关系。这一指标不仅反映了物种对资源的需求程度,还反映了它们在生物群落中的分布地段交织程度。在自然界中,物种的生态位往往表现为它们倾向于共享一部分基本生态位,这导致2个或多个物种对资源具有共同需求。这些具有相似生态特性的物种会共同利用相同的生境资源,从而形成了一种资源的共生关系。珠江八大口门区浮游植物生态位重叠值较低(Oik≤0.3),占总对数的61.90%,表明优势种间竞争不激烈,群落结构短期内不会发生明显的变化。单角盘星藻和二角盘星藻纤细变种的,生态位重叠值最高,表明二者利用资源能力和环境适应能力相似性高,竞争比较激烈。中肋骨条藻和单角盘星藻、二角盘星藻纤细变种生态位重叠值最低,利用资源相似性低,对环境适应能力差异大,竞争较弱。总体上,珠江八大口门浮游植物优势物种对资源的利用共性较小,优势种竞争态势处于相对均衡的状态。 相对资源占有量的大小能反映物种所占有空间资源能力的强弱和分布范围的广泛程度情况。基于 R 值可进一步确定不优势种对生境条件的生态响应状况。从珠江八大口门浮游植物优势种相对资源占有量来看,生态位宽度较大的藻种具有较强的发展空间,如颗粒直链藻(ΔOik=5.72)和单角盘星藻(ΔOik=5.02)。生态位宽度小的优势种大多属于衰退型种群,如中肋骨条藻。冬季二角盘星藻纤细变种的发展趋势最强(R=7.90),将会逐渐代替其他衰退型的浮游植物,生态因子的季节变化、种内或种间竞争都会直接或间接影响浮游植物群落演替。而衰退趋势较强的点型平裂藻将会逐渐消亡。珠江八大口门浮游植物优势种之间以及优势种和环境之间未达到相对的动态平衡,其优势种正处发展阶段。 3.2优势种的种间联结性 种间联结性大小反映物种间的相互关系以及群落演替的相互作用,总体关联性则反映群落演替阶段的稳定性[31]。本研究采用方差比率法(VR)对珠江八大口门冬季浮游植物群落优势种的总体关联性进行测定,结合χ2检验定性判定种间联结性。珠江八大口门冬季浮游植物群落优势种总体关联性呈不显著正关联,表明群落总体处于演替的初期阶段且存在正向演替的趋势。 3.3优势种与环境因子的关系 浮游植物的群落结构和分布受环境因素的综合影响,不同水体中浮游植物的群落结构和分布也不同[32]。珠江八大口门浮游植物优势种与环境因子的典范对应分析(CCA)结果显示,轴1和轴2可较好地反映优势种与环境因子的关系。轴1反映了总有机碳的变化,轴2反映了氨氮和浊度的变化。轴1、轴2分别是影响浮游植物的空间生态位分化的主要因子和次要因子。本研究发现,总有机碳、氨氮和浊度是影响珠江八大口门冬季浮游植物优势种的主要环境因子。其中中肋骨条藻和布氏双尾藻主要与总有机碳呈正比,在崔鑫[33]研究中发现,在中肋骨条藻生长过程中产生大量的胶体有机碳,而胶体浓缩液可抑制赤潮异弯藻生长。由此可以推测有机碳可能是由于中肋骨条藻在种群竞争中释放出的抑制其他藻类生长的物质,或是有机碳为中肋骨条藻化感物质的合成提供了原料,从而使其在种群竞争中获胜。郭康丽等[34]研究发现,在布氏双尾藻整个生命周期均会产生透明胞外聚合颗粒物(TEP),而 TEP具有高含碳量,能对海洋碳循环做出直接贡献。Fukao 等[35]研究发现,呈链状生长的中肋骨条藻细胞在衰亡期会断裂破碎释放大量 TEP。上游浊度的变化是影响浮游植物光合代谢的主要环境因素[36],CCA 分析表明,浊度与点形平裂藻关系密切,进一步说明浊度变化所导致光照限制是限制浮游植物生产力的重要原因。受上游河水冲刷所带来的泥沙的影响,浊度升高,透明度降低,促进了耐受高浊度环境的种类在群落中占据优势地位,进而使群落结构发生改变。 4结论 珠江八大口门颗粒直链藻为绝对优势种,对水环境适应能力较强,有较广泛的生态适应幅度;中肋骨条藻对水环境变化适应较为敏感,其适应能力较弱。优势种生态位重叠值以较低等级为主,种间竞争较弱。优势种间以及它们和环境之间未达到动态平衡状态,正处于发展阶段,浮游植物群落总体处于演替的初期阶段且具有正向演替的趋势。氨氮、总有机碳和浊度是影响珠江八大口门浮游植物优势种分布和生态位的主要环境因子。 本研究初步揭示了珠江口门区冬季浮游植物优势种生态位特征及种间联结性,但本研究仅以珠江口门区冬季浮游植物为研究对象,获取的样本数量相对较少,未能完全反映浮游植物优势物种实际生态特征及种间关系。因此,准确反映珠江口门区浮游植物群落的生态位特征及种间关系,还需在不同水文期及空间增加采样点,将浮游植物分类、功能特征与环境数据进行耦合。 参考文献: [1] MUSTAQEEM A ,PADMA S,SONIA R ,et al. Niche width analyses facilitate identification of high-risk endemic species at high altitudes in western Himalayas[J]. Ecological Indicators,2021. DOI:10.1016/J. ECOLWD.2021.107653. [2] KAI F,SHANG W,ZIYAN W,et al. Niche width of above- and below-ground organisms varied in predicting biodiversity profiling along a latitudinal gradient[J]. Molecular Ecology,2020,29(10):1890-1902. [3] ROC?O T,MANUEL B ,MORALES,et al. Intraspecific and interspecific competition induces density-dependent habitat niche shifts in an endangered steppe bird[J]. Ecology and Evolution,2017,7(22):9720-9730. [4] BATES O K,OLLIER S,BERTELSMEIER C. Smaller climatic niche shifts in invasive than non-invasive alien ant species[J]. Nature Communications,2020,11. DOI:10.1038/S41467-02-19031-1. [5] CIANCIO J E ,YORIO P, BURATTI, et al. Isotopic niche plasticity in a marine top predator as indicator of a large marine ecosystem food web status[J]. Ecology Indication ,2021,126. DOI:10.1016/j. ecolind.2021.107687. [6] CHEN Y , YUAN Z L, BI S, et al. Macrofungal species distributions depend on habitat partitioning of topography,light, and vegetation in a temperate mountain forest[J]. Scientific Report ,2018(8):13589-13602. [7] CHAPARRO-PEDRAZA P C , DE ROOS A M. Ecological changes with minor effect initiate evolution to delayed regime shifts [J]. Nature Ecology Evolution,2020,4(3):412-418. [8] TILMAN D. Niche tradeoffs , neutrality, and community structure:a stochastic theory of resource competition,invasion, and community assembly[J]. Proceedings of the National Academy of Sciences of the United States of America ,2004,101(30):10854-10861. [9] ZSOLT N,JUDIT P,G?BOR B , et al. Analysis of niche characteristics of phytoplankton functional groups in fluvial ecosystems[J]. Journal of Plankton Research,2020,42(3):355-367. [10]NAGY-L?SZL? Z,PADIS?K J,BORICS G,et al. Analysis of niche characteristics of phytoplankton functional groups in fluvial ecosystems[J]. Journal of Plankton Research ,2020,42(3):355-367. [11]李港,林妙丽,陈诚,等.京杭运河苏北段秋冬季浮游植物群落结构特征及其与环境因子的关系[J].水生态学杂志,2021,42(5):119-126. [12]AVOLIO M L,FORRESTEL E J,CHANG C C,et al,Demystifying dominant species[J]. New Phytologist,2019,223(3):1106-1126. [13]BAERT J M ,JANSSEN C R ,SABBE K ,et al. Per capita interactions and stress tolerance drive stress-induced changes in biodiversity effects on ecosystem functions [J]. Nature Communition,2016(7):12486-12494. [14]崔伟中.珠江河口水环境的时空变异及对生态系统的影响[D].南京:河海大学,2006. [15]戴娟,王超,赖子尼,等.2006年夏季珠江口5大口门网采浮游植物群落的调查[J].淡水渔业,2007,37(3):63-66. [16]姚艳欣,陈楠生.珠江口及其邻近海域赤潮物种的生物多样性研究进展[J].海洋科学,2021,45(9):75-90. [17]戴明,李纯厚,贾晓平,等.珠江口近海浮游植物生态特征研究[J].应用生态学报,2004,15(8):1389-1394. [18]贾慧娟,赖子尼,王超.珠三角河网浮游植物物种丰富度时空特征[J].生态学报,2019,39(11):3816-3827. [19]王超,李新辉,赖子尼,等.珠三角河网浮游植物生物量的时空特征[J].生态学报,2013,33(18):5835-5847. [20]唐锦萍,林南芳,黎绍佐,等.陆源污染物对珠江口水质的影响:珠江八大口门10年水质监测成果分析[J].人民珠江,1996,16(3):35-41. [21]孙军,刘东艳.中国海区常见浮游植物种名更改初步意见[J].海洋与湖沼,2002(3):271-286. [22]MCNAUGHTON S J. Relationships among functional properties of Californian grassland[J]. Nature,1967,216(168/169):168-169. [23]郭卓然,冷天泽,陆斗定,等.两种孔径网具对大洋微(小)型浮游植物调查结果的影响:以西南印度洋海域第34次大洋春季航次为例[J].海洋与湖沼,2022,53(3):637-644. [24]COLWELL R K,FUTUYMA D J. On the measurement of NicheBreadth and Overlap[J]. Ecology,1971,52(4):567-576. [25]PIANKA E R. The structure of Lizard communities[J]. Annual Review of Ecology,Evolution,and Systematics,1973,4:53-74. [26]KREBS C J. Ecological methodology[M]. New York:Harper Collins Publishers,1989. [27]SCHLUTER D. A variance test for detecting species associations,with some example applications[J]. Ecology,1984,65(3):998-1005. [28]王超,赖子尼,李跃飞,等.西江颗粒直链藻种群生态特征[J].生态学报,2012,32(15):4793-4802. [29]WANG C,LI X H ,LAI Z N ,et al. Seasonal variations of Aulacoseira granulata population abundance in the Pearl River Estuary[J]. Estuarine,Coastal and Shelf Science,2009,85(4):585-592. [30]黄云峰,冯佳和,姜胜,等.广州珠江口海域中肋骨条藻的周年变化及其与环境因子的关系[J].生态科学,2007,26(1):50-54. [31]刘润红,陈乐,涂洪润,等.桂林岩溶石山青冈群落灌木层主要物种生态位与种间联结[J].生态学报,2020,40(6):2057-2071. [32]杜红春,朱挺兵,龚进玲,等.澜沧江西藏段浮游植物群落结构特征及其与环境因子的关系[J].生态学杂志,2022,41(9):1769-1777. [33]崔鑫.海洋胶体物质的性质及其对有害赤潮藻生长的影响[D].青岛:中国海洋大学,2005. [34]郭康丽,陈洁,王小冬,等.两种海洋硅藻透明胞外聚合颗粒物的产生及其生态学意义[J].海洋环境科学,2019,38(5):649-655. [35]FUKAO T,KIMOTO K,KOTANI Y. Production of transparent exopolymer particles by four diatom species[J]. Fisheries Science,2010,76(5):755-760. [36]马煜,陆欣鑫,范亚文.松花江哈尔滨段浮游植物群落格局及其与环境因子的相关性[J].生态学报,2021,41(1):224-234. (责任编辑:高天扬)

