血小板与白蛋白比值在IgA肾病中的临床价值
宋爽爽 杜宇 田加坤 张磊 张立元 曹微

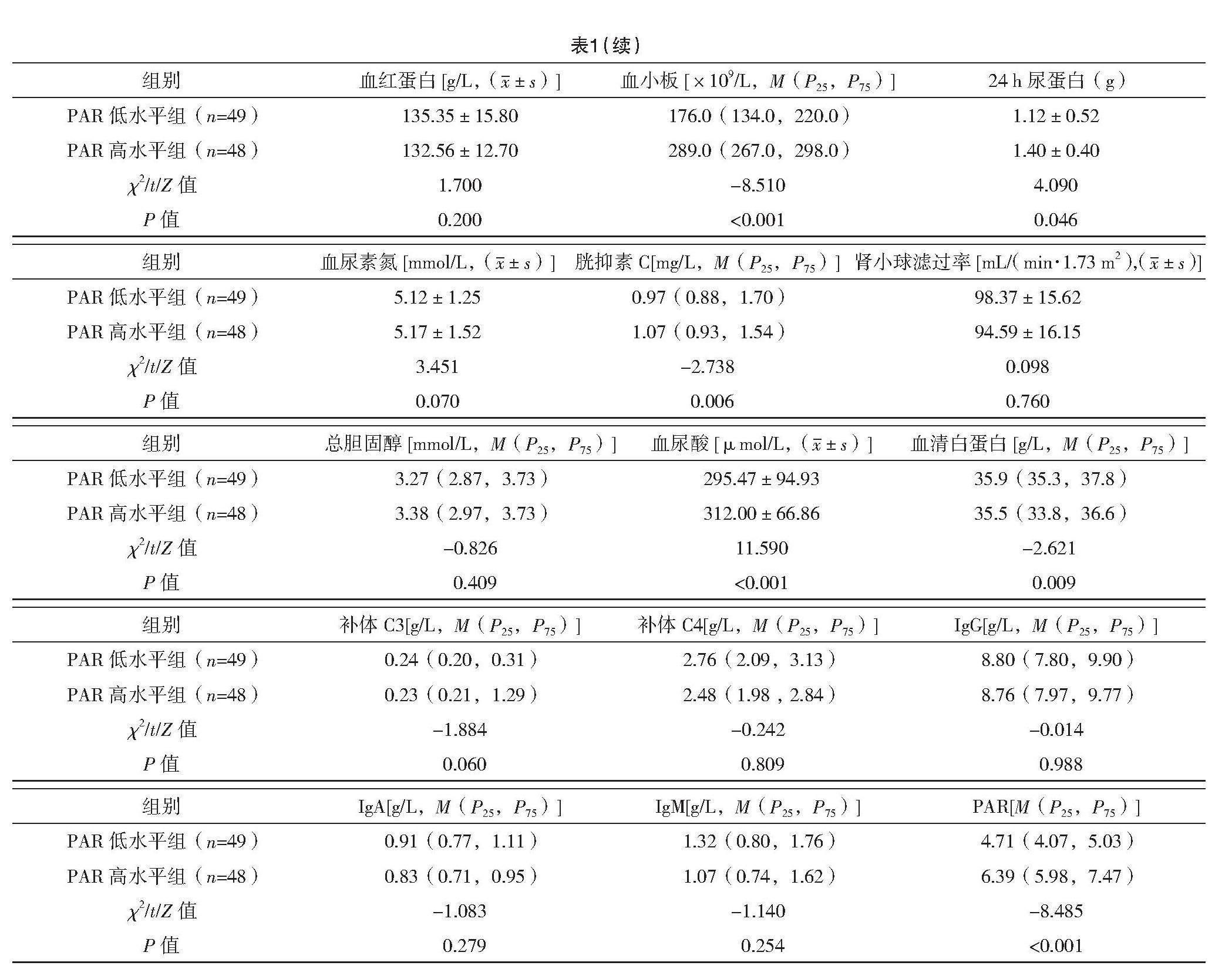
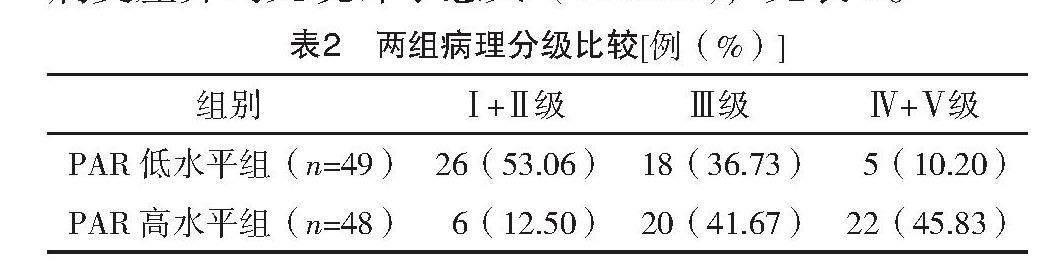
【摘要】 目的:探讨血小板与白蛋白比值(PAR)和IgA肾病(IgAN)患者的临床病理的关系。方法:回顾性收集2017年6月—2022年12月于连云港市第一人民医院肾内科行肾穿刺确诊的97例原发性IgAN患者的临床病理资料。根据PAR百分位数将患者分为两组,PAR低水平组(≤5.63)49例和PAR高水平组(>5.63)48例。结果:PAR高水平组的PLT、胱抑素C、血尿酸、白细胞、24 h尿蛋白水平均高于PAR低水平组(P<0.05);PAR高水平组系膜细胞过多(M)、毛细血管内细胞过多(E)、肾小管萎缩和间质纤维化(T)均多于PAR低水平组(P<0.05)。PAR高水平组患者的血清白蛋白低于PAR低水平组(P<0.05)。PAR低水平组的病理分级以Ⅰ+Ⅱ级为主,PAR高水平组的病理分级以Ⅳ+Ⅴ级为主,两组病理分级差异有统计学意义(字2=23.301,P<0.001)。结论:PAR可能反映IgA肾病患者疾病炎症状态及活动性,同时对高PAR水平的IgAN患者可予以更有效的治疗方案,从而改善肾脏结局。
【关键词】 IgA肾病 血小板与白蛋白比值 临床病理特征
Clinical Value of the Platelet-to-Albumin Ratio for IgA Nephropathy/SONG Shuangshuang, DU Yu, TIAN Jiakun, ZHANG Lei, ZHANG Liyuan, CAO Wei. //Medical Innovation of China, 2024, 21(13): 0-020
[Abstract] Objective: To explore the relationship between platelet-to-albumin ratio (PAR) and clinicopathology of patients with IgA nephropathy (IgAN). Method: The clinicopathological data of 97 patients with primary IgAN who were diagnosed by renal puncture in the Department of Nephrology of the First People's Hospital of Lianyungang from June 2017 to December 2022 were collected retrospectively. Patients were categorized into two groups based on PAR percentile, 49 patients in the low PAR group (≤5.63) and 48 patients in the high PAR group (>5.63). Result: The levels of PLT, cystatin C, blood uric acid, white blood cells and 24 h urinary protein in high PAR group were higher than those in low PAR group (P<0.05). Mesangial cell excess (M), capillary cell excess (E), renal tubule atrophy and interstitial fibrosis (T) in high PAR group were more than those in low PAR group (P<0.05). The serum albumin of high PAR group was lower than that of low PAR group (P<0.05). Pathologic grading in the low PAR group was dominated by grade Ⅰ+Ⅱ, while that in the high PAR group was dominated by grade Ⅳ+Ⅴ, the difference in pathologic grading between the two groups was statistically significant (字2=23.301, P<0.001). Conclusion: PAR may reflect the inflammatory state and activity of the disease in patients with IgA nephropathy, while IgAN patients with high PAR levels may be treated with more effective therapeutic regimens to improve renal outcomes.
[Key words] IgA nephropathy Platelet-to-albumin ratio Clinicopathologic features
First-author's address: The First People's Hospital of Lianyungang, Jinzhou Medical University Postgraduate Training Base, Lianyungang 222000, China
doi:10.3969/j.issn.1674-4985.2024.13.004
IgA肾病(IgA nephropathy,IgAN)是一种广泛存在于全球的原发性肾小球疾病,其患病率在不同种族之间存在显著差异,在亚洲地区,这种情况较为普遍。IgAN患者在我国原发性肾小球肾炎中所占比例为58.2%,而20%~40%的患者则在10~20年内被诊断为终末期肾病(end stage renal disease,ESRD)[1]。IgAN的特征为肾小球系膜区或/和毛细血管袢IgA或IgA为主的免疫复合物(IgA immune complex,IgA-IC)沉积[2]。免疫复合物的沉积可激活系膜细胞增殖并诱导细胞因子分泌,引发炎症反应并最终导致肾脏损害[3],故炎症反应可能是IgAN重要发病机制之一。最近的研究发现,血小板与白蛋白比值(platelet-to-albumin ratio,PAR)也可作为多种炎症性疾病的预后指标[4],但PAR在IgAN中的预后价值目前研究尚少。本研究通过收集原发性IgAN患者的临床病理资料探讨PAR和IgAN患者的临床病理的关系;研究表明,PAR可进一步判断IgAN疾病严重程度及治疗效果,预测IgAN预后不良的高风险患者,及早治疗,从而减少其进入ESRD及死亡风险。
1 资料与方法
1.1 一般资料
回顾性选取2017年6月—2022年12月经肾活检病理证实且在连云港市第一人民医院接受治疗的IgAN患者共97例,男55例,女42例,年龄(52.82±13.73)岁。纳入标准:首次行肾穿刺活检;临床、病理资料完整。排除标准:继发性IgAN;活动性感染、肾活检前使用强的松或其他免疫抑制治疗;原发性血小板增多症。根据参考文献[5]PAR百分位数将患者分为两组,为PAR低水平组(≤5.63)49例,PAR高水平组(>5.63)48例。本研究通过连云港市第一人民医院伦理委员会批准(批准号:LW-20231026001-01)。
1.2 方法
患者入院时均于肾活检前取凌晨空腹外周静脉血并离心分离血清后用血细胞分析仪测定血常规并计算PAR。测定肝功能、肾功能、尿酸、血脂。根据CKD-EPI公式计算估算肾小球滤过率(estimated glomerular filtration rate,eGFR)等。免疫比浊法分别测定免疫球蛋白IgA、IgG、IgM和补体C3、C4。
1.3 观察指标及评价标准
病理分级评价全部肾活检标本送病理科光镜、免疫组化、电镜检查。病理分级参照1982年IgAN Lee氏病理分级标准分为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ级。根据2017年国际IgA肾病网络协作组和肾脏病理协会依据IgAN牛津分型,评价肾脏病理特征,(1)系膜细胞过多(M):50%的肾小球系膜区超过3个系膜细胞为(M1),反之则是(M0);(2)肾小球硬化(S):没有肾小球硬化的为(S0),有的则为(S1);(3)毛细血管内细胞过多(E):无毛细血管内细胞过多为E0,有则为E1;(4)肾小管萎缩和间质纤维化(T):肾皮质小管萎缩或间质纤维化≤25%为T0,>25%且≤50%为T1,>50%为T2;(5)细胞或纤维细胞新月体(C):无细胞或纤维细胞性新月体为C0,细胞或纤维细胞性新月体<25%为C1,≥25%为C2。
1.4 统计学处理
使用SPSS 27.0统计软件,测量数据符合正态分布,使用(x±s)表示,两组间比较使用t检验,计量资料满足偏态分布用中位数(四分位数间距)
[M(P25,P75)]来表示,两组之间采用Mann-Whitney U检验来进行。分类资料采用率(%)表示,组间比较采用字2检验。P<0.05为差异有统计学意义。
2 结果
2.1 PAR高水平组和PAR低水平组基线资料对比
PAR高水平组年龄大于PAR低水平组,差异均有统计学意义(P<0.05);两组性别、血压差异均无统计学意义(P>0.05);PAR高水平组的PLT、胱抑素C、血尿酸、白细胞、24 h尿蛋白水平均高于PAR低水平组,差异均有统计学意义(P<0.05);PAR高水平组的血清白蛋白水平低于PAR低水平组,差异均有统计学意义(P<0.05);两组中性粒细胞、淋巴细胞、血尿素氮、血红蛋白、总胆固醇、肾小球滤过率、补体C3、补体C4、免疫球蛋白G、免疫球蛋白M、免疫球蛋白A比较,差异均无统计学意义(P>0.05)。见表1。
2.2 两组病理分级比较
PAR低水平组的病理分级以Ⅰ+Ⅱ级为主,PAR高水平组的病理分级以Ⅳ+Ⅴ级为主,两组病理分级差异有统计学意义(字2=23.301,P<0.001),见表2。
2.3 两组病理特征比较
PAR高水平组M、E、T病变均多于PAR低水平组,差异均有统计学意义(P<0.05),两组S、C病变差异均无统计学意义(P>0.05),见表3。
3 讨论
IgAN是世界上最常见的肾小球疾病类型[6]。IgAN只能通过肾活检标本的组织病理学检查来确诊,这表明肾小球内存在IgA显性或共显性免疫沉积物[7]。当IgAN仅局限于肾脏时,它被诊断为原发性IgAN。然而,IgAN也可能表现为一系列肾外疾病的继发表现,如慢性肝病、糖尿病、淀粉样变性或狼疮。在这种情况下,则被归类为继发性IgAN。原发性IgAN是成人原发性肾小球肾炎的主要病理类型,同时也是导致ESRD的主要原因。Tossier等[8]研究了伴IgAN弥漫性支气管炎患者呼吸道感染活动期IgA1向血液循环分泌和蓄积,该炎症区域血清IgA1及多聚IgA1含量显著升高,同时增加了肾脏组织IgA沉积,导致肾损伤。因此,目前一致公认IgAN是免疫复合物介导的炎症反应。
血小板相关参数,包括PLT、PAR在临床上是容易检测而且廉价的实验室指标。重要的是血小板可通过与免疫细胞相互作用并分泌促炎细胞因子来触发和加重炎症,多项研究结果一致表明血小板相关参数与炎症相关,可作为新的炎症指标[9-11]。研究发现,循环活化的PLT富含促炎因子并且能够释放多种生物活性微粒,与损伤血管管腔内的红细胞、中性粒细胞和淋巴细胞相互作用并产生免疫、炎症和血栓性疾病[12-14]。临床观察性研究表明,在患有类风湿性关节炎的患者中,血小板计数会随着疾病的进展而逐渐增加,而白细胞和红细胞计数的变化并不显著[15-16]。另外对于患有巨细胞动脉炎的颞动脉炎症的老年患者,高血小板计数不仅反映疾病活动,同时还具有诊断价值[17]。血清白蛋白(albumin,ALB)除了反映身体的营养状况外,通常还与炎症紧密有关[18-19]。白蛋白降低总是与C反应蛋白升高有关,常引起全身炎症反应的加重[20]。同时白蛋白可抑制组蛋白H4诱导的血小板活化和聚集,并通过结合花生四烯酸发挥抗凝作用[21]。PAR即PLT比ALB,作为一种组合标记,在预测方面比其他血小板相关参数更准确,与其他血小板参数和/或炎症标志物相比,PAR更稳定且受到较小的生理条件动态变化的影响[22-25]。PAR现已被证明与许多炎症性疾病的严重程度和预后密切相关,比如文献[26]中所报道的PAR与中轴型脊柱关节炎的疾病活动度呈正相关。因此,多个研究的结果一致表明,PAR可能成为一种新型炎性预后指标[10-11]。在慢性肾脏病进展过程中,肾功能的丧失会引发内皮细胞活化和炎症增加,加速了血小板活化和聚集,高PAR水平进一步促进血栓形成和出血风险[27]。PAR在预测腹膜透析(peritoneal dialysis,PD)患者的预后方面起着类似的作用,PAR水平较高的PD患者死亡率较高[23]。PAR在急性肾损伤的发生、发展和预后中发挥同等重要作用,较高的PAR值具有较高的心脏相关急性肾损伤风险和院内死亡率[28]。本研究发现,在IgAN患者中,PAR高水平组的PLT、胱抑素C、血尿酸、白细胞、24 h尿蛋白水平均高于PAR低水平组,PAR与IgAN疾病严重程度相关,提示高水平PAR的IgAN患者肾脏损伤更重;推测与高水平PAR意味着过度炎症状态和/或营养不良相关。ALB作为一种营养状况、免疫功能的标志:全身炎症的可靠标志,且降低的ALB普遍认为是预后不良的指标[29]。在肾脏疾病方面,研究证实低ALB是IgAN患者发生ESRD的独立危险因素[30]。此外对合并有低白蛋白血症者肾脏病理多表现为非微小病变,非微小病变一般治疗反应不佳,故成为该类患者预后较差的主要病理基础[31]。本研究发现PAR高水平组的ALB低于PAR低水平组,其机制可能是大量血清白蛋白的丢失,减弱了ALB的抗炎作用,引发更为严重的炎症反应,使肾脏疾病进展,造成不良预后。
本研究结果显示,PAR高水平组患者的系膜细胞过多、毛细血管内细胞过多、肾小管萎缩和间质纤维化的病变均显著多于低水平组。可能原因是高PAR组IgAN患者处于高炎症状态,炎症反应可诱导免疫细胞浸润和纤维化,加重肾脏病理损伤。因此推测PAR高水平组的IgAN更有可能发展为ESRD。有研究指出,PAR高的患者蛋白尿更严重,病理病变更明显(毛细血管内增生和间质纤维化),揭示了高蛋白尿水平、毛细血管内重度增生在高PAR组中更常见,与本研究结果一致。本研究不足的是对S、C病变患者失去预测能力,可能大多数入组患者没有进入严重的病理损伤,同时研究样本量较小,不除外干扰因素导致。国内外许多研究者表明,IgAN病理分级与其预后有一定相关性,并根据IgAN Lee氏病理分级对病情预后进行判断。Lee氏病理分级Ⅰ、Ⅱ级预后良好,为低危险水平;Ⅲ级及以上为高危险水平。本试验结果表明低PAR组Lee氏病理分级主要为Ⅰ、Ⅱ级,而高PAR组则主要为Ⅳ、Ⅴ级,说明IgAN患者肾脏病理分级在低PAR时偏低、肾脏损伤轻微,但PAR水平高的IgAN患者肾脏病理分级更高,肾脏损伤更严重,提示PAR水平既能反映机体炎症反应状态又能提示IgAN病理分级轻重,更进一步可以预测PAR高水平组的IgAN患者更有可能发展为ESRD,这与一项回顾性研究中高PAR患者似乎有更严重的临床表现和病理病变研究结果一致[5]。有研究通过Cox回归模型来确定IgAN的独立危险因素,结果表明PAR是ESRD的独立危险因素[32]。本研究同样验证了PAR可以更好地预测及判断IgAN患者的疾病严重状态,这可能是因为轻度肾功能不全的患者进展为ESRD的速度相对较慢,炎症状态反映较轻。
本研究的局限性首先在于它是一项回顾性单中心研究,两组患者年龄比有统计学差异,可能与地域相关。同时患者样本量相对较小且达到的终点数量较少。其次,分组是基于这个队列的,这意味着它可能不适合其他人群和种族。因此,未来需要对不同种族、不同年龄阶段的患者进行更大规模的前瞻性研究、多中心研究来证实这些初步结果。此外,除了PAR外,还有一些其他炎症标志物,如CRP、铁蛋白,这应该在未来的研究中进行收集和分析。总之,PAR是一种新兴的炎症标志物,为IgAN病情严重程度评估、疗效评价提供一种简单易行的新方法。
参考文献
[1] BARBOUR S J,CATTRAN D C,KIM S J,et al.Individuals of pacific Asian origin with IgA nephropathy have an increased risk of progression to end-stage renal disease[J].Kidney Int,2013,84(5):1017-1024.
[2] WU X,ZHAO L,LI K,et al.The role of NLRP3 inflammasome in IgA nephropathy[J].Medicina (Kaunas),2022,59(1):82.
[3] ZACHOVA K,KOSZTYU P,ZADRAZIL J,et al.Role of Epstein-Barr virus in pathogenesis and racial distribution of IgA nephropathy[J].Front Immunol,2020,11:267.
[4] TAN J,SONG G,WANG S,et al.Platelet-to-albumin ratio:a novel IgA nephropathy prognosis predictor[J].Front Immunol,2022,13:842362.
[5]徐阳,韩拓,刘莉君,等.血小板/白蛋白和血小板/血红蛋白及C-反应蛋白/白蛋白各比值与糖尿病患病的相关性分析[J].西安交通大学学报(医学版),2022,43(3):348-353.
[6] SCHENA F P,NISTOR I.Epidemiology of IgA nephropathy:a global perspective[J].Semin Nephrol,2018,38(5):435-442.
[7] ROBERTS I S.Pathology of IgA nephropathy[J].Nat Rev Nephrol,2014,10(8):445-454.
[8] TOSSIER C,PILETTE C,GUILLEMINAULT L,et al.Diffuse panbronchiolitis and IgA nephropathy[J].Am J Respir Crit Care Med,2014,189(1):106-109.
[9] KUMARASAMY C,TIWARY V,SUNIL K,et al.Prognostic utility of platelet-lymphocyte ratio, neutrophil-lymphocyte ratio and monocyte-lymphocyte ratio in head and neck cancers:a detailed PRISMA compliant systematic review and Meta-analysis[J].Cancers (Basel),2021,13(16):4166.
[10] LI L,YU J,ZHOU Z.Platelet-associated parameters in patients with psoriasis: a PRISMA-compliant systematic review and meta-analysis[J/OL].Medicine (Baltimore),2021,100(50):e28234.https://pubmed.ncbi.nlm.nih.gov/34918687/.
[11] LI L Q,BAI Z H,ZHANG L H,et al.Meta-analysis of hematological biomarkers as reliable indicators of soft tissue sarcoma prognosis[J].Front Oncol,2020,10:30.
[12] COGNASSE F,HAMZEH-COGNASSE H,LAFARGE S,et al.
Human platelets can activate peripheral blood B cells and increase production of immunoglobulins[J].Exp Hematol,2007,35(9):1376-1387.
[13] KOUPENOVA M,CLANCY L,CORKREY H A,et al.
Circulating platelets as mediators of immunity,inflammation,and thrombosis[J].Circ Res,2018,122(2):337-351.
[14] YEUNG J,LI W,HOLINSTAT M.Platelet signaling and disease:targeted therapy for thrombosis and other related diseases[J].Pharmacol Rev,2018,70(3):526-548.
[15] MILOVANOVIC M,NILSSON E,JAREMO P.Relationships between platelets and inflammatory markers in rheumatoid arthritis[J].Clin Chim Acta,2004,343(1-2):237-240.
[16] ZHA Q,HE Y,LU Y,et al.Relationship between platelet counts and cartilage erosion in 436 cases of rheumatoid arthritis[J].Clin Chim Acta,2006,371(1-2):194-195.
[17] EL-DAIRI M A,CHANG L,PROIA A D,et al.Diagnostic algorithm for patients with suspected giant cell arteritis[J].
J Neuroophthalmol,2015,35(3):246-253.
[18] ARROYO V,GARCIA-MARTINEZ R,SALVATELLA X.
Human serum albumin,systemic inflammation, and cirrhosis[J].J Hepatol,2014,61(2):396-407.
[19] LI T,LI X,WEI Y,et al.Predictive value of C-reactive protein-to-albumin ratio for neonatal sepsis[J].J Inflamm Res,2021,14:3207-3215.
[20] CHOJKIER M.Inhibition of albumin synthesis in chronic diseases: molecular mechanisms[J].J Clin Gastroenterol,2005,39(4 Suppl 2):S143-S146.
[21] LAM F W,CRUZ M A,LEUNG H C,et al.Histone induced platelet aggregation is inhibited by normal albumin[J].Thromb Res,2013,132(1):69-76.
[22] GUI Y,XU Y,YANG P.Predictive value of the platelet-to-albumin ratio (PAR) on the risk of death at admission in patients suffering from severe fever with thrombocytopenia syndrome[J].
J Inflamm Res,2021,14:5647-5652.
[23] YANG Y,YUAN J,LIU L,et al.Platelet-to-albumin ratio:a risk factor associated with technique failure and mortality in peritoneal dialysis patients[J].Ren Fail,2021,43(1):1359-1367.
[24] SAITO N,SHIRAI Y,HORIUCHI T,et al.Preoperative platelet to Albumin ratio predicts outcome of patients with cholangiocarcinoma[J].Anticancer Res,2018,38(2):987-992.
[25] GUO M,SUN T,ZHAO Z,et al.Preoperative platelet to albumin ratio predicts outcome of patients with non-small-cell lung cancer[J].Ann Thorac Cardiovasc Surg,2021,27(2):84-90.
[26] HUANG Y,DENG W,PAN X,et al.The relationship between platelet to albumin ratio and disease activity in axial spondyloarthritis patients[J].Mod Rheumatol,2022,32(5):974-979.
[27] BAATEN C,SCHROER J R,FLOEGE J,et al.Platelet abnormalities in CKD and their implications for antiplatelet therapy[J].Clin J Am Soc Nephrol,2022,17(1):155-170.
[28] HE Z,WANG H,WANG S,et al.Predictive value of platelet-to-albumin ratio (PAR) for the cardiac-associated acute kidney injury and prognosis of patients in the intensive care unit[J].Int J Gen Med,2022,15:8315-8326.
[29] COLOTTA F,ALLAVENA P,SICA A,et al.Cancer-related inflammation, the seventh hallmark of cancer:links to genetic instability[J].Carcinogenesis,2009,30(7):1073-1081.
[30] KAWAI Y,MASUTANI K,TORISU K,et al.Association between serum albumin level and incidence of end-stage renal disease in patients with Immunoglobulin a nephropathy:a possible role of albumin as an antioxidant agent[J/OL].PLoS One, 2018,13(5):e0196655.https://pubmed.ncbi.nlm.nih.gov/29795559/.
[31]管娜,丁洁,杨霁云,等.基于病例对照研究的儿童肾病综合征低白蛋白血症诊断标准探讨[J].中国循证儿科杂志,2017,12(2):131-134.
[32] AKBOGA M K,CANPOLAT U,YUKSEL M,et al.Platelet to lymphocyte ratio as a novel indicator of inflammation is correlated with the severity of metabolic syndrome: a single center large-scale study[J].Platelets,2016,27(2):178-183.
(收稿日期:2023-11-17) (本文编辑:何玉勤)

