石榴皮植物染料及其染色羊绒纤维的鉴别
桂祖文 何剑锋 徐昊宁 陈胜航 余志成 侯战昌 陈超

DOI: 10.19398j.att.202309034
摘 要:为完善植物染标准体系,建立石榴皮植物染料的鉴别方法与标准,通过紫外分光光度计对石榴皮植物染料的标志物进行分析,并采用液质联用仪对石榴皮植物染料及其染色羊绒纤维上萃取的染料进行鉴别。结果表明:安石榴苷与鞣花酸可以作为鉴别石榴皮植物染料及其染色羊绒纤维的标志物。石榴皮植物染料的质谱中检测到准分子离子峰m/z 300.9862,保留时间为1.02 min;直接染色和硫酸亚铁后媒染羊绒纤维萃取液的质谱中检测到准分子离子峰m/z 300.9896和300.9868,保留时间分别为1.02 min和1.04 min。两者均与鞣花酸标准品1.02 min的出峰时间相近,在标准允许的±2.5%偏差范围内,结合其紫外可见光吸收光谱中只含有277 nm处的没食子酸与255、357 nm处的鞣花酸特征峰,可确定该染料及其染色羊绒纤维均为纯石榴皮植物染料。
关键词:石榴皮;植物染料;羊绒纤维;安石榴苷;鞣花酸;染料鉴别;植物染标准体系
中图分类号:TS193.6
文献标志码:A
文章编号:1009-265X(2024)06-0018-10
收稿日期:20230925
网络出版日期:20240116
基金项目:宁波市科技创新2025重大专项(2022Z100)
作者简介:桂祖文(1995—),男,安徽池州人,硕士研究生,主要从事新型染整技术的应用与开发方面的研究。
通信作者:余志成,E-mail:yuzhicheng8@aliyun.com
石榴皮是石榴果实的废弃物,约占整个石榴质量的20%~30%[1],是一种成本低廉且来源丰富的植物染料原料。石榴皮中含有大量的多酚类化合物,包括安石榴苷、鞣花酸、没食子酸、儿茶素等[2],其中安石榴苷[3]是2~3个鞣花酸的低聚合化合物,是石榴特有的鞣花单宁,也是石榴皮中天然黄色素的主要成分[4]。有研究表明,安石榴苷与鞣花酸都具有抗菌、抗氧化、抗肿瘤等功效[5],用石榴皮植物染料对纺织品进行染色,可获得抗菌、抗紫外和抗氧化等功能[4],因此,石榴皮植物染料具有十分重要的应用价值;但目前对于石榴皮植物染料及其染色面料系列产品还没有对应的鉴别方法与标准,为完善植物染料标准体系的缺失,需尽快建立石榴皮植物染料的鉴别方法与标准,促进植物染产业的健康发展。
本文研究石榴皮植物染料及其染色羊绒纤维的鉴别,首先通过紫外分光光度计对石榴皮植物染料进行测试,确定鉴别石榴皮植物染料的标志物;然后采用紫外分光光度计和液质联用仪在负离子模式下分别对标准品、石榴皮植物染料及其染色羊绒纤维萃取液进行检测;最后通过比对染料、染色羊绒纤维萃取液与标准品的保留时间和质谱图,并结合其紫外可见光吸收光谱中含有的特征峰,建立一个完善的鉴别标准体系,以鉴别该染料和羊绒纤维是否为纯石榴皮植物染料及其染色羊绒纤维。本文建立的石榴皮植物染料的鉴别方法与标准,可为植物染溯源论证系统工程的开展提供参考。
1 实验
1.1 材料及仪器
实验材料:优质白山羊绒(纤维细度15~17 μm,长度28~40 mm,宁波康赛妮新纤维科技有限公司);石榴皮植物染料(常州美胜生物材料有限公司);安石榴苷鞣花酸(上海同田生物技术有限公司);冰醋酸、甲醇、硫酸亚铁、柠檬酸、无水碳酸钠、中性皂片(杭州高晶精细化工有限公司);促进剂DP(传化精细化工有限公司)。
实验仪器:DYE-24型可调向式打色机(上海千立自动化设备有限公司);雷磁pH计(上海仪电科学仪器股份有限公司);RE-2000B旋转蒸发器(巩义瑞德仪器设备有限公司);赛多利斯BSA124S电子分析天平(济南欧莱博科学仪器有限公司);DR6000紫外-可见光分光光度计(美国哈希公司);ZQ2000液质联用仪(沃特世科技(上海)有限公司);0.22 μm有机系针式样品过滤器(天津市领航实验设备股份有限公司)。
1.2 实验方法
1.2.1 石榴皮植物染料染色羊绒纤维样品的制备
a)直接染色:将羊绒纤维在浴比1∶50,染料用量2.5%(o.w.f),染液pH值4~5,90 ℃条件下染色60 min。其升温曲线如图1所示。
dyes extracted from pomegranate peel
b)后媒染处理工艺:将直接染色的羊绒纤维在浴比1∶50,FeSO4 5%(o.w.f),柠檬酸1 g/L,60 ℃条件下处理30 min。其后媒染处理升温曲线如图2所示。
c)皂洗工艺:皂片2 g/L、浴比1∶50,50 ℃处理20 min。
1.2.2 标准品和石榴皮植物染料液质联用检测样品的制备
1.2.2.1 安石榴苷与鞣花酸标准品
准确称取1 mg的安石榴苷与鞣花酸标准品,分别用甲醇溶液溶解,定容于10 mL的容量瓶之中,得到0.1 mg/mL的标准品溶液;再用一次性0.22 μm有机系针式样品过滤器进行过滤,制得液质联用检测样品。
1.2.2.2 石榴皮植物染料
准确称取1 mg的石榴皮植物染料,用甲醇溶液溶解,定容于10 mL的容量瓶中,得到0.1 mg/mL的石榴皮植物染料溶液,再用一次性0.22 μm有机系针式样品过滤器进行过滤,制得液质联用检测样品。
1.2.3 羊绒纤维上石榴皮植物染料萃取及液质联用检测样品的制备
a)羊绒纤维上石榴皮植物染料萃取
准确称取0.5 g石榴皮植物染料直接染色羊绒纤维剪碎置于染杯中,加入30%甲醇水溶液,用碳酸钠调节溶液pH为8,浴比1∶30,在100 ℃下加热萃取80 min。取出羊绒纤维得到萃取液,采用旋转蒸发器浓缩至5 mL,得到浓缩后萃取液。
准确称取0.5 g石榴皮植物染料硫酸亚铁后媒染羊绒纤维剪碎置于染杯中,加入30%甲醇与2 g/L促进剂DP水溶液,用碳酸钠调节溶液pH为10,浴比1∶30,在100 ℃下加热萃取80 min。取出羊绒纤维得到萃取液,采用旋转蒸发器浓缩至5 mL,得到浓缩后萃取液。
b)液质联用检测样品的制备
将石榴皮植物染料直接染色羊绒纤维萃取液浓缩至5 mL,先用甲醇溶液将其稀释一定倍数,再用一次性0.22 μm有机系针式样品过滤器进行过滤,制得液质联用检测样品。
将石榴皮植物染料硫酸亚铁后媒染羊绒纤维浓缩后萃取液的pH调回至中性,再用甲醇溶液将其稀释一定倍数,最后用一次性0.22 μm有机系针式样品过滤器进行过滤,制得液质联用检测样品。
1.3 测试方法
1.3.1 吸收光谱
配置一定浓度的石榴皮植物染料溶液及其染色羊绒纤维萃取液,采用DR6000紫外-可见光分光光度计测其波长200~760 nm范围的吸光度,绘制紫外-可见光吸收光谱图。
1.3.2 液质联用测试
采用ZQ2000液质联用仪对石榴皮植物染料及其染色羊绒纤维萃取液进行测试,并绘制总离子流图与质谱图。
a)色谱条件
色谱柱:C18反相色谱柱(250 mm×4.60 mm I.D,5 μm);流动相:50% A和50% B(A为0.1%甲酸水溶液、B为乙腈);流速:0.3 mL/min;进样量:100 μL;柱温:30 ℃;检测波长:200~500 nm。
b)质谱条件
进样方式:LC-MS;离子源:ESI;离子源温度:320 ℃;检测模式:负离子;扫描范围(m/z):50~1200 nm;毛细管电压:3500.0 V;毛细口出口电压:109.7 V。
2 结果与讨论
2.1 石榴皮植物染料的紫外-可见光吸收光谱及标志物确定
以50%甲醇水溶液为溶剂,将1 g/L的石榴皮植物染料溶液稀释5倍,并用紫外分光光度计测试其吸收光谱,结果如图3所示。
由图3可知,石榴皮植物染料的紫外可见吸收光谱中出现了3个吸收峰,其中:277 nm处的吸收峰为没食子酸的特征峰,255 nm和357 nm处为安石榴苷与鞣花酸的特征峰[6]。
已有研究表明,石榴皮植物染料的主要成分为安石榴苷、鞣花酸以及没食子酸等多酚类物质,其中安石榴苷含量最高,鞣花酸次之,没食子酸含量最低,并且安石榴苷的含量约为鞣花酸的25倍、没食子酸的470倍[6-7],这说明安石榴苷和鞣花酸是石榴皮植物染料中多酚类物质的主
体。同时考虑到安石榴苷是石榴特有的鞣花单宁[3],鞣花酸也只是较少存在于使君子科榄仁树的叶、诃子等植物染料中[7],而没食子酸却广泛存在于中药材、水果农产品中[8],不具有一定的代表性,因此考虑选择安石榴苷与鞣花酸作为鉴别石榴皮植物染料的标志物。
2.2 安石榴苷与鞣花酸标准品的液质联用检测
2.2.1 安石榴苷标准品的液质联用检测
采用液质联用仪对安石榴苷标准品溶液进行检测,其离子流和质谱如图4所示。
由图4可知,在负离子模式下检测,安石榴苷标准品(C48H28O30,M=1084.72)的保留时间为0.63 min,m/z 1083.0941([M-H]-)为安石榴苷失去一个氢离子产生的准分子离子峰;m/z 541.0272([M-2H]2-)为安石榴苷失去两个氢离子产生的碎片离子峰[9]。
2.2.2 鞣花酸标准品的液质联用检测
采用液质联用仪对鞣花酸标准品溶液进行检测,其离子流和质谱如图5所示。
由图5可知,在负离子模式下检测,鞣花酸标准品(C14H6O8,M=302.28)的保留时间为1.02 min;m/z 300.9856([M-H]-)为鞣花酸失去一个氢离子产生的准分子离子峰[9]。
2.3 石榴皮植物染料的液质联用检测
采用液质联用仪对石榴皮植物染料进行检测,其离子流和质谱如图6所示。
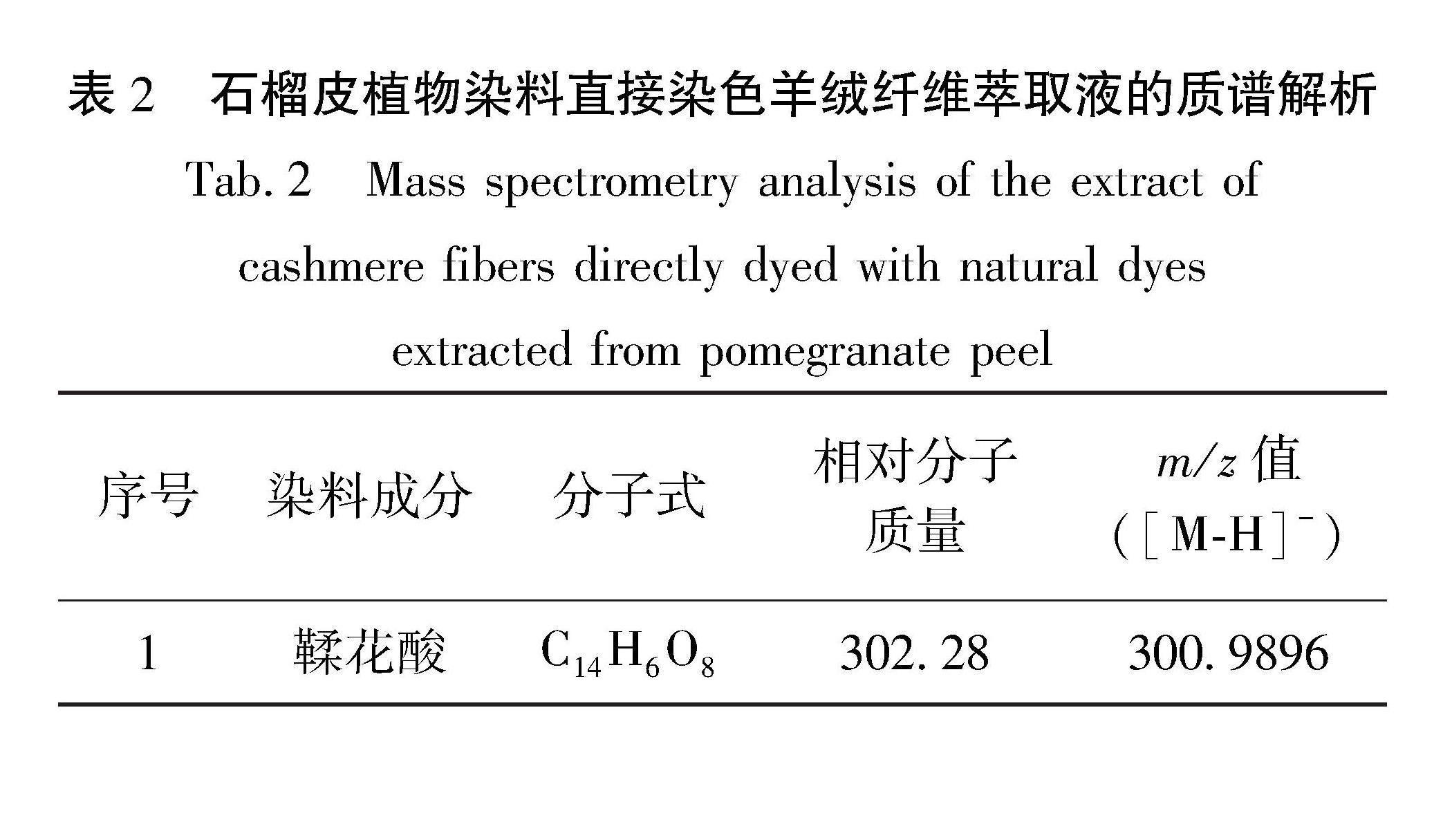
由图6(b)可知,石榴皮植物染料在负离子模式下检测到鞣花酸和没食子酸的离子峰,其各成分对应的质谱解析如表1所示。质谱中m/z 300.9862([M-H]-)为鞣花酸(C14H6O8,M=302.28)失去一个氢离子产生的准分子离子峰,m/z 168.9986([M-H]-)为没食子酸(C7H6O5,M=170.12)失去一个氢离子产生的准分子离子峰[9],且鞣花酸的离子峰强度较高,没食子酸的离子峰强度较低;质谱中未检测到安石榴苷的离子峰,是因为安石榴苷的化学性质不稳定,它是由一个六羟基联苯二甲酰基(HHDP)单元、一个gallagyl单元和一个葡萄糖单元组成[7],其中HHDP是由两个3,4,5-三羟基苯甲酰基(没食子酸酰基)通过C—C键连接而成[10];目前已有研究[11-12]表明,安石榴苷的酯键容易在高温、酸或碱条件下被水解,失去一分子六羟基联苯二酸(HHDP)形成安石榴林(Punicalin),失去的HHDP基团会自发地内酯化水解产生鞣花酸,而生成的安石榴林化学性质同样不稳定,会失去一分子葡萄糖得到没食子酸四聚体(Gallagic Acid),然后进一步水解生成鞣花酸(Ellagic Acid)。安石榴苷的水解过程[11]如图7所示。目前市场上的石榴皮植物染料为节约成本通常都是采用碱提取,因此在制备石榴皮植物染料时已将安石榴苷脱去糖苷键以及酯键全部生成了鞣花酸[10,13-14]。所以在石榴皮植物染料中检测到了大量的鞣花酸,而未检测到安石榴苷。
由图6(a)可知,石榴皮植物染料中鞣花酸的保留时间为1.02 min,与图5(a)中鞣花酸标准品1.02 min的出峰时间一致,结合图3石榴皮植物染料的紫外可见光吸收光谱中只含有277 nm处的没食子酸与255、357 nm处的鞣花酸特征峰,可确定该染料为纯石榴皮植物染料。
2.4 石榴皮植物染料染色羊绒纤维萃取液的紫外-可见光吸收光谱及液质联用检测
2.4.1 直接染色羊绒纤维萃取液的紫外-可见光吸收光谱及液质联用检测
以50%甲醇水溶液为溶剂,将石榴皮植物染料直接染色羊绒纤维萃取液稀释5倍,并用紫外分光光度计测试其吸收光谱,结果如图8所示。
从图8中可以看出,石榴皮植物染料直接染色羊绒纤维萃取液的紫外可见吸收光谱中含有277 nm处的没食子酸特征峰,255、357 nm处的鞣花酸特征峰。
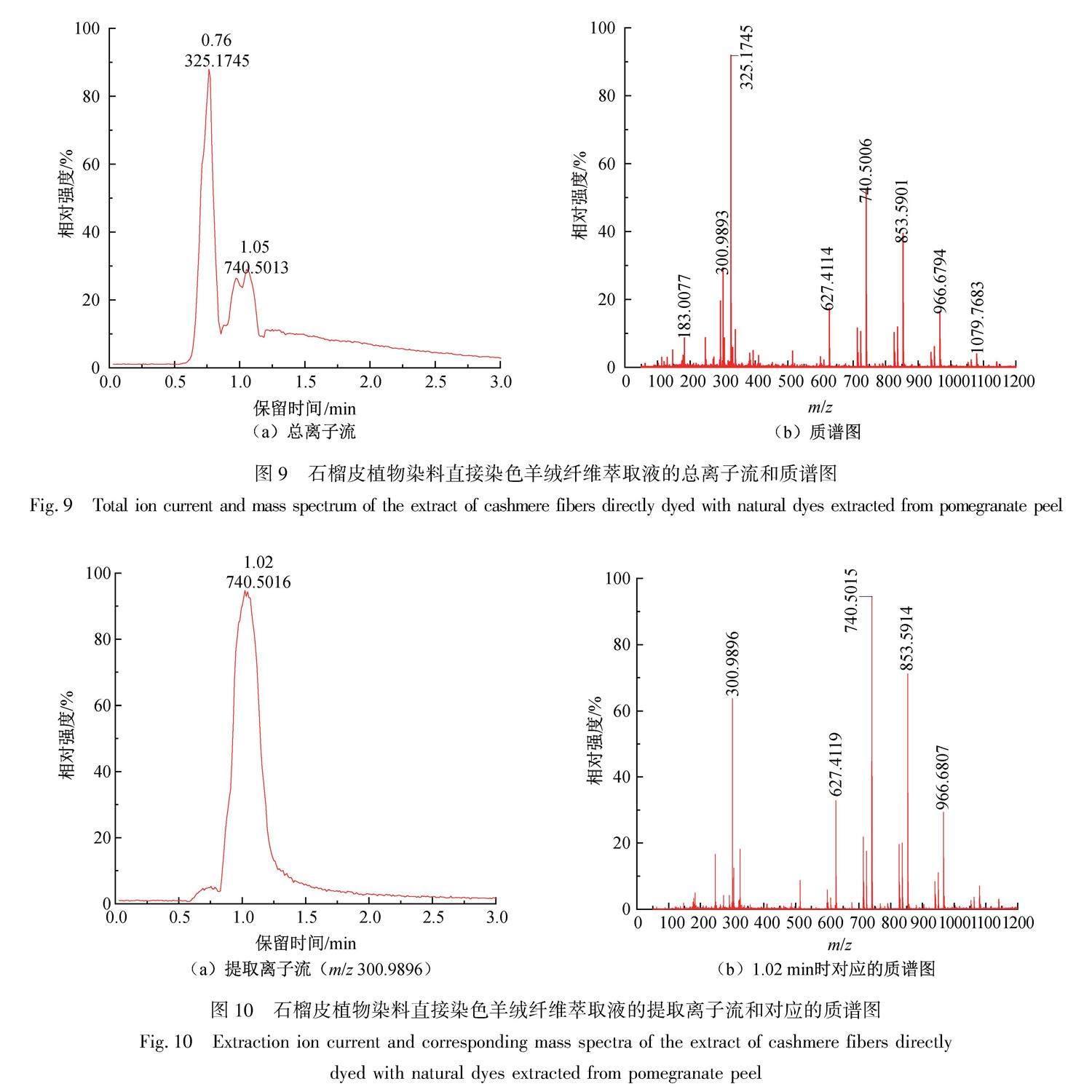
采用液质联用仪对石榴皮植物染料直接染色羊绒纤维萃取液进行检测,其离子流和质谱如图9、图10所示。
由图9(b)可知,石榴皮植物染料直接染色羊绒纤维萃取液在负离子模式下检测到鞣花酸的离子峰,质谱中m/z 300.9893([M-H]-)为鞣花酸(C14H6O8)失去一个氢离子产生的准分子离子峰。因从图9(a)中没有直接找到萃取液中鞣花酸对应的保留时间,所以需要先从萃取液的总离子流(见图9(a))中调出保留时间为1.02 min时对应的质谱图,然后再从其质谱图中鞣花酸的准分子离子峰处调出石榴皮植物染料直接染色羊绒纤维萃取液的提取离子流,其结果如图10所示。
在负离子模式下对石榴皮植物染料直接染色羊绒纤维萃取液进行液质联用检测分析,首先从萃取液的总离子流(见图9(a))中调出保留时间为1.02 min时对应的质谱图(见图10(b)),可以看到离子峰m/z 300.9896,该离子峰为石榴皮植物染料中的鞣花酸失去一个氢离子产生的准分子离子峰,其对应的质谱解析如表2所示。其次,从图10(b)中m/z 300.9896准分子离子峰处调出石榴皮植物染料直接染色羊绒纤维萃取液的提取离子流(见图10(a)),可知萃取液中鞣花酸的保留时间为1.02 min,与图5(a)中鞣花酸标准品1.02 min的出峰时间一致,结合图8石榴皮植物染料直接染色羊绒纤维萃取液的紫外可见光吸收光谱中只含有277 nm处的没食子酸与255、357 nm处的鞣花酸特征峰,可确定该染色羊绒纤维为纯石榴皮植物染料染色。
2.4.2 硫酸亚铁后媒染羊绒纤维萃取液的紫外-可见光吸收光谱及液质联用检测
以50%甲醇水溶液为溶剂,将石榴皮植物染料硫酸亚铁后媒染羊绒纤维萃取液稀释5倍,并用紫外分光光度计测试其吸收光谱,结果如图11所示。
从图11中可以看出,石榴皮植物染料硫酸亚铁后媒染羊绒纤维萃取液的紫外可见吸收光谱中同样只含有277 nm处的没食子酸特征峰,255、357 nm处的鞣花酸特征峰。
采用液质联用仪对石榴皮植物染料硫酸亚铁后媒染羊绒纤维萃取液进行检测,其离子流和质谱如图12、图13所示。
由图12(b)可知,石榴皮植物染料硫酸亚铁后媒染羊绒纤维萃取液在负离子模式下检测到鞣花酸的离子峰,质谱中m/z 300.9873([M-H]-)为鞣花酸(C14H6O8)失去一个氢离子产生的准分子离子峰。因从图12(a)中没有直接找到萃取液中鞣花酸对应的保留时间,所以需要先从萃取液的总离子流(见图12(a))中调出保留时间为1.02 min时对应
的质谱图,然后再从其质谱图中鞣花酸的准分子离子峰处调出石榴皮植物染料硫酸亚铁后媒染羊绒纤维萃取液的提取离子流,其结果如图13所示。
在负离子模式下对石榴皮植物染料硫酸亚铁后媒染羊绒纤维萃取液进行液质联用检测分析,首先从萃取液的总离子流(见图12(b))中调出保留时间为1.02 min时对应的质谱图(见图13(b)),可以看到离子峰m/z 300.9868,该离子峰为石榴皮植物染料中的鞣花酸失去一个氢离子产生的准分子离子峰,其对应的质谱解析如表3所示。其次,从图13(b)中m/z 300.9868准分子离子峰处调出石榴皮植物染料硫酸亚铁后媒染羊绒纤维萃取液的提取离子流(见图13(a)),可知萃取液中鞣花酸的保留时间为1.04 min,与图5(a)中鞣花酸标准品1.02 min的出峰时间相近,在标准GB/Z 35959—2018《液相色
谱-质谱联用分析方法通则》中允许的±2.5%偏差范围内。结合图11石榴皮植物染料硫酸亚铁后媒染羊绒纤维萃取液的紫外可见光吸收光谱中只含有277 nm处的没食子酸与255、357 nm处的鞣花酸特征峰,可确定染色该羊绒纤维为纯石榴皮植物染料染色。
3 结论
本文研究石榴皮植物染料及其染色羊绒纤维的鉴别,选用安石榴苷与鞣花酸为标志物,采用紫外分光光度计和液质联用仪在负离子模式下分别对标准品、石榴皮植物染料及其染色羊绒纤维萃取液进行检测。得到如下结论:
a)在石榴皮植物染料的质谱中检测到准分子离子峰m/z 300.9862,且保留时间为1.02 min,与鞣花酸标准品1.02 min的出峰时间一致,结合其紫外可见光吸收光谱中只含有277 nm处的没食子酸与255、357 nm处的鞣花酸特征峰,可确定该染料为纯石榴皮植物染料。
b)在石榴皮植物染料直接染色和硫酸亚铁后媒染羊绒纤维萃取液的质谱中检测到准分子离子峰m/z 300.9896和300.9868,且保留时间分别为1.02 min和1.04 min;与鞣花酸标准品1.02 min的出峰时间相近,在标准允许的±2.5%偏差范围内,结合其紫外可见光吸收光谱中只含有277 nm处的没食子酸与255、357 nm处的鞣花酸特征峰,可确定该染色羊绒纤维为纯石榴皮植物染料染色。
本文建立了石榴皮植物染料的鉴别方法与标准,完善了植物染标准体系,为后期植物染溯源论证系统工程的开展提供参考。
参考文献:
[1]贾冬英, 姚开, 谭薇, 等. 石榴皮中多酚提取条件的优化[J]. 林产化学与工业, 2006, 26(3): 123-126.
JIA Dongying, YAO Kai, TAN Wei, et al. Optimization of extraction condition of polyphenols from pomegranate peel[J]. Chemistry and Industry of Forest Products, 2006, 26(3): 123-126.
[2]宋薇薇, 焦士蓉, 周佳, 等. 石榴皮多酚的微波辅助提取及提取物抗氧化与抑菌作用研究[J]. 现代食品科技, 2008, 24(1): 23-27.
SONG Weiwei, JIAO Shirong, ZHOU Jia, et al. Microwaves assisted extraction of polyphenol from pomegranate peel and its antioxidant and antimicrobial activities[J]. Modern Food Science and Technology, 2008, 24(1): 23-27.
[3]陈欣子, 侯秀良, 郭盟盟, 等. 石榴皮染料对毛织物的染色性能研究[J]. 天然产物研究与开发, 2012, 24(11): 1528-1533.
CHEN Xinzi, HOU Xiuliang, GUO Mengmeng, et al. Dyeing properties of pomegranate peel dye to wool fabrics[J]. Natural Product Research and Development, 2012, 24(11): 1528-1533.
[4]洪浩月, 纪俊玲, 王东方. 石榴皮植物染料的提取及其在真丝上的预媒染工艺研究[J]. 印染助剂, 2017, 34(2): 47-52.
HONG Haoyue, JI Junling, WANG Dongfang. Study on natural dye extraction from pomegranate peel and its pre-mordant process on silk[J]. Textile Auxiliaries, 2017, 34(2): 47-52.
[5]DHAR DUBEY K K, SHARMA G, KUMAR A. Conjugated linolenic acids: Lmplication in cancer[J]. Journal of Agricultural and Food Chemistry, 2019, 67(22): 6091-6101.
[6]刘振平. 石榴不同部位4种多酚类成分检测方法的研究[D]. 成都: 西华大学, 2012: 17-49.
LIU Zhenping. The Study of the Determination of Four Polyphenols in Different Parts of Pomegranate Fruit[D]. Chengdu: Xihua University, 2012: 17-49.
[7]张杰, 崔艳娜, 刘绣华. 安石榴苷的研究进展[J]. 化学研究, 2014, 25(6): 551-562.
ZHANG Jie, CUI Yanna, LIU Xiuhua. Research advances of punicalagin[J]. Chemical Research, 2014, 25(6): 551-562.
[8]郑秀霞, 祝冬, 贯东艳, 等. 没食子酸检测方法的研究进展[J]. 中国食物与营养, 2022, 28(7): 26-29.
ZHENG Xiuxia, ZHU Dong, GUAN Dongyan, et al. Research progress of gallic acid detection methods[J]. Food and Nutrition in China, 2022, 28(7): 26-29.
[9]周本宏, 易慧兰, 郭咸希, 等. HPLC-ESI-MS对石榴皮中鞣质类化学成分的初步分析[J]. 中国药师, 2015, 18(2): 201-204.
ZHOU Benhong, YI Huilan, GUO Xianxi, et al. Preliminary analysis of Tannin-related constituents in pomegranate peel by HPLC-ESI-MS[J]. China Pharmacist, 2015, 18(2): 201-204.
[10]屈艳君, 王文慧, 曹家南, 等. 鞣花酸的制备及应用研究进展[J]. 中国食物与营养, 2022, 28(6): 39-45.
QU Yanjun, WANG Wenhui, CAO Jiannan, et al. Research progress on preparation and application of ellagic acid[J]. Food and Nutrition in China, 202, 28(6): 39-45.
[11]纪白慧. 石榴籽和石榴皮生物活性成分的研究[D]. 无锡: 江南大学, 2013: 29-32.
JI Baihui. Study on Biological Active Substance from Pomegranate Seeds and Peels[D]. Wuxi: Jiangnan University, 2013: 29-32.
[12]张佳浩, 李道明, 钟小荣, 等. 石榴皮多酚的提取、制备及其应用研究进展[J]. 食品研究与开发, 2022, 43(14): 204-211.
ZHANG Jiahao, LI Daoming, ZHONG Xiaorong, et al. Extraction, preparation, and application of pomegranate peel polyphenols: A review[J]. Food Research and Development, 2022, 43(14): 204-211.
[13]SEERAM N, LEE R, HARDY M, et al. Rapid large scale purification of ellagitannins from pomegranate husk, a by-product of the commercial juice industry[J]. Separation and Purification Technology, 2005, 41(1): 49-55.
[14]MAYER W, GORNER A, ANDRA K. Punicalagin und Punicalin, zwei Gerbstoffe aus den Schalen der Granatapfel[J]. Justus Liebigs Annalen Der Chemie, 1977, 11/12: 1976-1986.
创新节能减排 引领循环经济
——公益广告
Identification of the natural dye extracted from pomegranate peel and
its dyed cashmere fibers
GUI Zuwen1, HE Jianfeng2, XU Haoning1, CHEN Shenghang1,
YU Zhicheng1, HOU Zhanchang3, CHEN Chao3
(1a. College of Textile Science and Engineering (International Institute of Silk); 1b. Engineering Research
Center for Eco-Dyeing & Finishing of Textiles, Ministry of Education, Zhejiang Sci-Tech University,
Hangzhou 310018, China; 2.China Textile Planning Institute of Construction, Beijing 100020, China;
3.Ningbo Consinee New Fibre Technology Co., Ltd., Ningbo 315200, China)
Abstract:
In recent years, the international community has paid close attention to global environmental issues, and the concept of sustainable development has gradually become the theme of social development. With the popularization of the concept of ecology, health and environmental protection, increasing attention has been paid to the application of natural dyes in textiles. At present, plant dyes are one of the most important sources of natural dyes. A variety of plant dyes have been applied in textiles. Pomegranate peel, as a renewable resource, is one of the common plant dyes and has been widely used in the field of ecological textile dyeing. However, there is no corresponding identification method and standard for the natural dye extracted from pomegranate peel on the market. To make up the lack of plant dyeing standard system, it is necessary to establish the identification method and standard for the natural dye extracted from pomegranate peel.
To fill the gap of plant dyeing standard system and establish a identification method and standard for the natural dye extracted from pomegranate peel, this paper studied the identification of the natural dye extracted from pomegranate peel and its dyed cashmere fibers. Firstly, the natural dye extracted from pomegranate peel was tested by ultraviolet spectrophotometer to determine the markers for identifying the natural dye extracted from pomegranate peel. Then, the standard substance, the natural dye extracted from pomegranate peel and its dyed cashmere fiber extract were detected by ultraviolet spectrophotometer and liquid chromatography-mass spectrometry in negative ion mode. By comparing the retention time and mass spectrum of the dyes, the dyed cashmere fiber extract and the standard substance, and combining with the characteristic peaks contained in the ultraviolet-visible absorption spectrum, a perfect identification standard system was established to identify whether the dye and cashmere fiber were pure natural dye extracted from pomegranate peel and its dyed cashmere fiber.The experimental results show that punicalagin and ellagic acid can be used as markers to identify the natural dye extracted from pomegranate peel and its dyed cashmere fibers. The quasi-molecular ion peak m/z 300.9862 was detected in the mass spectrometry of the natural dye extracted from pomegranate peel, and the retention time was 1.02 min. The quasi-molecular ion peaks m/z 300.9896 and 300.9868 were detected in the mass spectrometry of direct dyeing and ferrous sulfate post-mordanting cashmere fiber extract, and the retention time was 1.02 min and 1.04 min, respectively. Both of them were similar to the peak time of ellagic acid standard at 1.02 min. In the range of ±2.5 % deviation allowed by the standard, combined with the fact that the UV-visible absorption spectrum only contained gallic acid at 277 nm and ellagic acid at 255 and 357 nm, it could be determined that the dye and its dyed cashmere fiber were pure natural dye extracted from pomegranate peel.
At present, although a variety of identification methods and standards for plant dyes have been established, there is still a lack of standard systems for some plant dyes in the market, and consumers cannot verify the conformity of products from the standards. Therefore, to enable consumers to purchase satisfactory plant dye products, identifying the corresponding plant dyes and their dyed fabrics is still the top priority in the development of plant dyes.
Keywords:
pomegranate peel; plant dyeing; cashmere fiber; punicalagin; gallogen; dyes identification; standard system of plant dyeing

