岩土高效溶蚀菌株Bt NL-11发酵条件优化及应用效果分析

摘要:【目的】为科学治理废弃矿山边坡,探究土壤细菌永久绿化法在生态修复中的应用与推广,对分离筛选出的高效溶蚀菌株进行发酵条件优化及应用效果分析。【方法】从南京幕府山风化岩壁土壤中分离出多种溶蚀微生物,并从中挑选出1种表现突出的溶蚀细菌菌株NL-11[经16S rRNA鉴定为苏云金芽孢杆菌(Bacillus thuringiensis,Bt)]进行发酵条件优化,利用盆栽试验观测其应用效果。首先利用单因素和Plackett Burman(PB)试验筛选出影响菌株生长的3个主要因素,即装液量、培养温度和时间;在此基础上使用最陡爬坡路径逼近最大响应区域;再利用Box-Behnken试验设计及响应面分析法进行回归分析;最后通过比较预测值与实测值验证模型可靠性。利用优化结果制备菌液,将制备好的菌液调节为低(10 cfu/mL)、中(1×105 cfu/mL)和高(1×109 cfu/mL)3种菌液浓度拌入基质(分别为T1、T2、T3处理)进行盆栽试验,设置不加菌液的处理为空白对照(CK),研究不同浓度菌液对矿物风化、植物和根系生长的促进作用。【结果】模型准确可靠,菌株NL-11的最佳发酵培养条件为:装液量19.51 mL,接种量2%(体积分数),初始pH 7.0,培养温度30.30 ℃,培养时间22.07 h,在此优化条件下发酵液中活菌数达到1.47×1010 cfu/mL,是未优化前的2.03倍。盆栽试验结果表明,菌株NL-11能够促进矿物风化,以高浓度菌液效果最显著;NL-11能够促进矿质养分溶解,以高浓度菌液效果最显著;NL-11能够促进植物及根系生长,以中浓度效果最显著。【结论】通过优化试验显著提高了菌株NL-11的发酵活菌产量,为菌株在边坡治理中的应用提供技术支持,综合评价菌株的应用效果并考虑生产成本等因素,喷播实践中的合适菌液浓度为1×105 cfu/mL。
关键词:生态修复;苏云金芽孢杆菌;发酵条件优化;Box-Behnken设计
中图分类号:X751;S732;Q89 文献标志码:A开放科学(资源服务)标识码(OSID):
文章编号:1000-2006(2024)03-0071-10
Optimization for fermentation conditions and analysis of application effect for high efficiency dissolution strain Bt NL-11 from Bacillus thuringiensis
WANG Lingjian1,2, JIA Zhaohui1, ZHANG Jinchi1*, TANG Xinggang1, SUN Xin1, MENG Miaojing1, LIU Xin1,2
(1. Jiangsu Province Key Laboratory of Soil and Water Conservation and Ecological Restoration, College of Water and Soil Coservation, College of Forestry and Grassland, Nanjing Forestry University, Nanjing 210037, China; 2. Co-Innovation Center for Sustainable Forestry in Southern China, Nanjing Forestry University, Nanjing 210037, China)
Abstract:【Objective】This study aimed to scientifically manage abandoned mine slopes, explore the application and promotion of the soil bacteria permanent greening method in restoration, optimize the fermentation conditions, and analyze the application effect of the isolated and screened high-efficiency solubilizing bacteria.【Method】A variety of solubilizing microorganisms were isolated from the weathered rock wall soil in Nanjing Mufu Mountain, and a prominent solubilizing strain, NL-11, identified as Bacillus thuringiensis by 16S rRNA, was selected to optimize fermentation conditions, and its application effect was observed with the potting test. The three main factors affecting the growth of the strain (liquid volume, temperature, and time), were screened using the univariate and Plackett Burman tests; on this basis, the steepest climbing path was used to approximate the maximum response area; then, the Box-Behnken experimental design was used and the response surface analysis method was used for regression analysis. Finally, model reliability was verified by comparing the predicted values with the measured values. The optimized results were used to prepare the bacterial solution, and then adjusted to low (10 cfu/mL), medium (1 × 105 cfu/mL), and high (1 × 109 cfu/mL) concentrations and mixed into the substrate (T1, T2, and T3 treatments, respectively) for the pot experiments, and the treatment without the bacterial solution was set as a blank control (CK) to study the effects of the different bacterial solution concentrations on mineral weathering and plant and root growth.【Result】The model was accurate and reliable, and the optimal fermentation culture conditions for NL-11 were as follows: a liquid volume of 19.51 mL, an inoculum level of 2%, an initial pH of 7.0, a temperature of 30.30 ℃, and a time of 22.07 h. The number of viable bacteria in the fermentation broth under these optimized conditions reached 1.47 × 1010 cfu/mL, which was 2.03 times higher than that before optimization. The results of the pot tests showed that strain NL-11 could promote mineral weathering, and the effect of the high concentration of the bacterial solution was the most significant. Furthermore, strain NL-11 could promote the dissolution of mineral nutrients, and the effect of the high concentration of the bacterial solution was the most significant. Strain NL-11 could also promote plant and root growth, and the effect of the medium concentration was the most significant. 【Conclusion】The optimization test significantly improved the production of fermentation of the live bacteria of strain NL-11 and provided technical support for the application of the strain in the management of slopes. The suitable concentration of the bacterial solution in spraying practice is 1 × 105 cfu/mL by the comprehensive evaluation of the application effect and consideration of the production cost and other factors.
Keywords:ecological restoration; Bacillus thuringiensis; fermentation process optimization; Box-Behnken design
开发利用矿产资源促进了区域经济和社会发展,但同时也产生了一系列环境和社会问题[1-4],出现了大量的裸露石质边坡。国际上石质边坡复绿一直是矿山生态恢复的重点难题[5-8],喷播绿化法是石质边坡生态修复的一种重要方法[9-10],近年来,日本科学家通过在基质中添加有效土壤菌的方式对其进行改良,发明了一种新型护坡绿化技术——土壤菌永久绿化法,即利用有效土壤菌对岩石的风化作用,加快岩石的土壤化进程,人为制造出具高次团粒结构并可栖息各种小型土壤动物与微生物的土壤,模拟自然生境,促进植物繁育生长,克服了客土喷播技术绿化效果难以长期维持的缺陷[11-13]。由于缺乏优质的土壤有效菌和专业的技术指导,土壤菌永久绿化法在我国的应用还存在诸多困难[14-15]。
目前,全世界被保藏的苏云金芽孢杆菌估计有60 000株,分布于世界各地[16],在植物保护和害虫防治等方面已得到广泛应用[17-18]。关于其培养优化已有很多研究报道,杨静等[19]为提高苏云金芽孢杆菌菌株Ⅸ17的胞外多糖(EPS)产量,通过响应面试验优化发酵培养基和发酵培养条件,优化后的EPS产量与初始发酵工艺相比,提高了133.3%;宋健等[20]利用单因素和响应面法对苏云金芽孢杆菌菌株JQD117发酵条件进行优化,提高其芽孢产量。由于同种菌株的来源和发酵目的差异对营养的需求不同,最适发酵条件也有差异[2,21-23]。因此,对菌种发酵条件的优化是获得最佳生产效率和经济效益的基础[24]。
为获得适应性强且安全高效的土壤微生物,研究团队从南京幕府山风化岩壁土壤中分离、挑选出1株高效溶蚀细菌NL-11[经16S rRNA鉴定为苏云金芽孢杆菌(Bacillus thuringiensis,Bt)][15]。此次试验利用单因素法、PB以及响应面设计,对能够高效溶蚀碳酸盐岩的菌株NL-11进行发酵参数优化,以获得高密度、低成本的菌液。利用优化结果制备菌液进行盆栽试验,探究菌株对基质养分及紫穗槐生长的影响,评估其在喷播实践中作为土壤有效菌的应用潜力,为形成并推广具有中国特色的溶蚀菌种绿化法提供数据和理论支持。
1 材料与方法
1.1 供试材料
菌株:苏云金芽孢杆菌菌株NL-11 分离自南京幕府山风化岩壁表层土壤,经16S rRNA基因序列分析,鉴定为苏云金芽孢杆菌(Bacillus thuringiensis,Bt)[15],现保存于中国典型培养物保藏中心(CCTCC NO:M2012453)。
NA培养基:蛋白胨10.0 g/L,牛肉膏3.0 g/L,氯化钠5.0 g/L,琼脂18.0 g/L。
NB培养基:蛋白胨10.0 g/L,牛肉膏3.0 g/L,氯化钠5.0 g/L。
基质:基础基质由土壤、泥炭土、木纤维、黏结剂、保水剂按比例配制(质量比例为土壤75.82%,泥炭土10%、木纤维14%,保水剂1‰,黏合剂0.8‰),调节含水量至50%,搅拌均匀后,121 ℃灭菌40 min,保存备用。基质土壤采自幕府山的林地;基质泥炭土、木纤维、黏结剂、保水剂购自Eco工程绿化公司。
矿物:采自幕府山石质边坡,根据X射线衍射结果得出其矿物组成(化学成分及质量占比为:CaO,62.34%;MgO,27.93%;K2O,1.75%;Fe2O3,3%;Al2O3,0.61%;SiO2,1.35%;Na2O,0.04%;其他2.98%)。将矿物洗净、粉碎过筛(孔径0.282 mm),灭菌备用。
植物:紫穗槐(Amorpha fruticosa),购于德阳种业有限公司。
1.2 试验设计
1.2.1 种子液制备
将保存良好的苏云金芽孢杆菌菌株NL-11植于NA培养基,30 ℃培养24~48 h,选择发育较好的菌落,转移至NB培养基,30 ℃震荡(175 r/min)24 h制成种子液,保存备用。
1.2.2 菌株NL-11高密度发酵条件优化
1)发酵条件优化单因素试验。将种子液接入NB培养基,在初始发酵条件(时间24 h、接种量5%、装液量20 mL/150 mL、温度30 ℃、pH 7.0、转速175 r/min)基础上,分别考察时间(14、16、18、20、22、24、26 h)、接种量(1%、2%、3%、4%、5%、6%、7%,均为体积分数)、装液量(10、20、30、40、50、60、70 mL,装于150 mL三角瓶中)、培养温度(26、28、30、32、34、36、38 ℃)、pH(5.5、6.0、6.5、7.0、7.5、8.0、8.5)等发酵参数对菌株NL-11生长状况的影响。
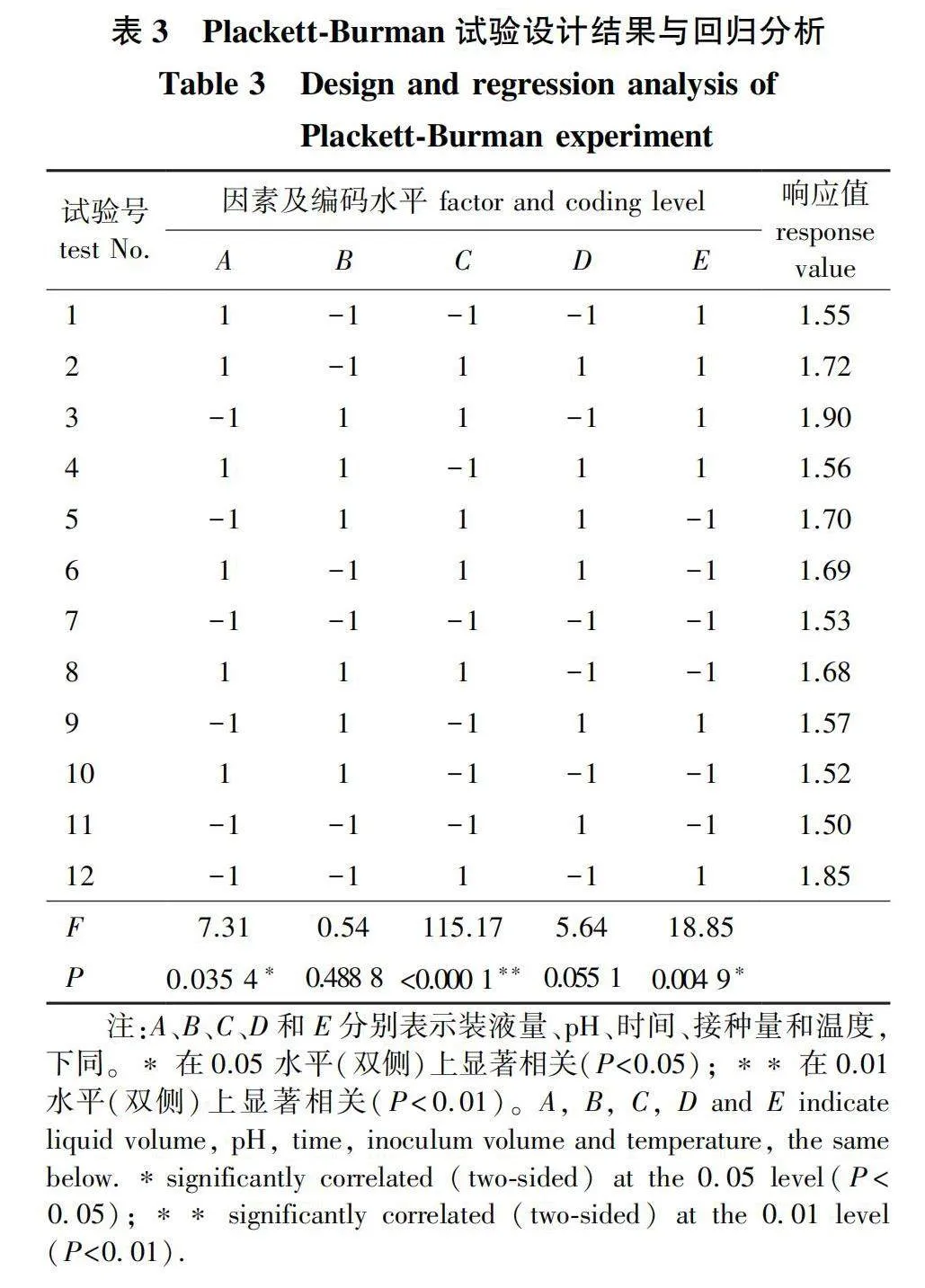
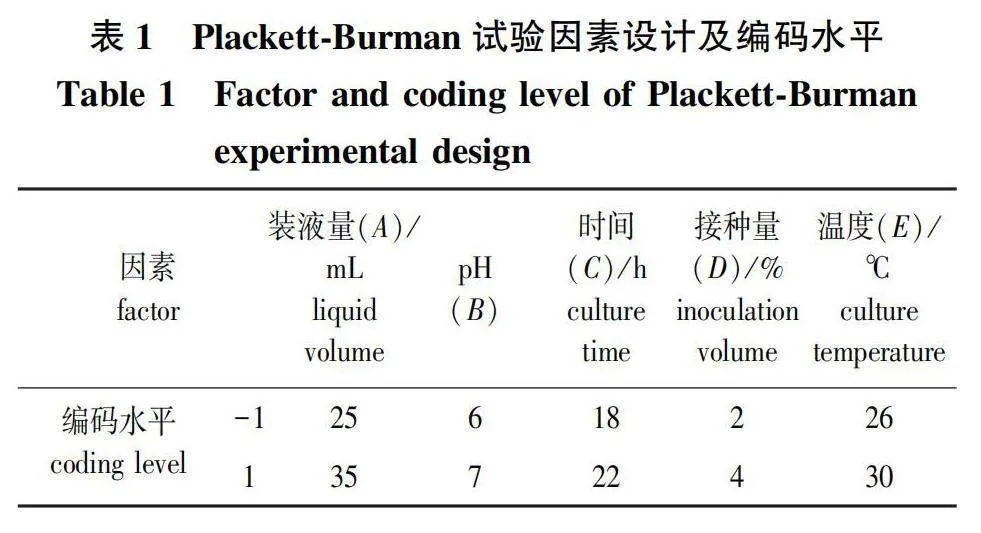
2)Plackett-Burman(PB)试验设计。根据单因素试验结果,利用Design-Expert 8.0的PB法对装液量、pH、时间、接种量、温度等5个因素进行考察,每个因素取两个水平(试验设计见表1),以发酵液OD600值作为响应值筛选出影响菌株NL-11生长状况的重要因素,进行下一步试验。
3)最陡爬坡试验。
根据PB试验结果得出对菌株NL-11生长状况影响最显著的3个因素,即装液量、时间和温度,根据3个因素效应大小的比例设定它们的变化方向及步长,安排最陡爬坡试验来确定因素的中心点,从而逼近最大响应值(发酵液OD600值)。
4)响应面试验优化。
在PB试验和最陡爬坡试验基础上,根据Box-Behnken试验设计原理,以发酵液OD600值为响应值,利用Design-Expert 8.0软件设计3因素3水平的响应面试验(试验设计见表2),其中包括12个析因试验和5个中心试验,并对结果进行响应面分析,通过比较预测值和试验值验证模型的有效性。
1.2.3 盆栽试验及处理
采用优化后的发酵工艺制备菌液,将100 mL菌液与基础基质(3.5 kg)充分混合装盆(盆底放有100 g矿物),以未添加菌液处理作为对照。试验设置4个处理,分别为T1(低浓度,菌液浓度为10 cfu/mL)、T2(中浓度,菌液浓度为1×105 cfu/mL)、T3(高浓度,菌液浓度为1×109 cfu/mL)、CK(未添加菌液),每个处理3个重复。基质放置5 d后栽植紫穗槐,于温室内常规管理90 d后进行样品采集和指标测定。
1.3 测试方法
1.3.1 菌株生长曲线绘制
按照比浊法测定菌体密度,以OD600值表示;稀释琼脂平板计数法测定菌落总数,绘制菌株NL-11的生长曲线。
1.3.2 矿物表面形貌观测
收集待测矿物,干燥处理,固定喷金,用扫描电镜(Quanta 200,FEI公司)观察表面形貌。
1.3.3 基质指标测定
参考文献[25]测定以下指标:基质全钙、镁采用消煮-原子吸收分光光度法测定;水溶性钙、镁采用振荡-原子吸收分光光度法测定;交换性钙、镁采用乙酸铵振荡-原子吸收分光光度法测定;基质速效氮采用碱解扩散吸收法测定;速效磷采用碳酸氢钠法测定;速效钾采用醋酸铵-火焰光度法测定;有机质采用重铬酸钾氧化法测定。
1.3.4 植物生长指标测定
分别利用皮尺、游标卡尺和LI-3000C便携式叶面积仪(哈量605系列,哈量工具有限公司)分别测定幼苗的苗高、地径和整株叶面积指数;利用Epson perfection V 700根系扫描仪测定根系生长指标(根长、根表面积、根直径、根体积)。
1.4 数据处理
使用Excel、SPSS 20.0、Design-Expert 8.0、Origin 8.5,Photoshop CS6等软件进行试验设计、数据分析和图件绘制。
2 结果与分析
2.1 菌株 NL-11培养条件优化
2.1.1 菌株 NL-11培养条件单因素试验
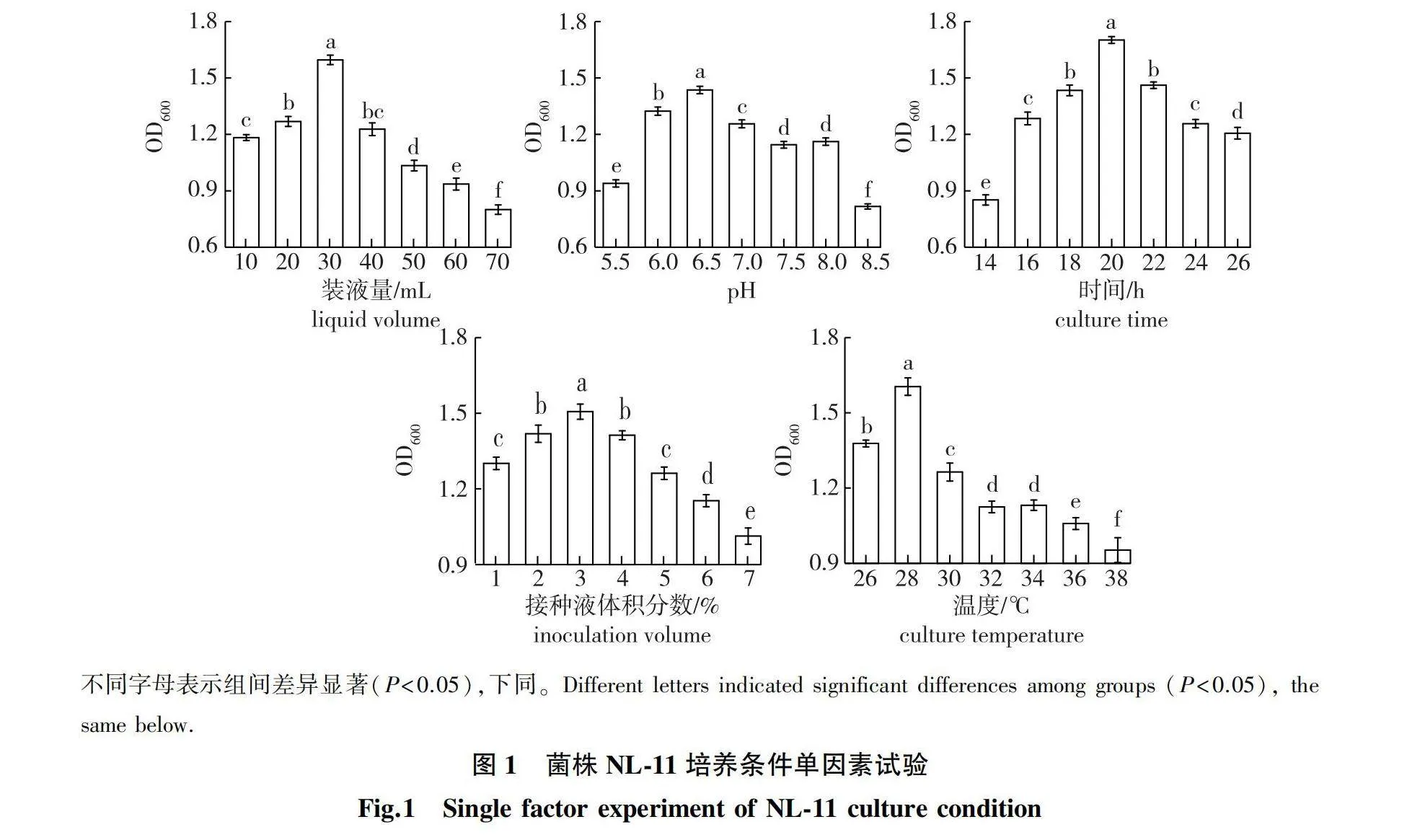
菌株NL-11培养条件单因素试验结果如图1所示。
由图1可知,初始装液量为10~70 mL时,最终发酵液OD600值随初始装液量的增加呈先增加后降低,当初始装液量为30 mL时,发酵液OD600值达到最大值(发酵液活菌数达到1.00×1010 cfu/mL)。初始pH为5.5~8.5时,随着pH的增大,最终发酵液OD600值呈现先增加后减少的趋势,当初始pH为6.5时,发酵液OD600值达到最大,活菌数达到最大(8.46×109 cfu/mL)。试验表明菌株NL-11在微酸性环境中长势较好,过酸或偏碱性条件均不利于该菌的生长。在发酵初期,菌株快速生长,发酵液活菌数显著增加;当培养至20 h时,该菌液的OD600值达到最大值,活菌数量达到9.87×109 cfu/mL;随着发酵时间延长,菌株生长进入衰亡期,由于营养的匮乏,以及自身的生长周期限制,发酵液OD600值显著降低。当接种量为1%~3%(体积分数,下同)时,菌株的发酵液OD600值随着接种量的增加而升高,当接种量为3%时,发酵液OD600值达到最大值(活菌数达8.85×109 cfu/mL);接种量超过3%,随着接种量的增加,最终发酵液OD600值显著降低。这可能是由于接种量过大,导致菌体前期生长较快,消耗营养物质多,同时产生了大量代谢废物[26-27],从而抑制了菌体的正常生长。随着培养温度的升高,发酵液OD600值先增加后减少,当培养温度为28 ℃时,发酵液OD600值最大,活菌达到9.49×109 cfu/mL;当温度高于28 ℃时,发酵液活菌数显著下降。因此,28 ℃为菌株生长的适宜温度。
2.1.2 Plackett-Burman(PB)及爬坡试验
PB试验设计结果与回归分析见表3。对PB试验结果进行分析可知,回归模型Plt;0.05,回归模型显著。PB试验结果的回归分析表明,因素B、D的P值分别为0.488 8、0.055 1(Pgt;0.05),说明在测试范围内,这些因素对响应值无显著影响;因素A、C、E的P值分别为0.0345、lt;0.000 1、0.004 9(Plt;0.05或Plt;0.01),这3个因素对响应值有极显著或显著影响。各因素对菌株生长状况影响的重要性排序为:Cgt;Egt;Agt;Dgt;B,因此应选择A、C、E进行后续试验。
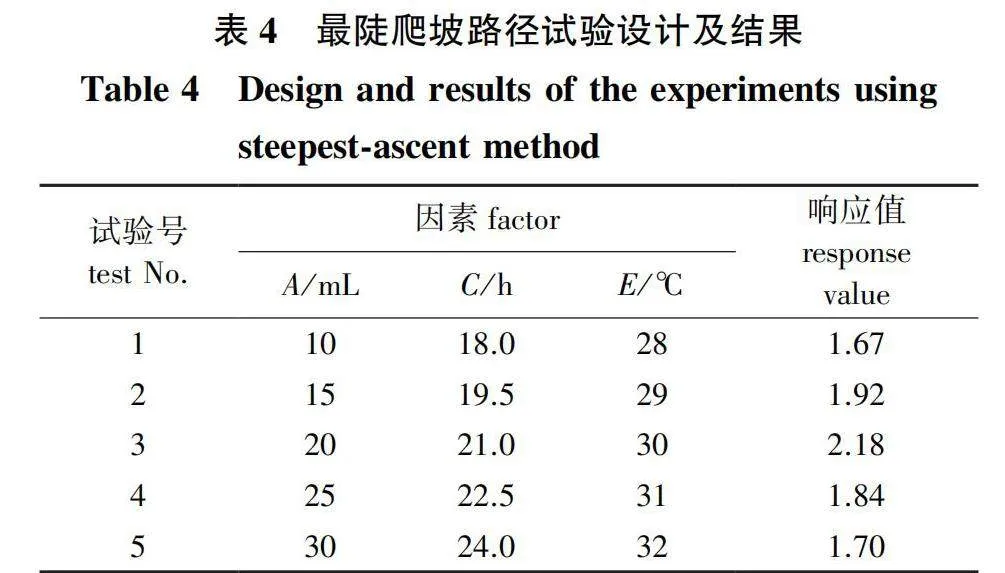
最陡爬坡试验可以快速确定最佳中心,根据PB试验结果筛选出因素A、C、E作为最陡爬坡试验的考察对象,固定因素B为7.0,因素D为2%。根据PB试验结果可知,因素C和E对响应值有显著正效应,应增加;因素A有显著负效应,应减小。试验设计及结果如表4所示,3个因素的最佳组合因子在第3组试验附近,即当因素A为20 mL,因素C为21 h,因素E为30 ℃时响应值最大,故以试验3的条件为响应面试验的中心点。
2.1.3 响应面分析
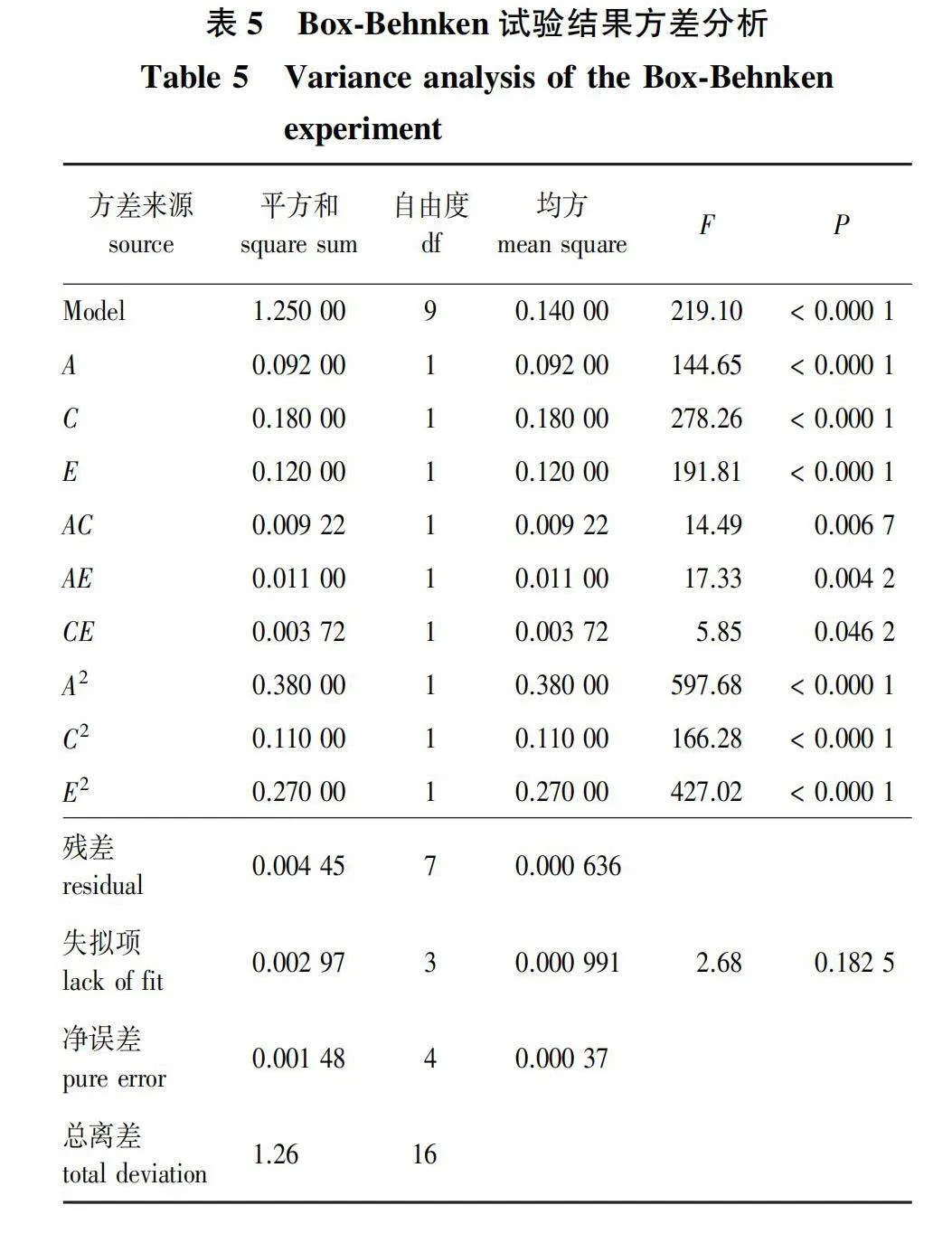
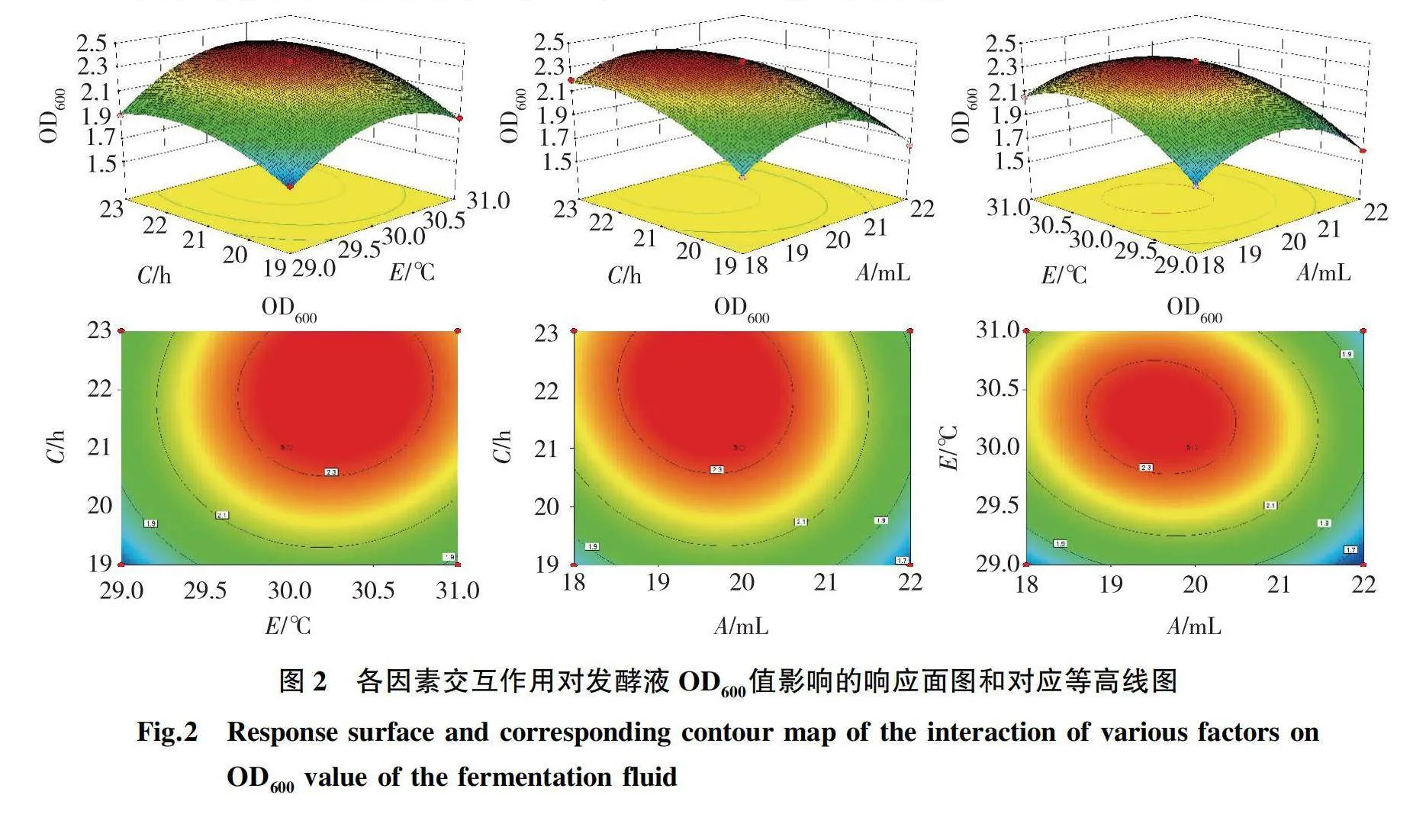
根据PB试验和最陡爬坡试验结果,以因素A、C、E为变量,以发酵液OD600值为响应值(Y),进行响应面试验,利用Design-Expert 8.0软件对试验结果构建回归模型,并进行方差分析(表5)。由表5可知,响应值对因素A、C、E的回归方程为:Y=2.33-0.11A+0.12C+0.15E-0.053AC-0.048AE+0.031CE-0.3A2-0.25C2-0.16E2。模型具有极高的显著性(Plt;0.01),拟合精度好,可以利用其进行后续的优化设计;失拟项不显著,试验可信,误差小。模型回归方程决定系数为R2=0.996 5,且与R2adj的值相近,说明模型拟合度较好,可以很好地模拟不同条件下发酵液OD600值的理论预测;变异系数(C.V.)为1.26%lt;10%,说明二次回归方程可以很好地对响应值进行预测,不需引入更高次项。方差分析结果表明:因素A、C、E的一次项和二次项均对响应值的回归模型影响极显著(Plt;0.01);因素A和E、A和C的交互作用对响应值影响极显著(Plt;0.01);因素E和C的交互对响应值影响显著(Plt;0.05)。由F值可知,各因素对发酵液OD600值的影响次序为Cgt;Egt;A,与PB试验结果相同。
各因素交互作用影响的显著性可通过等高线图的形状来反映,当等高线图呈椭圆形时,交互作用显著,而呈圆形时,表示不显著。因此,可以通过响应曲面和等高线图直观地观察到各因素间的交互作用对响应值的影响(图2)。由图2可知,因素A、C、E均对响应指标有显著影响,其中AC、AE的交互作用相对更强,对响应值的影响更大,响应面坡度更陡,等高线呈现的椭圆形角度更大;CE响应面坡度相对平缓,等高线所呈椭圆角度相对较小,更趋近于圆形。
由Design-Expert 8.0软件分析结果可知,菌株预测最佳发酵条件为:初始pH 7.0,接种量2%,装液量19.51 mL,培养温度30.30 ℃,培养时间22.07 h,相应的发酵液OD600值为2.404,以此条件进行了3组平行试验,实际测得发酵液OD600值为2.401(活菌数为1.472×1010 cfu/mL),与预测值相接近,证实采用响应面优化得到的发酵条件准确可靠,具有实用价值。
2.2 菌株 NL-11对矿物表面形貌的影响
经过细菌作用的矿石颗粒表面有明显的溶蚀坑,与基质接触的表面积增加,结构变得疏松;对照的矿石颗粒表面无明显的溶蚀痕迹(图3)。添加不同浓度的菌液对矿物表面的溶蚀效果差异明显,其中T3处理中菌株对矿物的溶蚀作用最强,矿物表面大颗粒棱角磨平,数量减少,小颗粒增多,大颗粒的孔隙逐渐被风化残体或细小的矿粉颗粒填满。
2.3 菌株 NL-11对基质养分的影响
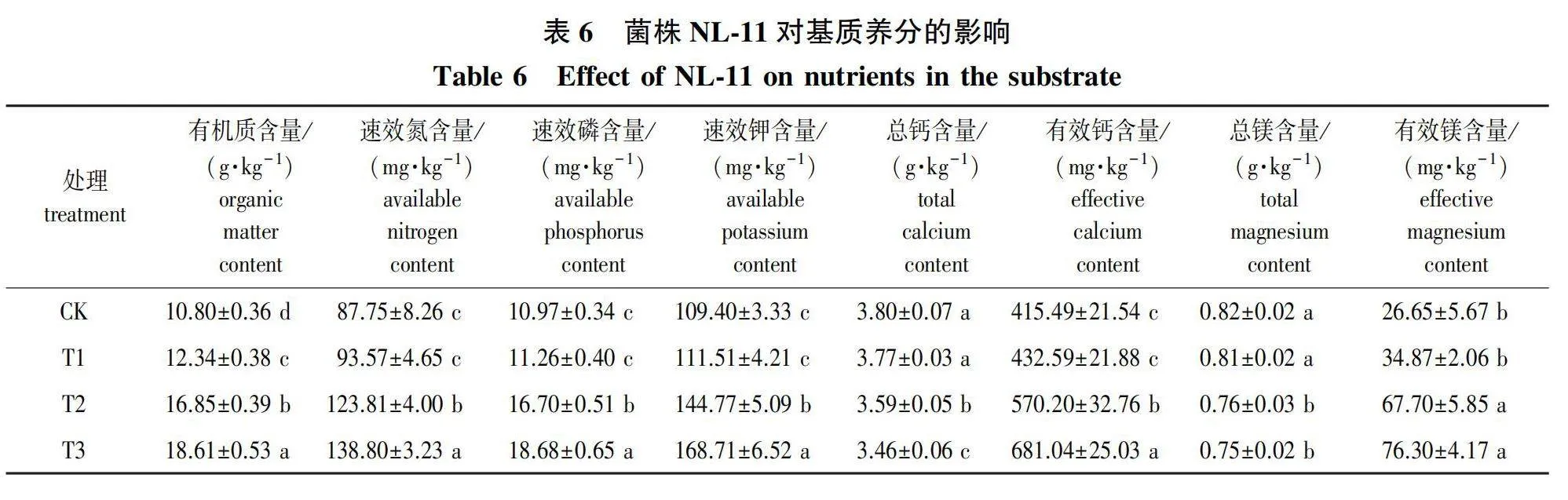
经分析(表6)可知,在基质中加入菌液,基质的有机质、速效氮、速效磷和速效钾含量、有效钙、镁离子含量与对照相比均有增加,其中, T2、T3处理变化显著(Plt;0.05),各处理的应用效果表现为CKlt;T1lt;T2lt;T3;基质的总钙、镁含量与对照相比均有减少,其中,T2、T3处理变化显著(Plt;0.05),各处理应用效果表现为T3lt;T2lt;T1lt;CK。综上,在基质中添加菌液有助于基质养分的溶解释放,提高土壤肥力,T3处理的综合效果最佳。
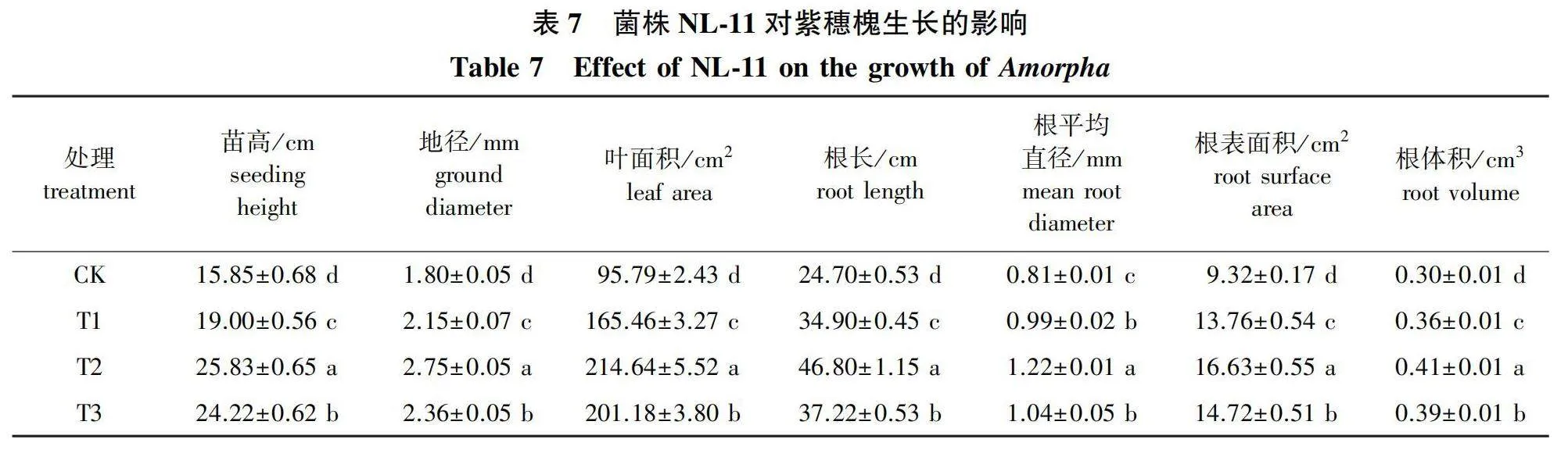
2.4 菌株 NL-11对紫穗槐生长的影响
经分析(表7)可知,在基质中加入菌液,紫穗槐的苗高、地径、叶面积均显著高于对照(Plt;0.05)。各处理对紫穗槐植生长的促进效果表现为T2gt;T3gt;T1gt;CK,且不同处理间各指标差异显著。T2处理促进紫穗槐生长效果最佳,其苗高、地径、叶面积与对照相比,分别提高了62.97%、52.78%、124.07%。在基质中加入菌液,紫穗槐的根长、根平均直径、根表面积、根体积均显著高于对照(Plt;0.05)。各处理对紫穗槐根系生长的促进效果表现为T2gt;T3gt;T1gt;CK。其中T2处理对紫穗槐根系生长的促进效果最佳。
3 讨 论
近年来,中国大力开展生态文明建设,为落实碳达峰、碳中和以及“1+N”的政策体系[28-30],不断提高重要生态系统的科学治理水平。为了科学修复岩质边坡,解决边坡绿化效果难以长期维持的问题,研究团队从南京幕府山岩质边坡风化表层土壤中分离出多种微生物用以改良传统喷播绿化技术,以期形成具有中国特色的溶蚀菌种绿化法。在之前的研究中,利用控制试验评估了不同菌株的增溶效果[31-33],并鉴定出16株表现较好的菌株,对其中4株申请了专利保护[15,34-36]。此次研究挑选了表现突出且具有专利保护的苏云金芽孢杆菌NL-11进行发酵条件优化试验,为溶蚀菌种绿化法在矿山修复中的应用和推广提供数据支撑和技术支持。单因素法、正交试验法和响应面优化法是微生物发酵条件优化中被广泛应用的方法[37]。但传统的单因素法试验次数多,试验周期长,且无法分析因素间的交互作用。正交试验法相较于单因素法有很多优越性,但当考虑因子的交互作用时,试验工作量会大大增加;且正交试验是对各个孤立的试验点进行分析,试验结果准确性较低。响应面法(RSM)考虑了试验的随机误差以及因素间的交互作用,同时,其预测模型是连续的,可对试验各个水平进行连续的分析以得到整个区域的最优值[38-39]。
响应面法是近年来应用最多的一种优化技术,综合了试验设计和数学建模,能够快速有效地确定多因子系统的最佳条件[37,38,40-43]。因此,此次试验采用响应面法对菌株NL-11的发酵条件进行优化。装液量是影响微生物生长和代谢的重要因素,装液量较小,氧气有余而营养不足;装液量较大,则溶氧不足,菌株的生长以及产物的生成受到影响[44-45]。试验结果表明,菌株NL-11为好氧细菌,在装液量为10~30 mL时,生长状况较好。发酵液的pH能够通过影响酶活性进而影响菌种的代谢、生长和繁殖,菌株NL-11表现出了较强的耐酸耐碱性,在偏酸至偏碱环境中都可存活,但在偏酸环境中长势较好。发酵培养的温度是影响菌种生长状况的最重要的因素之一,对菌株体内的生物化学反应的影响极为明显,温度较低时,细胞的正常生长受到抑制,随着发酵温度升高,菌种生化反应速率增大,代谢速度加快,但温度过高时,酶易因过热而变质,菌种生长代谢受阻,甚至死亡[46-48],与相关研究相似[49],此次研究中,菌株NL-11表现出一定的耐热性。
菌株NL-11通过风化作用溶解释放基质及矿物中的矿质养分。菌株对矿物的溶蚀和基质养分的释放作用随着添加菌液浓度的升高而逐渐增强,T3处理(高浓度,菌液浓度为1×109 cfu/mL)的影响最显著。基质中速效氮含量随着添加菌液浓度升高而显著增加,T3处理下比对照分别增长了58.17%,这可能是由于菌种对基质中氮素的活化作用,将氮元素转化为可以植物吸收的形式,或菌种直接从环境中吸收氮元素以合成体内的生命物质、转移给基质及植物体[50];菌株能够显著促进紫穗槐的生长,T2处理(中浓度,菌液浓度为1×105 cfu/mL)的促生效果最佳。菌株能够促进紫穗槐及其根系的生长可能是由于菌株产生了某些植物激素[51-53]、维生素[54-56],或菌株促进了植物对营养物质的吸收(溶蚀分解、固氮等作用)[53,57-58],亦或是菌株提高了植物的抗性(抗病性、抗逆性)等[59-67],这有待进一步研究。
本研究明确了实际应用中苏云金芽孢杆菌NL-11菌液添加的大致范围,为进一步研究其喷播应用中最适添加浓度提供了数据支持。微生物是土壤养分转化、传输过程中的重要一环,目前,菌株 NL-11作为有效溶蚀菌种在喷播应用推广中还存在如下问题:①菌株的稳定性、保存及运输方式仍有待改进;②菌株对植物的促生机制尚未明确;③菌株在喷播应用中添加的合适浓度暂未确定等。因此,今后的研究中需深入探究菌株对基质养分、结构和植物形态、生理的影响及其机制,力求探索出植物-土壤-微生物间养分的动态平衡以及互作机理,加强技术攻关,改进工艺流程、优化菌种保存及运输方式,在综合考虑应用效果和生产成本的基础上确定合适的添加浓度,进一步改进土壤菌喷播绿化技术,推动溶蚀菌种喷播绿化技术在中国的应用和推广。
参考文献(reference):
[1]关军洪,郝培尧,董丽,等.矿山废弃地生态修复研究进展[J].生态科学,2017,36(2):193-200.GUAN J H,HAO P Y,DONG L,et al.Review on ecological restoration of mine wasteland[J].Ecol Sci,2017,36(2):193-200.DOI:10.14108/j.cnki.1008-8873.2017.02.028.
[2]许晓明,胡国峰,邵雁,等.我国矿山生态修复发展状况及趋势分析[J].矿产勘查,2022,13(S1):309-314.XU X M,HU G F,SHAO Y,et al.Analysis on the development status and trend of mine ecological restoration in China[J].Miner Explor,2022,13(S1):309-314.DOI:10.20008/j.kckc.202203018.
[3]李海东,沈渭寿,贾明,等.大型露天矿山生态破坏与环境污染损失的评估[J].南京林业大学学报(自然科学版),2015,39(6):112-118.LI H D,SHEN W S,JIA M,et al.Economic losses assessment for ecological destruction and environmental pollution in large-scale opencast mine[J].J Nanjing For Univ (Nat Sci Ed),2015,39(6):112-118.
[4]周跃,WATTS D.坡面生态工程及其发展现状[J].生态学杂志,1999,18(5):68-73,79.ZHOU Y,WATTS D.Lope eco-engineering andits current developing state[J].Chin J Ecol,1999,18(5):68-73,79.
[5]谢建华.废弃采石场石质边坡植被重建与关键技术试验研究[J].亚热带水土保持,2018,30(3):11-13,70.XIE J H.Experimental study on vegetation reconstruction and key technologies of stone slopes in abandoned Quarries[J].Subtrop Soil Water Conserv,2018,30(3):11-13,70.
[6]孙其河.高陡石质边坡植被修复技术应用与效益评价[D].兰州:兰州大学,2020.SUN Q H.Application and benefit evaluation of vegetation restoration technology for high and steep rock slope[D].Lanzhou:Lanzhou University,2020.
[7]CHEN Z,CHEN W L,LI C J,et al.Effects of polyacrylamide on soil erosion and nutrient losses from substrate material in steep rocky slope stabilization projects[J].Sci Total Environ,2016,554/555:26-33.DOI:10.1016/j.scitotenv.2016.02.173.
[8]ZHANG W J,LI R R,AI X Y,et al.Enzyme activity and microbial biomass availability in artificial soils on rock-cut slopes restored with outside soil spray seeding (OSSS):influence of topography and season[J].J Environ Manag,2018,211:287-295.DOI:10.1016/j.jenvman.2018.01.005.
[9]王世杰,季宏兵,欧阳自远,等.碳酸盐岩风化成土作用的初步研究[J].中国科学(D辑:地球科学),1999,29(5):441-449.WANG S J,JI H B,OUYANG Z Y,et al.Preliminary study on weathering and soil formation of carbonate rocks[J].Sci Sin (Terrae),1999,29(5):441-449.DOI:10.3321/j.issn:1006-9267.1999.05.008.
[10]李国保,王秀英.客土喷播技术在水库坝肩石质边坡处理中的应用[J].低碳世界,2019,9(7):69-70.LI G B,WANG X Y.Application of guest soil spray seeding technology in the treatment of rock slope of reservoir abutment[J].Low Carbon World,2019,9(7):69-70.DOI:10.16844/j.cnki.cn10-1007/tk.2019.07.041.
[11]王广林,黄玲玲,张明,等.基于菌土技术的温湿地区困难立地快速绿化法[J].安徽林业科技,2016,42(3):7-9.WANG G L,HUANG L L,ZHANG M,et al.A rapid greening method based on microorganism soil techniques for difficult sites in warm and humid Areas[J].Anhui For Sci Technol,2016,42(3):7-9.
[12]郎煜华.土壤菌绿化法与普通喷播绿化的对比试验研究[C]//第二届全国水土保持生态修复学术研讨会论文集.贵阳,2010:211-237.LANG Y H. Comparative experimental study of soil fungus greening method and ordinary spraying greening[C]//Proceedings of the Second National Symposium on Soil and Water Conservation and Ecological Restoration. Guiyang,2010:211-237.
[13]姚正学,杨军.岩石坡面土壤菌永久绿化法原理[J].甘肃科学学报,2005,17(4):37-39.YAO Z X,YANG J.The principle of perpetual greening by the action of soil fungi on rock slopes[J].J Gansu Sci,2005,17(4):37-39.DOI:10.16468/j.cnki.issn1004-0366.2005.04.011.
[14]郎煜华,邱茂国.喷播绿化工程的失败经验与对策[J].建筑,2011(17):73-74.LANG Y H,QIU M G.Failure experience and countermeasures of spray seeding greening project[J].Constr Archit,2011(17):73-74.
[15]张金池,王广林,张波,等.一种石灰岩高效侵蚀细菌苏云金芽孢杆菌NL-11及其应用:CN103087954A[P].2013-05-08.ZHANG J C,WANG G L,ZHANG B,et al.Bacillus thuringiensis NL-11 bacterium capable of efficiently eroding limestone and application thereof:CN103087954A[P].2013-05-08.
[16]关雄.苏云金芽孢杆菌研究回顾与展望[J].中国农业科技导报,2006,8(6):5-11.GUAN X.Progress in the studies and application of Bacillus thuringiensis[J].Rev China Agric Sci Technol,2006,8(6):5-11.
[17]AKHTAR M,MIZUTA K,SHIMOKAWA T,et al.Enhanced insecticidal activity of Bacillus thuringiensis using a late embryogenesis abundant peptide co-expression system[J].J Microbiol Methods,2021,188:106207.DOI:10.1016/j.mimet.2021.106207.
[18]ISAYAMA S,SUZUKI T,NAKAI M,et al.Influence of tannic acid on the insecticidal activity of a Bacillus thuringiensis serovar aizawai formulation against Spodoptera litura Fabricius (Lepidoptera:Noctuidae)[J].Biol Control,2021,157:104558.DOI:10.1016/j.biocontrol.2021.104558.
[19]杨静,高泽鑫,朱莉,等.产胞外多糖的苏云金芽孢杆菌的筛选及发酵工艺优化[J].食品与发酵工业,2021,47(24):124-131.YANG J,GAO Z X,ZHU L,et al.Screening of an extracellular polysaccharides producing Bacillus thuringiensis strain and its fermentation optimization[J].Food Ferment Ind,2021,47(24):124-131.DOI:10.13995/j.cnki.11-1802/ts.027440.
[20]宋健,张海剑,丰硕,等.对韭菜迟眼蕈蚊高活性的苏云金芽胞杆菌JQD117发酵培养基及摇瓶发酵条件优化[J].中国生物防治学报,2022,38(2):333-341.SONG J,ZHANG H J,FENG S,et al.Optimization of fermentation culture medium and flask fermentation conditions for Bacillus thuringiensis strain JQD117 with high toxicity against Bradysia odoriphaga[J].Chin J Biol Control,2022,38(2):333-341.DOI:10.16409/j.cnki.2095-039x.2021.07.013.
[21]闫洪雪,刘露,李丽,等.一株苏云金杆菌Bt02发酵条件的优化研究[J].现代农业科技,2015(23):127-128,130.YAN H X,LIU L,LI L,et al.Study on optimization of fermentation conditions of a strain of Bacillus thuringiensis Bt02[J].Mod Agric Sci Technol,2015(23):127-128,130.
[22]张路路,朱朝华,郭刚.苏云金芽孢杆菌A322菌株发酵培养基和发酵条件的优化[J].热带生物学报,2014,5(3):253-259.ZHANG L L,ZHU C H,GUO G.Optimization of Bacillus thuringiensis A322 strain fermentation medium and cultural conditions[J].J Trop Biol,2014,5(3):253-259.DOI:10.15886/j.cnki.rdswxb.2014.03.009.
[23]申烨华,孙君,周茂林,等.苏云金芽孢杆菌HD-1发酵工艺研究[J].西北大学学报(自然科学版),2001,31(5):396-398.SHEN Y H,SUN J,ZHOU M L,et al.A study on fermentation process of Bt-HD-1 in annulus-ailift reactor[J].J Northwest Univ (Nat Sci Ed),2001,31(5):396-398.
[24]梁艳琼,黄兴,吴伟怀,等.解淀粉芽孢杆菌TWC2发酵条件的优化[J].中国糖料,2017,39(6):17-22.LIANG Y Q,HUANG X,WU W H,et al.Optimizing fermentation condition for Bacillus amyloliquefaciens TWC2[J].Sugar Crops China,2017,39(6):17-22.DOI:10.13570/j.cnki.scc.2017.06.005.
[25]鲍士旦.土壤农化分析[M].3版.北京:中国农业出版社,2000.BAO S D.Soil and agricultural chemistry analysis[M].3rd ed.Beijing:China Agriculture Press,2000.
[26]马欣娟,吕慧威,孙玉梅.接种量对草莓酒发酵特性的影响[J].中国酿造,2019,38(5):123-126.MA X J,LV H W,SUN Y M.Effect of inoculum on fermentation characteristics of strawberry wine[J].China Brew,2019,38(5):123-126.DOI:10.11882/j.issn.0254-5071.2019.05.024.
[27]闫建芳,赵柏霞,刘秋,等.链霉菌组合ST-2发酵条件优化及对黄瓜枯萎病的防治效果[J].中国生物防治学报,2016,32(4):531-538.YAN J F,ZHAO B X,LIU Q,et al.Optimization of Streptomyces combination ST-2 fermentation conditions and control effect on cucumber Fusarium wilt[J].Chin J Biol Control,2016,32(4):531-538.DOI:10.16409/j.cnki.2095-039x.2016.04.016.
[28]MALLAPATY S.How China could be carbon neutral by mid-century[J].Nature,2020,586(7830):482-483.DOI:10.1038/d41586-020-02927-9.
[29]WU P,GUO F,CAI B,et al.Co-benefits of peaking carbon dioxide emissions on air quality and health,a case of Guangzhou,China[J].J Environ Manage,2021,282:111796.DOI:10.1016/j.jenvman.2020.111796.
[30]ZHANG S F,XIANG X W,MA Z L,et al.Carbon neutral roadmap of commercial building operations by mid-century:lessons from China[J].Buildings,2021,11(11):510.DOI:10.3390/buildings11110510.
[31]WU Y W,ZHANG J C,GUO X P.An indigenous soil bacterium facilitates the mitigation of rocky desertification in carbonate mining Areas[J].Land Degrad Develop,2017,28(7):2222-2233.DOI:10.1002/ldr.2749.
[32]WU Y W,ZHANG J C,GUO X P,et al.Isolation and characterisation of a rock solubilising fungus for application in mine-spoil reclamation[J].Eur J Soil Biol,2017,81:76-82.DOI:10.1016/j.ejsobi.2017.06.011.
[33]WU Y W,ZHANG J C,WANG L J,et al.A rock-weathering bacterium isolated from rock surface and its role in ecological restoration on exposed carbonate rocks[J].Ecol Eng,2017,101:162-169.DOI:10.1016/j.ecoleng.2017.01.023.
[34]张金池,王广林,庄家尧,等.一种石灰岩高效侵蚀细菌巨大芽孢杆菌NL-7及其应用:CN103087953A[P].2013-05-08.ZHANG J C,WANG G L,ZHUANG J Y,et al.Efficient limestone eroded Bacillus megaterium NL-7 and application thereof:CN103087953A[P].2013-05-08.
[35]张金池,王广林,王丽,等.一种石灰岩高效侵蚀放线菌嗜热一氧化碳链霉菌NL-1及其应用:CN103103151A[P].2013-05-15.ZHANG J C,WANG G L,WANG L,et al.Streptomyces thermocarboxydus NL-1 as actinomycete capable of efficiently eroding limestone and application of Streptomyces thermocarboxydus NL-1:CN103103151A[P].2013-05-15.
[36]王广林,张金池,林杰,等.一种石灰岩高效侵蚀真菌卵形孢球托霉NL-15及其应用:CN103087926A[P].2013-05-08.WANG G L,ZHANG J C,LIN J,et al.Gongronellabutleri NL-15 fungus capable of efficiently eroding limestone and application thereof:CN103087926A[P].2013-05-08.
[37]李莉,张赛,何强,等.响应面法在试验设计与优化中的应用[J].实验室研究与探索,2015,34(8):41-45.LI L,ZHANG S,HE Q,et al.Application of response surface methodology in experiment design and optimization[J].Res Explor Lab,2015,34(8):41-45.
[38]杨津,杨霰霜,段中余,等.化学试验设计及优化方法的发展与应用[J].广东化工,2010,37(10):67-68.YANG J,YANG X S,DUAN Z Y,et al.Development and application of studies on method of experiment design and optimization[J].Guangdong Chem Ind,2010,37(10):67-68.DOI:10.3969/j.issn.1007-1865.2010.10.035.
[39]范玲,王鑫,胡风华,等.正交试验与响应面法优选六月雪-葎草药对提取工艺比较[J].中国药业,2021,30(10):40-44.FAN L,WANG X,HU F H,et al.Comparison of orthogonal test and response surface methodology in optimizing the extraction process of Serissa japonica-Humulus scandens[J].China Pharm,2021,30(10):40-44.DOI:10.3969/j.issn.1006-4931.2021.10.010.
[40]王瑞君,袁欣.响应面法优化产木聚糖酶耐热菌株的发酵条件[J].宜春学院学报,2022,44(3):83-89.WANG R J,YUAN X.Response surface optimization of fermentation conditions for xylanase production by a thermotolerant strain[J].J Yichun Univ,2022,44(3):83-89.
[41]袁辉林,康丽华,马海滨.响应曲面法及其在微生物发酵工艺优化中的应用[J].安徽农业科学,2011,39(16):9498-9500,9502.YUAN H L,KANG L H,MA H B.Response surface method and its application in the microbial fermentation process optimization[J].J Anhui Agric Sci,2011,39(16):9498-9500,9502.DOI:10.13989/j.cnki.0517-6611.2011.16.046.
[42]田泱源,李瑞芳.响应面法在生物过程优化中的应用[J].食品工程,2010(2):8-11,53.TIAN Y Y,LI R F.Application of response surface method on biological process optimization[J].Food Eng,2010(2):8-11,53.
[43]石子林, 李军乔, 王雅琼, 等. 密花香薷总皂苷提取工艺优化及其生物活性[J]. 江苏农业学报, 2021,37 (1): 185-191. SHI Z L, LI J Q, WANG Y Q, et al. Optimization on the extraction process of total saponins from the Elsholtzia densa Benth. and its biological activity[J]. Jiangsu J of Agr Sci, 2021,37(1): 185-191. DOI:10.3969/j.issn.1000-4440.2021.01.024.
[44]白云洲,赵前程,吕东,等.纳豆芽孢杆菌发酵海参条件的响应面优化[J].农产品加工,2022(5):7-11,15.BAI Y Z,ZHAO Q C,LV D,et al.Optimization of fermentation process of sea cucumber with Bacillus natto by response surface methodology[J].Farm Prod Process,2022(5):7-11,15.DOI:10.16693/j.cnki.1671-9646(X).2022.05.034.
[45]徐宇飞,张晓敏,朱佳美,等.具有杀线虫活性的郭霍氏芽孢杆菌发酵条件优化及稳定性评价[J].微生物学通报,2022,49(7):2612-2624.XU Y F,ZHANG X M,ZHU J M,et al.Optimization of fermentation conditions and evaluation of stability of Bacillus kochii[J].Microbiol China,2022,49(7):2612-2624.DOI:10.13344/j.microbiol.china.211099.
[46]孙承文,赖迎迢,巩华,等.基于响应面法的维氏气单胞菌灭活疫苗菌液发酵工艺优化及免疫效力比较[J].大连海洋大学学报,2021,36(4):546-553.SUN C W,LAI Y S,GONG H,et al.Optimization of fermentation process by response surface methodology and comparison of immune efficacy of inactivated vaccine of Aeromonas veronii[J].J Dalian Ocean Univ,2021,36(4):546-553.DOI:10.16535/j.cnki.dlhyxb.2020-238.
[47]樊丹,邓福容,李绍戊,等.一株虹鳟源枯草芽孢杆菌产胞外蛋白发酵条件优化[J].江西农业大学学报,2022,44(2):452-460.FAN D,DENG F R,LI S W,et al.Fermentation condition optimization for extracellular protein of Bacillus subtilis from rainbow trout(Oncorhynchus mykiss)[J].Acta Agric Univ Jiangxiensis,2022,44(2):452-460.DOI:10.13836/j.jjau.2022047.
[48]白长胜.禽用乳酸菌SR1发酵条件优化[J].发酵科技通讯,2022,51(1):15-18.BAI C S.Optimization of fermentation conditions of lactic acid bacterium SR1 as poultry[J].Bull Ferment Sci Technol,2022,51(1):15-18.DOI:10.16774/j.cnki.issn.1674-2214.2022.01.005.
[49]白雪,李运杰,孟冬冬,等.解纤维素热酸菌来源的耐热磷酸酶的酶学性质与应用[J].生物加工过程,2021,19(2):123-129. BAI X,LI Y J,MENG D D,et al.Characterization and application of thermostable sugar phosphatase from Acidothermus cellulolyticus[J].Chi J Bio Eng,2021,19(2):123-129.DOI:10.3969/j.issn.1672-3678.2021.02.002.
[50]王金萍.肥料配施对微生物及土壤养分的影响研究[D].长春:吉林农业大学,2014.WANG J P.The effect research of fertilizer combined application for microorganisms and soil nutrient[D].Changchun:Jilin Agricultural University,2014.
[51]RANI R,KUMAR V,GUPTA P,et al.Potential use of Solanum lycopersicum and plant growth promoting rhizobacterial (PGPR) strains for the phytoremediation of endosulfan stressed soil[J].Chemosphere,2021,279:130589.DOI:10.1016/j.chemosphere.2021.130589.
[52]HUSSAIN A,ARSHAD M,HUSSAIN A,et al.Response of maize (Zea mays) to Azotobacter inoculation under fertilized and unfertilized conditions[J].Biol Fert Soils,1987,4(1):73-77.DOI:10.1007/BF00280354.
[53]FERREIRA N S,MATOS G F,MENESES C H S G,et al.Interaction of phytohormone-producing rhizobia with sugarcane mini-setts and their effect on plant development[J].Plant Soil,2020,451(1):221-238.DOI:10.1007/s11104-019-04388-0.
[54]DA SILVA R R,SANTOS A C M D,DA SILVA C J S,et al.Biostimulants based on humic acids,amino acids and vitamins increase growth and quality of lettuce seedlings[J].J Agric Sci,2019,11(6):235.DOI:10.5539/jas.v11n6p235.
[55]PALACIOS O A,BASHAN Y,DE-BASHAN L E.Proven and potential involvement of vitamins in interactions of plants with plant growth-promoting bacteria—an overview[J].Biol Fertil Soils,2014,50(3):415-432.DOI:10.1007/s00374-013-0894-3.
[56]MAREK-KOZACZUK M,SKORUPSKA A.Production of B-group vitamins by plant growth-promoting Pseudomonas fluorescens strain 267 and the importance of vitamins in the colonization and nodulation of red clover[J].Biol Fertil Soils,2001,33(2):146-151.DOI:10.1007/s003740000304.
[57]MD RASHEDUL ISLAM,SULTANA T,JOE M M,et al.Nitrogen-fixing bacteria with multiple plant growth-promoting activities enhance growth of tomato and red pepper[J].J Basic Microbiol., 2013,53(12):1004-1015. DOI:10.1002/jobm.201200141.
[58]SALIH S A, MASRI E A N, BARAKA A M. Effect of rhizobium inoculation, phosphorus and potassium fertilization on growth, nodulation and yield of faba bean cultivated in the newly reclaimed soils of Middle Egypt[J]. Bulletin of Faculty of Agriculture Cairo Univ, 1998, 36(10):2547-2555. DOI:10.1023/A:1017954720772.
[59]王琦.一株耐盐促生菌对植物的促生机制探讨[J].长治学院学报,2021,38(2):47-51.WANG Q.Study on the growth-promoting mechanism of salt-tolerant growth-promoting bacteria on plants[J].J Chang Univ,2021,38(2):47-51.
[60]王鹰翔.不同土壤菌配置对紫穗槐幼苗生理生态学特性的影响[D].南京:南京林业大学,2017.WANG Y X.Effects of soil bacteria inoculation in spray seeding matrix on physiological and ecological character of Amorpha fruticose[D].Nanjing:Nanjing Forestry University,2017.
[61]王鹰翔,张金池,吴雁雯,等.喷播基质中土壤菌施用对紫穗槐幼苗光合特性和叶绿素荧光参数的影响[J].环境科学研究,2017,30(6):902-910.WANG Y X,ZHANG J C,WU Y W, et al.Effects of soil bacteria inoculation in spray seeding matrix on photosynthesis characteristics and chlorophyll fluorescence parameters of Amorpha fruticose[J].Res Environ Sci,2017,30(6):902-910.DOI:10.13198/j.issn.1001-6929.2017.01.82.
[62]刘晶晶,孙合美,岳胜天,等.不同溶磷菌菌液对盛花期大豆生长的影响[J].大豆科学,2016,35(2):275-279.LIU J J,SUN H M,YUE S T,et al.Effect of different phosphate-solubilizing bacteria liquid on the growth of soybean in florescence stage[J].Soybean Sci,2016,35(2):275-279.DOI:10.11861/j.issn.1000-9841.2016.02.0275.
[63]蒋晓玲.解淀粉芽孢杆菌Y19微生物菌肥的研制及其生物效益研究[D].昆明:云南农业大学,2015.JIANG X L.Development of microbial fertilizer and biological effect of Bacillus amyloliquefaciens Y19[D].Kunming:Yunan Agricultural University,2015.
[64]占新华,蒋延惠,徐阳春,等.微生物制剂促进植物生长机理的研究进展[J].植物营养与肥料学报,1999,5(2):97-105. ZHAN X H,JIANG Y H,XU Y C,et al.Advances in researches on mechanism of microbial inoculants on promoting plant growth[J].Plant Natrition Fertil Sci,1999,5(2):97-105. DOI:10.11674/zwyf.1999.0201.
[65]ZHANG Q,GAO X,REN Y,et al.Improvement of Verticillium wilt resistance by applying arbuscular mycorrhizal fungi to a cotton variety with high symbiotic efficiency under field conditions[J].Int J Mol Sci,2018,19(1):E241.DOI:10.3390/ijms19010241.
[66]AIT RAHOU Y,AIT-EL-MOKHTAR M,ANLI M,et al.Use of mycorrhizal fungi and compost for improving the growth and yield of tomato and its resistance to Verticillium dahliae[J].Arch Phytopathol Plant Prot,2021,54(13/14):665-690.DOI:10.1080/03235408.2020.1854938.
[67]BENJAMIN L.Arbuscular mycorrhizal fungi pre-colonisation for improving the growth and health of strawberry (Fragaria × ananassa)[D].York, UK:University of York,2017.
(责任编辑 王国栋)

