质谱分析小鼠神经母细胞瘤细胞外泌体的蛋白组成
胡家 殷爱红

摘要:目的 了解外泌体的蛋白组成,认识外泌体蛋白的功能。方法 通过超速离心获得小鼠神经母细胞瘤细胞的外泌体,用液质联用仪分析外泌体的蛋白成分。通过在线数据库分析、预测外泌体蛋白功能。结果 液质联用共鉴定到951个蛋白,GO功能聚类分析所鉴定到的蛋白与28条生物过程相关,与19条细胞组成相关,与19项分子功能相关;KEGG通路分析共有89条通路。结论 通过超速离心的方法可以获得外泌体,对外泌体进行蛋白质组学分析有助深入了解外泌体功能,并为外泌体的临床应用研究提供参考。
关键词:外泌体;超速离心;液质联用
中图分类号:R739.4 文献标识码:A DOI:10.3969/j.issn.1006-1959.2024.11.014
文章编号:1006-1959(2024)11-0079-05
Mass Spectrometry Analysis of Protein Composition of Exosomes from Mouse Neuroblastoma Cells
Abstract:Objective To understand the proteins composition of exosomes and the functions of the proteome.Methods The exosomes of mouse neuroblastoma cells were obtained by ultracentrifugation, and the protein components of exosomes were analyzed by liquid chromatography-mass spectrometry. Through online database analysis, the function of exosome protein was predicted.Results A total of 951 proteins were identified by liquid chromatography-mass spectrometry. The proteins identified by GO functional clustering analysis were related to 28 biological processes, 19 cell compositions, and 19 molecular functions. There were 89 pathways in KEGG pathway analysis.Conclusion Exosomes can be obtained by ultracentrifuge. Proteomic analysis of exosomes is helpful to understand the function of exosomes. It will provide a reference for the clinical application of exosomes.
Key words:Exosomes;Ultracentrifuge;Liquid chromatography-mass spectrometry
外泌体是一些小的膜泡,直径在40~160 nm(平均约100 nm),由细胞的内吞作用产生并释放到细胞外环境中融合成带有质膜的多囊泡体。所有细胞以及各种生物体液都可以产生外泌体,外泌体包含原始细胞的许多成分,包括DNA、RNA、脂质、代谢物,以及胞质和细胞表面蛋白[1-3]。最近的研究表明[4],外泌体是一种功能性的、靶向的、机制驱动的特定细胞成分的积累,承担了一些独特的生物学功能,尤其对于细胞间通迅起到很重要的作用;针对不同疾病,外泌体提供了一个了解细胞或组织状态是否产生变化的窗口,在生物体液中检测到的外泌体进行临床试验分析还可以提供一种诊疗数据。细胞间通过外泌体交换有效的细胞成分,这也提示了可以设计出基于外泌体的疾病治疗方案[4,5]。由此可见对于外泌体功能的深入研究具有很大意义。通过一系列过滤和超速离心等步骤可获得外泌体[6],超速离心指转速不低于30 000 rpm的离心技术,是一项生物化学和分子生物学不可缺少的技术手段[7,8]。基于质谱技术进行蛋白质组学研究一直是生命科学的研究热门,其中液质联用技术(LC-MS/MS)是目前蛋白质组学研究中应用最为广泛且极为有力的技术[9]。对于质谱鉴定到的蛋白采用在线数据库进行生物信息学分析,可帮助了解已鉴定蛋白的主要功能、参与信号传导途径及一些生理过程,从而为后续深入研究指明方向。小鼠神经母细胞瘤细胞系(Neuro 2A,N2a)被广泛用于研究神经元分化、轴突生长和信号传导通路[10]。本实验通过超速离心提取小鼠神经母细胞瘤细胞的外泌体,利用质谱分析N2a外泌体的蛋白组成,再对鉴定结果进行生物信息学分析,以期了解N2a外泌体的蛋白成分及其功能。
1材料与方法
1.1实验试剂与仪器 胎牛血清和DMEM高糖(含谷氨酰胺和丙酮酸钠)培养液为Vistech公司产品;磷酸缓冲液(PBS)是Biosharp公司产品;尿素、Tris、二硫苏糖醇(Dithiothreitol, DTT)和碘乙酰胺均为Sigma公司产品;10 kD超滤浓缩管是Millipore公司产品;胰蛋白酶为Promega公司产品;水、乙腈、甲酸和三氟乙酸(Fisher公司)。SpeedVac真空浓缩仪(Thermo公司);Easy-Nano LC液相色谱仪和Triple TOF6600质谱仪(Sciex公司);超速离心机Optima XPN-100(BECKMAN公司);NanoDrop微量分光光度计(Thermo公司)。
1.2外泌体提取 收集无外泌体血清培养的N2a细胞培养液,用10 000 g,4 ℃ 离心30 min以去除死细胞、细胞碎片等杂质,留取上清液。将所得上清液用超速离心,BECKMAN Optima XPN-100,SW32转子,120 000 g,4 ℃离心1.5 h,获取N2a细胞培养液中外泌体;收集外泌体沉淀,并用PBS洗涤,超速离心,120 000g,4 ℃ 离心1.5 h,收集沉淀,用PBS溶解沉淀后保存于-80 ℃备用。
1.3质谱样品制备 按参考文献[11]方法,取80 μl外泌体样品溶液置于10 kD超滤浓缩管内管,加入8 mol/L尿素/0.1 mol/L Tris-HCl,pH 8.5溶液,进行溶液置换并使外泌体蛋白变性;再加入DTT至终浓度10 mmol/L,37 ℃孵育2.5 h,使样品中蛋白质的二硫键处于打开状态;再使样品恢复至室温,加入碘代乙酰胺至终浓度50 mmol/L,避光放置40 min,对蛋白打开的二硫键进行烷基化保护。向超滤浓缩管中加入200 μl 8 mol/L尿素/0.1 mol/L Tris-HCl,pH 8.5溶液,10 000 g、20 ℃离心30 min,重复本步骤洗涤2~3次。在超滤浓缩管中加入200 μl 50 mmol/L NH4HCO3,10 000 g、4 ℃离心30 min,重复本步骤2~3次洗涤样品以去除尿素。换1个新的超滤管套管,在内管中加入150 μl 50 mmol/L NH4HCO3,再按照蛋白:Trypsin(M/M)50∶1的比例加入酶液,37 ℃孵育16 h进行酶切反应。10 000 g、4 ℃离心30 min。收集超滤管套管中洗脱下来的多肽溶液,再向内管加入100 μl 50 mmol/L NH4HCO3,涡旋几次,10 000 g、4 ℃离心30 min,重复该步骤3次洗脱多肽产物,收集每次洗脱的多肽样品混合在同一管内。最后,向多肽样品中加入终浓度1%的甲酸,再用真空浓缩仪旋干样品,保存备用。
1.4液质分析 将外泌体蛋白的酶切产物用液相色谱的A相溶液(2%乙腈、0.1%甲酸)重溶后,经NanoDrop定量,再15 000 g离心15 min。根据定量结果取4 μl样品上清液进行纳升级液相与Triple TOF6600质谱联用分析。色谱柱:C18除盐柱(3 μm,120 ?,350 μm×0.5 mm)、C18分析柱(3 μm,120 ?,75 μm×150 mm),系统柱压小于6000 Psi;流速:600 nl/min;液相1 h分析梯度设置为:0 min,5% B(B相溶液:0.1%甲酸、2%水、98%乙腈);0~0.1 min,5%~9% B;0.1~32 min,9%~22% B;32~48 min,22%~32% B;48~51 min,32%~40% B;51~51.1 min,40%~80% B;51.1~56 min,80% B;56~56.1 min,80%~5% B;56.1~60 min,5% B。质谱条件:ESI离子源、正离子扫描模式、喷雾电压设为2.3 kV、离子源温度设150 ℃。蛋白鉴定质谱扫描模式:一级全扫描,质荷比(m/z)范围350~1500;二级质谱挑选40个丰度高的母离子进行CID动态碎裂;扫描范围m/z 100~1500,动态排除扫描,动态排除时间设置10 s。
1.5数据处理 用Sciex公司的“Protein Pilot Software 5.0”对质谱数据进行数据库检索分析,使用UNIPROT Mus musculus数据库(更新于2016年8月),设置一级质谱质量偏差10 ppm、二级质谱质量偏差20 ppm,胰蛋白酶酶切,半胱氨酸碘乙酰胺烷基化固定修饰。获得置信度较高(假阳性率,即FDR<1%)的蛋白鉴定结果。
2结果
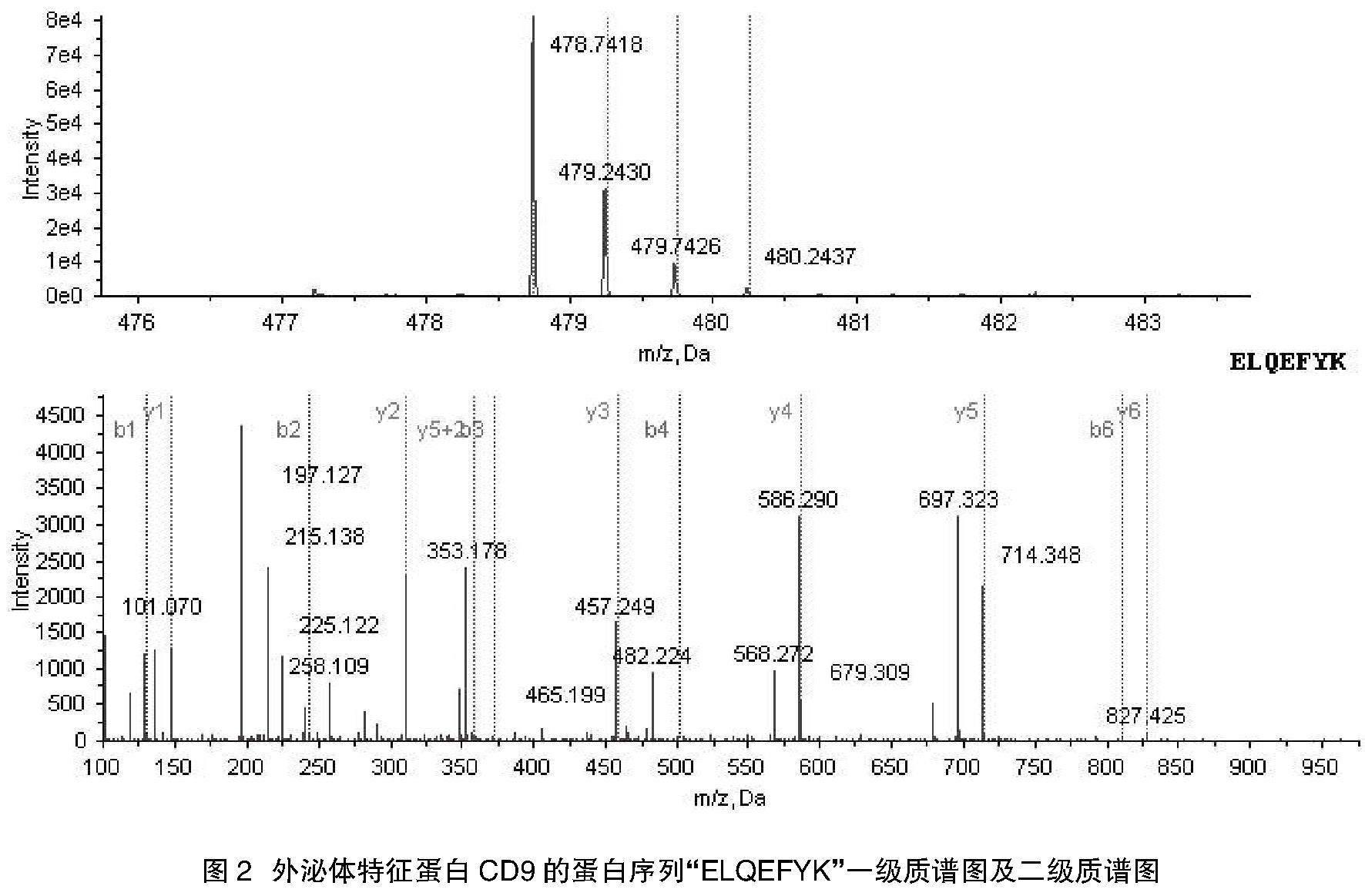
2.1液质联用鉴定外泌体蛋白成分 由图1可看出液相色谱能分离出一系列色谱峰,代表外泌体蛋白经酶切后得到了混合多肽样品,经液相色谱的梯度洗脱,按照多肽组分的极性不同进行了分离。其中横坐标表示液相洗脱时间,纵坐标表示洗脱样品的丰度。在前32 min,液相的B液浓度小于22%,色谱出峰多,表示流出的样品多,说明样品中亲水性多肽(极性大)占绝对大多数。液相依据梯度设置不断洗脱出的多肽均直接进入质谱同步检测,得到了22 070张质谱图,再通过与小鼠蛋白数据库匹配检索,共鉴定到951个蛋白。图2所示为外泌体特征性蛋白CD9的一级质谱峰,以及匹配序列“ELQEFYK”的二级质谱峰。
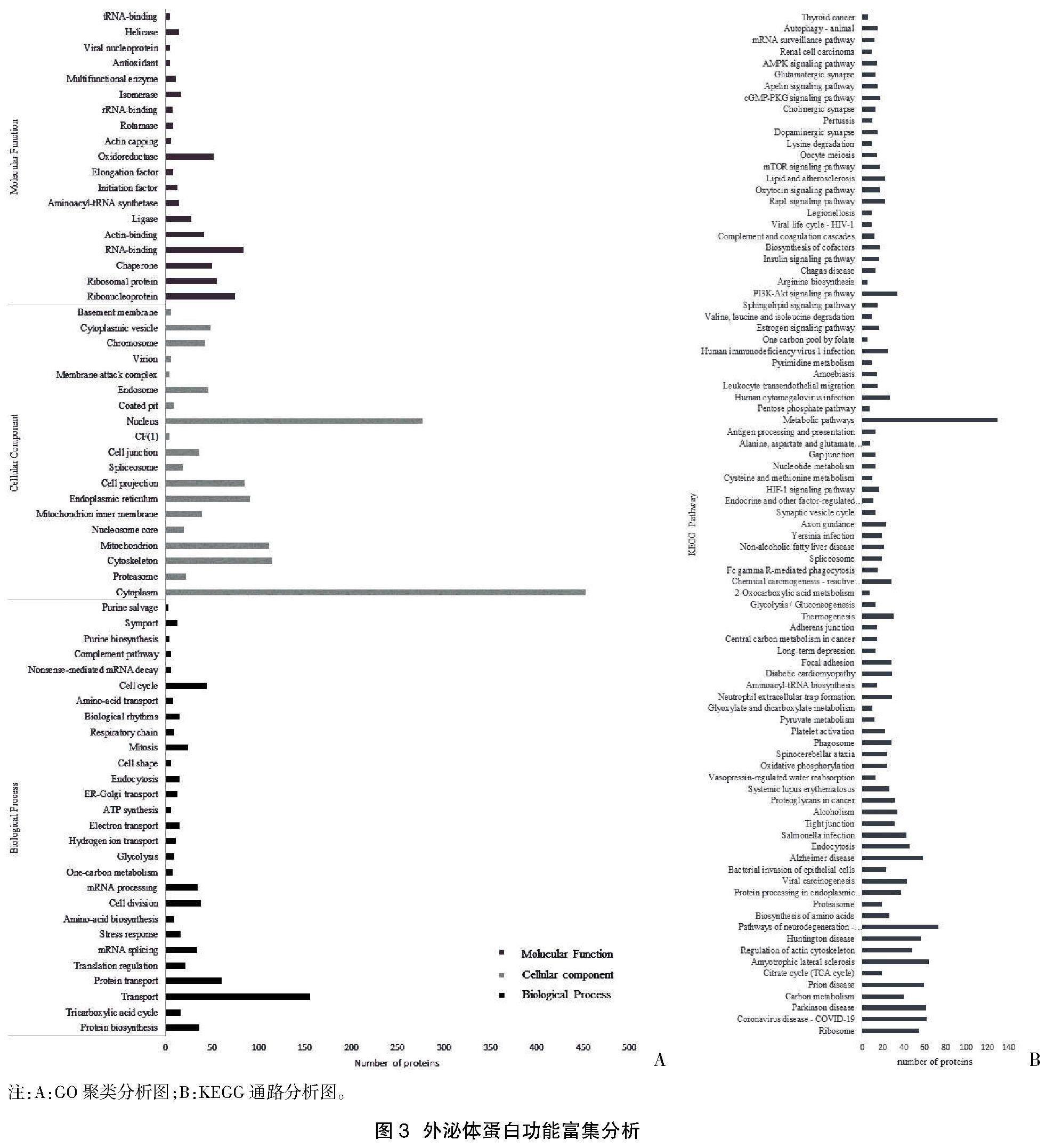
2.2外泌体蛋白成分功能分析 通过DAVID数据库(https://david.ncifcrf.gov/home.jsp)对本实验鉴定到的蛋白质进行GO功能聚类分析和KEGG通路分析(P<0.05)。GO功能聚类分析见图3A,所鉴定到的外泌体蛋白与28条生物过程(Biological Process)相关,主要是物质运输(Transport)、蛋白转运(Protein transport)、细胞周期(Cell cycle)等。有19条细胞组成(Cellular Component)相关,主要涉及细胞质(Cytoplasm)、细胞核(Nucleus)及细胞骨架(Cytoskeleton)等。有19项分子功能(Molecular Function)相关,包含RNA结合蛋白(RNA-binding)、核蛋白(Ribonucleoprotein)和核糖体蛋白(Ribosomal protein)等。KEGG分析见图3B,共有89条通路,主要涉及代谢途径(Metabolic pathways)、多种疾病相关及多种信号通路。
3讨论
本实验通过超速离心的方法获得小鼠神经母细胞瘤细胞外泌体,使用液质联用技术鉴定外泌体蛋白质组,再通过在线数据库对实验结果进行蛋白功能分析、预测。结果显示,液相色谱能有效分离外泌体蛋白经酶切后得到的混合多肽样品,液相洗脱出的多肽均直接进入质谱同步检测,所鉴定蛋白结果包含外泌体特征性蛋白CD9、CD81[5],均为跨膜蛋白。既往文献报道显示[12],小鼠癌细胞来源的外泌体富含热休克蛋白,如HSP70、HSP90,本实验与既往研究一致,说明外泌体提取方法得当,质谱鉴定结果可靠。通过本实验可加深对小鼠神经母细胞瘤细胞外泌体蛋白质组的认识,对于进一步发现其生理功能,或是利用外泌体进行蛋白功能研究,以及未来在临床上的应用等提供参考。
外泌体通过细胞膜的内陷作用导致多泡体形成,这些多泡体可以与细胞内其他囊泡以及细胞器进行物资交换,由此形成外泌体成分的多样性,可能决定其分泌到细胞外空间之后的功能。已有研究发现[13],外泌体的独特生理功能,除了跟外泌体所包含的一些功能元件有关,还和外泌体所介导的传输机制相关,包括细胞与细胞之间的通讯以及细胞与外环境的相互作用都很重要。本实验鉴定到一系列运输蛋白、膜转运蛋白、信号受体蛋白及调节因子等均可能参与外泌体介导的细胞通讯过程,由此为后续进行N2a细胞通讯引起的相关生理功能研究提供了方向。
外泌体以其独特的生理功能为临床应用研究提供了很好的材料,目前已有学者正在积极探索外泌体作为治疗药物或作为药物载体的应用。一些研究结果显示[14-16],外泌体蛋白质可以选择性地诱导受体细胞中的特定的信号通路,诸如在发育、免疫反应、并对一些疾病进行调节。对于外泌体将功能性物质运送到其他细胞并引起细胞病变特征的进一步研究,有利于将外泌体用于疾病治疗,比如设计外泌体类似结构的新药[16]。外泌体的临床应用除了具备治疗潜力外,还有帮助疾病诊断的潜力。外泌体存在于所有的生物体液中,并且所有细胞都会产生外泌体。由此可以通过无创或微创获取体液进行活检,提取外泌体以检测疾病生物标志物,也可由此跟踪疾病进展。已有报道说明外泌体能够转运疾病相关物质,在神经退行性疾病发生、发展的病理过程起到重要作用[17,18]。本实验经KEGG通路分析发现一系列与疾病相关蛋白,特别是与神经退行性疾病相关的蛋白较多,有61种蛋白与帕金森疾病(PD)相关、有58种蛋白与阿尔茨海默症(AD)相关、有56种蛋白与亨廷顿舞蹈症(HD)相关。另有6种蛋白与甲状腺癌相关,Feng K等[19]阐述了甲状腺肿瘤来源的外泌体可以作为一种潜在的无创诊断工具以便于甲状腺瘤的检测和监测。外泌体的功能及应用尚需临床验证,未来可能产生让患者受益更多的诊断及治疗方法。
综上所述,通过对N2a细胞外泌体蛋白质组的研究,鉴定了外泌体蛋白质组成分,并对外泌体蛋白进行了功能分析与预测,有效帮助了解外泌体的生物学功能,并可能为外泌体在临床应用提供理论支持。
参考文献:
[1]Kalluri R,LeBleu VS.The biology, function, and biomedical applications of exosomes[J].Science,2020,367(6478):eaau6977.
[2]Li D,Wang Y,Jin X,et al.NK cell-derived exosomes carry miR-207 and alleviate depression-like symptoms in mice[J].J Neuroinflammation,2020,17(1):126.
[3]Kimiz-Gebologlu I,Oncel SS.Exosomes: Large-scale production, isolation, drug loading efficiency, and biodistribution and uptake[J].J Control Release,2022,347:533-543.
[4]Zhang L,Yu D.Exosomes in cancer development, metastasis, and immunity[J].Biochim Biophys Acta Rev Cancer,2019,1871(2):455-468.
[5]Kowal J,Arras G,Colombo M,et al.Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes[J].Proc Natl Acad Sci U S A,2016,113(8):E968-E977.
[6]Faruqu FN,Xu L,Al-Jamal KT.Preparation of Exosomes for siRNA Delivery to Cancer Cells[J].J Vis Exp,2018(142):10.3791/58814.
[7]黄靖娴.超速离心机技术原理与操作维护注意事项[J].科技创新与应用,2018(36):130-132.
[8]黄素梅,殷明,张春芳,等.超速离心机在公共实验平台发挥的作用[J].实验室研究与探索,2008,27(3):29-30,58.
[9]Li J,Zhu HJ.Liquid Chromatography-Tandem Mass Spectrometry (LC-MS/MS)-Based Proteomics of Drug-Metabolizing Enzymes and Transporters[J].Molecules,2020,25(11):2718.
[10]Tremblay RG,Sikorska M,Sandhu JK,et al.Differentiation of mouse Neuro 2A cells into dopamine neurons[J].J Neurosci Methods,2010,186(1):60-67.
[11]Wisniewski JR,Zougman A,Nagaraj N,et al.Universal sample preparation method for proteome analysis[J].Nat Methods,2009,6(5):359-362.
[12]Zhang G,Liu Z,Ding H,et al.Tumor induces muscle wasting in mice through releasing extracellular Hsp70 and Hsp90[J].Nat Commun,2017,8(1):589.
[13]Zhang H,Wang L,Li C,et al.Exosome-Induced Regulation in Inflammatory Bowel Disease[J].Front Immunol,2019,10:1464.
[14]王艺莹,李瑞青,李婧雯,等.外泌体介导细胞通讯:帕金森病的潜在生物标志物分析[J].中国组织工程研究,2023,27(24):3883-3891
[15]Choi D,Montermini L,Kim DK,et al.The Impact of Oncogenic EGFRvIII on the Proteome of Extracellular Vesicles Released from Glioblastoma Cells[J].Mol Cell Proteomics,2018,17(10):1948-1964.
[16]Liang Y,Duan L,Lu J,et al.Engineering exosomes for targeted drug delivery[J].Theranostics,2021,11(7):3183-3195.
[17]Pinnell JR,Cui M,Tieu K.Exosomes in Parkinson disease[J].J Neurochem,2021,157(3):413-428.
[18]Zhang T,Ma S,Lv J,et al.The emerging role of exosomes in Alzheimer's disease[J].Ageing Res Rev,2021,68:101321.
[19]Feng K,Ma R,Zhang L,et al.The Role of Exosomes in Thyroid Cancer and Their Potential Clinical Application[J].Front Oncol,2020,10:596132.

