广聚萤叶甲Vg基因的鉴定及表达分析
周永平 黄玉锋 张燕 马超 陈红松 桂富荣 周忠实


摘要
卵黃原蛋白(vitellogenin,Vg)作为雌性多功能生殖蛋白,为卵黄发生提供所需的储备能源。为明确Vg基因在广聚萤叶甲Ophraella communa生殖过程中的潜在作用,本研究通过RTPCR技术克隆得到广聚萤叶甲的3个Vg基因,其OcVg1,OcVg2和OcVg3开放阅读框(ORF)分别为5 310、5 322 bp和5 298 bp,对应编码1 768、1 772和1 764个氨基酸。其OcVgs蛋白具有LLTP超家族的保守结构域:LPD_N、DUF1943和VWD结构域;多位于N端的多聚丝氨酸区(polyserine domains),保守的GL/ICG、R/KXXR/K、DGXR基序和C端半胱氨酸残基等。构建系统进化树发现,OcVgs与鞘翅目昆虫聚为一支。时空表达分析发现,OcVgs基因在不同组织及发育阶段的表达动态相似,在脂肪体中特异性高表达(P<0.05);在成虫羽化后的性成熟阶段的表达量最高,幼虫期的表达水平可以忽略不计(P<0.05)。研究结果为深入理解广聚萤叶甲生殖作用的分子机制奠定基础。
关键词
广聚萤叶甲; 卵黄原蛋白基因; 克隆; 序列分析; 表达水平
中图分类号:
S 433.5
文献标识码: A
DOI: 10.16688/j.zwbh.2023141
Identification and expression analysis of Vg genes in Ophraella communa
ZHOU Yongping1,2, HUANG Yufeng3, ZHANG Yan2, MA Chao2, CHEN Hongsong2,4,GUI Furong1*, ZHOU Zhongshi2,4*
(1. College of Plant Protection, Yunnan Agricultural University, Kunming 650201, China; 2. Institute of Plant
Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China; 3. Livestock and Veterinary
Station in Lixian County, Longnan City, Gansu Province, Longnan 742200, China; 4. Institute of Plant
Protection Research Institute, Guangxi Academy of Agricultural Sciences, Nanning 530007, China)
Abstract
Vitellogenin (Vg) as a female multifunctional reproductive protein, which plays an important role in vitellogenesis. This study aimed to clarify the potential role of the Vg gene in the reproductive process of Ophraella communa. Three Vg genes were cloned by RTPCR, and the open reading frames of OcVg1, OcVg2, and OcVg3 were 5 310, 5 322, and 5 298 bp, respectively, encoding 1 768, 1 772, and 1 764 amino acids. OcVg proteins have the conserved domain of the LLTP superfamily, including LPD_N, DUF1943, and VWD domains. Polyserine domains located at the Nterminal, with the conserved GL/ICG, R/KXXR/K, DGXR motifs, and Cterminal cysteine residues. The OcVgs clustered with those of Coleoptera insects by constructing a phylogenetic tree. Spatiotemporal expression analysis showed that the expression dynamics of OcVg genes in different tissues and developmental stages were similar, with high specificity in fat bodies (P<0.05). The expression level was the highest at the sexual maturity stage after adult emergence, and the expression level at the larval stage could be ignored (P<0.05). The results of this study lay the foundation for a deeper understanding of the molecular mechanism of the reproductive function of O. communa.
Key words
Ophraella communa; vitellogenin gene; clone; sequence analysis; expression level
卵黄发生是昆虫生殖调控的先决条件,包括产卵前后的胚胎和子代发育的维持[12]。在所有卵生动物中,雌性生殖成功的关键取决于卵黄原蛋白(vitellogenin,Vg)的生物合成及被发育的卵母细胞所摄取和吸收的情况[35]。Vg蛋白主要在脂肪体中合成,分泌到血淋巴中,通过卵泡上皮细胞的细胞间隙转运到卵母细胞膜上,然后通过卵黄原蛋白受体(vitellogenin receptor,VgR)介导的内吞作用运输到卵巢,被发育的卵母细胞选择性摄取[3,6],最终经修饰、剪切、加工和蛋白酶水解后以卵黄蛋白(vitellin,Vn)晶体的形式沉积在卵子内部,为发育的卵母细胞及受精卵提供不可或缺的营养物质,包括氨基酸、脂肪、碳水化合物、磷、硫和其他微量元素[7]。在大多数昆虫中,Vg作为卵黄蛋白Vn 的前体蛋白,占可溶性卵黄蛋白的60%~90%,其氨基酸大约占84% (主要是谷氨酸和天冬氨酸),糖类占1%~14% (主要是寡聚甘露糖)以及占比不到16%的脂类物质[3,89]。Vg作为卵黄蛋白中含量最为丰富的一类蛋白而被广泛研究。在卵黄发生和卵子形成过程中的大部分能源物质来源于Vg,也就是说,Vg蛋白在雌性生殖过程扮演着不可替代的角色。
Vg是一类同源性较高的大分子磷酸化糖脂复合蛋白,在大脂质转移蛋白(LLTP)超家族中占主导地位,其伴随着庞大的基因数目[3]。研究表明,Vg蛋白一般由6~7 kb的mRNA轉录本所编码,完整的开放阅读框(open reading frame,ORF)大约为1 800个氨基酸,等电点(PI)为6.1~6.3,分子量为200~700 kD,前体蛋白被糖基化、磷酸化、蛋白裂解、脂化和硫酸化等修饰,水解为由1~4个亚基组成的天然卵黄原蛋白,包括一个分子量140~180 kD的大亚基和一个40~60 kD的小亚基[3,1011]。目前,已有7个目50多种昆虫的Vg基因序列被克隆,主要集中在鳞翅目、双翅目、膜翅目和半翅目[1213]。通常来说,Vg蛋白一级结构包含几个保守的结构域或氨基酸基序(motif),如信号肽序列,多位于N端的多聚丝氨酸区(polyserine domains),特殊功能的GL/ICG、R/KXXR/K、DGXR基序和C端的9个半胱氨酸残基[3,1215]。此外,Vg蛋白还具有典型的结构域特征,包括保守的N端脂质结合结构域(lipid protein Nterminal domain,LPD_N)、未知功能的DUF1943(domain of unknown function,DUF1943)和血管性血友病因子D型结构域(Von Willebrand factor type D domains,VWD)[6,16]。在所有卵生动物中,Vg蛋白的定量通常被认为是评估雌性生育能力的常规手段[17]。
众所周知,豚草的入侵对我国农业生态系统、农业牧业生产和生物多样性产生巨大影响,并且导致严重的公共卫生问题,引起花粉过敏症(枯草热)以及一些呼吸系统疾病,严重威胁着人类的身心健康[1822]。随着绿色植保概念的提出,天敌昆虫的商业化生产应用受到越来越多的关注。广聚萤叶甲作为重大入侵杂草豚草Ambrosia artemisiifolia的一种重要的专食性天敌,其高繁殖能力和世代重叠多是有效控制豚草的关键要素,其幼虫和成虫取食豚草叶片或幼嫩组织[19],可将整株植物吃光吃净呈现火烧状,达到显著的控制豚草效果[2324]。Vg作为雌性多功能生殖蛋白,为发育的卵母细胞和胚胎生长提供营养物质,其含量的多少将直接影响雌性的繁殖水平[6]。因此,本研究基于转录组数据结合RTPCR技术克隆获得了广聚萤叶甲3个Vg基因,通过实时荧光定量PCR(RTqPCR)检测了OcVgs基因在不同发育阶段和组织中的mRNA表达水平,旨在为探究广聚萤叶甲Vg基因的生物学功能和作用机理奠定基础。本研究填补了广聚萤叶甲Vg基因的研究空白,同时为优化该叶甲的繁殖能力奠定了良好基础,对保护和更好地利用我国广聚萤叶甲资源具有重要意义。
1 材料与方法
1.1 供试寄主和虫源
广聚萤叶甲成虫采自广西壮族自治区来宾市金鸡镇(109°23′E,23°43′N),带回实验室置于室内饲养,条件设置:温度(26±1)℃,相对湿度(70±5)%,光周期L∥D=14 h∥10 h[28]。
1.2 总RNA提取与cDNA链合成
使用TRIzol(美国Invitrogen公司)法提取广聚萤叶甲的总RNA,用1%的琼脂糖凝胶电泳检测RNA样品的完整性,用紫外分光光度计Nanophoto meter P330s (IMPLEN, Germany)检测RNA浓度和质量,A260/A280在1.9~2.1之间,A260/A230在1.8~2.2之间时可用于下一步试验。以1 μg RNA样品为模板,采用Super Script FirstStrand Synthesis System (北京全式金公司) 合成cDNA第一链:10 μL 2×TS Reaction Mix,1 μL Olig(dT)18,1 μL TransScript RT/RI Enzyme Mix,1 μg RNA,1 μL gDNA Remover,补齐ddH2O至20 μL,混合液用移液枪轻轻吹打数次混合均匀,放入PCR仪中42℃ 30 min,85℃ 5 s。合成好的cDNA存于-20℃冰箱备用。
1.3 广聚萤叶甲Vg基因的克隆
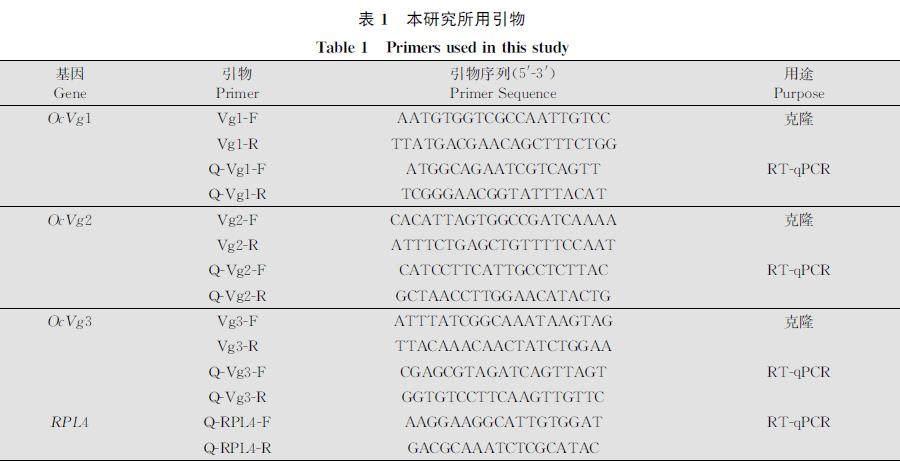
根据广聚萤叶甲转录组数据库筛选到的Vg基因unigene序列(未发表),利用Primer Premier 5.0软件设计特异性引物(表1),引物由生工生物工程(上海)股份有限公司合成。以cDNA为模板进行PCR扩增,反应体系:TransStart Taq DNA Polymerase 0.5 μL, 上、下游引物各1 μL,dNTPs 1 μL,10×PCR buffer 2.5 μL,模板cDNA 0.5 μL,ddH2O補齐至25 μL。PCR反应程序:94℃变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸 1 min,35个循环;72℃ 10 min。目的产物用1%琼脂糖凝胶电泳检测,利用AxyPrep DNA凝胶回收试剂盒(美国Axygen公司)进行产物回收纯化,并测定其浓度;将纯化产物连接到克隆载体pEASYT3克隆载体(北京全式金公司)上,连接体系为:1 μL pEASYT3 Cloning Vector和4 μL纯化产物混合,室温连接,并转化至Trans1T1感受态细胞中,待细胞复苏后,取200 μL涂在含有氨苄抗生素的培养基上,37℃过夜培养。最后,通过蓝白斑筛选和菌液PCR验证获得阳性克隆,并把菌液送至生工生物工程(上海)股份有限公司测序。
1.4 生物信息学分析
使用DNAman软件对测序结果进行校正和剪接,获得Vg基因的完整序列;利用网站(http:∥www.ncbi.nlm.nih.gov/gorf)查找开放阅读框(ORF),并用EditSeq软件将ORF核苷酸序列推导为氨基酸序列。使用SMART在线网站(http:∥smart.embl.de/)预测蛋白的结构域,利用DNAman软件进行氨基酸序列多重比较,对Vg蛋白序列进行BLAST,使用MEGA 7.0软件邻接法(neiighborjoining,NJ)构建系统发育树。使用SignalP (https:∥services.healthtech.dtu.dk/service.php?SignalP5.0)预测蛋白信号肽,在线软件(https:∥web.expasy.org/protparam/)计算蛋白的相对分子量(Mr)、等电点(PI),使用TMHMMServerv (https:∥services.healthtech.dtu.dk/service.php?TMHMM2.0)进行蛋白跨膜区分析。在线网站(https:∥web.expasy.org/protscale)分析卵黄原蛋白的疏水性,使用软件(https:∥services.healthtech.dtu.dk/service.php?NetNGlyc1.0)分析糖基化位点及NetPhos3.1分析磷酸化位点。利用SWISSMODEL(https:∥swissmodel.expasy.org/)预测蛋白的三级结构模型。最后,将广聚萤叶甲的3个Vg基因序列提交到GenBank数据库中。
1.5 OcVgs基因的时空表达分析
为明确广聚萤叶甲Vg基因在不同组织和发育阶段的表达水平,收集卵150粒、幼虫(1龄30头、2龄20头和3龄8头)、蛹(2日龄蛹和老熟蛹)和成虫(性成熟前后的雌、雄成虫)各5头。在磷酸盐缓冲液(PBS,pH 7.4)中解剖羽化后5日龄雌虫的不同组织,包括头、胸、翅、肠道、卵巢和脂肪体。每组样品共解剖3~5头雌虫,每组样品4个生物学重复,取完用液氮速冻,存于-80℃冰箱。
根据设计特异性引物(表1),以各样品的cDNA为模板进行实时荧光定量PCR(RTqPCR)。使用广聚萤叶甲体内稳定表达的RPL4基因为内参基因[25]。利用2×TransStartTipGreen qPCR SuperMix染料的荧光标记法检测基因的表达量,反应体系:2×TransStartTipGreen qPCR SuperMix 10 μL、上下游引物各0.4 μL、cDNA模板 1 μL、ddH2O 8.2 μL。反应条件:94℃预变性30 s;94℃变性5 s,60℃退火30 s,40个循环。
1.6 数据处理
采用2-ΔΔCT计算法对目的基因的相对表达量进行计算,ΔΔCT=(CT试验组目标基因-CT试验组内参基因)-(CT对照组目标基因-CT对照组内参基因)。采用SPSS 19.0软件进行单因素方差分析(Oneway ANOVA)和Duncan氏多重比较,显著性水平为0.05,结果以平均值±标准误(mean±SE)表示,并用软件GraphPad Prism 6.0作图分析。
2 结果与分析
2.1 广聚萤叶甲Vg基因的克隆与鉴定
利用设计的Vg基因特异性引物进行RTPCR扩增,得到了广聚萤叶甲3个Vg基因的CDS序列,分别命名为OcVg1、OcVg2和OcVg3,
GenBank登录号分别为OQ164771、OQ818861和OQ818862,序列长度分别为5 310、5 322 bp和5 298 bp (图1),
2.2 OcVgs序列分析
生物信息学分析表明,OcVgs与其他昆虫的Vg蛋白的理化性质相似。其OcVg1、OcVg2和OcVg3的蛋白质分子量分别为202.64、203.21 kD和202.48 kD;其氨基酸的等电点(PI)分别为5.50、6.37和5.96。利用在线SMART网站进行蛋白结构域预测,如圖2所示,广聚萤叶甲Vg蛋白属于脂质转运蛋(large lipid transfer protein,LLTP)超家族,具有LLTP家族3个高度保守的结构域,包括LPD_N、DUF1943和VWD结构域。
多重序列比对发现(图3),OcVgs含有几个保守氨基酸基序、残基和切割位点,如位于N端的多聚丝氨酸区(polyserine domains),特殊功能的GL/ICG、R/KXXR/K、DGXR基序和C端半胱氨酸残基等。如表2所示,通过SignalP 5.0 Server信号肽预测,OcVgs蛋白N端均含一段氨基酸残基为信号肽序列。OcVgs具有一定的亲水性,无明显跨膜区,不属于膜蛋白,推测该蛋白需要其受体VgR的介导作用。OcVgs氨基酸序列含有丰富的糖基化和磷酸化位点,推测该蛋白的糖基化和磷酸化的修饰在蛋白功能行使中发挥重要角色。利用SwissModel软件进行同源模型建模,预测了OcVgs蛋白的三维空间结构(图4)。
2.3 OcVgs系统进化分析
利用MEGA 7.0软件中邻接法(neighborjoining,NJ)对不同目昆虫的Vg氨基酸序列进行多重比较,并构建了系统进化发育树。结果如图5所示,OcVg1、OcVg2、OcVg3与鞘翅目昆虫亲缘关系最近,整齐地聚集在一支,与鞘翅目昆虫玉米根萤叶甲Diabrotica virgifera virgifera的相似性较高。
2.4 OcVgs基因的时空表达分析
利用RTqPCR技术对OcVgs基因在不同组织的mRNA转录水平进行了分析。结果表明,广聚萤叶甲的3个Vg基因在不同组织部位的表达模式相似。3个OcVgs基因在雌成虫体内的脂肪体中均特异性高表达,显著高于其他组织,在头、翅、肠道组织中的表达水平极其微弱。OcVg1基因在脂肪体的mRNA转录水平高于其他组织400倍左右;同样,OcVg2基因在脂肪体的mRNA转录水平高于其他组织600倍左右;而OcVg3基因在脂肪体的mRNA转录水平高于其他组织上千倍(图6)。
同样,OcVg1、OcVg2和OcVg3基因在不同发育阶段的表达动态相似(图7),其广聚萤叶甲的3个Vg基因的表达趋向于成虫羽化后开始高表达,特别是性成熟之后;在幼虫期和化蛹初期表达量极低,仅为雌成虫羽化后表达量的千分之几(P<0.05)。
3 结论与讨论
昆虫卵黄发生内在机理和调控机制是昆虫生理学和生物化学的一个重要研究领域[26]。在卵生动物中,繁殖的成功与否主要取决于卵黄原蛋白的生物合成和积累[31],其胚胎的生长发育主要依靠发育中的卵母细胞积累大量的卵黄蛋白提供必需的营养物质[3,67]。Vg的合成和摄取是昆虫生殖调控过程中的关键事件[1011]。1954年,Telfer等[28]首次在天蚕蛾Hyalophora cecropia的血淋巴中发现了一种雌性特异蛋白参与卵黄的形成,后来Bell等[29]将其命名为卵黄原蛋白。基因组测序技术和分子生物学的快速发展,极大地促进了昆虫学领域的发展研究。在卵黄发生过程中,Vg合成及被卵母细胞所摄取是保证雌性成功繁殖的先决条件[5,11]。在大多数卵生动物中,Vg蛋白作为雌性多功能生殖蛋白,最基本的功能就是为发育的卵母细胞和组织提供所需的营养物质[3031]。
迄今为止,Vg基因在许多昆虫物种中被克隆和鉴定,并且它们的数量在不同物种间有所不同,含有多个基因拷贝数。在本文中,我们克隆和鉴定得到了广聚萤叶甲的3个Vg基因,并对其进行生物信息学分析以及OcVgs基因的时空表达分析。OcVgs蛋白含有LLTP家族的典型结构域,包括LPD_N、DUF1943和VWD结构域[67,1213];含有几个保守的结构域或氨基酸基序,如多聚丝氨酸区(polyserine domains)、GL/ICG、R/KXXR/K、DGXR和C端半胱氨酸等[3,68,11],这些结果表明Vg蛋白在物种的进化上高度保守。Vg作为多效性蛋白,其保守的位点、基序和不同的剪切形式能发挥着特定的生物学功能[32]。SfVg序列包含RXXR的裂解位点,在Vg初级蛋白的成熟过程中发挥重要作用[15]。Vg蛋白C末端与脂质的摄取、运输和传递有关[33]。Vg蛋白N端具有重要的蛋白识别、修饰区域,其多聚丝氨酸区域是昆虫Vg最显著的特征之一[34]。
大量研究表明,不同物种间的Vg基因个数存在差异[3,14]。例如:西方蜜蜂Apis mellifera中有一个Vg基因[33],秀丽隐杆线虫Caenorhabditis elegans中高达6个Vg基因[35],莲草直胸跳甲Agasicles hygrophila、褐飞虱Nilaparvata lugens均有3个Vg基因[12,36]。随着长期的适应进化,选择突变和基因漂流的压力,导致Vg衍化出新的功能。因此,昆虫中Vg基因数量的变化可能反映了进化选择和适应环境的策略[6]。许多昆虫可多个Vg基因共同作用,以确保提供足够的营养物质供卵母细胞的生长和发育,强大的繁殖能力以更好地适应环境。众所周知,Vg和VgR对昆虫的成功繁殖至关重要,以Vg分子标记评估繁殖力可作为一种常规手段和方法[36]。在本文中,我们从广聚萤叶甲中成功获得了Vg基因的3个转录本,可能多个基因相互作用能促进卵黄发生,为发育的卵母细胞提供足够的营养物质。然后,这3个Vg基因在广聚萤叶甲生殖过程中是否具有相同的生理功能,还有待进一步深入研究。
本研究通过RTPCR技术克隆得到了广聚萤叶甲的3个Vg基因。一方面,填补了广聚萤叶甲Vg基因的研究空白;另一方面,为深入理解广聚萤叶甲的生殖分子机制和适合度产生的内在机制奠定基础,对保护和利用我国广聚萤叶甲资源具有重要意义。
参考文献
[1] SWEVERS L. Vitellogenesis and postvitellogenic maturation of the insect ovarian follicle [J]. Gill, 2005, 1: 87155.
[2] JING Yupu, AN Hongli, ZHANG Shanjing, et al. Protein kinase C mediates juvenile hormone dependent phosphorylation of Na+/K+ATPase to induce ovarian follicular patency for yolk protein uptake [J]. Journal of Biological Chemistry, 2018, 293(52): 2011220122.
[3] TUFAIL M, TAKEDA M. Molecular characteristics of insect vitellogenins [J]. Journal of Insect Physiology, 2008, 54: 14471458.
[4] ZHU Shiming, LIU Fangfang, ZENG Huanchao, et al. Insulin/IGF signaling and TORC1 promote vitellogenesis via inducing juvenile hormone biosynthesis in the American cockroach [J/OL]. Development, 2020, 147(20): 188805. DOI: 10.1242/dev.188805.
[5] ROY S, SAHA T T, ZOU Z, et al. Regulatory pathways controlling female insect reproduction [J]. Annual Review of Entomology, 2018, 63: 489511.
[6] WU Zhongxia, YANG Libin, HE Qiongjie, et al. Regulatory mechanisms of vitellogenesis in insects [J/OL]. Frontiers in Cell and Developmental Biology, 2021, 8: 593613. DOI: 10.3389/fcell.2020.593613.
[7] 馬杰, 张士璀. 卵黄蛋白的结构和功能[J]. 鲁东大学学报(自然科学版), 2012, 28(3): 252260.
[8] 董胜张, 叶恭银, 刘朝良. 昆虫卵黄蛋白分子进化的研究进展[J]. 昆虫学报, 2008, 51(11): 11961209.
[9] VEERANA M, KUBERA A, NGERNSIRI L. Analysis of the vitellogenin gene of rice moth, Corcyra cephalonica Stainton [J]. Archives of Insect Biochemistry and Physiology, 2014, 87(3): 126147.
[10]戈林泉, 吴进才. 昆虫卵黄蛋白及其激素调控的研究进展[J]. 昆虫知识, 2010, 47(2): 236246.
[11]UPADHYAY S K, SINGH H, DISIT S, et al. Molecular characterization of vitellogenin and vitellogenin receptor of Bemisia tabaci [J/OL]. PLoS ONE, 2016, 11(5): e0155306. DOI: 10.1371/journal.pone.0155306.
[12]SHEN Yan, CHEN Yuanzhi, LOU Yihan, et al. Vitellogenin and vitellogeninlike genes in the brown planthopper [J/OL]. Frontiers in Physiology, 2019, 10: 1181. DOI: 10.3389/fphys.2019.01181.
[13]梁慧芳, 曾凡荣, 毛建军. 大眼长蝽卵黄原蛋白基因克隆、序列分析及表达研究[J]. 生物技术通报, 2015, 31(10): 149156.
[14]LEE J M, HATAKEYAMA M, NISHIMORI Y, et al. Vitellogenin of the cicada Graptopsaltria nigrofuscata (Homoptera): analysis of its primary structure [J]. Insect Biochemistry and Molecular Biology, 2000, 30(1): 17.
[15]SAPPINGTON T W, RAIKHEL A S. Molecular characteristics of insect vitellogenins and vitellogenin receptors [J]. Insect Biochemistry and Molecular Biology, 1998, 28(5/6): 277300.
[16]TREWITT P M, HEILMANN L J, DEGRUGILLIER S S, et al. The boll weevil vitellogenin gene: nucleotide sequence, structure, and evolutionary relationship to nematode and vertebrate vitellogenin genes [J]. Journal of Molecular Evolution, 1992, 34(6): 478492.
[17]SUN Yang, XIAO Liubin, CAO Guangchun, et al. Molecular characterisation of the vitellogenin gene (AlVg) and its expression after Apolygus lucorum had fed on different hosts [J]. Pest Management Science, 2016, 72(9): 17431751.
[18]萬方浩. 重要农林外来入侵物种的生物学与控制[M]. 北京: 科学出版社, 2005.
[19]CARDARELLI E, MUSACCHIO A, MONTAGNANI C, et al. Ambrosia artemisiifolia control in agricultural areas: Effect of grassland seeding and herbivory by the exotic leaf beetle Ophraella communa [J]. NeoBiota, 2018, 38: 122.
[20]王建军, 赵宝玉, 李明涛, 等. 生态入侵植物豚草及其综合防治[J]. 草业科学, 2006, 23(4): 7175.
[21]ZHOU Zhongshi, WAN Fanghao, GUO Jianying. Common ragweed Ambrosia artemisiifolia L., in biological invasions and its management in China [M]. New York: Springer, 2017: 99109.
[22]周忠实, 郭建英, 万方浩, 等. 豚草防治措施综合评价[J]. 应用生态学报, 2008, 19(9): 19171924.
[23]孟玲, 李保平. 新近传入我国大陆取食豚草的广聚萤叶甲[J]. 中国生物防治, 2005, 21(2): 6569.
[24]ZHOU Zhongshi, GUO Jianying, CHEN Hongsong, et al. Effects of temperature on survival, development, longevity and fecundity of Ophraella communa (Coleoptera: Chrysomelidae), a biological control agent against invasive ragweed, Ambrosia artemisiifolia L. (Asterales: Asteraceae) [J]. Environmental Entomology, 2010, 39(3): 10211027.
[25]ZHANG Yan, CHEN Jiqiang, CHEN Guangmei, et al. Identification and validation of reference genes for quantitative gene expression analysis in Ophraella communa [J/OL]. Frontiers in Physiology, 2020, 11: 355. DOI: 10.3389/fphys.2020.00355.
[26]龔和, 翟启慧. 昆虫卵黄原蛋白和卵黄发生[J]. 昆虫学报, 1979, 22(2): 219236.
[27]HUSAIN M, RASOOL K G, TUFAIL M, et al. Molecular characterization, expression pattern and RNAimediated silencing of vitellogenin receptor gene in almond moth, Cadra cautella [J]. Insect Molecular Biology, 2020, 29(4): 417430.
[28]TELFER W H. Immunological studies of insect metamorphosis. II. The role of a sexlimited blood protein in egg formation by the Cecropia silkworm [J]. Journal of General Physiology, 1954, 37(4): 539558.
[29]BELL W J, TELFER W H, PAN L. Vitellogenic blood protein synthesis by insect fat body [J]. Science, 1969, 25(3891): 393394.
[30]HU Kui, TIAN Ping, TANG Yan, et al. Molecular characterization of vitellogenin and its receptor in Sogatella furcifera, and their function in oocyte maturation [J/OL]. Frontiers in Physiology, 2019, 10: 1532. DOI: 10.3389/fphys.2019.01532.
[31]HAN Shipeng, WANG Da, SONG Peng, et al. Molecular characterization of vitellogenin and its receptor in Spodoptera frugiperda (J. E. Smith, 1797), and their function in reproduction of female [J/OL]. International Journal of Molecular Sciences, 2022, 23(19):11972. DOI: 10.3390/ijms231911972.
[32]霍岩, 陈晓英, 方荣祥, 等. 卵黄蛋白原的产生及其非营养功能的研究现状[J]. 生物技术通报, 2018, 34(2): 6673.
[33]LEIPART V, HALSKAU , AMDAM G V. How honey bee vitellogenin holds lipid cargo: a role for the Cterminal [J/OL]. Frontiers in Molecular Biosciences, 2022, 9: 865194. DOI: 10.3389/fmolb.2022.865194.
[34]YANO K, SAKURAI M T, IZUMI S, et al. Vitellogenin gene of the silkworm, Bombyx mori: structure and sexdependent expression [J]. FEBS Letters, 1994, 356: 207211.
[35]PEREZ M F, LEHNER B. Vitellogeninsyolk gene function and regulation in Caenorhabditis elegans [J/OL]. Frontiers in Physiology, 2019, 10: 1067. DOI: 10.3389/fphys.2019.01067.
[36]ZHANG Tao, ZHANG Guocai, ZENG F, et al. Molecular cloning of the vitellogenin gene and the effects of vitellogenin protein expression on the physiology of Harmonia axyridis (Coleoptera: Coccinellidae) [J/OL]. Scientific Reports, 2017, 7(1): 13926. DOI: 10.1038/s41598017143393.
(責任编辑:田 喆)

