不同肉色脚板薯营养成分和功能成分分析
邵勤 陈娜 李晓鹏 袁九香
摘要 以紫色、白色2种肉色脚板薯为试材,采用高效液相色谱法、电感耦合等离子体发射光谱法(ICP-OES)和pH示差法对其氨基酸、单糖、尿囊素、薯蓣皂苷、微量元素及总花色苷含量进行检测分析,并测定水分、蛋白质、淀粉等成分含量。结果表明:2种不同肉色脚板薯营养成分和功能成分存在一定差异性。白色肉脚板薯蛋白质含量显著高于紫色肉,而水分和淀粉含量显著低于紫色肉;微量元素Bi、Rb和Se含量为白色>紫色,Mo、Ca、Mg元素为白色<紫色,其他元素差异不明显;必需和非必需氨基酸总含量为白色>紫色;富含精氨酸,含量为白色>紫色,分别为297.96和97.08 mg/kg;富含尿囊素,含量为白色>紫色,分别为30.03和24.53 mg/kg;单糖、薯蓣皂苷、总花色苷含量均为白色<紫色,单糖组成为葡萄糖>半乳糖>甘露糖>半乳糖醛酸>木糖>核糖>阿拉伯糖>葡萄糖醛酸>鼠李糖>岩藻糖。
关键词 脚板薯;肉色;营养成分;微量元素;功能成分
中图分类号 TS201.4 文献标识码 A
文章编号 0517-6611(2024)10-0182-04
doi:10.3969/j.issn.0517-6611.2024.10.041
Analysis of Nutritional and Functional Components of Dioscorea alata of Different Colors
SHAO Qin,CHEN Na,LI Xiao-peng et al
(College of Life Science & Resource and Environment,Yichun University,Yichun,Jiangxi 336000)
Abstract The content of amino acids,monosaccharides,allantoin,diosgenin,trace elements,and total anthocyanins in purple and white Dioscorea alata were detected and analyzed using high-performance liquid chromatography,inductively coupled plasma emission spectroscopy (ICP-OES) and pH differential method.The content of water,protein,starch and other components was also determined.The results showed that there were certain differences in the nutritional and functional components between two different types of Dioscorea alata.The protein content of white was significantly higher than that of purple,while the content of water and starch were significantly lower than that of purple meat.The contents of Bi,Rb and Se in micronutrient was in the order of white > purple,but Mo,Ca and Mg was white < purple,and there was no significant difference among the other elements.The contents of essential amino acid and non-essential amino acid order was white > purple,rich in arginine,297.60 mg/kg and 97.08 mg/kg,respectively.The content of allantoin in two colors of Dioscorea alata order was white > purple,30.03 mg/kg and 24.53 mg/kg.The contents of monosaccharide,diosgenin and total anthocyanin were white < purple,among which the monosaccharide contents,in the order of glucose > galactose > mannose > galacturonic acid > xylose > ribose > arabinose>glucuronic acid>rhamnose>fucose.
Key words Dioscorea alata;Flesh color;Nutritional components;Trace elements;Functional components
基金項目 江西省重点研发计划项目(20202BBFL63002);江西省教育厅科学技术研究项目(GJJ201618)。
作者简介 邵勤(1981—),男,浙江杭州人,讲师,博士,从事蔬菜品质育种及生理生化研究。*通信作者,高级农艺师,从事经济作物引种、示范及推广研究。
收稿日期 2023-07-05
脚板薯(Dioscorea alata Lirm.sp)是薯蓣科(Dioscoreaceae)薯蓣属(Dioscorea)一年生或多年生缠绕性藤本植物[1],因其地下器官(块根、块茎)肥大呈掌状或块状,酷似“脚板”而出名,富含微量元素、氨基酸等营养性成分及薯蓣皂苷、尿囊素等功能性成分,是一种珍贵的药食同源蔬菜[2-3];栽培历史悠久、种植范围分布广泛,主要分布在我国南方沿海诸省的温暖地带,如江西、浙江、广东、广西、福建、台湾等地,市场需求量较大、种植效益好,也是一种重要的菜粮兼用作物。脚板薯是江西省极具特色的山药地方品种之一,品种类型丰富,分为白肉品种群和紫肉品种群,主要包括紫红皮种、白皮种、紫红肉种、白肉种和全紫种等,赣州、宜春等地区是主要的种植区域。近年来许多研究表明,紫色和白色肉脚板薯营养成分和功能成分差别较大,具有各自特有的营养物质。随着人们对健康的日益重视,紫色肉脚板薯越来越受消费者的青睐和研究人员的关注[4-8],但无论从营养价值角度还是食品加工和药用方面考虑都应具有较高的开发利用价值,目前关于脚板薯口感品质、营养及功能成分的系统比较研究在国内鲜见报道。因此,该研究以2种不同肉色脚板薯块茎为研究对象,通过比较分析不同肉色脚板薯营养成分和功能成分含量的差异,旨在为深入了解脚板薯的营养价值、食品开发利用、品质评价和新品种选育提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 供试材料。
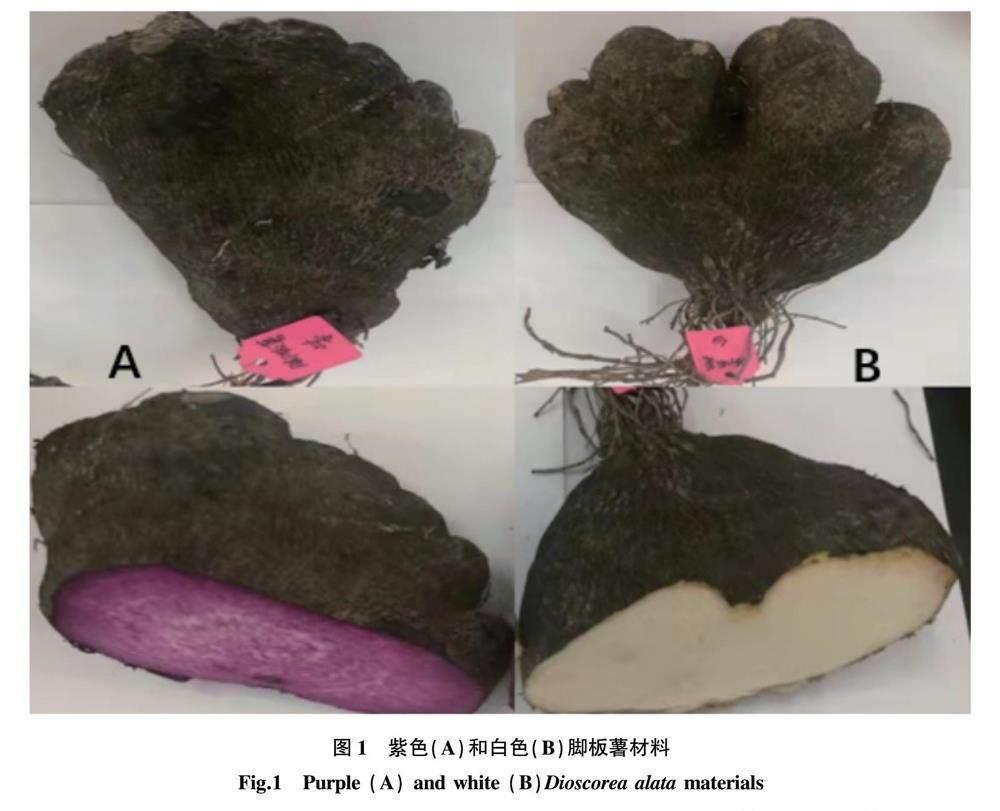
随机选取白色和紫色脚板薯品种2个(图1),每个品种10株,于2022年4—10月在宜春学院农学基地地方特色蔬菜种植区块进行种植,期间进行正常的田间栽培管理,至10月26日统一收获取样,每个样品随机选取3株,每株取薯块3块用蒸馏水清洗干净并冷藏备用。
1.1.2 供试试剂。三氯乙酸、乙醇、柠檬酸、氢氧化钠、考马斯亮兰、盐酸,分析纯,广州霖华生物科技有限公司;乙腈、甲醇,色谱纯,默克西格玛奥德里奇(上海)贸易有限公司;尿囊素、氨基酸、薯蓣皂苷等标准品,购于默克西格玛奥德里奇(上海)贸易有限公司;As、Ba、Bi、Cd、Co、Cr、Fe、Cu、Ga、Rb、Mo、Ca、In、Mn、Ni、Pb、Zn、Tl、Ag、Hg、B、Se、Mg等标准物质,购于德国MERCK公司。
1.1.3 供试设备。安捷伦高效液相色谱仪(1200系列),美国安捷伦公司;岛津液相色谱仪(LC-2030Plus系列),日本岛津公司;电耦合等离子体发射光谱仪(AVIO200),美国铂金埃尔默公司;紫外可见分光光度计(UV2800A),尤尼柯(上海)仪器有限责任公司。
1.2 试验方法
1.2.1 水分测定。
采用直接干燥法进行测定。精确称取白色和紫色腳板薯薯肉各10 g(厚度不超过5 mm),分别放入称量瓶中,置于101~105 ℃干燥箱中,干燥3 h后,盖好取出,放入干燥器冷却0.5 h后称重,然后再放入101~105 ℃干燥箱中干燥1 h,取出放入干燥器内冷却0.5 h后再称重,重复上述操作3次,至恒重。
1.2.2 蛋白质含量测定。
采用考马斯亮蓝法进行测定。称取白色和紫色脚板薯薯肉2 g放入研钵中,加入2 mL蒸馏水研磨成匀浆,转移到离心管中,再用6 mL蒸馏水分次洗涤研钵,收集于离心管中,放置1 h,4 000 r/min离心20 min,去上清液转入10 mL容量瓶中,以蒸馏水滴定,用分光光度计法比色测定595 nm处的吸光度(A595)。
1.2.3 淀粉含量测定。
1.2.3.1 淀粉提取。称取0.1 g紫色和白色肉脚板薯薯肉于研钵中研碎,加入1 mL试剂一,充分匀浆后转移到EP管中,80 ℃水浴提取30 min,6 000 r/min常温离心5 min,弃上清,留沉淀;沉淀中加入0.5 mL蒸馏水,放入沸水浴中糊化15 min(盖紧,以防止水分散失);冷却后,加入0.35 mL试剂二,常温提取15 min,振荡3~5次;加入0.85 mL双蒸水,混匀,6 000 r/min 常温离心10 min,取上清液备用。
1.2.3.2 含量测定。采用淀粉含量检测试剂盒(BC0700- 50T/48S,solarbio)进行淀粉测定,具体按照试剂盒步骤操作,以样本鲜重计算。
淀粉含量(mg/g)=[(A+0.029 5)×V1]/(W×V1/V2) =0.289×(A+0.029 5)/W
式中:V1为加入反应体系中样本体积,0.2 mL;V2为加入提取液体积,1.7 mL;W为样本质量(g);A为620 nm波长下记录的吸光度。
1.2.4 微量元素含量测定。
脚板薯薯肉中微量元素含量测定参照曹志源等[9]的方法,利用电感耦合等离子体发射光谱法(ICP-OES)进行测定。参数条件:功率1 150 W,等离子气流量15 L/min,辅助气流量1.5 L/min,雾化气压力0.2 MPa,泵速50 r/min,清洗时间30 s。
1.2.5 氨基酸含量测定。
脚板薯薯肉中氨基酸含量测定参照Dilobar等[10]的方法,利用高效液相色谱法进行检测。色谱条件:Shim-pack VP-ODS分析柱(4.6 mm×150 mm,5 μm);流速1.0 mL/min;检测波长248 nm;柱温37 ℃。
1.2.6 单糖组成测定。
脚板薯薯肉中单糖组成测定参照Yang等[11]的方法,利用高效液相色谱法进行检测。色谱条件:色谱柱为Agilent Eclipse XDB-C18(4.6 mm×150 mm,5 μm);流速1.0 mL/min;检测波长250 nm,柱温为室温。
1.2.7 尿囊素含量测定。
脚板薯薯肉中尿囊素含量测定参照王海波等[12]的方法,利用高效液相色谱法进行检测。色谱条件:色谱柱为Zorbax ODS C18(250 mm×4.6 mm,5 μm),保护柱为Zorbax ODS (20 mm×2.0 mm,3 μm);流动相为甲醇-氯仿-水(0.5∶0.012∶100);流速0.5 mL/min;检测波长224 nm;柱温35 ℃。
1.2.8 薯蓣皂苷含量测定。
脚板薯薯肉中薯蓣皂苷含量测定参照史君星等[13]的方法,利用高效液相色谱法进行检测。色谱条件:色谱柱为DIKMA C18(250 mm×4.6 mm,5 μm),流动相为乙腈-水(52∶48),流速1.0 mL/min;检测波长203 nm;柱温30 ℃。
1.2.9 总花色苷含量测定。
脚板薯薯肉中总花色苷含量测定参照于东等[14]的方法,采用pH示差法进行检测。取白色和紫色脚板薯薯肉各10 g,在4 ℃条件下加入250 mL盐酸甲醇溶液(pH=3),避光条件下提取24 h,4 000 r/min离心10 min 后去上清液,在40 ℃条件下进行真空浓缩除甲醇,浓缩液用0.01%盐酸水溶液定容至50 mL待用。测试前,岛津UV-2800A紫外分光光度计在250~600 nm进行扫描,测定待测样品溶液最大吸收波长。分别在最大吸收波长和700 nm 处测定样品花色苷提取液在pH 4.5和pH 1.0时的吸光度。总花色苷含量计算公式如下:
A=(A1-A3)-(A2- A4)
C=(A×103×MW×DF)/(ε×1)
总花色苷含量(mg/kg)=(C×V)/(M×104)
式中:A1、A2分别表示在最大吸收波长处测定样品花色苷提取液在pH 4.5和pH 1.0时的吸光度;A3、A4分别表示在波长700 nm处测定样品花色苷提取液在pH 4.5和pH 1.0时的吸光度;MW表示以矢车菊-3-葡萄糖苷为标准的相对分子质量,取449.4;ε为消光系数,取29 600;DF为待测液稀释倍数;C为花色苷浓度(mg/L);V为待测液体积(mL);M为样品重量(g)。
1.3 数据分析
采用Excel 2016软件进行数据统计,利用SPSS 19.0 软件对数据进行分析,采用最小显著差数法(P<0.05,LSD)进行均值的显著性差异比较。
2 结果与分析
2.1 不同肉色脚板薯薯肉中水分、淀粉和蛋白质含量分析
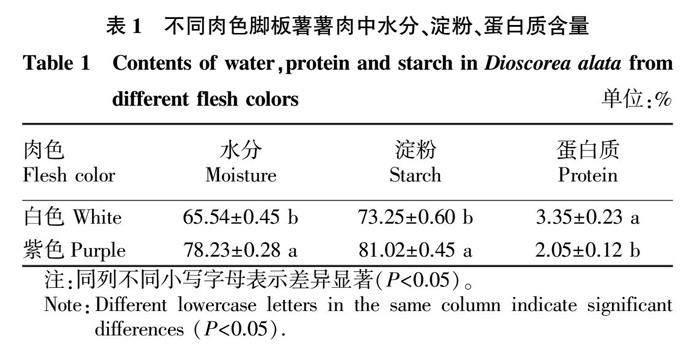
由表1可知,2种肉色脚板薯薯肉中水分含量差异显著,其中白色肉水分含量为65.54%,紫色肉为78.23%,由此可以推断白色肉脚板薯块茎因含水量低,更利于贮藏,紫色肉则不耐贮藏,易变质;同时,淀粉和蛋白质含量差异较大,紫色肉淀粉含量较高,白色肉蛋白质含量较高,这可能与紫色肉口感偏硬、白色肉口感较好密切相关。
2.2 不同肉色脚板薯薯肉中微量元素含量分析
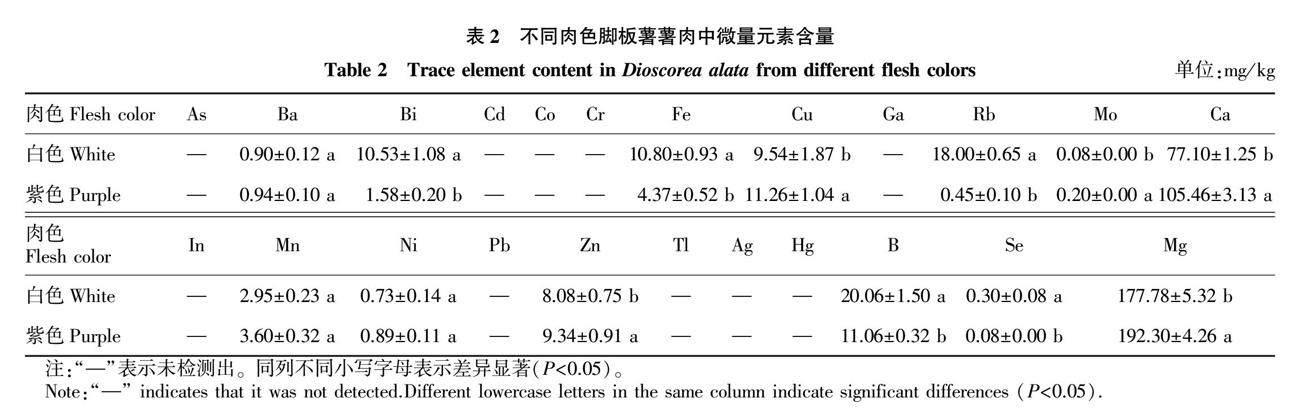
利用ICP-OES测得2种肉色脚板薯薯肉中的微量元素含量见表2。由表2可知,白色肉、紫色肉色脚板薯薯肉中均未检测到As、In、Cd、Co、Cr、Ga、Pb、Tl、Ag、Hg,符合国家标准要求;Ba、Mn、Ni这3种元素含量差异较小;白色肉脚板薯薯肉中的Bi、Fe、Rb、B、Se元素含量均较高,其中Bi、Rb和Se含量分别为10.53、18.00、0.30 mg/kg,是紫色肉脚板薯薯肉的6.7、40.0和3.8倍;紫色肉脚板薯薯肉中的Mo、Ca、Mg含量较高,分别是白色肉脚板薯薯肉中对应元素的2.5、1.4、1.1倍。
2.3 不同肉色脚板薯薯肉中氨基酸组成及含量分析
利用高效液相色谱法对2种肉色脚板薯样品中的18种氨基酸进行检测。由表3可知,脚板薯薯肉样品中共检测出17种氨基酸,其中组氨酸未检测出。主要包括人体必需氨基酸8种(苏氨酸、甲硫氨酸、异亮氨酸、亮氨酸、苯丙氨酸、赖氨酸、色氨酸、缬氨酸)、非必需氨基酸9种(精氨酸、半胱氨酸、天冬氨酸、谷氨酸、脯氨酸、丙氨酸、酪氨酸、丝氨酸、甘氨酸)。各种氨基酸在不同肉色脚板薯薯肉中有一定的差异,其中白色、紫色2种肉色脚板薯薯块的氨基酸总量分别为1 819.39和719.52 mg/kg,其中精氨酸含量均为最高,分别为297.96和97.08 mg/kg,分别占氨基酸总量的16.38%和13.49%;必需氨基酸中亮氨酸含量差异最大,含量分别为147.40和43.90 mg/kg,占必需氨基酸总量的20.23%、15.75%。
2.4 不同肉色脚板薯薯肉中单糖组成及含量分析
利用高效液相色谱法测定脚板薯薯肉中甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖的含量,初步分析了10种单糖组成。由表4可知,不同肉色脚板薯薯肉中单糖含量存在差异且紫色>白色,其中半乳糖醛酸、葡萄糖醛酸含量差异较大,均为白色肉脚板薯2倍以上;2种肉色脚板薯薯肉中单糖含量从大到小依次为葡萄糖>半乳糖>甘露糖>半乳糖醛酸>木糖>核糖>阿拉伯糖>葡萄糖醛酸>鼠李糖>岩藻糖,其中葡萄糖含量均为最高,大于200 000 mg/kg,而巖藻糖含量均为最低,小于500 mg/kg。
2.5 不同肉色脚板薯薯肉中主要功能成分及含量分析 脚板薯薯肉中的主要功能成分为尿囊素、薯蓣皂苷、花色苷等。该研究对不同肉色脚板薯薯肉中的尿囊素、薯蓣皂苷和总花色苷进行测定,结果发现(表5),白色肉脚板薯尿囊素含量显著高于紫色肉,而薯蓣皂苷和总花色苷含量显著低于紫色肉,说明白色肉脚板薯和紫色肉脚板薯的功能成分的积累存在差异,这可能受到品种、栽培措施以及种植地的环境条件等因素影响。
3 结论与讨论
通过测定2种肉色脚板薯主要营养成分(水分、淀粉、蛋白质、氨基酸、微量元素、单糖)和功能成分(尿囊素、薯蓣皂苷、总花色苷)的含量,紫色肉脚板薯和白色肉脚板薯几乎涵盖了人体日常需要的营养成分,发现白色肉脚板薯薯肉中蛋白质含量较高,水分、淀粉含量偏低,氨基酸、尿囊素以及Bi、Fe、Rb、B、Se元素含量普遍较高,而Mo、Ca和Mg元素、总花色苷、薯蓣皂苷和单糖含量则显著低于紫色肉脚板薯。
前人研究发现脚板薯种植土壤环境、栽培管理措施和气候条件等不同会影响营养成分和功能成分的积累,从而导致不同地区、相同类型脚板薯薯肉在营养和功能成分含量上有较大的差异,如花色苷、氨基酸、淀粉、蛋白质等,与该研究结果一致。脚板薯地方特色品种较多,不同类型脚板薯资源间营养成分和功能成分差异较大,其含量高低对品质有重要影响。在常种的几种脚板薯地方品种中,紫色肉脚板薯越来越受到消费者的青睐和关注,尤其与氨基酸、尿囊素、花色苷、薯蓣皂苷含量等有密切关系,直接影响食品功效、口感品质和营养价值等。综上所述,从营养价值还是功效角度看,紫色肉和白色肉脚板薯薯肉中均含有各自的营养物质和功能成分,利用这些差异和特点可以建立脚板薯品种营养评价体系,改进评价手段,可为消费者选择适宜的脚板薯提供参考,也可为不同类型脚板薯的品种选育、分类筛选以及功能性产品开发等提供科学依据。
参考文献
[1] 袁经相.优质赣南脚板薯品种介绍[J].长江蔬菜,2017(5):18-19.
[2] 刘媛洁,余俏,张良.脚板薯的研究进展[J].安徽农业科学,2013,41(24):9951-9953,9956.
[3] HU G J,ZHAO Y,GAO Q,et al.Functional properties of Chinese yam (Dioscorea opposita Thunb.cv.Baiyu) soluble protein[J].Journal of food science and technology,2018,55(1):381-388.
[4] BUCKMAN E S,ODURO I,PLAHAR W A,et al.Determination of the chemical and functional properties of yam bean (Pachyrhizus erosus(L.) Urban) flour for food systems[J].Food science and nutrition,2018,6(2):457-463.
[5] ALVES R M,GROSSMANN M V,FERRERO C,et al.Chemical and functional characterization of products obtained from yam tubers[J].Starch/Strke,2002,54(10):476-481.
[6]龚凌霄,池静雯,王静,等.山药中主要功能性成分及其作用机制研究进展[J].食品工业科技,2019,40(16):312-319.
[7] PARK J M,KIM Y J,KIM J S,et al.Anti-inflammatory and carbonic anhydrase restoring actions of yam powder (Dioscorea spp.) contribute to the prevention of cysteamine-induced duodenal ulcer in a rat model[J].Nutrition research,2013,33(8):677-685.
[8] ZHANG B,GUO K,LIN L S,et al.Comparison of structural and functional properties of starches from the rhizome and bulbil of Chinese yam(Dioscorea opposita Thunb.)[J].Molecules,2018,23(2):1-12.
[9] 曹志源,方建慧,陆伟,等.微波消解ICP-OES法测定当归中的微量元素[J].微量元素与健康研究,2011,28(5):18-20.
[10] DILOBAR,NURULLAEVA.Study of amino-acid composition of seed of oats fruit (Avena sativa L.)[J].Chemistry and chemical engineering,2019 (3):64-67.
[11] YANG W,WANG Y,LI X,et al.Purification and structural characterization of Chinese yam polysaccharide and its activities [J].Carbohydrate polymers,2015,117:1021-1027.
[12] 王海波,蔡寶昌.反相高效液相色谱法测定不同产地山药中尿囊素的含量[J].中药新药与临床药理,2004,15(3):190-192.
[13] 史君星,左春芳,谢彩侠.反相高效液相色谱法测定盾叶薯蓣中薯蓣皂苷的含量[J].中医学报,2012,27(8):983-984.
[14] 于东,叶兴乾,方忠祥,等.采用HPLC-DAD-ESIMS技术鉴定紫山药中的花色苷成分[J].中国食品学报,2010,10(3):213-218.

