治疗前格拉斯哥评分及血液炎性指标与鼻咽癌患者预后相关性研究
李晓惠 许啸 范元平 文娟 陈静茹 夏云飞

【摘要】目的 探讨治疗前格拉斯哥预后评分(GPS)及血液炎性指标与鼻咽癌患者预后相关性。方法 将来自2个临床中心的鼻咽癌患者428例分成训练集和验证集,比较2组临床特征是否均衡。在训练集中分析治疗前GPS及血液炎性指标对鼻咽癌患者5年疾病特异生存率的影响,寻找鼻咽癌独立预后危险因素,并计算每位患者的预后指数,将其分为低危、中危和高危组。在验证集中进一步验证。结果 训练集Cox多因素分析发现治疗前年龄>50岁、T分期T3~T4、N分期N2~N3、GPS 1~2分、中性粒细胞与淋巴细胞比值(NLR)>2.5、淋巴细胞与单核细胞比值(LMR)≤
2.35是影响鼻咽癌患者5年疾病特异生存率的不良预后因素,验证集得以验证。结论 治疗前GPS、NLR、LMR等联合年龄、TNM分期可能为鼻咽癌患者预后评估提供了新途径。
【关键词】鼻咽癌;中性粒细胞与淋巴细胞比值;格拉斯哥预后评分;血小板与淋巴细胞比值;
淋巴细胞与单核细胞比值
Study on the correlation between pre-treatment Glasgow score and blood inflammatory markers and prognosis of nasopharyngeal carcinoma patients
LI Xiaohui1, XU Xiao1, FAN Yuanping1, WEN Juan1, CHEN Jingru1, XIA Yunfei2,3
(1.Department of Oncology, Army 32265, Guangzhou 510318, China; 2.Department of Radiation Oncology, Sun Yat-sen University Cancer Center, Guangzhou 510060, China; 3.Sun Yat-sen University Cancer Center, State Key Laboratory of Oncology in South China, Guangzhou 510060, China)
Corresponding authors: XIA Yunfei, E-mail: xiayf@sysucc.org.cn
【Abstract】Objective To investigate the correlation between Glasgow score and blood inflammatory markers before treatment with the efficacy of nasopharyngeal carcinoma. Methods Cases from the two clinical centers were divided into training set and validation set, and the clinical characteristics of the two groups were compared to be balanced. To search the independent prognostic risk factors of nasopharyngeal carcinoma and then the prognostic index of each patient was calculated, and the patients were divided into high-risk, intermediate-risk and low-risk groups. Further validation in the validation set. Results Cox multivariate analysis of the training set showed that age >50, T3-T4, N2-N3, GPS score of 1-2, NLR>2.5, and LMR≤2.35 before treatment were poor prognostic factors affecting the 5-year disease-specific survival rate of patients with nasopharyngeal carcinoma. Conclusion The combination of GPS, NLR, LMR and age, TNM staging may provide a new way for the prognosis evaluation of patients with nasopharyngeal carcinoma before treatment.
【Key words】Nasopharyngeal carcinoma; Glasgow prognostic score; Neutrophil lymphocyte ratio; Platelet lymphocyte ratio;
Lymphocyte mononuclear ratio
鼻咽癌具有独特的生物学行为、明显种族及地域差异,我国南方各省鼻咽癌发病率占我国发病人数的80%[1]。由于肿瘤异质性存在很大差异,在临床工作中,仅仅依靠TNM分期判断鼻咽癌患者的預后,会有比较大的局限性。因此,积极寻找一些常规、经济、易于基层单位推广的炎症及营养指标联合TNM分期是实现鼻咽癌患者个体化治疗的关键[2-3]。既往研究发现被感染组织癌变的概率较正常组织大大增加,可能是因为在炎症状态下恶性肿瘤患者免疫耐受,从而激活致癌信号通路,活化致癌信号因子及血管生成因子等,促进肿瘤的生长及扩散[4]。因此,机体的全身炎症状态通常与肿瘤患者不良预后相关[5-6]。近年来多项研究提示,血液炎性指标如CRP、中性粒细胞与淋巴细胞比值(NLR)、淋巴细胞与单核细胞比值(LMR)、血小板与淋巴细胞比值(PLR)等与恶性肿瘤的预后相关[7-8]。鼻咽癌患者在放射治疗期间常常因为口腔黏膜炎而进食困难,能量摄入不足,导致患者营养不良。白蛋白与机体营养状态关系密切,血浆白蛋白水平较低者往往预后较差。格拉斯哥预后评分(GPS)以外周血CRP和白蛋白为基础,既反映炎症反应对肿瘤细胞的作用,又考虑了营养状态对患者预后的影响,已被发现是多种类型癌症的预后标志物[9-10]。本研究旨在通过对营养综合指标GPS以及血液炎症指标的研究,进一步探讨其与鼻咽癌患者预后的关系。
1 对象与方法
1.1 研究对象
428例鼻咽癌患者分别来源于中山大学肿瘤防治中心2006年12月27日至2011年7月27日收治的初诊鼻咽癌患者(249例),以及32265部队2013年3月1日至2016年5月31日收治的接受根治性放射治疗的初诊鼻咽癌患者(179例)。入组标准:①病理诊断为鼻咽癌;②首次接受放射治疗;③Karnofsky功能状态(KPS)评分≥70分;④无远处转移;⑤无严重器质性疾病及系统性疾病;⑥预计生存时间>6个月。排除标准:①未完成根治性放射治疗;②治疗前一般临床特征及血常规、生化等化验结果不完善。本研究经过32265部队伦理委员会审批(伦理审批时间2012年12月22日)。
1.2 治疗方法
采用直线加速器6~8 MV高能X线放射治疗,放射治疗技术采用适形或者调强放射治疗(IMRT)。鼻咽原发灶(GTVnx)剂量为68~70 Gy,区域淋巴结(GTVnd)剂量为60~66 Gy,高危区临床靶体积(CTV1)剂量为60 Gy,低危区临床靶体积(CTV2)剂量为54 Gy。放射治疗1天1次,1次1.8~2.3 Gy,1周5次,6~7周内完成放射治疗。
425例患者采用同期放射化学治疗,化学治疗方案主要采用PF方案,顺铂(江苏豪森制药有限公司,H20010743)用法为80~100 mg/m2,静脉滴注,第1日;氟尿嘧啶(上海旭东海普药业,H31020593)用法为500~1 000 mg/m2,静脉滴注,第2~5日,每21~28日一个周期,化疗2~3周期。
1.3 观察指标
开始治疗前1周收集患者血常规及生化指标。包括:①GPS,对鼻咽癌患者CRP升高(外周血CRP质量浓度>10 mg/L)和低蛋白血症(血清白蛋白质量浓度<35 g/L)2项均阳性者记作GPS 2分;1项异常的记作GPS 1分;无异常的记作GPS 0分。按GPS值的不同分为3组。②NLR,NLR定义为中性粒细胞绝对值除以淋巴细胞绝对值。③LMR,LMR定义为淋巴细胞绝对值除以单核细胞绝对值。④PLR,PLR定义为血小板绝对值除以淋巴细胞绝对值。⑤TNM分期依据中国鼻咽癌分期2017版(2008鼻咽癌分期修订专家共识)。
1.4 分 组
将中山大学肿瘤中心的249例鼻咽癌患者作为训练集,筛选与鼻咽癌疗效相关的指标;32265部队179例鼻咽癌患者作为验证集。
1.5 预后模型的建立及验证
在训练集中将单因素分析中有意义因子通过多因素分析建立预后模型,并计算每例患者的预后指数。根据预后指数将患者分为低危组、中危组和高危组。
计算验证集每例患者的预后指数,并按照训练集确定的危险分组界值进行分组,对验证集的低危组、中危组和高危组生存率进行比较。
1.6 随 访
随访时间从开始治疗第1日起算,患者放射化学治疗结束后前2年每3个月进行1次随访,2年后间隔从3个月逐渐增加到6个月。随访形式包括电话、微信、门诊等,末次随访以微信随访为主,失访者以末次门诊随访结果为准。中山大学肿瘤防治中心患者中位随访时间为67个月;32265部队患者中位随访时间77个月。
1.7 统计学处理
数据处理采用SPSS 22.0。以患者开始放射治疗始计算生存期,以5年疾病特异生存作为结局,采用受试者操作特征(ROC)曲线来选择治疗前NLR、PLR、LMR的最佳临界值。最佳临界值是指在ROC曲线上离理想点(灵敏度=特异度=100%)最近的点,在该点时约登指数为最大[11]。根据该界值将患者分为2组进行生存分析。
采用Kaplan-Meier法计算5年疾病特异生存率(DSS),组间差别采用Log-rank检验;计数资料以n(%)表示,组间比较采用χ 2检验。采用Cox比例风险模型进行单因素、多因素生存分析,P < 0.05为差异有统计学意义。
2 结 果
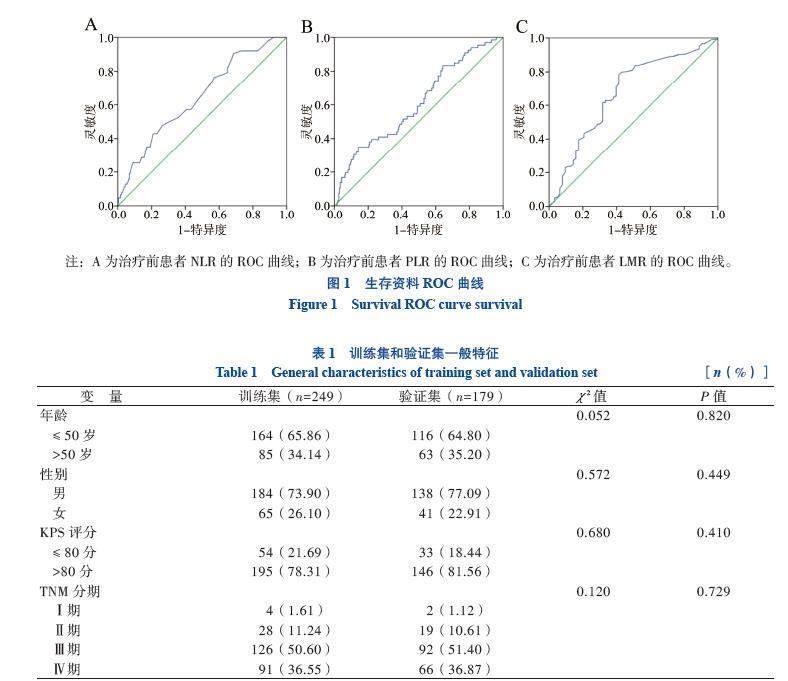
2.1 治疗前NLR、PLR、LMR最佳临界值的选取
以5年疾病特异生存作为结局,选择ROC曲线上的最佳临界值,将患者分为低NLR组(NLR≤
2.5,n = 149)和高NLR组(NLR>2.5,n = 100)(图1A);低PLR组(PLR≤166,n = 193)和高PLR组(PLR>166,n = 56)(图1B);低LMR组(LMR≤2.35,n = 76)和高LMR组(LMR>2.35,n = 173)(图1C)。
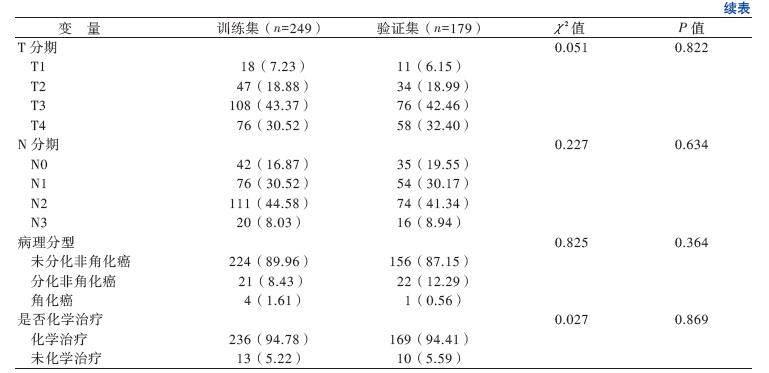
2.2 训练集和验证集临床特征
训练集和验证集鼻咽癌患者的基本特征及相关统计分析见表1,对2集患者的各项临床特征进行比较,差异均无统计学意义(P均> 0.05)。
2.3 單因素分析
单因素分析显示年龄>50岁、T3~T4、N2~N3、GPS1~2分、NLR>2.5、PLR>166、LMR≤2.35是鼻咽癌患者疾病特异生存率的不良预后因素,见表2。
2.4 多因素分析
多因素分析显示年龄>50岁、T分期T3~T4、N分期N2~N3、GPS 1~2分、NLR>2.5、LMR≤2.35是鼻咽癌患者疾病特异生存的不良预后因素,见表3。
2.5 预测模型的建立及危险分组
根据Cox比例风险模型,预后指数(prognostic index,PI)计算公式如下:PI=βl×Χl+β2×Χ2+β3×
Χ3+β4×Χ4+β5×Χ5+β6×Χ6。
β值以上表结果为依据,进行了调整,重新给予赋值,为便于临床使用,采用其相对应的β转换值,模型如下:PI=3×年龄+4×T+2×N+3×
GPS+2×NLR+2×LMR。计算训练集中每例患者的预后指数。训练集中PI为0到16,根据预后指数,将其分为3组,0~5分为低危组,6~10分为中危组,11~16分为高危组。
2.6 预测模型的验证
分别计算验证集中每例患者的PI,通过ROC曲线分析该模型预测效果,结果显示PI值在预测患者5年DSS时曲线下面积(AUC)为0.742,95%CI为0.655~0.829,国际抗癌联盟(UICC)分期预测患者5年DSS时AUC为0.634,95%CI为0.539~0.729。该模型AUC大于UICC TNM分期,两者比较差异有统计学意义(P < 0.05;图2)。
分别计算验证集中每例患者的预后指数,根据训练集得出的危险分组标准,将验证集中患者分为低危组、中危组、高危组,分别作出各组生存曲线,各组生存率比较差异均有统计学意义(P均<0.05)。见图3。
3 讨 论
近年来,多项研究深入剖析了鼻咽癌患者机体营养状态与治疗效果及预后的关系,发现治疗前的营养状况是鼻咽癌患者生存率的重要预后因素,并且局部晚期鼻咽癌患者更易發生营养不
良[12-15],主要是因为营养不良和体重减轻可能会导致患者免疫功能和对疾病的抵抗力降低。鼻咽癌患者常常在放射治疗第2周开始出现急性放射性黏膜炎,随着放射治疗剂量的累积,患者的不适感逐渐加重,逐渐从口咽部黏膜红肿演变为假膜覆盖、触痛,甚至出现糜烂、溃疡,严重妨碍了患者摄入固体食物,甚至摄入液体食物也会出现吞咽困难,从而导致食物摄入减少,进而影响患者营养状况。GPS是纳入炎症指标CRP和营养指标血清白蛋白两项指标,可以反映全身炎症及营养状况[16]。关于GPS和肿瘤预后的相关性尚未完全清楚,但也许和恶病质相关,因其往往提示患者营养缺失包括体质量下降、能量消耗增加、预后不良。而CRP是一种炎症相关蛋白,也被报道和机体营养状态相关,且CRP水平直接影响到疾病的预后,与生存期呈负相关[17]。
Sarraf等[18]对可手术完整切除非小细胞肺癌的患者研究发现,分期越晚NLR升高越明显,NLR是影响生存率的独立预后因素。Teramuka等[19]发现,升高的中性粒细胞计数是晚期非小细胞肺癌患者死亡的独立预测因素。同样,我们的研究发现NLR随着肿瘤分期的增加而升高,NLR升高的患者预后明显差于NLR未升高的患者。NLR升高的患者预后较差的原因考虑可能是由于NLR升高同中性粒细胞增加和(或)淋巴细胞减少。中性粒细胞既是免疫系统的第一道防线,同时也因其参与循环血管生成调节趋化因子和肿瘤血管生成的,使其为肿瘤发生发展提供了所需微环境[20]。单核细胞和中性粒细胞同属于白细胞免疫防御系统,其可分化为巨噬细胞,而肿瘤相关巨噬细胞释放血管内皮生长因子、表皮生长因子和TNF-α,促进肿瘤细胞生长、转移及肿瘤血管生成,影响患者预后。LMR降低提示淋巴细胞计数的相对或绝对减少或者单核细胞计数相对或者绝对增加。近来有研究报道,LMR的降低是恶性血液肿瘤和肺癌的不良预后因素[21-22],可能与单核细胞与淋巴细胞共同参与特异性免疫反应有关。PLR的升高提示血小板计数的相对或绝对增加或者淋巴细胞计数相对或者绝对减少。Gao等[23]发现血小板增多是影响鼻咽癌预后的独立不良因素,分析原因可能是由于血小板分泌各种促血管生成因子或肿瘤生长因子促进肿瘤血管形成,为肿瘤发展和转移提供条件。
本研究发现随着GPS的升高,NLR、PLR逐渐升高,LMR逐渐降低,可能是因为随着鼻咽癌患者营养状态的下降,机体的免疫力也逐渐下降,作为机体免疫防线的中性粒细胞及单核细胞反倒促进肿瘤细胞的生长及肿瘤血管的生成。本研究进一步通过Cox多因素分析发现年龄>50岁、T3~T4、N2~N3、GPS 1~2分、NLR>2.5、LMR≤2.35是鼻咽癌患者的不良预后因素,进一步证实了机体营养免疫状态与营养炎性指标具有相关性,提示它们可以共同反映鼻咽癌患者的营养免疫情况,联合应用可以更好地预测鼻咽癌患者的疗效。因为,这些不良预后因素中既包含了解剖因素及机体因素,也包括了机体微环境因素,可以在治疗前简单、直观地向医师及患者提供鼻咽癌生存预后情况。同时,这些指标均是临床常规检测指标,无需复杂检测设备及技术,花费较低,便于临床推广使用,有利于开展个体化治疗。综上所述,治疗前GPS、NLR、LMR等联合TNM分期可为鼻咽癌患者预后评估提供了新途径。
尽管如此,由于各种原因的限制,研究还有许多不足之处,首先,本研究为回顾性分析,治疗方案、复查随访不能按照标准化流程进行,可能会对研究结果带来影响;其次,本研究虽然采用了2个中心的数据,但总的研究对象数量偏少,尚需进一步扩大样本量为本研究提供更有力的证据。虽然存在许多欠缺,但本研究结果仍提示治疗前GPS、NLR、LMR等指标,不论对于患者疾病的诊断治疗,预后的判断,还是对于患者及家属了解病情发展,都提供了简洁可行的办法。
参 考 文 献
[1] ARTHUR C, RUAN H, WANG X F, et al. Retrospective Analysis of 5-Year Survival Rate of Nasopharyngeal Carcinoma: Correlation with Clinical Features and Prognosis[J]. J Oncol Res Ther, 2019, 1(1): 1-5. DOI: 10.17303/jcrto.2019.7.102.
[2] 袁洛花, 李文丽, 刘海兵, 等. miR-498过表达对鼻咽癌细胞增殖、侵袭、迁移和上皮间质转化的影响及其机制[J]. 山东医药, 2024, 64(01): 25-29.
YUAN L H, LI W L, LIU H B, et al. Effects of overexpression of miR-498 on proliferation, invasion, migration, and EMT of nasopharyngeal carcinoma cells[J]. Shandong Med J, 2024, 64(1): 25-29.
[3] SONG, J, LI, A, QIAN, Y, et al. Genetically pre-dicted circulating levels of cytokines and the risk of cancer[J]. Front Immunol, 2022, 13: 886144. DOI: 10.3389/fimmu.
2022.886144.
[4] LIU J F, CHEN P C, CHANG T M, et al. Monocyte Chemoattractant Protein-1 promotes cancer cell migration via c-Raf/MAPK/AP-1 pathway and MMP-9 production in osteosarcoma[J]. J Exp Clin Cancer Res, 2020, 39(1) : 254. DOI: 10.1186/s13046-020-01756-y.
[5] BURGESS B, LEVINE B, TAYLOR R N, et al. Preoperative circulating lymphocyte and monocyte counts correlate with patient outcomes in type I and type II endometrial cancer[J]. Reprod Sci, 2020, 27(1): 194-203. DOI: 10.1007/s43032-019-00009-4.
[6] YANG S, ZHAO K, DING X, et al. Prognostic significance of hematological markers for patients with nasopharyngeal carcinoma: a meta-analysis[J]. J Cancer, 2019, 10(11): 2568-2577. DOI: 10.7150/jca.26770.
[7] YAO J J, ZHU F T, DONG J, et al. Prognostic value of neutrophil-to-lymphocyte ratio in advanced nasopharyngeal carcinoma: a large institution-based cohort study from an endemic area[J]. BMC Cancer, 2019, 19(1): 37. DOI: 10.1186/s12885-018-5236-2.
[8] CHEN Y, JIANG W, XI D, et al. Development and validation of nomogram based on SIRI for predicting the clinical outcome in patients with nasopharyngeal carcinomas[J]. J Investig Med, 2019, 67(3): 691-698. DOI: 10.1136/jim-2018-000801.
[9] 吳平,杜仁佳,俞筠,等. 格拉斯哥预后评分在鼻咽癌预后评估中的作用[J].中华放射肿瘤学杂志, 2021, 30(12) : 1233-1237. DOI: 10.3760/cma.j.cn113030-20210510-00184.
WU P, DU R J, YU J, et al. The role of Glasgow prognostic score in prognostic evaluation of nasopharyngeal carcinoma[J]. Chin J Radiat Oncol, 2021, 30(12): 1233-1237. DOI: 10.3760/cma.j.cn113030-20210510-00184.
[10] OGAWA S, ITABASHI M, BAMBA Y, et al. Stage II colon cancer staging using the number of retrieved lymph nodes may be superior to current TNM staging for prognosis stratification: the Japanese study group for postoperative follow-up of colorectal cancer[J]. Int J Colorectal Dis, 2021, 36(10): 2205-2214. DOI: 10.1007/s00384-021-03990-y.
[11] GREINER M, PFEIFFER D, SMITH R D. Principles and practical application of the receiver-operating characteristic analysis for diagnostic tests[J]. Prev Vet Med, 2000, 45(1/2): 23-41. DOI: 10.1016/s0167-5877(00)00115-x.
[12] 丘文泽, 杨李, 江家丽, 等. 基于治疗前常规临床指标的鼻咽癌预后模型构建[J]. 广东医学, 2022, 43(6): 664-669. DOI: 10.13820/j.cnki.gdyx.20213159.
QIU W Z, YANG L, JIANG J L, et al. Preliminary study for building pretreatment prognostic model based on routine clinical indicators in nasopharyngeal carcinoma[J]. Guangdong Med J, 2022, 43(6): 664-669. DOI: 10.13820/j.cnki.gdyx.20213159.
[13] 胡婧晔, 易炜, 夏云飞, 等. 治疗前体重指数对鼻咽癌患者预后的影响[J]. 癌症, 2009, 28(10): 1043-1048.
HU J Y, YI W, XIA Y F, et al. Impact of pretherapy body mass index on prognosis of nasopharyngeal carcinoma[J]. Chin J Cancer, 2009, 28(10): 1043-1048.
[14] HONG J S, HUA Y J, SU L, et al. Modified-nutrition index is a significant prognostic factor for the overall survival of the nasopharyngeal carcinoma patients who undergo intensity-modulated radiotherapy[J]. Nutr Cancer, 2017, 69(7): 1011-1018. DOI: 10.1080/01635581.2017.1359311.
[15] 魏学燕, 韩光, 吴媛, 等. 局部晚期鼻咽癌患者营养状况及其与预后相关性分析[J]. 中国肿瘤临床, 2020, 47(6): 282-288. DOI: 10.3969/j.issn.1000-8179.2020.06.271.
WEI X Y, HAN G, WU Y, et al. Nutritional status and its relationship with prognosis in patients with locally advanced nasopharyngeal carcinoma[J]. Chin J Clin Oncol, 2020, 47(6): 282-288. DOI: 10.3969/j.issn.1000-8179.2020.06.271.
[16] 罗蓓蓓, 朱姝, 李姿霖, 等. 格拉斯哥预后评分对鼻咽癌放化疗患者预后判断的临床价值[J]. 实用医院临床杂志, 2023, 20(4): 162-166. DOI: 10.3969/j.issn.1672-6170.2023.
04.040.
LUO B B, ZHU S, LI Z L, et al. The clinical value of Glasgow Prognostic Score in predicting the clinical prognosis of patients with nasopharyngeal carcinoma undergoing radiotherapy and chemotherapy[J]. Pract J Clin Med, 2023, 20(4): 162-166. DOI: 10.3969/j.issn.1672-6170.2023.04.040.
[17] 施毓婷, 王凱, 赵江南, 等. C反应蛋白与白蛋白相关免疫营养参数在肺癌中的研究进展[J]. 国际呼吸杂志, 2022, 42(17): 1350-1355. DOI: 10.3760/cma.j.cn131368-20220623-00531.
SHI Y T, WANG K, ZHAO J N, et al. Research progress of C-reactive protein and albumin related immune-nutrition parameters in lung cancer[J]. Int J Respir, 2022, 42(17): 1350-1355. DOI: 10.3760/cma.j.cn131368-20220623-00531.
[18] SARRAF K M, BELCHER E, RAEVSKY E, et al. Neutrophil/lymphocyte ratio and its association with survival after complete resection in non-small cell lung cancer [J]. J Thorac Cardiovasc Surg, 2009, 137(2): 425-428. DOI: 10.1016/j.jtcvs.2008.05.046.
[19] TERAMUKAI S, KITANO T, KISHIDA Y, et al. Pretreatment neutrophil count as an independent prognostic factor in advanced non-small-cell lung cancer: an analysis of Japan Multinational Trial Organisation LC00-03[J]. Eur J Cancer, 2009, 45(11): 1950-1958. DOI: 10.1016/j.ejca.2009.01.023.
[20] 朱梦怡,汪天培,颜财旺,等. 血清C反应蛋白和遗传风险在恶性肿瘤发病中的联合作用[J]. 中华疾病控制杂志, 2021, 25(9): 1008-1013. DOI: 10.16462/j.cnki.zhjbkz.2021.
09.004.
ZHU M Y, WANG T P, YAN C W, et al. Joint effect of serum C-reactive protein and genetic risk in the pathogenesis of cancer[J]. Chin J Dis Contr Prev, 2021, 25(9): 1008-1013. DOI: 10.16462/j.cnki.zhjbkz.2021.09.004.
[21] ZHOU J W, MAO Y H, LIU Y, et al. A novel robust nomogram based on peripheral monocyte counts for predicting lymph node metastasis of prostate cancer[J]. Asian J Androl, 2021, 23(4): 409-414. DOI: 10.4103/aja.aja_89_20.
[22] LIN G N, PENG J W, XIAO J J, et al. Prognostic impact of circulating monocytes and lymphocyte-to-monocyte ratio on previously untreated metastatic non-small cell lung cancer patients receiving platinum-based doublet[J]. Med Oncol,2014,3197: 70. DOI: 10.1007/s12032-014-0070-0.
[23] GAO J, ZHANG H Y, XIA Y F. Increased platelet count is an indicator of metastasis in patients with nasopharyngeal carcinoma[J]. Tumor Biol, 2013, 34(1): 39-45. DOI: 10.1007/s13277-012-0508-y.
(责任编辑:杨江瑜)

