朱鹮源大肠埃希氏菌的耐药性及毒力基因与种系分型检测分析
吴滨滨,冯 航,刘 英,张域琪,丁敬茹,王 娟,杨增岐
(西北农林科技大学动物医学院/农业农村部反刍动物重大疫病防控重点实验室(西部)/动物高效新型疫苗教育部工程研究中心 ,陕西杨凌 712100)
朱鹮(Nipponianippon)曾被认为是“极度濒危”的野生鸟类,自2000年以来,在世界自然保护联盟(IUCN)濒危物种红色名录中被视为“濒危物种”,属于我国一级保护动物[1]。朱鹮的肠道微生物种群与其生长相关,尤其是幼鸟开始在自然界活动采食时[2]。朱鹮由于起初人工繁殖时数量极少,存在严重近亲繁殖的现象,出现雏鸟高致残率和严重的消化系统疾病问题,严重威胁着朱鹮种群数量的增长。其中大肠埃希氏菌(Escherichiacoli)是引起朱鹮肠道疾病中最重要的病原菌,主要引起以腹泻和败血症为主的疾病[3-4]。抗菌药物在维护朱鹮的健康和预防疾病方面发挥着不可或缺的作用,而耐药现象也随之出现。现有文献中已有对朱鹮大肠埃希氏菌耐药的报道,例如李佳悦等已发现存在有朱鹮源大肠埃希氏菌携带Incl2质粒介导的mcr-1耐药基因[5]。
大肠埃希氏菌能够在许多动物的肠道内定植,是一个很好的检测性指标,既是肠道共生菌又是条件性致病菌,可导致人和动物肠道的感染[6]。由于临床不合理用药,耐药机制日渐复杂,大肠埃希氏菌的多重耐药现象增多,治疗大肠埃希氏菌感染成为严重的临床问题,特别是随着高风险克隆的增加,如大肠埃希氏菌克隆型ST131[7-8]。细菌的耐药性与耐药基因的表达有关,耐药基因由整合子携带、质粒或转座子,通过转化、转导或融合可在不同种属之间转移,使得多重耐药现象增多[9]。大肠埃希氏菌的系统进化分群较复杂,且血清型较多,且大肠埃希氏菌可携带多种毒力基因,不同的毒力基因和血清型组合,大肠埃希氏菌的致病性也不同。目前,对经济动物大肠埃希氏菌耐药性研究较多,由于濒危物种的特殊性,对濒危物种的大肠埃希氏菌的耐药性等相关的研究文献较少。
本研究旨在通过对圈养朱鹮大肠埃希氏菌分离鉴定与耐药性检测,阐明朱鹮源大肠埃希氏菌的耐药现状,为朱鹮及野生动物由大肠埃希氏菌导致的疾病的合理用药、治疗及预防供科学依据,以减少耐药菌株的产生和耐药基因的传播,同时也为圈养朱鹮放飞提供参考依据。
1 材料与方法
1.1 材料
1.1.1 样品来源与试验用动物 2021年10月在陕西省周至县楼观台朱鹮饲养基地无菌采集朱鹮肛门拭子32份,冷藏保存送至西北农林科技大学动物医学院传染病实验室。8只20 g SPF级昆明系雌性小鼠,购自成都达硕实验动物有限公司。
1.1.2 主要试剂 普通营养琼脂、肉汤、麦康凯琼脂、伊红美蓝琼脂(EMB)、大肠埃希氏菌科生化鉴定管、甲基红指示剂、VP指示剂、吲哚指示剂,杭州天和微生物试剂有限公司产品;含有氨苄西林(AM)、头孢他啶(CTD)、头孢噻呋(CFT)、美罗培南(IPM)、庆大霉素(GM)、四环素(TE)、黏菌素(COL)、恩诺沙星(ENR)、替加环素(CAS)9种抗菌标准药品的耐药性监测板,天津金章科技发展有限公司产品。
1.1.3 主要仪器 恒温振荡器,常州国华电器有限公司产品;PCR仪(X50s),Eppendorf公司产品;电泳仪(DYCP-32B),北京六一生物科技有限公司产品;凝胶成像仪(GenoSens 2000),上海勤翔科学仪器有限公司产品。标准菌株E.coliATCC25922由中国兽医药品监察所惠赠。
1.2 方法
1.2.1 病原菌分离与鉴定 32份样品无菌接种于普通琼脂培养基,37 ℃温箱中培养24 h,挑取单菌落进行革兰氏染色并镜检,观察菌体形态。挑取单菌落接种于麦康凯培养基和伊红美蓝培养基观察菌落特征,并纯化培养,保菌备用。并进行生化试验,挑取单菌落于葡萄糖、乳糖、麦芽糖、鸟氨酸试验及细菌微量生化试验管内,37 ℃温箱内培养18 h。根据细菌DNA提取试剂盒,提取纯化菌株的DNA,参考文献合成16S rRNA(F:AGAGTTTGATCCTGGCTCAG,R:TACGGTTACCTTGTTACGACTT)引物,扩增目的基因,送至西安擎科生物公司测序。
1.2.2 药敏试验 通过微量肉汤稀释法,测定分离纯化的大肠埃希氏菌对氨苄西林、头孢他啶、头孢噻呋、美罗培南、庆大霉素、四环素、黏菌素、恩诺沙星、替加环素9种抗菌药物的最小抑菌浓度(MIC),将E.coliATCC25922作为质控菌株。观察96孔细菌培养板内大肠埃希氏菌生长情况,统计菌株对所选抗菌药物的MIC值,根据CLSI抗微生物药物敏感性试验判断标准判断试验菌株对所选抗菌药物耐药性。
1.2.3 大肠埃希氏菌系统进化分群 根据CLERMONT[10]等报道合成目的基因chuA、yjaA、TspE4.C2,根据其所提出的三重PCR判定大肠埃希氏菌的系统进化群。PCR反应体系为40 μL:dNTP Mix20 μL,ddH2O 8 μL,上、下游引物各1 μL,模板6 μL。上述引物均由西安擎科生物公司合成。判断标准:不出现条带或仅出现YjaA条带为A群;仅出现TspE4.C2为B1群;出现chuA、YjaA2种条带,或出现chuA、YjaA、TspE4.C2这3种条带的为B2群;仅出现chuA,或chuA和TspE4.C2的为D群。
1.2.4 耐药基因和毒力基因的检测 根据参考文献[11-13]选择以下大肠埃希氏菌的9种耐药基因和18种毒力基因作为检测对象。耐药基因:blaTEM、blaSHV、blaCTX-M、cfr、floR、phop、PmrB、tetx3、tetx4。毒力基因:saf、cnf1、hlyA、rfC、etrA、Tsh、aer、hlyE、hlyF、ompT、iutA、iutB、ompA、stx1、stx2、papC、FasA、fimC。PCR反应体系为20 μL:dNTP Mix10 μL,ddH2O 7 μL,上、下游引物各0.5 μL,模板2 μL。PCR产物经1%琼脂糖凝胶电泳成像,并进行测序鉴定。以上引物均由西安擎科生物公司合成,引物信息见表1。
表1 引物信息
1.2.5 小鼠致病性试验 结合试验1.2.3和1.2.4筛选出含有最多毒力基因谱的2株不同型的大肠埃希氏菌,进行小鼠致病性试验。将8只20 g昆明系雌性小鼠随机分2组,每组4只,每组分为2只试验组,2只对照组。0.2 mL/只(菌液浓度1.7×109CFU/mL )剂量腹腔注射菌液,对照组腹腔注射等量生理盐水,观察并记录小鼠状态。
2 结果
2.1 大肠埃希氏菌的分离鉴定
经鉴定从32份朱鹮样品中分离出15株大肠埃希氏菌,该批朱鹮源大肠埃希氏菌的分离率为46.87%。在麦康凯琼脂培养基上大肠埃希氏菌形成粉色湿润且边缘光滑整齐的圆形菌落;在伊红美蓝培养基上形成黑蓝色带有金属闪光的菌落。16S rRNA测序的序列在NCBI中进行Blast比对,与大肠埃希氏菌的相似性均>97%。该15株分离菌对葡萄糖、麦芽糖、乳糖发酵;鸟氨酸试验、山梨醇试验、靛基质试验、甲基红试验均为阳性;硫化氢试验、枸橼酸盐试验、乙酰甲基甲醇试验均为阴性;与《伯杰氏细菌鉴定手册》中大肠埃希氏菌的生化特性的结果吻合。
2.2 药敏试验结果
15株朱鹮源大肠埃希氏菌对9种临床常用抗菌药物的耐药情况见表2。由表2可知,分离菌株对除对多黏菌素B完全不耐药以外,对其他8种抗菌药物均具有不同程度的耐药性。其中对氨苄西林耐药率达100%,对多西环素和恩诺沙星耐药率较高;其次,对头孢噻夫、头孢他啶、庆大霉素等也有耐药性;对美罗培南、替加环素、黏菌素敏感。

表2 朱鹮源大肠埃希氏菌对9种药的药敏试验结果
2.3 大肠埃希氏菌系统进化分群
根据大肠埃希氏菌系统进化分群的鉴定方法,PCR检测chuA、yiaA、TspE4.C2在朱鹮源大肠埃希氏菌中的分布情况,确定菌株的系统进化分群。结果显示,该批朱鹮源大肠埃希氏菌以B2型为主(占53.33%),其次为D型(占33.34%),A型仅占比13.33%,且未检测到B1型(表3)。

表3 朱鹮源大肠埃希氏菌系统进化分群检测
2.4 耐药基因和毒力基因检测结果
15株朱鹮源大肠埃希氏菌耐药基因结果显示,blaSHV、FloR、EmgrB、blaTEM耐药基因占比较高,分别为100%、100%、93.33%和93.3%;phop、tetx3占比较高(66.67%、53.33%);blaCTX-M占比为33.33%;该批朱鹮源大肠埃希氏菌尚未检测到cfr、tetx4。
毒力基因结果显示,15株朱鹮源大肠埃希氏菌被检18种毒力基因中检测出10种,其中etrA、aer、hlyE、ompA的检出率最高,均达到93.33%,其他依次为iutA(80%)、fimC(73.33%)、rfc(60%)、ompT(53.33%)、hlyF(46.67%)、Tsh(20%);检测的大肠埃希氏菌均携带多种毒力基因,26.67%的菌株携带3~5种毒力基因,60%的菌株携带6~9种毒力基因,其中有2株大肠埃希氏菌携带10种毒力基因(图1)。
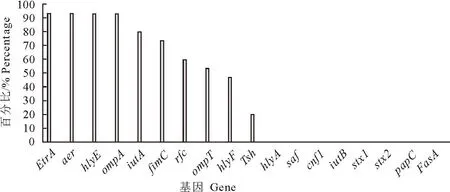
图1 朱鹮源大肠埃希氏菌毒力基因检测结果
2.5 小鼠致病性试验结果
含有最多毒力基因谱的2株不同型(B2群、D群)大肠埃希氏菌分离菌株接种小白鼠后,试验组小鼠被毛光滑,刚接种后,精神不振后恢复正常,粪便稀软;剖检无明显眼观病变;对照组小鼠无任何异常。
3 讨论
本研究调查了陕西省周至县朱鹮源大肠埃希氏菌的耐药情况。从32份朱鹮源样品中分离出15株大肠埃希氏菌,分离率达46.87%,说明大肠埃希氏菌在陕西省周至县中具有一定程度的流行。药敏试验结果表明,分离菌株全部为耐药菌株,耐药率为100%。该批朱鹮为圈养方式饲养保护,在与人类环境接触时,可能会获得携带多种耐药的共生微生物群,多重耐药占比达86.67%。该试验中分离出的大肠埃希氏菌株对氨苄西林及多西环素的耐药率较高,与邵志勇、吕玉金等从禽类分离出的大肠埃希氏菌对氨苄西林及多西环素的耐药率的分析基本一致[14-15]。近年来,抗菌药物在经济动物上用药有一定的限制,由于朱鹮作为我国一级保护野生动物的特殊性和保护濒危动物的需要以及该批朱鹮为圈养方式饲养,人用药物仍在朱鹮的疾病防治中使用,在增加朱鹮抗菌药物使用的选择性的同时,也增加了耐药性传播的风险,头孢他啶主要作为人用药,该批朱鹮表现出对头孢噻夫(耐药率为53.33%)和头孢他啶(46.67%)耐药,耐药率相比于其他禽类较高[16-18]。有研究发现头孢噻夫和头孢他啶等广谱类抗菌药物存在交叉耐药性[19]。虽然圈养饲养方式可以有效增加朱鹮种群的数量,但最终保护濒危物种的有效方法是将其放飞至野外。圈养朱鹮放飞至自然保护湿地,其携带的耐药基因会传播给野生朱鹮和其他野生种群,增加野生物种耐药风险,同时也可通过生物链传递给人;并且携带耐药基因的大肠埃希氏菌可通过转移结合等方式传递给其他细菌,也有可能增加其他菌的耐药性,故对该地区朱鹮科学合理地使用抗菌药物迫在眉睫。但该试验具有一定的局限性,该试验只调查该地区圈养朱鹮大肠埃希氏菌耐药情况,不能代表中国其他地区以及湿地野生型朱鹮耐药流行情况。
根据耐药基因检测结果,该批朱鹮源大肠埃希氏菌携带β-内酰胺类的耐药基因的检出率与其耐药表型检出率基本一致,blaTEM、blaSHV、blaC的耐药基因的检出率分别为100%、93.3%和33.3%。氨基糖苷类和替加环素的耐药基因的检出率低于其耐药表型的检出率,这可能存在其他耐药机制,如细胞膜通透性的改变等。
大肠埃希氏菌系统进化分群显示,该批朱鹮的B2群大肠埃希氏菌的检出率最高(53.33%),其次为D群(33.34%)。B2群的共生大肠埃希氏菌具有较高遗传的多样性。与其他经济动物相比,例如,羊源大肠埃希氏菌主要为A群、B1群,B2群的大肠埃希氏菌在工业化国家人类共生大肠埃希氏菌菌株中较多,但有学者从野猪肠道共生菌分离得到菌株也主要为B2群大肠埃希氏菌,然而其分离得到的菌株耐药性较低,上述现象可能与其饮食、环境等因素有关[20-21]。
本研究对15株朱鹮源大肠埃希氏菌进行毒力基因检测,结果显示在18种毒力基因中共检测到10种,总检出率高达100%,表明携带毒力因子的大肠埃希氏菌在该批朱鹮中传播和流行。其中etrA、aer、hlyE、ompA的检出率最高,均达到93.33%。etrA与大肠埃希氏菌的增植及毒力因子的调节有关;aer与菌体的黏附定制有关;hlyE具有溶血性,且检测到7株携带hlyF的毒力基因,hlyF的表达可增强细菌外膜囊泡(OMVs)的产生,在宿主感染肠道外致病性大肠埃希氏菌期间表达[22]。值得注意的是,在该批朱鹮源大肠埃希氏菌中检测出9株携带有rfc毒力基因,rfc主要影响脂多糖的合成,与O4型大肠埃希氏菌相关[23]。
该批朱鹮源大肠埃希氏菌虽然携带多种毒力基因,系统进化分群B2群和D群占主要部分,但该批朱鹮并未出现明显的临床症状,对携带毒力基因最多(10种)的B2群和D群2株菌株小鼠致病性试验,试验组小鼠临床症状表现较轻微。Schierack P等[24]和Fu Q等[25]提出,致病性菌株和共生菌株之间的基因分布无明显的差异,大量携带毒力基因或者具有溶血性的大肠埃希氏菌也不一定引起临床症状。
综上所述,本研究对分离的15株朱鹮源大肠埃希氏菌进行了药敏试验、三重PCR、毒力基因和耐药基因鉴定、小鼠致病性试验,该批朱鹮源大肠埃希氏菌耐药现象较为严重,毒力基因、耐药基因在该批朱鹮中较流行,与其他动物相比,其种系分型较特殊。本研究可为朱鹮源大肠杆菌病的防控、治疗及圈养朱鹮的放飞提供参考依据。

