辣椒叶α-葡萄糖苷酶抑制剂的提取及稳定性研究
李春英 叶春杰 李妍妍 李瑜 申晓晔 吴哲熊

摘 要:辣椒叶中含有在小肠中延缓糖分分解吸收的α-葡萄糖苷酶抑制剂,以辣椒叶粉为原料,乙醇为提取溶剂,在单因素(液料比、乙醇体积分数、提取温度和提取时间)试验的基础上设计响应面试验,优化提取α-葡萄糖苷酶抑制剂的工艺,并探索α-葡萄糖苷酶抑制剂在提取后真空浓缩过程中的温度、食品加工过程中的温度、强酸条件下的稳定性。结果表明,辣椒叶中α-葡萄糖苷酶抑制剂的最佳提取条件为:液料比10∶1、乙醇体积分数35%、提取温度26 ℃、提取时间5 h;提取液在真空浓缩过程中温度控制在50 ℃以下相对稳定,而在加工特性研究中发现,α-葡萄糖苷酶抑制剂对高温比较敏感,而在pH 2.0~6.0范围内稳定性良好。研究结果可为辣椒叶资源的高值化开发利用提供理论依据。
关键词:α-葡萄糖苷酶抑制剂;提取;响应面法;稳定性;辣椒叶
中图分类号:S641.3 文献标志码:A 文章编号:1673-2871(2024)05-071-10
Study on the extraction and stability of α-glucosidase inhibitory components from pepper (Capsicum annuum L.)leaves
LI Chunying1, 2, 3, YE Chunjie1, LI Yanyan1, LI Yu1, 3, SHEN Xiaoye1,3, WU Zhexiong4
(1. College of Food Science and Technology, Henan Agricultural University, Zhengzhou 450002, Henan, China; 2. Key Laboratory of Bulk Grain Processing Ministry of Agriculture and Rural Affairs, Zhengzhou 450002, Henan, China; 3. Zhengzhou Key Laboratory of Vegetable Processing, Storage and Safety Control, Zhengzhou 450002, Henan, China; 4. Jiangxi Green Collar Agricultural Technology Co,. LTD, Leping 333300, Jiangxi, China)
Abstract: Pepper leaves contain α- glucosidase inhibitor that delays sugar breakdown and absorption in small intestine. The ethanol was used to extract α- glucosidase inhibitory components in pepper leaf powder and optimized the extraction process was optimized by changing liquid to material ratio, ethanol volume fraction, extraction temperature and extraction time in this study. The stability of α- glucosidase inhibitory components were further investigated with different temperature during vacuum concentration process and different temperature and acidified conditions during food processing. The results showed the optimized extraction condition for α- glucosidase inhibitory components in pepper leaf powder were liquid to material ratio of 10∶1, ethanol volume fraction of 35%, extraction temperature of 26 ℃, and extraction time of 5 h. The α- glucosidase inhibitory components were relatively stable during vacuum concentration process at 50 ℃. The food processing analysis showed α- glucosidase inhibitory components were sensitive to high temperature but were stable during pH 2.0-6.0, collectively, the results provide scientific data for high value application of pepper leaves.
Key words: α-glucosidase inhibitor; Extraction; Response surface method; Stability; Pepper leaves
根據国际糖尿病联盟组织发布的最新信息显示,截至2021年,全球约有5.37亿成年人患有糖尿病,在2021年,糖尿病导致670万人死亡,预计到2030年,患者人数将上升至6.43亿,到2045年将上升至7.83亿[1],其中90%的糖尿病患者是2型糖尿病,表现为体内胰岛素水平相对较低[2]。α-葡萄糖苷酶抑制剂(alpha-glucosidase inhibitor, AGI)作为糖尿病治疗的口服药物,通过抑制肠道中α-葡萄糖苷酶(alpha-glucosidase, AG)的活性,延缓食物中多糖在小肠中的消化和吸收,从而有效降低餐后血糖水平,改善多种糖尿病并发症。目前市售的治疗糖尿病的AGI有米格列醇(miglitol)、阿卡波糖(acarbose)、伏格列波糖(voglibose)等,均通过微生物获得,在人体内普遍存在对糖类物质不完全分解而导致对胃肠道的刺激和细胞耐药性增强等问题,因此从天然产物中探索安全、有效、新颖的AGI已成为预防和治疗糖尿病的研究热点[3]。
我国辣椒年产量稳居世界第一[4],种植范围覆盖全国28个省(區、市),产业规模持续扩大,辣椒叶资源丰富、成本低。辣椒叶中含有丰富的营养物质,如膳食纤维、维生素C以及钙、钾、镁、铁等矿物质(本实验室内部数据),同时还含有多种多酚、黄酮类化合物,其中,多酚类化合物主要包括儿茶素、花青素、类黄酮等,而黄酮类化合物则包括槲皮素、山奈酚、异鼠李素及其衍生物(本实验室内部数据),赋予辣椒叶抗氧化[5-7]、抗炎[8]、抗菌[9]、抗肿瘤[10-11]、降血糖[12]等多种功效,是预防慢性疾病、增强免疫力、改善身体健康的良好资源。然而,到目前为止,辣椒商品化仍然以果实为主,而果实采收后,辣椒叶连同枝干被视为农业垃圾被丢弃,造成了资源浪费[13]。国内外关于辣椒叶药理功效方面的研究论文相对有限,严重阻碍了辣椒副产物资源的利用。为了有效开发应用辣椒叶资源,张友仁[10]对辣椒叶的生物活性进行研究,指出辣椒叶多酚具有抗氧化、抗炎、抑菌活性,其纯化物清除ABTS+自由基、DPPH自由基和铁还原能力的IC50与维生素C浓度处于同一数量级,可作为有效的天然抗氧化剂,并在二甲苯所致小鼠耳肿胀试验中抗炎症效果显著,安全性较高,值得开发和利用。笔者的研究团队发现,辣椒叶水提液具有抑制α-葡萄糖苷酶活性,并通过caco-2细胞试验和动物试验证实了其降血糖功效[12,14],同时还发现辣椒叶乙醇萃取液中的α-葡萄糖苷酶抑制活性显著高于水萃取液,其活性成分对α-葡萄糖苷酶的抑制能力有别于水提取液,并通过薄层层析证实其活性物质不同(实验结果未发表)。
笔者旨在通过对辣椒叶α-葡萄糖苷酶抑制剂的提取工艺及其稳定性进行研究,获得辣椒叶α-葡萄糖苷酶抑制剂的有效提取参数,阐明其食品加工特性,为辣椒叶高值化利用提供试验基础和理论指导的同时,有望为糖尿病辅助治疗提供新的资源和方法。
1 材料与方法
1.1 材料
试验于2023年8-11月在河南农业大学食品科学技术学院实验室进行。试验原料为大连养生之家生物科技有限公司提供的从韩国引进的功能性辣椒品种的叶粉,系大棚种植的成熟辣椒叶采收后经-60 ℃速冻、冷冻干燥、粉碎制得。公司提供的辣椒叶粉,在实验室将原料粉进行过筛(80目),装入自封袋后抽气,放于-18 ℃保存。
1.2 方法
1.2.1 α-葡萄糖苷酶抑制活性的测定 参考杨彦[14]的方法测定α-葡萄糖苷酶抑制活性。反应液利用酶标仪在405 nm下测定其吸光值,并按照下列公式计算AGI抑制活性。
AGI抑制活性/%=[1-(SR-SB)/(CR-CB)]×100。
式中:SR为样品反应组所测得的吸光值;SB为样品空白组所测得的吸光值;CR为对照反应组所测得的吸光值;CB为对照空白组所测得的吸光值。
1.2.2 辣椒叶中AGI活性物质提取的单因素试验 (1)不同料液比对辣椒叶AGI活性物质提取的影响:称取1.00 g辣椒叶粉于50 mL离心管中,分别在液料比为5∶1、10∶1、20∶1、30∶1、40∶1(mL∶g)的条件下,加入体积分数为40%的乙醇溶液,在30 ℃条件下提取4 h,每隔20 min振荡1次,使物料与提取溶剂混合均匀,过滤,上清液定容至100 mL,研究不同液料比对辣椒叶AGI活性物质的提取效果。试验3次重复,AGI活性物质的提取效果用AGI活性(%)来表示。
(2)不同乙醇浓度对辣椒叶AGI活性物质提取的影响:称取1.00 g辣椒叶粉于50 mL离心管中,固定液料比为10 mL∶1 g,分别加入体积分数为0、20、40、60、80、100%的乙醇溶液,在30 ℃条件下提取4 h,每隔20 min振荡1次,使物料与提取溶剂混合均匀,过滤,上清液定容至100 mL,研究不同乙醇体积分数对辣椒叶AGI活性物质的提取效果。试验3次重复。
(3)不同提取温度对辣椒叶AGI活性物质提取的影响:称取1.00 g辣椒叶粉于50 mL离心管中,固定液料比为10 mL∶1 g,加入体积分数为40%的乙醇溶液,分别在20、30、40、50、60、70 ℃条件下提取4 h,每隔20 min振荡1次,使物料与提取溶剂混合均匀,过滤,上清液定容至100 mL,研究不同提取温度对辣椒叶AGI活性物质的提取效果。试验3次重复。
(4)不同提取时间对辣椒叶AGI活性物质提取的影响:称取1.00 g辣椒叶粉于50 mL离心管中,固定液料比为10 mL∶1 g,加入体积分数为40%的乙醇溶液,在40 ℃条件下分别提取1、2、4、6、8 h,每隔20 min振荡1次,使物料与提取溶剂混合均匀,过滤,上清液定容至100 mL,研究不同提取时间对辣椒叶AGI活性物质的提取效果。试验设3次重复。
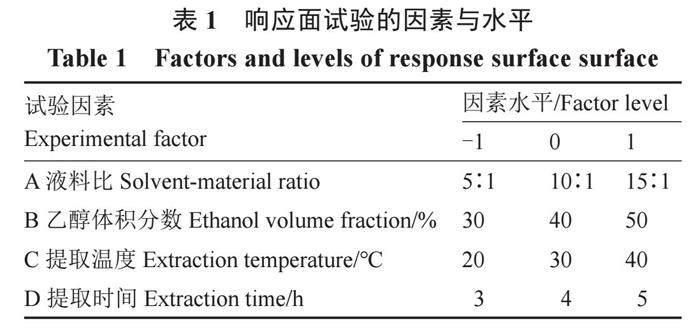
1.2.3 响应面试验 以AGI活性作为响应值,在单因素试验结果的基础上选取对AGI活性影响显著的因素,设计响应面试验优化工艺参数,因素与水平的设置见表1。
表1 响应面试验的因素与水平
Table 1 Factors and levels of response surface surface
[试验因素
Experimental factor
因素水平/Factor level -1 0 1 A 液料比Solvent-material ratio 5∶1 10∶1 15∶1 B乙醇体积分数Ethanol volume fraction/% 30 40 50 C 提取温度Extraction temperature/℃ 20 30 40 D 提取时间Extraction time/h 3 4 5 ]
1.2.4 辣椒叶中AGI活性物质的稳定性 (1)温度对AGI活性物质稳定性的影响:取25个100 mL锥形瓶,加AGI提取液50 mL,封口后分别置于20、40、60、80、100 ℃的条件下避光放置100 min,每隔20 min取样,迅速冷却,转移至50 mL容量瓶并定容至刻度,测定AGI活性。
(2)酸度对AGI活性物质稳定性的影响:取3份AGI提取液80 mL于100 mL锥形瓶中,用盐酸分别调节pH至2、4、6,然后转移至100 mL容量瓶并定容至刻度,室温避光放置100 min,每隔20 min各取10 mL,用氢氧化钠调节pH 7.0后定容至25 mL,分别测定AGI活性。
(3)真空浓缩过程中温度对AGI活性物质稳定性的影响:取AGI提取液25 mL于100 mL旋蒸瓶内,分别在30、40、50 ℃下真空浓缩10、20、30、40 min,取出定容至25 mL,测定AGI活性。
1.3 数据处理与分析
采用Excel 2021整理数据,采用Origin 22.0、Design Expert 8.0、IBM SPSS Statistics 26.0作图及进行差异显著性分析。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 液料比对AGI提取液抑制活性的影响 液料比对辣椒叶AGI提取液中AGI活性的影响如图1所示。随着提取溶剂体积增加,AGI活性呈先升高后降低的变化趋势。适当的液料比有利于细胞破碎和胞内物质的释放[15],当液料比为10∶1时,AGI提取液的活性达到最大值,当AGI活性物质的溶出达到平衡状态时,溶出量不再增加。继续增大提取溶剂体积会使溶剂分子与AGI分子运动提前达到平衡,也会削弱传质效率[16],最终使提取液中的AGI活性物质含量减少,而导致AGI活性降低。提高液料比会浪费溶剂,增加成本,经单因素方差分析,确定最佳提取液料比为10∶1。
2.1.2 乙醇体积分数对AGI提取液抑制活性的影响 辣椒叶AGI活性物质的提取溶剂乙醇体积分数对AGI抑制活性的影响如图2所示。随着乙醇体积分数的增加,辣椒叶AGI提取液中AGI活性呈先升高后降低的变化趋势,适当体积分数的乙醇溶液有利于AGI从细胞内渗出,当乙醇体积分数为40%时,AGI活性最高,说明辣椒叶中AGI活性物质的渗出量最大。继续增大乙醇体积分数,AGI抑制活性降低,当乙醇体积分数为100%(无水乙醇)时,AGI活性几乎为零。若提取过程中乙醇体积分数过高,大量的醇溶性物质(如黄酮苷元)及脂溶性雜质(如叶绿素)溶出量增大,从而降低组织渗透性,阻碍AGI活性物质的溶出[17-19]。经单因素方差分析,确定提取辣椒叶中AGI活性物质的最佳乙醇体积分数为40%。
2.1.3 提取温度对AGI提取液抑制活性的影响 辣椒叶AGI活性物质的提取温度对AGI活性的影响如图3所示。当温度为20~70 ℃时,随着提取温度的升高,辣椒叶AGI活性呈先升高后降低的变化趋势。当提取温度为30 ℃时,AGI活性达到最高值,之后随着温度的升高,AGI活性降低。在一定温度范围内,随着温度升高辣椒叶中AGI活性物质分子运动逐渐加剧,使得溶出量增加,AGI活性增高,但当温度过高时,抑制活性显著降低,这说明辣椒叶中α-葡萄苷酶抑制剂对温度比较敏感,较高的温度可能破坏了活性成分的结构,使抑制活性降低。经单因素方差分析,确定提取辣椒叶中AGI活性物质的最佳温度为30 ℃。
2.1.4 提取时间对AGI提取液抑制活性的影响 辣椒叶AGI活性物质的提取时间对AGI活性的影响如图4所示。当提取时间为1~8 h时,随着提取时间的延长,辣椒叶AGI活性显著升高,当提取4 h时,AGI活性达到最高值,继续延长提取时间,AGI活性整体趋于稳定且呈稍微下降的趋势。在一定时间范围内,随着提取时间的延长,辣椒叶中AGI活性物质的溶出量增加,AGI活性增高。在4 h的时候AGI活性物质已经基本被提取完全,再增加提取时间,提取效果没有大的改善,提取时间越长,会降低溶剂对细胞壁的渗透性,部分活性成分会在较长的提取时间内发生改变或降解,导致活性反而有所下降[16]。因此,结合实验结果,同时考虑经济效益,确定最适的提取时间为4 h。
2.2 响应面试验结果
2.2.1 辣椒叶提取液中AGI活性回归模型的建立与分析 以辣椒叶提取液中AGI活性为响应值,通过单因素试验选取对提取效果影响显著的4个因素(液料比、乙醇体积分数、提取温度、提取时间),设计4因素3水平响应面试验,通过Box-Behnken共设29个试验点,试验结果见表2。
使用Design-Expert.V8.0.6分析软件,以液料比(A)、乙醇体积分数(B)、提取温度(C)和提取时间(D)为自变量,AGI活性为因变量,通过响应面分析、二次多项拟合,得到预测模型如下:
Y(AGI活性)=-163.862+8.572 89 A+2.518 72 B+3.275 71 C+23.944 82 D-0.036 18 AB-0.010 29 AC-0.755 45 AD+0.017 135 BC-0.096 45 BD-0.085 675 CD-0.180 75 A2-0.032 339 B2-0.064 373 C2-1.141 63 D2。
回归模型方差分析结果见表3。回归模型的F值为49.99>1,p<0.000 1,说明辣椒叶中提取AGI活性物质的回归模型极显著,失拟项p值为0.690 9>0.05(不显著)。一次项A、B、C,二次项A2、B2、C2和交互相AB、AD、BC的p值<0.01,均表现出极显著影响,一次项D、二次项D2的p值<0.05,表现出显著影响。
根据p值和F值大小,因素对AGI活性物质的提取影响大小依次为C(提取温度)>B(乙醇体积分数)>A(液料比)>D(提取时间)。模型的决定系数达到0.980 4,矫正拟合度值和预测拟合度值分别为0.960 8和0.916 3,两值相近且其差值为0.044 5<0.2,说明回归方程具有很好的可信度,模型的变异系数为8.94%<10%,表明精密度较好。综上所述,回归模型的结果与实际的试验结果拟合程度良好。建立的回归方程可用于提取辣椒叶中AGI活性物质的分析及预测。
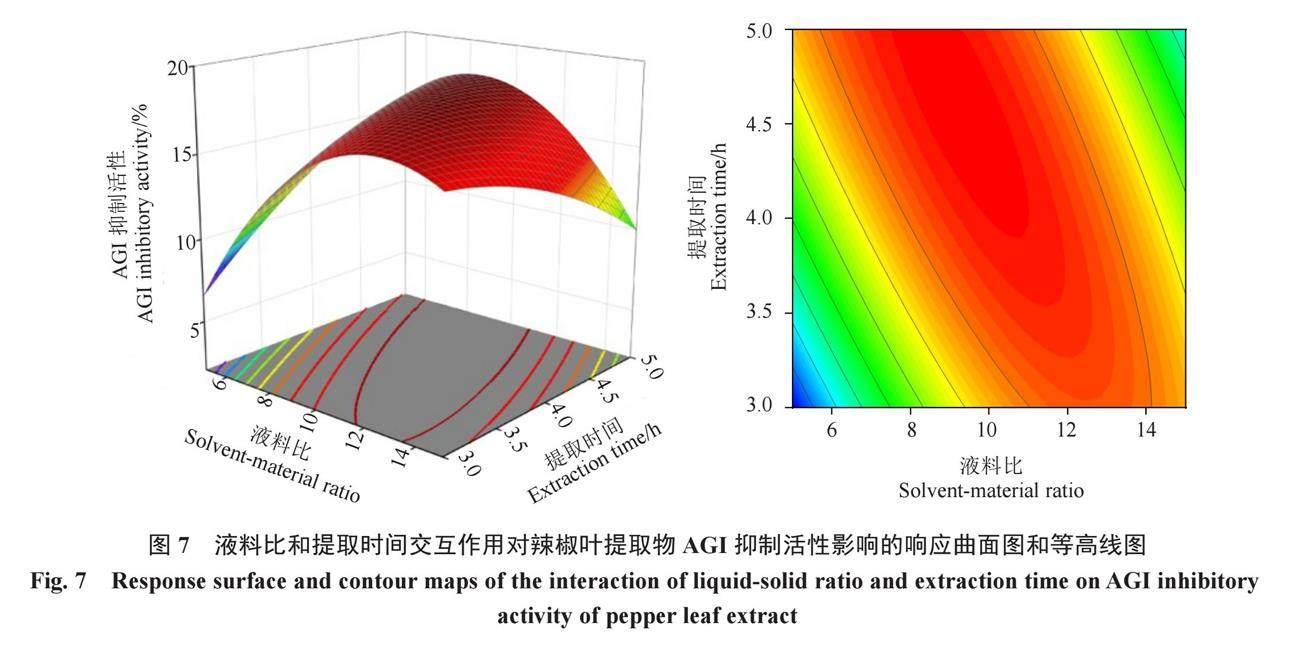
2.2.2 响应面分析 交互作用项可以直观地反映两个因素对AGI活性的影响,并且确定最佳提取条件范围。为考察各因素交互作用对辣椒叶AGI活性大小的影响,利用Design-Expert 8.0.6软件分析液料比(A)、乙醇体积分数(B)、提取温度(C)、提取时间(D)之间交互作用的三维响应曲面图和等高线图(图5、图6、图7、图8、图9、图10)。
等高线的形状反映交互效应的强弱,圆形表示两因素交互作用不显著,而椭圆形则表示两因素交互作用显著[20]。由图5、图7、图8可知,液料比与乙醇体积分数(AB)、液料比与提取时间(AD)、乙醇体积分数与提取温度(BC)的等高线呈现明显的椭圆形,等高线分布密集,说明各因素之间的交互作用对响应值(AGI活性)的影响显著,与表3分析结果一致,对AGI活性影响最大的是液料比与提取时间的交互作用,其次是液料比和乙醇体积分数,最后是乙醇体积分数与提取温度的交互作用,而其余因素之间的交互作用对响应值的影响不显著。
2.2.3 最佳提取工艺参数的验证 由Design-Expert8.0.6软件分析可知,提取辣椒叶中AGI活性物质的最优工艺参数为液料比9.21∶1、乙醇体积分数33.17%、提取温度25.8 ℃、提取时间5 h,通过响应面分析得到的辣椒叶AGI提取量(AGI活性)的预测值为19.90%。结合实际试验条件,将最佳工艺条件修改为液料比10∶1、乙醇体积分数为35%、提取温度为26 ℃、提取时间为5 h。通过3次平行试验验证,实际测得平均AGI活性为(19.47±0.47)%,与模型理论值接近,说明响应面模型预测的准确性良好,证明该工艺条件稳定、可靠,应用响应面优化条件来提高辣椒叶AGI活性物质提取量的方法可行,同时也说明建立的回归模型合理。
2.3 辣椒叶中AGI活性物质的稳定性
2.3.1 真空浓缩过程中温度对辣椒叶AGI活性的影响 虽然辣椒叶中AGI成分具有降血糖功效,但真空浓缩的温度限制了辣椒叶AGI的制备。真空浓缩过程中温度对AGI活性的影响如图11所示,真空浓缩辣椒叶提取物40 min时,在30~40 ℃范围内,随着温度的升高,AGI活性沒有显著性差异。当温度为50 ℃时,随着真空浓缩时间的延长,AGI活性呈缓慢下降的趋势,真空浓缩40 min时活性下降8.76个百分点。由此可见,辣椒叶中AGI活性物质的提取浓缩过程中短时间内可采用40 ℃左右的温度,但随着温度的升高和时间的延长,AGI活性物质可能会发生分解。
2.3.2 温度对辣椒叶中AGI活性物质稳定性的影响 辣椒叶中AGI活性物质的氧化稳定性会限制其作为食品添加剂或直接应用于食品中增强其保健作用。加热温度对AGI活性物质稳定性的影响如图12所示。温度对辣椒叶中AGI活性物质稳定性的影响较大,经过80 min的加热处理,60~100 ℃范围内AGI活性显著降低,在20~40 ℃范围内AGI活性保持稳定。加热时间为40 min时,20~80 ℃范围内AGI活性相对较稳定,继续延长加热时间,60~80 ℃范围内AGI活性相对缓慢下降,而加热温度为100 ℃时,AGI活性呈直线式下降,直到80 min时,活性下降16.59个百分点。其原因可能是温度过高导致黄酮类物质分解,且随着温度的升高,分解速度加快[21]。由此可见,辣椒叶AGI活性物质在保存过程中应采用低温条件,在食品加工过程中当温度过高时,应加入一定的保护剂,并且加热时间不宜过长。
2.3.3 酸处理对辣椒叶α-葡萄糖苷酶抑制剂活性稳定性的影响 酸度对AGI活性物质稳定性的影响如图13所示,辣椒叶提取液在pH 2.0~6.0的酸性条件下处理100 min,AGI活性表现出无显著性差异。pH值过高或过低均会影响黄酮类物质的稳定性,洛神花总黄酮在pH为3.0~6.0条件下稳定性最好[22],而辣椒叶中AGI活性物质在pH为2.0~6.0条件下稳定性最好。由此可见,辣椒叶AGI活性物质在加工、存放和作为食品添加剂加入酸性饮料中可以稳定存在,即辣椒叶AGI活性物质可以添加到果蔬汁酸性饮料中。
3 讨论与结论
用于治疗糖尿病患者的口服降糖药存在一定的副作用,而植物提取物中多种多酚、多糖、黄酮类化合物具有抑制α-葡萄糖苷酶的作用,且安全性高、作用过程相对温和,因此从植物中提取α-葡萄糖苷酶抑制剂受到强烈的关注[23]。研究表明,紫苏叶中含有多糖、黄酮等活性成分,不仅对麦芽糖酶和蔗糖酶有抑制作用,对不同来源的α-葡萄糖苷酶也具有抑制作用[24-25],同样作为蔬菜的辣椒叶,其水提取物对猪胰肠来源、酵母来源和大米来源的α-葡萄糖苷酶均有抑制作用,但目前对辣椒叶中α-葡萄糖苷酶抑制剂的提取条件优化是采用热水浸泡的方式[14],而一定浓度的辣椒叶乙醇提取物与以多糖为主的水提取物存在差别,且后续研究可对辣椒叶乙醇粗提取物进行进一步的分离、纯化,以明确辣椒叶中主要的α-葡萄糖苷酶抑制剂。
笔者以辣椒叶粉为原料,以α-葡萄糖苷酶抑制率为导向,在单因素试验基础上,通过响应面试验优化得到辣椒叶中AGI活性物质最佳提取条件为:提取温度26 ℃、乙醇体积分数35%、液料比10∶1、提取时间5 h。在此条件下,辣椒叶AGI提取液的活性为(19.47±0.47)%,与预测值接近。AGI活性物质的稳定性研究结果表明,高温对辣椒叶AGI活性物质有一定影响,随着温度的升高和高温时间的延长,AGI活性显著下降。AGI活性在真空状态下浓缩时温度低于50 ℃时相对较稳定,在pH 2.0~6.0范围内非常稳定。对辣椒叶中α-葡萄糖苷酶抑制剂提取工艺条件进行优化及提取物稳定性研究,可为辣椒叶α-葡萄糖苷酶抑制剂的提取和进一步加工提供一定的理论基础。
参考文献
[1] 国际糖尿病联合会.2021IDF全球糖尿病地图[N].10版.医师报,2021-12-09(B03).
[2] 姚怀韬.糖尿病患者胰岛素治疗的新进展[J].安徽医专学报,2022,21(2):54-56.
[3] LIU D M,CHEN J,SHI Y P.Screening of enzyme inhibitors from traditional Chinese medicine by magnetic immobilized a-glucosidase coupled with capillary electrophoresis[J].Talanta,2017,164:548-555.
[4] 张子峰.我国辣椒产业发展现状、主要挑战与应对之策[J].北方园艺,2023(14):153-158.
[5] JIANG Z G,WANG Y H,XIANG D,et al.Structural properties, antioxidant and hypoglycemic activities of polysaccharides purified from pepper leaves by high-speed counter-current chromatography[J].Journal of Functional Foods,2022,89:104916.
[6] AVILES-BETANZOS K A,ONEY-MONTALVO J E,CAUICH-RODRIGUEZ J Y,et al.Antioxidant capacity, vitamin C and polyphenol profile evaluation of a Capsicum chinense by-product extract obtained by ultrasound using eutectic solvent[J].Plants-Basel,2022,11(15):2060.
[7] 常方照,程宣,李倩,等.辣椒叶多糖抗氧化作用研究[J].现代生物医学进展,2019,19(11):2019-2024.
[8] LIU Y,MENG X,WANG H,et al.Inositol derivatives with anti-inflammatory activity from leaves of Solanum capsicoides allioni[J].Molecules,2022,27(18):6063.
[9] NONGMAI C,KANOKMEDHAKUL K,PROMGOOL T,et al.Chemical constituents and antibacterial activity from the stems and leaves of Piper wallichii[J].Journal of Asian Natural Products Research,2022,24(4):344-352.
[10] 张友仁.辣椒叶多酚生物活性检测[D].北京:北京中医药大学,2013.
[11] CHEL-GUERRERO L D,SCAMPICCHIO M,FERRENTION G,et al.In vitro assessment of antiproliferative activity and cytotoxicity modulation of Capsicum chinense by-product extracts[J].Applied Sciences,2022,12(12):5818.
[12] 李春英,杨彦,李赫,等.辣椒叶提取物对α-葡萄糖苷酶的抑制活性[J].浙江大学学报(农业与生命科学版),2013,39(2):173-177.
[13] 宋燕春,张伦德,宋华,等.辣椒叶价值浅析[J].四川农业与农机,2023(3):51-52.
[14] 杨彦.辣椒叶提取物的降血糖活性研究[D].杭州:浙江大学,2015.
[15] WU E Y,SUN W J,WANG Y,et al.Optimization of ultrasonic-assisted extraction of total flavonoids from Abrus cantoniensis (Abriherba) by response surface methodology and evaluation of its anti-inflammatory effect[J].Molecules,2022,27(7):2036.
[16] 李贞.超声波辅助提取金鱼藻中α-葡萄糖苷酶抑制剂及其抑制机理研究[D].南昌:南昌大学,2021.
[17] 常国立.杨梅渣降血糖活性成分的筛选及作用机制研究[D].杭州:浙江科技学院,2023.
[18] 苏适,王双侠.响应曲面优化超声波辅助提取无花果叶总黄酮的工艺研究[J].食品研究与开发,2019,40(9):101-106.
[19] HOU M Y,HU W Z,WANG A S,et al.Ultrasound-assisted extraction of total flavonoids from Pteris cretica L.:Process optimization,HPLC analysis,and evaluation of antioxidant activity[J].Antioxidants,2019,8(10):425.
[20] 張晨.黑皮鸡枞总黄酮提取工艺优化及功效成分鉴定[D].成都:成都大学,2023.
[21] 干建松.荸荠皮多酚的纯化与抗氧化性、稳定性研究[J].食品研究与开发,2022,43(17):27-33.
[22] 黄琼,谢向机,林嘉丽,等.洛神花总黄酮提取工艺及其稳定性研究[J].保鲜与加工,2021,21(2):102-108.
[23] KUMAR S,NARWAL S,KUMAR V,et al.α-glucosidase inhibitors from plants: A natural approach to treat diabetes [J].Pharmacognosy Reviews,2011,5(9):19-29.
[24] LUCARINI M,DI S V,COPETTA A,et al.Pharmacological studies,with focus on antidiabetic response of Perilla frutescens(L.)Britt[J].Antidiabetic Medicinal Plants and Herbal Treatments,2023,1:189-195.
[25] 李项辉.紫苏叶提取物的降血糖活性研究[D].杭州:浙江大学,2017.

