外源2,4-表油菜素内酯对碱性盐胁迫下马铃薯根系生长、生理特性及土壤酶活性的影响
李明 颉嘉丽 石铭福 康益晨 张卫娜 刘玉汇 杨昕宇 秦舒浩

摘要: 為探究外源2,4-表油菜素内酯(EBR)对碱性盐胁迫下马铃薯根系形态、生理特性及土壤酶活性的影响,本研究以马铃薯大西洋为试验材料进行盆栽试验,设置不添加NaHCO3(CK)和添加300 mmol/L NaHCO3(T0),以及添加300 mmol/L NaHCO3后喷施0.25 μmol/L(T1)、0.50 μmol/L(T2)、1.00 μmol/L(T3)、2.00 μmol/L(T4)外源EBR,共6个处理。结果表明,300 mmol/L NaHCO3(T0)胁迫抑制马铃薯根系的生长发育、生理特性及土壤酶活性。喷施不同浓度外源EBR均能缓解NaHCO3对马铃薯的胁迫,相比于T0处理,T1处理~T4处理的根粗、根表面积、根体积、根尖数、根系活力以及根系干质量均得到提高;整个生育期根系相对电导率、丙二醛(MDA)含量、过氧化氢含量及超氧阴离子含量明显下降;脯氨酸(Pro)含量以及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、脲酶、蔗糖酶、碱性磷酸酶、脱氢酶活性增强。对19个指标进行主成分分析,依据主成分得分排序,外源EBR对马铃薯碱性盐胁迫缓解能力由高到低为T3>T2>T4>T1>T0。因此1.00 μmol/L 的外源EBR可更好地改善盐碱胁迫下马铃薯根系的生长,增强生物膜的稳定性,提高抗氧化酶及土壤酶的活性,从而起到缓解盐碱胁迫的作用。
关键词: 2,4-表油菜素内酯; 碱性盐胁迫; 马铃薯; 根系形态; 生理特性; 土壤酶活性
中图分类号: S532 文献标识码: A 文章编号: 1000-4440(2024)03-0394-09
Effects of exogenous 2,4-epibrassinolide on root growth, physiological characteristics and soil enzyme activities of potato under alkaline salt stress
LI Ming1, XIE Jia-li1, SHI Ming-fu1, KANG Yi-chen1, ZHANG Wei-na1, LIU Yu-hui2, YANG Xin-yu3, QIN Shu-hao1
(1.College of Horticulture, Gansu Agricultural University, Lanzhou 730070, China; 2.Gansu Provincial Key Laboratory of Crop Genetic Improvement and Germplasm Innovation, Lanzhou 730070, China; 3.Potato Research Institute, Gansu Academy of Agricultural Sciences, Lanzhou 730070, China)
Abstract: In order to explore the effects of exogenous 2,4-epibrassinolide (EBR) on potato root morphology, physiological characteristics and soil enzyme activities under alkaline salt stress, a pot experiment was carried out with potato “Atlantic” as the test material, and no NaHCO3 (CK) and adding 300 mmol/L NaHCO3 (T0) were set up. After addition, exogenous EBR was sprayed with 0.25 μmol/L (T1), 0.50 μmol/L (T2), 1.00 μmol/L (T3), 2.00 μmol/L (T4), a total of six treatments. The results showed that 300 mmol/L NaHCO3 (T0) stress inhibited the growth, development and physiological characteristics of potato roots, and soil enzyme activities. Exogenous EBR at different concentrations could alleviate the stress of NaHCO3 on potatoes. Compared with T0 treatment, root diameter, root surface area, root volume, root tip number, root vigor and root dry weight of T1 treatment-T4 treatment were improved. Root relative electrical conductivity, malondialdehyde (MDA) content, hydrogen peroxide content and superoxide anion content decreased during the whole growth period. Proline (Pro) content, superoxide dismutase (SOD), catalase (CAT), peroxidase (POD), urease, sucrase, alkaline phosphatase and dehydrogenase activities were enhanced. Based on the principal component analysis of 19 indexes, the ability of exogenous EBR to alleviate potato alkaline salt stress from high to low was T3>T2>T4>T1> T0. Therefore, 1.00 μmol/L exogenous EBR could better improve the growth of potato roots, enhance the stability of biofilm, and improve the activities of antioxidant enzymes and soil enzymes under salt-alkali stress, so as to alleviate the salt-alkali stress.
Key words: 2,4-epibrassinolide; alkaline salt stress; potato; root morphology; physiological characteristics; soil enzyme activity
土壤盐渍化造成了土地资源的严重浪费,据联合国粮农组织统计,截至2021年10月,全球盐渍土地面积逾8.33×108 hm2,占地球面积的8.7%[1]。盐碱胁迫作为非生物胁迫之一,严重威胁植物的生长发育[2]。有研究结果表明,碱性盐胁迫导致作物CO2同化量减少,细胞膜损伤,使作物氧化应激的敏感性增强,影响作物对养分及水分的吸收与转运[3],致使作物减产甚至死亡[4]。马铃薯(Solanum tuberosum L.)作为世界最重要的非谷类粮食之一[5],对全球粮食安全具有重要作用。而马铃薯属于中度盐敏感植物,近年来,由于有限的土壤资源以及不合理施用化肥和农药,导致土壤盐碱面积增加,严重限制了马铃薯产业的可持续发展[6]。因此,如何缓解土壤盐碱化对作物带来的影响,提升作物对其的适应性已经成为亟待解决的问题。
施用外源物质可以加强植物对胁迫的应激反应,增强其自身适应性[7],如油菜素内酯、赤霉素、茉莉酸、水杨酸和乙烯都可不同程度地增强植物对不良环境的抵御能力,提高自身存活率[8];此外,褪黑素、外源硅的施用可以调节植物的耐热性[8-9],缓解碱性盐胁迫[10]。而油菜素内酯是生物学上最活跃的生长调节剂之一[11],有研究结果表明,施用油菜素内酯可以保持盐胁迫下马铃薯离子稳态以及有利于活性氧清除[12],缓解重金属胁迫对番茄生长的不利影响[13],对小麦的耐盐性具有积极的作用[14]。根系作为植物吸收养分和水分的主要器官,在作物抵御干旱、盐碱和病虫害等胁迫的过程中发挥重要作用[15]。当前,已经有许多研究关注在胁迫下外源激素对马铃薯光合特性、叶片抗氧化酶及激素转运蛋白的影响[16-17],而有关外源油菜素内酯在盐碱胁迫下对作物根系形态、生理生化以及土壤酶活性影响的研究较少。
因此,本研究拟以马铃薯大西洋为材料,研究不同浓度2,4-表油菜素内酯(EBR)对NaHCO3胁迫下马铃薯根系形态、活性氧代谢、渗透调节物含量和土壤酶活性的影响,进而筛选出缓解马铃薯碱性盐胁迫的最佳外源2,4-表油菜素内酯浓度,以期为马铃薯应对碱性盐胁迫提供参考依据。
1 材料与方法
1.1 试验地点与试验材料
本研究在甘肃农业大学校园(36°3′N~38°1′N,105°89′E~107°33′E)遮雨棚内进行,为盆栽种植。供试材料为甘肃省定西市农业科学研究院提供的马铃薯大西洋脱毒种薯,该品种全生育期110 d。栽培盆上直径、下直径、高分别为35.0 cm、21.0 cm和23.5 cm。基质选用蛭石、珍珠岩和营养土(体积比为3∶1∶1),播种前2 d撒入多菌灵灭菌消毒。每株以基肥的形式施尿素0.006 1 kg、硫酸钾0.008 7 kg、过磷酸钙0.005 4 kg。
1.2 试验设计
本研究共设6个处理,分别是不添加NaHCO3(CK)和添加300 mmol/L NaHCO3(T0),以及添加300 mmol/L NaHCO3后喷施0.25 μmol/L(T1)、0.50 μmol/L(T2)、1.00 μmol/L(T3)、2.00 μmol/L(T4)外源2,4-表油菜素内酯(EBR)(表1),每个处理3个重复,每个重复10盆。苗龄20 d时,T0~T4处理灌入1 L浓度为300 mmol/L的 NaHCO3,CK用同体积清水代替。当日晚,CK喷施清水,T0~T4处理分别喷施0 μmol/L、0.25 μmol/L、0.50 μmol/L、1.00 μmol/L、2.00 μmol/L EBR至叶面挂珠,每隔3 d喷施1次,共喷施4次。分别在株高20 cm(EBR处理结束后第5 d)即现蕾之前(苗期)、出现开花植株(块茎形成期)、进入盛花期后(块茎膨大期)和茎叶衰老时(块茎成熟期)取样。
1.3 测定方法
1.3.1 根系形态指标测定
将根系置于扫描仪带水的扫描盘中(仪器型号:Epson Perfection V700),并用镊子轻轻拨开须根,扫描成图片文件。用根系分析软件(WinRHIZO)分析根系,获得根长、根粗、根表面积、根体积、根尖数等形态指标。
1.3.2 根系活力及根系干质量测定
取马铃薯根系洗净,于105 ℃杀青30 min后在85 ℃烘至恒质量后称取根干质量。
根系活力采用三苯基氯化四氮唑(TTC)还原法测定[18]。
1.3.3 根系活性氧代谢相关指标、相对电导率、脯氨酸含量及丙二醛含量测定 过氧化氢(H2O2)含量、超氧阴离子(O·-2)含量以及超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)的活性测定参考邹琦[18]的方法。
丙二醛(MDA)含量、脯氨酸(Pro)含量及相对电导率测定参考陈建勋等[19]的方法。
1.3.4 土壤酶活性的测定
土壤酶活性参考贾丽琴[20]的方法:土壤脲酶活性测定采用靛酚比色法;土壤蔗糖酶活性测定采用3,5-二硝基比色法;土壤碱性磷酸酶活性测定采用磷酸苯二钠比色法;土壤脱氢酶活性测定采用三苯基氯化四氮唑还原法。
1.4 数据分析
采用Microsoft Excel 2010和SPSS 25.0對原始数据进行统计、方差分析、主成分分析和作图;采用LSD法进行差异显著性分析,采用Origin 2022作图。
2 结果与分析
2.1 外源EBR对NaHCO3胁迫下马铃薯根系生长的影响
如表2所示, NaHCO3胁迫能明显抑制马铃薯根系的生长,与CK相比,各个生育期各指标(根长、根粗、根表面积、根体积和根尖数)显著下降。随着外源EBR浓度的增加,马铃薯根系各形态指标呈现先增后减的趋势。在苗期、块茎形成期、块茎膨大期、块茎成熟期,根粗在T2处理达到最高,与T0处理相比,分别增加39.47%、71.43%、63.27%和62.75%,其余各指标(根长、根体积、根表面积和根尖数)皆在T3处理达到最高且与T0处理差异显著。
2.2 外源EBR对NaHCO3胁迫下马铃薯根系活力及根系干质量的影响
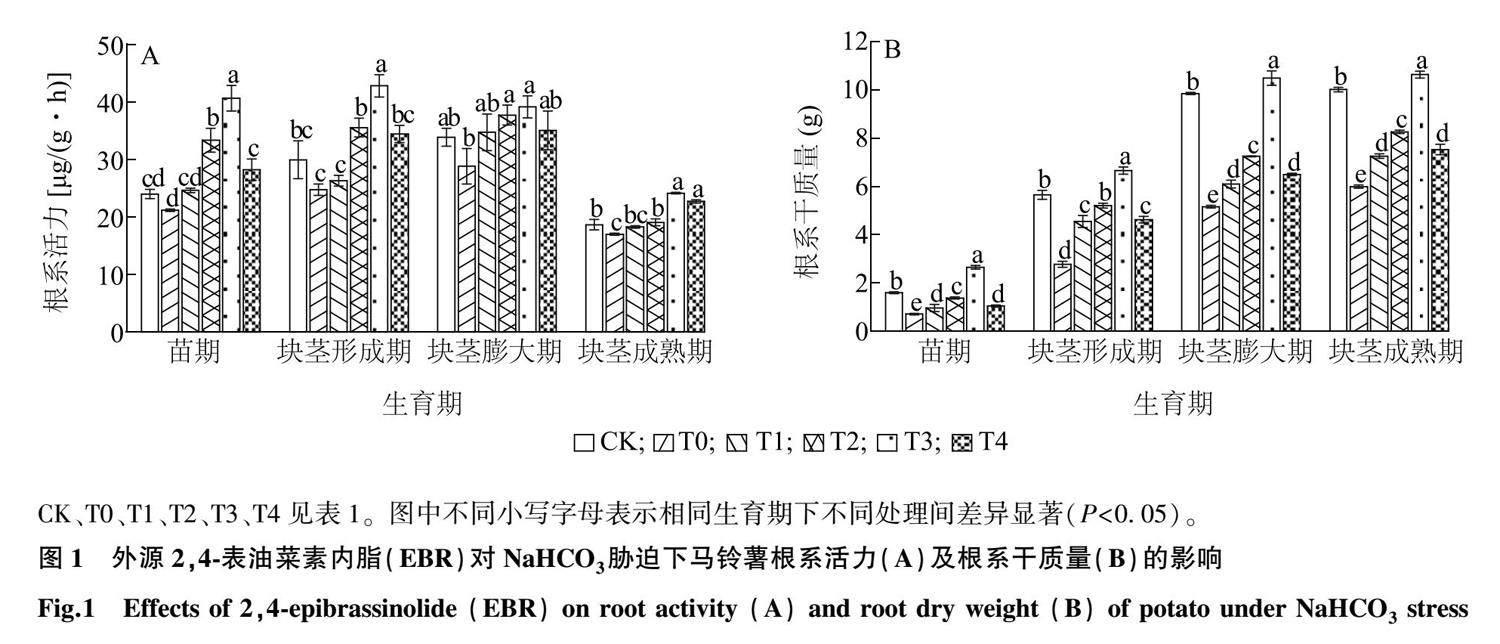
如图1所示,NaHCO3胁迫可以影响马铃薯根系活力及根系干质量,图1A中,从苗期至块茎成熟期,T0处理根系活力与CK相比差异不显著,喷施外源EBR后,根系活力随外源EBR浓度的增加而呈现先增后减的趋势,但始终高于T0处理。整个生育期中,根系活力均在T3处理达到峰值,最高在块茎形成期,可达42.78 μg/(g·h),较T0处理增加了73.02%,差异显著(P<0.05)。图1B中,根系干质量随外源EBR浓度的增加先增后减,在T3处理达到峰值,且高于CK,其根系干质量最高为10.88 g。
2.3 外源EBR对NaHCO3胁迫下马铃薯根系相对电导率、丙二醛含量及脯氨酸含量的影响
如图2所示,整个生育期中,与CK相比,受碱性盐胁迫(T0)的马铃薯根系相对电导率及丙二醛含量显著增加,脯氨酸含量显著下降。在不同浓度EBR处理后,根系相对电导率和丙二醛含量呈现先减后增的趋势,且均在T2处理达到最低值,与T0处理差异显著,在苗期、块茎形成期、块茎膨大期、块茎成熟期,T2处理相对电导率较T0处理分别降低51.75%、53.06%、43.08%、33.99%,丙二醛含量较T0处理分别降低33.03%、17.27%、30.71%和31.98%。脯氨酸含量的变化如图2A所示,随外源EBR濃度的增加,脯氨酸含量为先增后减的变化趋势,在T2处理达到最高,与T0处理差异显著,其含量最高可达61.49 μg/g。
2.4 外源EBR对NaHCO3胁迫下马铃薯根系活性氧代谢的影响
如图3所示,整个生育期中,碱性盐胁迫下各处理的过氧化氢含量和超氧阴离子含量与CK相比显著增加,且随外源EBR浓度升高,均呈现先减后增的趋势。在块茎膨大期,T3处理下过氧化氢含量及超氧阴离子含量达到最低,分别为0.893 3 μmol/g,FW和30.714 7 μmol/g,FW。
如图4所示,T0~T4处理中SOD、POD和CAT活性的变化整体呈现先增高后降低的趋势。如图4A所示,在各个生育期,SOD活性均在T2处理时最高,且与T0处理差异显著。而从图4B、图4C可知,POD活性和CAT活性均在T3处理达到峰值,块茎膨大期,T3处理POD活性在整个生育期中达到最高,为144.34 U/g,较T0处理增加36.62%,而CAT活性在块茎形成期T3处理下达到最大值,为1.58 U/g,较T0处理增加144.78%。
2.5 外源EBR对NaHCO3胁迫下马铃薯土壤酶活性的影响
如图5所示,在马铃薯的整个生育期内,各处理中4种土壤酶活性的动态变化规律基本相似。各生育期T0处理土壤酶活性最低,随着外源EBR浓度的增加,马铃薯根际土壤酶活性呈现先增加后减小的趋势。脲酶(图5A)和蔗糖酶(图5D)的活性均在T2处理达到最高,脲酶活性最高在块茎膨大期,可达12.10 mg/(g·d),较T0处理显著增加113.38%。而土壤蔗糖酶在马铃薯苗期T2处理时活性达到最高值,为13.12 mg/(g·d)。碱性磷酸酶(图5B)和脱氢酶(图5C)的活性的变化趋势基本相同,皆在T3处理达到峰值,碱性磷酸酶活性和脱氢酶活性最高分别为178.71 mg/(g·d)、220.65 mg/(g·d),较T0处理分别显著增加82.35%、103.71%。
2.6 碱性盐胁迫下不同浓度外源EBR对马铃薯根系各指标及土壤酶活性影响的综合评价
对不同浓度EBR处理下马铃薯根系及土壤的19个指标进行主成分分析。提取特征值>1的3个主成分,其方差贡献率分别为59.48%、31.11%和6.67%,累计方差贡献率达到97.26%,符合分析要求。综合得分(F)为每个主成分得分与相应贡献率乘积的和,即F=Z1×0.594 8+Z2×0.311 1+Z3×0.066 7。由表3可知,外源EBR处理对碱性盐胁迫下马铃薯地下部各指标的效应大小表现为:T3>T2>T4>T1>T0。
3 讨 论
本试验中,施加300 mmol/L NaHCO3(T0)与CK相比,马铃薯根系活力下降,根系生长受到抑制;根系抗氧化酶活性下降,相对电导率和丙二醛含量上升,脯氨酸含量下降,渗透平衡遭到破坏;土壤酶活性降低,根系对养分的吸收和转化受到限制。这与诸多研究结果相符,如盐胁迫使谷物细胞膨压降低,细胞膜透性改变,产生氧化应激反应[21];对藜麦根系产生毒害作用,从而抑制其正常生长[22],导致植株营养匮乏[23]等。碱性盐胁迫对作物生长发育有严重影响[24]。植物受到重度胁迫后虽能成活,但会影响根系生长,各种防御酶活性及渗透调节物含量降低,课题组试验发现,当NaHCO3浓度为300 mmol/L时为碱性盐重度胁迫,故脯氨酸含量等指标在此浓度下显著降低,这与盐胁迫下小麦根系抗氧化酶活性及渗透调节物含量变化结果相一致[24]。
根是植物获取营养、吸收水分的主要器官,易受环境因子的调控,植物通过调节根系形态(包括根长、根粗、根表面积、根体积等)与根系活力来适应环境胁迫[25-26]。本研究发现,在碱性盐胁迫下,经不同浓度外源EBR处理后的根系活力、根系干质量及形态各项指标均有所提升,1.00 μmol/L EBR处理(T3)时,根系干质量、根系活力、根长、根表面积、根体积以及根尖数等指标达到最高,这与Gupta等[27]对拟南芥的研究结果一致。外源EBR与众多内源激素相互形成复杂的调控网络,加速根分生组织的增殖与分化[28],促进根细胞伸长及侧根的生长,增强根系活力,从而提高根系干质量[29]。
不良环境会使细胞膜受到不同程度的损伤[27],导致丙二醛含量增加,细胞相对电导率增大[30],而脯氨酸作为渗透调节物质以游离状态广泛存在于植物体中[31]。本研究中,随着外源EBR浓度的增加,丙二醛含量及根系相对电导率逐渐减小,在0.50 μmol/L处理时最低,继而逐步上升,但始终低于T0处理。而脯氨酸含量的变化与之相反,呈现先增后减的趋势,在0.50 μmol/L EBR处理(T2)达到最高,这与王洋[32]的研究结果一致,说明喷施适宜浓度外源EBR会增加质膜稳定性,增加渗透调节物质的含量,缓解碱性盐胁迫对马铃薯植株的影响。
在碱性盐胁迫影响下,活性氧会过度积累,导致膜质过氧化及氧化酶产生应激反应,严重影响植物的生长发育[33]。SOD与POD、CAT等酶共同构成了保护酶体系,清除植物体内有毒性的过氧化氢含量及超氧阴离子自由基[34-35]。本研究中,喷施不同浓度外源EBR,SOD、POD、CAT的活性均随外源EBR浓度的增加而呈现先增后减的趋势,过氧化氢及超氧阴离子含量变化则与之相反,在1.00 μmol/L外源EBR处理抗氧化酶活性总体最高,细胞膜受到的伤害最小。这与在胁迫下水杨酸及EBR等外源激素对黄瓜[10]、番茄[36]中抗氧化酶活性的影响一致,表明碱性盐胁迫下喷施EBR可以减轻细胞膜受到的损害,减缓细胞的衰老和解体,进而加强马铃薯植株对碱性盐胁迫的适应性。
土壤酶大多由土壤微生物分泌而来,对促进植物吸收养分及生长有重要作用[37-44]。本研究发现,外源EBR处理会对碱性盐胁迫下马铃薯根际土壤酶活性产生促进作用,并随EBR浓度的增大,脲酶、脱氢酶、碱性磷酸酶及蔗糖酶的活性先升后降,但始终整体高于T0处理下土壤酶的活性。这与范志伟等[45]在草莓叶片上喷施茉莉酸甲酯可增加土壤酶活性的研究结果一致,喷施外源激素可以改善叶片光合作用,调节光合产物向根系的分配及運输,促进根系的生长及干物质的积累,增加微生物数量,从而使得土壤酶的活性升高[46-47],最终提高马铃薯对碱性盐胁迫的适应能力。
由主成分分析结果可知,T0~T4处理中,T3处理(1.00 μmol/L外源EBR)得分最高,其缓解盐胁迫效应远高于其他处理,T2处理次之。外源EBR通过调控活性氧代谢、土壤酶活性和细胞膜的稳定性以及根系形态来适应碱性盐胁迫。
4 结 论
本研究结果表明,300 mmol/L NaHCO3会严重影响马铃薯根系的生长发育以及降低土壤酶的活性。施加适宜浓度外源EBR增强了马铃薯在碱性盐胁迫下的适应性,保证了根系的正常生长,提高了抗氧化酶及土壤酶的活性,增加了渗透调节物质的含量。主成分分析结果表明,当喷施外源EBR浓度为1.00 μmol/L时,对碱性盐胁迫的缓解效果最佳。因此,喷施1.00 μmol/L外源EBR可有效提升马铃薯对碱性盐胁迫的耐受性。
参考文献:
[1] 赵明辉,白雅梅,孟令波,等. 二倍体马铃薯耐盐性评价及其指标筛选[J]. 生态学杂志,2022,41(3):610-617.
[2] AGHAEI K, EHSANPOUR A, KOMATSU S. Proteome analysis of potato under salt stress[J]. Journal of Proteome Research,2008,7(11):4858-4868.
[3] LU Z Q, LIU D L, LIU S K. Two rice cytosolic ascorbate peroxidases differentially improve salt tolerance in transgenic Arabidopsis[J]. Plant Cell Reports,2007,26(10):1909-1917.
[4] BOHNERT H J, JENSEN R G. Metabolic engineering for increased salt tolerance-the next step[J]. Functional Plant Biology,1996,23(5):661-667.
[5] SANWAL S K, KUMAR P, KESH H, et al. Salinity stress tolerance in potato cultivars:evidence from physiological and biochemical traits[J]. Plants,2022,11(14):1842.
[6] 李 青,秦玉芝,胡新喜,等. 马铃薯耐盐性研究进展[J]. 园艺学报,2017,44(12):2408-2424.
[7] FENG D, GAO Q, LIU J, et al. Categories of exogenous substances and their effect on alleviation of plant salt stress[J]. European Journal of Agronomy,2023,142:126656.
[8] CUI G C, XIAO X, ZHANG W J, et al. Exogenous silicon relieve drought stress and salt stress of Glycyrrhiza uralensis seedlings by regulating proline metabolism and nitrogen assimilation[J]. The Journal of Horticultural Science and Biotechnology,2021,96(6):728-737.
[9] IMRAN M, AAQIL KHAN M, SHAHZAD R, et al. Melatonin ameliorates thermotolerance in soybean seedling through balancing redox homeostasis and modulating antioxidant defense, phytohormones and polyamines biosynthesis[J]. Molecules,2021,26(17):5116.
[10] ZHANG T G, SHI Z F, ZHANG X H, et al. Alleviating effects of exogenous melatonin on salt stress in cucumber[J]. Scientia Horticulturae,2020,262:109070.
[11] 沈家濤,金雅芳,李金灵,等. 植物激素调控植物耐涝响应机理研究进展[J]. 植物生理学报,2022,58(4):643-653.
[12] KHALID A, AFTAB F. Effect of exogenous application of 24-epibrassinolide on growth, protein contents, and antioxidant enzyme activities of in vitro-grown Solanum tuberosum L. under salt stress[J]. In Vitro Cellular & Developmental Biology-Plant,2016,52(1):81-91.
[13] MAIA C F, PEREIRA Y C, DA SILVA B R S, et al. Exogenously applied 24-epibrassinolide favours stomatal performance, ROS detoxification and nutritional balance, alleviating oxidative damage against the photosynthetic apparatus in tomato leaves under nickel stress[J]. Journal of Plant Growth Regulation,2022,42:2196-2211. DOI:10.1007/s00344-022-10693-3.
[14] DONG Y G, WANG W W, HU G Q, et al. Role of exogenous 24-epibrassinolide in enhancing the salt tolerance of wheat seedlings[J]. Journal of Soil Science and Plant Nutrition,2017,17(3):554-569.
[15] 康书瑜,庞春花,张永清,等. 干旱胁迫下外源水杨酸对藜麦生理效应及产量的影响[J]. 干旱区资源与环境,2022,36(12):151-157.
[16] HE Q L, WU X, LIU Y, et al. Elucidating the molecular mechanisms of exogenous melatonin for improving heat tolerance in Solanum tuberosum L. seedlings[J]. Scientia Horticulturae,2023,322:112423.
[17] YANG C H, WANG D D, ZHANG C, et al. Comprehensive analysis and expression profiling of PIN, AUX/LAX, and ABCB auxin transporter gene families in Solanum tuberosum under phytohormone stimuli and abiotic stresses[J]. Biology,2021,10(2):127.
[18] 邹 琦. 植物生理学实验指导[M]. 北京:中国农业出版社,2007:159-165.
[19] 陈建勋,王晓峰. 植物生理学实验指导[M]. 广州:华南理工大学出版社,2006:115-124.
[20] 贾丽琴. 豆科植物土壤浸提液对马铃薯连作土壤微生物群落和酶活性的影响[D]. 兰州:甘肃农业大学,2016.
[21] KUMAR P, CHOUDHARY M, HALDER T, et al. Salinity stress tolerance and omics approaches:revisiting the progress and achievements in major cereal crops[J]. Heredity,2022,128(6):497-518.
[22] RUIZ K B, BIONDI S, MARTNEZ E A, et al. Quinoa-a model crop for understanding salt-tolerance mechanisms in halophytes[J]. Plant Biosystems,2016,150(2):357-371.
[23] RANGANI J, PARIDA A K, PANDA A, et al. Coordinated changes in antioxidative enzymes protect the photosynthetic machinery from salinity induced oxidative damage and confer salt tolerance in an extreme halophyte Salvadora persica L.[J]. Frontiers in Plant Science,2016,7:50.
[24] LI X Y, LI S X, WANG J H, et al. Exogenous abscisic acid alleviates harmful effect of salt and alkali stresses on wheat seedlings[J]. International Journal of Environmental Research and Public Health,2020,17:3770.
[25] ARIF M R, ISLAM M T, ROBIN A H K. Salinity stress alters root morphology and root hair traits in Brassica napus[J]. Plants,2019,8(7):192.
[26] DE DORLODOT S, FORSTER B, PAGS L, et al. Root system architecture: opportunities and constraints for genetic improvement of crops[J]. Trends in Plant Science,2007,12(10):474-481.
[27] GUPTA A, SINGH M, LAXMI A. Interaction between glucose and brassinosteroid during the regulation of lateral root development in Arabidopsis[J]. Plant Physiology,2015,168(1):307-320.
[28] HEYMAN J, COOLS T, VANDENBUSSCHE F, et al. ERF115 controls root quiescent center cell division and stem cell replenishment[J]. Science,2013,342(6160):860-863.
[29] 吴志勇,顾 红,程大伟,等. 油菜素内酯调控植物根系发育机制研究进展[J]. 中国农业科技导报,2022,24(2):68-76.
[30] 高青海,郭远远,吴 燕,等. 盐胁迫下外源褪黑素和Ca2+对甜瓜幼苗的缓解效应[J]. 应用生态学报,2017,28(6):1925-1931.
[31] MA L J, LI Y Y, YU C M, et al. Alleviation of exogenous oligochitosan on wheat seedlings growth under salt stress[J]. Protoplasma,2012,249(2):393-399.
[32] 王 洋. 2,4-表油菜素内酯对水稻盐胁迫缓解的效应与利用[D]. 扬州:扬州大学,2022.
[33] PANCHA I, CHOKSHI K, MAURYA R, et al. Salinity induced oxidative stress enhanced biofuel production potential of microalgae Scenedesmus sp. CCNM 1077[J]. Bioresource Technology,2015,189:341-348.
[34] 杨雯一. 不同胁迫对各种植物体内抗氧化酶系统的影响综述[J]. 化工管理,2021(1):92-93.
[35] 王军萍,宋留丽,郁志芳. 2,4-表油菜素內酯处理对不同温度贮藏中小白菜品质和生理生化的影响[J]. 食品工业科技,2022,43(9):349-358.
[36] NAEEM M, BASIT A, AHMAD I, et al. Effect of salicylic acid and salinity stress on the performance of tomato plants[J]. Gesunde Pflanzen,2020,72(4):393-402.
[37] 张成龙,商美新,马梦雪,等. 肥料配施蚯蚓裂解液对马铃薯产量、品质和土壤酶活性影响[J]. 江苏农业科学,2023,51(1):110-116.
[38] 张金峰,谭小兵,吕世保,等. 化肥减量配施炭基肥对烤烟产质量及土壤酶活性的影响[J]. 南方农业学报,2022,53(11):3079-3087.
[39] 杜泽云,陶思敏,娄运生,等. 施用生物炭和硅肥对增温稻田土壤酶活性的影响[J]. 江苏农业科学,2023,51(1): 225-231.
[40] 周郑雄,冯 豪,丁继林,等. 复合微生物肥对植烟根际土壤团聚体稳定性和酶活性的影响[J]. 南方农业学报,2022,53(11):3088-3097.
[41] 王 宇,刘春成,李仁杰,等. 土壤酶活性对微咸水与再生水混合滴灌的响应与评估[J]. 排灌机械工程学报,2023,41(3):313-318.
[42] 刘倩倩,彭孝楠,刘 鑫,等. 踩踏干扰下紫金山土壤质量季节变化特征[J]. 南京林业大学学报(自然科学版),2022,46(3):185-193.
[43] 吴春发,关浩然,张锦路,等. 含磷钝化剂对镉污染农田土壤酶活性的影响[J]. 江苏农业学报,2022,38(2):361-368.
[44] WOJEWDZKI P, LEMANOWICZ J, DEBSKA B, et al. Soil enzyme activity response under the amendment of different types of biochar[J]. Agronomy,2022,12(3):569.
[45] 范志伟,张奇瑞,刘小林,等. 外源茉莉酸甲酯对连作草莓土壤酶活性和酚酸类物质含量的影响[J]. 江苏农业科学,2022,50(17):253-258.
[46] WANG Y F, GUO Y Y, ZHAO C F, et al. Exogenous melatonin achieves drought tolerance by improving photosynthesis in maize seedlings leaves[J]. Russian Journal of Plant Physiology,2021,68:718-727.
[47] ZHANG J, VRIELING K, KLINKHAMER P G L, et al. Exogenous application of plant defense hormones alters the effects of live soils on plant performance[J]. Basic and Applied Ecology,2021,56:144-155.
(责任编辑:陈海霞)

