月月竹竹秆变色后全长转录组分析
邵欣瑜 熊星 杨峰 赵云飞 刘昌来 刘国华

摘要: 为探究月月竹竹秆受到光照由绿色变为紫色的分子机制,本研究采集月月竹同一竹节紫色部分(Z)、渐变部分(M)和绿色部分(L)的竹青,提取RNA,利用PacBio Sequel三代全长转录组测序技术,结合生物信息学方法对不同颜色的竹青进行全长转录组分析。结果表明,经过三代测序和数据质量控制,共获得非冗余转录本66 961条,长度为500~3 000 bp,平均长度1 389.22 bp,序列总长度为93.02 Mbp,N50为1 830 bp,G+C碱基含量为49.56%。利用NR、Swiss-Prot、COG、GO、KEGG和Pfam数据库对所有转录本进行功能注释,共有56 938条转录本被成功注释,占全部转录本的85.03%;49 115条转录本被GO注释,其中催化活性、細胞器、代谢过程分别是GO数据库分子功能、细胞组分和生物过程中含转录本最多的项目;28 231个转录本被KEGG数据库注释,其中与碳水化合物代谢和基因翻译相关的转录本最多。结合GO注释和KEGG注释,66 961条转录本中有381条转录本与光信号的感受、传递以及光调控相关,包括红光和远红光的受体蛋白PHYA、PHYB及信号通路蛋白PIF3、ELF3,蓝光的受体蛋白CRY、ZTL及信号通路蛋白COP1、SPA1、ELF3、GI、HY5等。类黄酮(包括花青素)代谢、叶绿素合成、类胡萝卜素合成等与植物色素合成相关通路分别含有转录本187条、44条和72条。全长转录本共获得2 079个转录因子,其中包括18个由35个转录本编码的与花青素合成相关的R2R3MYB转录因子。CNCI、CPC、Pfam、PLEK等数据库同时注释到的长链非编码RNA(LncRNA)6 359个,数量高于孝顺竹等其他竹种。本研究获得了高质量的月月竹竹青全长转录组数据,与竹秆变色相关的红光和蓝光受体及光信号传递蛋白,与花青素、叶绿素和类胡萝卜素合成相关的转录因子及长链非编码RNA(LncRNA),为进一步深入分析月月竹竹秆变色机制提供基础。
关键词: 月月竹; 变色竹秆; 全长转录组测序; 光信号
中图分类号: S795.6 文献标识码: A 文章编号: 1000-4440(2024)03-0538-14
Full-length transcriptome sequencing analysis of Chimonobambusa sichuanensis after discoloration of bamboo culm
SHAO Xin-yu1, XIONG Xing1, YANG Feng2, ZHAO Yun-fei3, LIU Chang-lai1, LIU Guo-hua1
(1.Bamboo Research Institute, Nanjing Forestry University/Co-Innovation Center for Sustainable Forestry in Southern China, Nanjing 210037, China; 2.Heze College of Chemical Technology, Heze 274500, China; 3.Linyi Municipal Public Security Bureau, Linyi 276000, China)
Abstract: In order to explore the molecular mechanism of bamboo culm changing from green to purple under light, we collected the purple part (Z), median part (M) and green part (L) of the same bamboo node, extracted RNA, and used PacBio Sequel three-generation full-length transcriptome sequencing technology combined with bioinformatics methods to analyze the full-length transcriptome of bamboo barks with different colors. The results showed that a total of 66 961 non-redundant transcripts were obtained after three generations of sequencing and data quality control. The length ranged from 500 bp to 3 000 bp, with an average length of 1 389.22 bp. The total length of the sequence was 93.02 Mbp, the N50 was 1 830 bp, and the G+C base content was 49.56%. A total of 56 938 transcripts were successfully annotated based on NR, Swiss-Prot, COG, GO, KEGG, and Pfam databases, accounting for 85.03% of all transcripts. A total of 49 115 transcripts were annotated by GO database, among which catalytic activity, organelle and metabolic process were the items with the most transcripts in molecular function, cellular component and biological process of GO database, respectively. The 28 231 transcripts were annotated by KEGG database, of which the transcripts related to carbohydrate metabolism and gene translation were the most. Combined with GO annotation and KEGG annotation, 381 transcripts of 66 961 transcripts were related to the perception, transmission and light regulation of light signals, including red and far-red light receptor proteins PHYA, PHYB and signal pathway proteins PIF3, ELF3, blue light receptor proteins CRY, ZTL and signal pathway proteins COP1, SPA1, ELF3, GI, HY5, etc. The pathways related to plant pigment synthesis, such as flavonoid (including anthocyanin) metabolism, chlorophyll synthesis and carotenoid synthesis, contained 187 transcripts, 44 transcripts and 72 transcripts, respectively. A total of 2 079 transcription factors were obtained from the full-length transcripts, including 18 R2R3MYB transcription factors related to anthocyanin synthesis encoded by 35 transcripts. The number of long non-coding RNAs (LncRNAs) simultaneously annotated in the CNCI, CPC, Pfam, and PLEK databases was 6 359, which was higher than that of other bamboo species such as Xiaoshun bamboo. In this study, we obtained high-quality full-length transcriptome data, red and blue light receptors and light signal transduction proteins related to bamboo discoloration, and transcription factors and LncRNAs related to anthocyanin, chlorophyll and carotenoid synthesis, which provided a basis for further analysis of the mechanism of bamboo discoloration.
Key words: Chimonobambusa sichuanensis; color-changing bamboo culm; full-length transcriptome sequencing; light signal
中国是世界上竹类资源最丰富的国家,竹林面积、蓄积量、竹材产量均居世界之冠[1]。中国的竹子栽培和利用历史悠久,现代竹产业开发也居世界领先地位[2]。目前,竹子在建筑业、日用品、园林设计、食品等多个领域有广泛应用[3]。竹子的秆色有紫色(如紫竹)、黄色(如乌哺鸡竹)、彩条色(如绿槽毛竹)、紫褐与黄绿杂色(如斑竹)等[4],还有一些竹子在特殊情况下,秆色会由绿色变为紫色,如唐竹(Sinobambusa tootsik)、月月竹(Chimonobambusa sichuanensis)、鹅毛竹(Shibataea chinensis)、坝竹(Ampelocalamus microphyllus)等。其中,月月竹在秋冬季节秆色变化很明显,主要表现为向光一侧呈紫色而背光一侧呈绿色的特征,具有较好的观赏性[1]。
不同品种竹秆变色的主要原因有两个方面,一是由遗传因素造成的,例如紫竹竹秆一般在发笋当年的7、8月份逐渐变为黄色,到冬季逐渐变为紫色,第2年完全变为紫色,此后随着竹子年龄的增加紫色逐渐加深;黄秆乌哺鸡竹、绿槽毛竹等在发笋时颜色就已经呈现黄色或黄秆绿槽,而斑竹竹秆的斑点会随着竹龄的增加逐渐增加,直至竹秆被斑点全部覆盖,呈现出与紫竹竹秆类似的色泽;二是由环境引起的,例如月月竹、坝竹、鹅毛竹等,这些竹种的竹秆往往在秋冬季节或者特定条件下变为紫色。刘昌来等[5]研究发现每年9月份发笋的月月竹竹秆在12月份向光一侧变为紫色而背光一侧仍然为绿色,而4月份发笋形成的竹秆在6月份并不变色,同时,不同颜色膜包裹的竹秆的变色特征存在明显的差异,并通过单色光模拟试验,确定了诱导月月竹竹秆变色的光质。
光是植物生长的能量来源,同时也是植物众多生理活动的重要信号因子。光可以诱导植物体的形态建成[6]、光周期[7-8]、花开放[9]、叶绿体运动[10]、气孔开闭[11]及花青素和木质素合成[12-13]等诸多生理过程。光作为信号分子的作用是通过光受体来实现的。目前,在植物体中发现的光受体主要有3类:感受红光和远红光的光敏色素(phyA/phyB),感受蓝光的隐花色素(Cryptochromes)、向光素(Phototropins)、ZTL/KELCH 蛋白超家族等,感受紫外光的UVR8蛋白。其中,光敏色素phyB同时也是温度受体,在植物体的形态建成中发挥重要作用。月月竹竹秆的颜色一般认为是由色素决定的,且竹秆色素主要存在于竹青部位。色素种类包括叶绿素、类胡萝卜素、花青素以及一些有色黄酮类物质等。叶绿素的合成主要受红光的诱导,花青素合成受蓝光以及高光照度的白光誘导,同时高光照度白光还会诱导木质素和黄酮类物质的合成[12,14]。蓝光诱导色素合成的过程大致是,光受体感受到光信号后,通过PIFs(Phytochrome interacting factors)、COP1(Constitutive photomorphogenesis 1)、SPA1(Suppressor of phya 1)、HY5(Long hypocotyl 5)、GI(Gigantea)、PKS(Phytochrome kinase substrate)等蛋白将信号放大并进行传递,诱导转录因子合成从而调控相关基因表达,促进色素合成。同时,通过CIB(Cryptochrome-interaction basic helix-loop-helix)、PIFs、HFR1(Long hypocotyl in far-red1)等蛋白调控植物体的去黄化、低蓝光诱导的避荫反应、温度促进生长等生理活动[12,15]。调控花青素以及黄酮合成的转录因子主要是与bHLH和WD40形成MBW复合体的R2R3MYB转录因子和不依赖于bHLH和WD40的R2R3MYB转录因子[16]。
第三代测序技术是在第二代测序技术的基础上发展出来的长读长测序技术,为无参考基因组植物的研究开辟了新路径,在非模式物种基因功能、基因表达调控和进化关系等方面的研究上有诸多应用[17]。如Ma等[18]利用三代测序技术对西番莲(Passiflora edulis)进行染色体水平基因组装,通过基因组进化分析揭示了1个双子叶植物共有的γ全基因组三倍体事件,以及1个更近的全基因组复制事件。魏强等[19-21]通过高通量测序明确了竹子增粗、节间伸长等生长发育过程的潜在关键基因,且发现竹子节间生长过程中的模块化现象。
月月竹(Chimonobambusa sichuanensis)是禾本科竹亚科植物,因其优美的外形和较强适应性被视为观赏竹种的代表。由于不被笋箨包被的节间向阳一侧在经过阳光照射下由原本的翠绿色转变为深紫色,而同一节间背光一侧仍然呈现绿色,因此月月竹常作为竹秆变色的研究材料[5]。针对月月竹竹秆变色后全长转录组分析缺乏的现状,本研究使用第三代测序技术对月月竹不同颜色竹秆进行转录组测序,通过转录本功能注释、转录因子及长链非编码(LncRNA)等分析,明确月月竹竹秆变色机制与成色规律。
1 材料与方法
1.1 试验材料
2021年4月于南京林业大学竹园内(118°48′E,32°01′N)内随机选取2020年9月发笋,高度、粗度以及分枝状态一致的竹秆5棵,从没有长根的第一节算起,采集高度基本一致的第6节间露出笋箨的向阳面紫色竹青、背阴面绿色竹青和侧面渐变色竹青各5样本。取样后,样本迅速放入液氮,后置于超低温冰箱保存备用。
1.2 竹青样本总RNA提取
样本在YP-S500型超声波研磨仪 (宁波洛尚智能科技有限公司产品)上-20 ℃进行研磨,使用Trizol法提取竹青样本总RNA,利用Nanodrop2000微量分光光度计(美国赛默飞世尔科技有限公司产品)对所提取总RNA的质量浓度和纯度进行检测,利用1%琼脂糖凝胶电泳检测总RNA完整性,利用Agilent2100生物分析仪(美国安捷伦科技科技有限公司产品)测定RNA完整值(RIN)。单次建库要求RNA总量≥1 μg,质量浓度≥35 ng/μl,OD260/OD280≥1.8,OD260/OD230≥1.0(OD为吸光度)。利用带有Oligo(dT)的磁珠与多聚腺苷酸(ployA)进行A、T碱基配对,富集mRNA。
1.3 文库构建与测序
样品的总RNA检测合格后,进行文库构建。主要流程如下:以mRNA为模板使用SMARTerTM PCR cDNA合成试剂盒合成全长cDNA,PCR扩增放大cDNA片段,使用PB磁珠纯化扩增的全长cDNA,对全长cDNA进行末端修复,连接单分子实时测序(SMRT)哑铃型接头,对连接接头的cDNA进行核酸外切酶消化,使用 PB 磁珠纯化cDNA,构建全长cDNA测序文库,然后委托上海美吉生物医药科技有限公司,利用Pacbio Sequel三代测序平台完成测序。
1.4 序列分析和注释
参照鞠烨等[22]的方法对下机数据进行分析和注释:根据接头序列,利用CCS软件(https://ccs.how/)对测得的Subread测序单分子序列纠错,得到环形一致性序列(Circular consensus sequence,CCS)。使用Lima软件(https://lima.how/)将CCS序列去除barcode、5′-primer、3′-primer,利用IsoSeq3软件去掉polyA 尾和嵌合体序列(Concatemer),获得全长非嵌合序列(Full-length non-concatemer,FLNC),根据唯一分子标识(Unique molecular identifiers,UMIs)通过聚类去掉重复序列,得到预测精度≥99%的高精度非冗余共有序列(Consensus sequence),即全长转录本序列。利用BUSCO软件(https://gitlab.com/ezlab/busco)对全长转录本进行完整性评估,利用比对软件Diamond 0.8.36和HMMER 3.1及NR(NCBI non-redundant protein sequences)、Swiss-Prot(a manually annotated and reviewed protein sequence database)、COG(Clusters of orthologous groups of proteins)、GO(Gene ontology)、KEGG(Kyoto encyclopedia of genes and genomes)和Pfam(Protein family)等数据库对全长转录本进行功能注释。
1.5 转录本差异表达分析及全长转录本转录因子和长链非编码RNA(LncRNA)预测
使用DESeq2软件,设置P<0.05和差异倍数(FC)>1.5,对不同颜色竹青样品的转录本进行差异表达分析;利用Blastx 2.11.0软件和植物转录因子数据库(Plant TFDB)进行全长转录本转录因子预测;利用 CNCI(Coding-non-coding index)、CPC(Coding potential calculator)、PFAM(Protein families database)及PLEK(Psort-based LEss common nucleotide k-mers)等數据库,通过CNCI和PLEK软件对转录本的编码潜能进行预测,并利用CPC2软件对其结果进行评估,最终对月月竹竹青全长转录本进行长链非编码RNA(LncRNA)数量及长度进行预测。
2 结果与分析
2.1 月月竹竹秆颜色特征
月月竹竹秆的节间长度为10~15 cm,如图1所示。从图1可以明显看出月月竹竹秆颜色存在明显差异,笋箨未包裹的部分为紫色,而被笋箨包裹的部分为绿色,并且向光一侧为紫色,而背光一侧为绿色(图1B),紫色和绿色之间存在明显的过渡状态。
2.2 测序结果和序列分析
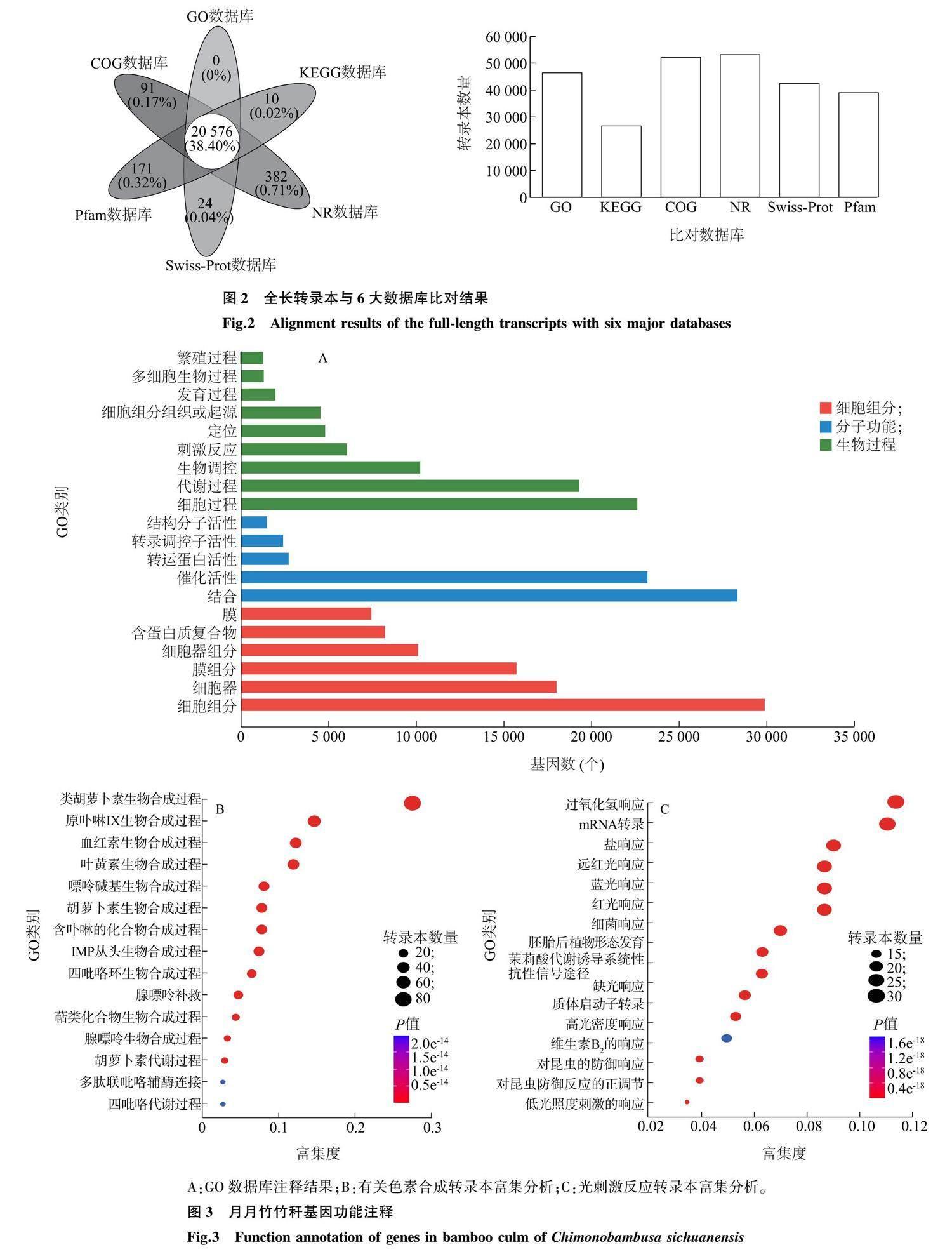
经质量控制,本研究共得到66 961条平均长度为1 389.22 bp的转录本,转录本长度主要分布在500~3 000 bp,全序列总长度为93.02 Mbp,最长转录本为8 021 bp,最短为51 bp, N50 (将拼接得到的所有序列,根据序列长度从大到小进行排序,然后逐步开始累加,当累加长度超过总长一半时,新加入的序列长度即为 N50 )为1 830 bp,G+C碱基含量为49.56%。去冗余后的转录本完整性(BUSCO值)为52.4%,转录本完整性达到后续分析的要求。
2.3 全长转录本的GO注释
将全长转录本与6大数据库比对后,共有56 938条转录本被成功注释,占全部转录本的85.03%。其中,GO和KEGG数据库分别注释到49 115条和28 231条转录本(图2)。GO数据库注释到的49 115条转录本分为51个功能,其中分子功能(Molecular function)中含有转录本最多的为结合和催化活性功能,细胞组分(Cellular component)中含有转录本最多的是细胞结构(Cell part),生物过程(Biological process)中含有转录本最多的为细胞过程(Cellular process)和代谢过程(Metabolic process)(图3A)。GO注释中与光诱导有关的2个生物过程辐射响应(Response to radiation)和节律过程(Rhythmic process)分别含有864条和199条转录本序列;代谢过程中(Metabolic process)与色素合成(Pigment biosynthetic process)相关的转录本有288条,这288条转录本主要富集到类胡萝卜素生物合成过程(Carotenoid biosynthetic process)、原卟啉IX 生物合成过程(Protoporphyrinogen IX biosynthetic process)、含卟啉的化合物代谢过程(Porphyris-containing compound metabolic process)等类胡萝卜素和叶绿素的合成过程中,有3个转录本富集到黄酮醇(Flavonol)和木质素生物合成过程中(图3B)。注释到辐射响应(Response to radiation)的864条转录本中有381条注释到光刺激反应(Response to light stimulus),且这381条转录本主要富集到红光、远红光、蓝光和光形态建成等生物过程(图3C)。
2.4 全长转录本的KEGG注释
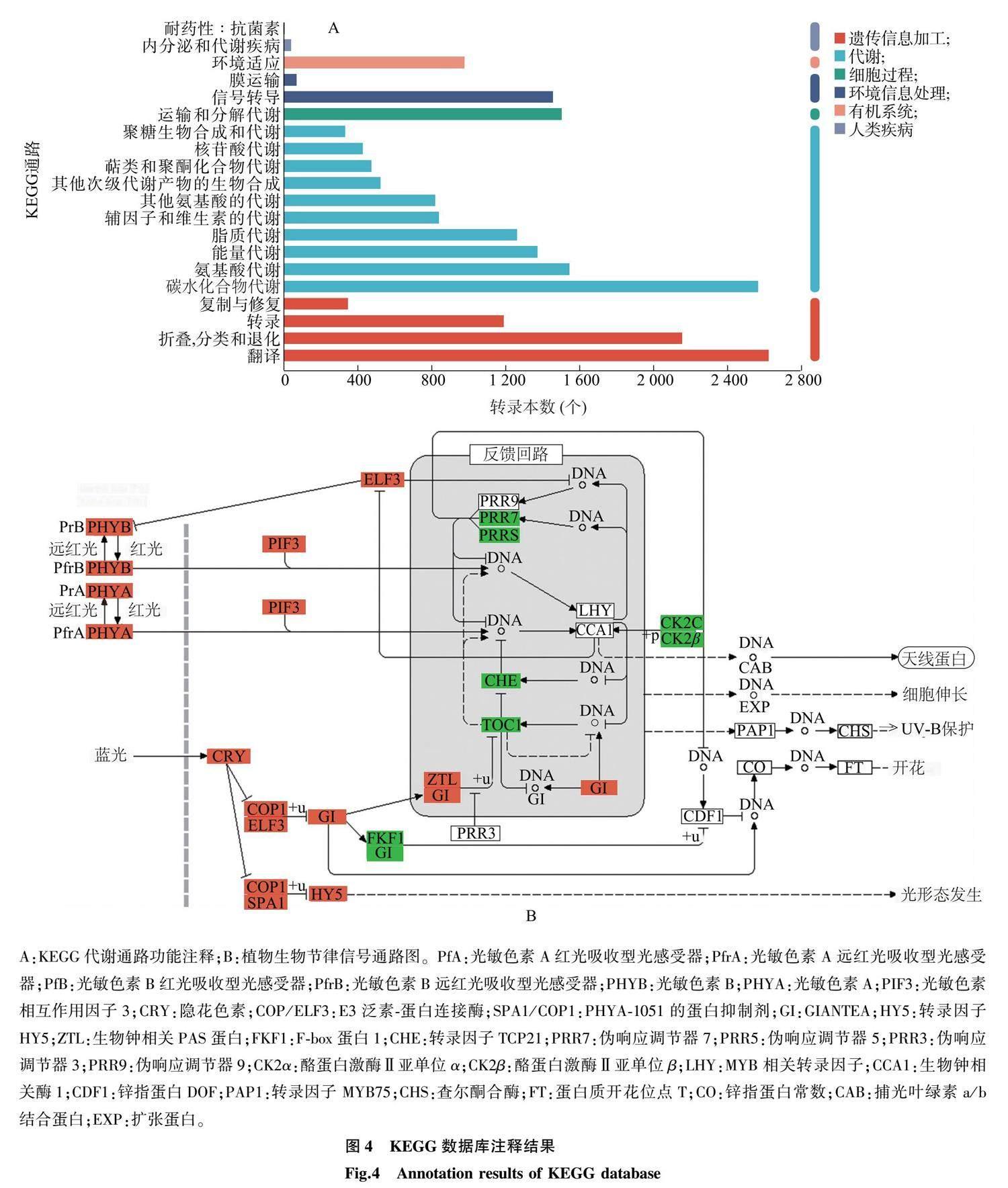
KEGG注释结果表明共有28 231条序列参与到133条代谢通路中。133条代谢通路可分为代谢过程(Metabolism)、遗传信息过程(Genetic information processing)、环境信息过程(Environmental information processing)、细胞过程(Cellular processes)、生物系统(Organismal systems)等(图4A)。其中萜类和聚酮代谢过程中的萜骨架合成(Terpenoid backbone biosynthesis)和类胡萝卜素代谢过程(Carotenoid biosynthesis)中转录本最多;苯丙烷类合成和黄酮醇合成等次生代谢过程中转录本也较多;在植物体应对外界环境(Environmental information processing)作用中,有178个转录本注释到植物生物节律信号通路中(Circadian rhythm-plant),包括红光和远红光受体PHYA、PHYB及信号通路蛋白PIF3、ELF3,蓝光受体CRY、ZTL及信号通路蛋白COP1、SPA1、ELF3、GI、HY5等(图4B)。
2.5 转录本差异表达分析
月月竹紫色竹青与绿色竹青、紫色竹青与渐变色竹青、渐变色竹青与绿色竹青3个比较组共获得差异表达转录本1 710个。渐变色竹青与绿色竹青比较组具有差异表达转录本400个,其中上调表达226个,下调表达174个;紫色竹青与渐变色竹青比较组共有差异表达转录本854个,其中上调表达724个,下调表达130个(图5A)。紫色竹青与渐变色竹青中有220个转录本表达量明显高于绿色竹青,138个转录本表达量明显低于绿色竹青(图5B)。1 710個差异表达转录本GO富集分析结果表明,转录本显著富集到海藻糖、双糖、寡糖等生物合成过程和阳离子、离子、门控等通道(图6A),同时脱落酸(ABA)信号和赤霉素(GA)信号响应途径也得到富集。差异表达转录本KEGG富集分析结果表明,差异表达转录本显著富集到内吞作用(Endocytosis)以及淀粉和蔗糖代谢(Starch and sucrose metabolism)等过程,黄酮类物质合成上游的苯丙氨酸代谢(Phenylalanine metabolism)和苯丙烷代谢(Phenylpropanoid biosynthesis)途径也分别富集到3个和6个差异表达转录本;类黄酮生物合成(Flavonoid biosynthesis)也富集到2个差异表达转录本,这2个差异表达转录本是黄酮醇合成花青素的关键基因;卟啉和叶绿素代谢过程(Porphyrin and chlorophyll metabolism) 富集到6个差异表达转录本,类胡萝卜素生物合成(Carotenoid biosynthesis)过程、萜类骨架生物合成(Terpenoid backbone biosynthesis)过程分别富集到2个和1个差异表达转录本,植物昼夜节律 (Circadian rhythm-plant)富集到2个编码光信号途径的差异表达转录本(HY5和CK2)。
2.6 色素代谢有关转录本
2.6.1 黄酮类代谢有关转录本 苯丙烷类代谢是木质素合成的重要途径,也是黄酮醇以及花青素合成的上游途径。根据KEGG的注释,共有186条转录本序列被注释到苯丙烷类代谢通路中(表1)。涉及到的编码蛋白质包括莽草酸/奎宁酸羟基肉桂酰转移酶(HCT)、苯丙氨酸解氨酶(PAL)、苯丙氨酸/酪氨酸解氨酶(PTAL)、4-香豆酸-CoA连接酶( 4CL )、肉桂醇脱氢酶(CAD)、肉桂酰辅酶α还原酶(CCR)、阿魏酸5-羟化酶( F5H )等(表1),其中,编码莽草酸/奎宁酸羟基肉桂酰转移酶(HCT)的转录本最多。黄酮醇在二氢黄酮醇-4-还原酶(DFR)、花青素合酶(ANR)、糖基转移酶的作用下合成为稳定的花青素。转录组测序中获得1个编码花色素苷3-O-葡萄糖苷转移酶( BZ1 )的转录本。
2.6.2 类胡萝卜素合成有关转录本 萜类骨架合成的牻牛儿基牻牛儿基焦磷酸(GGPP),在八氢番茄红素合成酶(crtB)催化下缩合形成八氢番茄红素的顺式异物体,然后进一步脱氢、催化合成叶黄素、胡萝卜素、玉米黄质等类胡萝卜素物质。本研究注释到的类胡萝卜素合成基因包括八氢番茄红素合成酶基因(crtB)、八氢番茄红素脱氢酶基因(PDS)、胡萝卜素去饱和酶基因(ZDS)、玉米黄质环氧化酶基因(ZEP)、紫黄质脱环氧化酶基因(VDE)、前番茄红素异构酶基因(crtISO)、胡萝卜素羟化酶基因(crtIz)、番茄红素环化酶基因(IcyE)等,共72个转录本(表2)。
2.6.3 叶绿素合成有关转录本 幼竹期至成竹期,竹秆往往表现出绿色,叶绿素是竹青中的重要色素。本研究中共富集到44个与叶绿素合成相关的基因,包括编码Glu-tRNA合成酶基因、Glu-tRNA还原酶基因、胆色素原合酶(ALAD)基因、镁螯合酶基因等。
2.7 光受体和光信号通路有关转录本
植物体通过光受体感受到各种光质的光,红光和远红光的受体为光敏色素蛋白,蓝光的受体为隐花色素(CRY)、向光素、ZTL蛋白家族等,紫外光的受体为UVB8等。这些受体感受到光信号的变化后,通过下游的信号分子将光信号传递下去。本研究共获得131个光受体和光信号通路的转录本(表1),包括光敏色素A(PHYA)转录本9个,光敏色素B(PHYB)转录本2个,蓝光受体隐花色素基因 CRY1 转录本22个、 CRY2 转录本4个,生物钟相关PAS蛋白基因ZTL转录本17个及光敏色素相互作用因子3基因( PIF3 )转录本11个、转录因子基因 HY2 转录本3个、转录因子基因 HY5 转录本12个、PHYA-1051的蛋白质抑制剂基因 (SPA1 )转录本3个、 GIANTEA(GI) 基因转录本18个、F-box蛋白1基因 (FKF1 )转录本2个等。上述转录本调控节间伸长、开花等生理过程。编码HY5蛋白的转录本具有明显的表达差异。
2.8 月月竹转录因子分析
转录因子是一种可与基因启动子区序列相结合的蛋白质,具有调控下游基因表达的功能,同时转录因子通过蛋白质互作具有参与信号传递的功能。本研究中,月月竹66 961个转录本(Unigenes)中共预测到转录因子2 079个,涵盖33个转录因子家族(图7),其中WRKY家族转录因子最多,有316个转录本,其次为AP2/ERF转录因子家族、MYB转录因子超家族、bHLH和NAC转录因子家族,含有HY5转录因子的bZIP转录因子家族也具有131个转录本。目前认为R2R3MYB类转录因子是由转录因子bHLH和转录因子WD40形成的MBW复合体,调控花青素和原花青素合成相关基因的转录[23]。本研究获得的转录本中有35转录本编码为18个R2R3MYB转录因子(表2),其中MYB2、MYB20/ODO1等转录因子与花青素和原花青素以及苯丙烷代谢的上游莽草酸合成途径有关。
2.9 长链非编码RNA(LncRNA)有关转录本
基于CNCI、CPC、PFAM及 PLEK等数据库及竹青全长转录本数据,月月竹长链非编码RNA(lncRNA)数量如图8A所示。从图中可以看出,CNCI、CPC、Pfam、Plek等数据库分别注释到9 421条、29 577条、26 436条、30 323条LncRNA,4个数据库同时注释到的LncRNA为6 359条。其中,最长的LncRNA为3 383 nt,平均长度为532.22 nt, N50 为604 nt,LncRNA长度分布见图8B所示。
3 讨 论
3.1 月月竹竹青中基因表达量较低
植物体不同部位的基因表达量并不一致,一般生长旺盛的组织,基因表达量较高,RNA数量也较多。在竹子的全生长期内,笋期RNA较丰富,而成熟的竹秆RNA丰富度较低。为了探究月月竹竹秆的变色机理,本研究利用PacBio Sequel全长转录组测序技术及生物信息学方法得到月月竹竹青变色后的高质量转录组,通过组装和质量控制,共获得高质量序列66 961条,平均长度为1 389.22 bp, N50 为1 830 bp,说明获得的序列组装完整性较高[24],但是组装序列少于生长盛期的孝顺竹笋箨(106 148条)[22],与早竹节间组装序列基本相似(63 776条)[25],表明月月竹竹青基因表达数量远小于笋箨中的基因表达数量,同时
也说明本研究所获得的全长转录组组装数据可以用于深入的分析。转录本功能注释发现,大多转录本与植物体生长发育相关,而基因表达差异分析发现,同一节间的不同颜色竹青中糖代谢基因和阳离子通道蛋白基因表达存在显著差异。多糖是组成细胞壁纤维素的主要成分,同时细胞壁上含有大量的钙、硅和钠离子,说明不同颜色竹青细胞壁上的多糖和钙、硅和钠离子存在显著差异。本实验室通过透射电镜观察发现,月月竹竹青向光面细胞壁厚度明显高于背光面,推测可能正是竹青变色后,不同颜色竹青糖代谢和阳离子运动差异导致的。Qi等[26]研究发现,番茄和拟南芥叶片背面与腹面由于极性信号差异导致细胞壁的力学异质性,同样与细胞壁果胶的结构变化有关[26]。
3.2 光是诱导竹青变色的主要信号
秋冬和春季时,寒竹属(月月竹、刺黑竹、金佛山方竹、筇竹等)、唐竹属、悬竹属、苦竹属及箭竹属竹子中都出现同一节竹秆向阳面呈现紫色、背阴面呈绿色的现象,这种现象在鸡爪槭、红叶石楠等植物中亦有发现。大量研究结果表明光照导致的植物变色与花青素的合成有关,Kondo等[27]发现,蓝光处理下葡萄花青素含量显著高于正常处理,而红光处理下花青素含量低于正常处理。宋哲等[28]研究发现UVB光源能影響红富士苹果的着色。因此本研究认为这种现象与光信号有关。本研究在组装的转录本中共获得了131个光信号相关转录本,同时基因表达差异分析也发现同一节间不同颜色的竹青光信号关键转录因子HY5表达量存在明显的差异。光不仅为植物体的光合作用提供能量,同时也作为信号诱导植物体的形态建成,调控植物体的生长发育(去黄化、叶绿体发育、光周期和开花等生理过程),但是光照度过高同样会对植物体造成伤害,诱导植物体产生一些光保护物质[12-13,29]。光信号的传递首先是被光受体感知,然后通过一些信号蛋白及转录因子将光信号放大,调控基因的表达,使得植物产生应激性响应,例如产生黄酮类和花青素类抗氧化物质。目前发现的光受体包括感受红光和远红光的光敏色素(PHYA、PHYB等),感受蓝光的隐花色素(CRY)、向光素、ZTL蛋白家族等,感受紫外光的UVB8蛋白等,这些受体感受到光密度、光质以及光周期后,通过MYB、PIFs、COPs、SPAs、HY5以及GI蛋白将光信号进行传递[7,12,30-31]。本研究组装获得的转录本中有131个转录本明显注释到光信号通路中,包括红光和远红光的受体PHYA、PHYB。
目前研究认为温度亦是影响植物变色的重要环境因子,原因在于低温能促进叶绿素降解,诱导花色素苷合成,从而使植物叶片在秋季呈现红色,例如红枫叶片的变红和苹果的变红。目前的研究发现光敏色素phyB同时亦是温度受体[32],但是自然界中仍然存在很多植物体在春季就表现出红色的现象,例如红叶石楠往往在向阳一侧要花红于背阴一侧,春季樱花的花托在向光一侧表现出红色,而背阴一侧并不变红。本课题组前期研究发现,在5 d以上 8 μmol/(s·m2)的蓝光刺激下,种植于25 ℃恒温气候室中的月月竹竹秆就会表现出明显的紫色,这种现象在坝竹、鹅毛竹等竹种上亦有发生。但如果使用不含蓝光的光源或者使用橙色透光膜处理月月竹竹秆,即使在-2~4 ℃的环境下,竹秆也不会出现变色现象[1]。这说明虽然温度可以影响竹秆的变色,但是引起竹秆变色的主要因素仍然为光,但光和温度协同调控竹秆变色的机制目前仍然不清楚。
3.3 激素参与月月竹竹秆中花青素的合成
高等植物中含有丰富的色素[33-37],这些色素有助于植物光合作用、吸引传粉者、抵御天敌以及生长发育。植物中重要的色素有叶绿素、类胡萝卜素、花青素和类黄酮等。目前认为光照、温度、糖类以及激素等因子能调节液泡pH值,从而影响花青素的合成和植物的呈色。光通过光受体以及光信号分子诱导植物体颜色的改变。激素通过调控茉莉酸、脱落酸(ABA)和生长素的代谢,从而影响花青素的合成[38]。本研究通过基因表达差异分析发现多个基因被富集到ABA信号途径中,因此,月月竹竹秆的变色还可能与ABA信号有关,但确切的调控机制还需要进一步分析。
3.4 光信号通过转录因子调控花青素的合成
竹秆中花青素和类黄酮的合成是受转录因子调控的,参与黄酮类物质合成调控的转录因子主要是2类R2R3MYB转录因子:一类是能与bHLH和WD40形成MBW复合体的R2R3MYB转录因子,该转录因子处于花青素合成的下游,调控花青素和原花青素相关基因转录,在拟南芥中主要有PAP1/PAP2、MYB113、GL3/EGL3、TT8和TTG1转录因子等;另一类为不依赖bHLH和WD40因子的R2R3MYB转录因子,主要调控黄烷酮合成。例如,玉米中的P1蛋白以及MYB12、MYB111和MYB11。本次组装获得的转录本中共有18个由35个转录本编码的R2R3MYB转录因子,其中MYB2、MYB20/ODO1、MYB6-like、Myb-related protein308等转录因子与花青素和原花青素以及苯丙烷代谢上游的莽草酸合成有关[39-41]。Xiao等[31]研究发现,光通过HY5蛋白对黄酮类物质的合成进行调控,HY5在BBX家族蛋白辅助作用下,结合ACEs(含有ACGT的原件),激活 CHS、CHI、F3H、F3H、MYB12和PAP1 等基因的表达,且HY5-BBX结合单元具有比较好的保守性。本研究获得的转录本中,有12个编码HY5蛋白,其中HY5_PH02Gene29106、HY5_PH02Gene25237在同一节间的不同部位有明显的表达差异。HY5蛋白处于多种光受体的下游,在光信号传递中发挥着重要作用[31],同时,还在下胚轴生长抑制、根伸长、色素合成和积累、各种激素信号响应以及高温和低温响应等生理过程中发挥着重要作用[31,41]。
3.5 LncRNA可能参与月月竹竹秆中花青素的积累
LncRNA是一种非编码蛋白质的RNA,具有调控基因表达以及催化和稳定基因结构的作用。LncRNA通过对基因启动子、非翻译区、外显子、内含子以及终止子等区域的作用,调控染色体结构、转录、剪切以及翻译,进而影响到基因的表达,调控植物开花时间、生殖器官发育及响应生物与非生物胁迫[42-43]。Sun等[44]研究结果表明随着蓝光处理时间的增加,拟南芥下胚轴lncRNA数量明显增加;Yang等[45]研究发现miRNA156a与lncRNA相互作用调控SPL2like和SPL33转录因子的表达,从而调控苹果皮花青素的合成。本研究中,CNCI、CPC、PFAM以及PLEK 4个数据库同时注释到的月月竹竹青LncRNA 6 359条,远多于毛竹和孝顺竹中预测的LncRNA数目[46],但LncRNA数量与花青素积累的关系还有待进一步的分析。
参考文献:
[1] 杜喜春,赵银萍,何祥博,等. 竹类植物开花生理研究现状[J]. 竹子学报,2018,37(3):7-11.
[2] 杨秀田,董文渊,邓天吉,等. 竹类植物在赤水市乡村景观建设中的应用[J]. 竹子学报,2021,40(4):37-43.
[3] 赵 芸. 地被类观赏竹的景观优势及应用[J]. 世界竹藤通讯,2020,18(6):48-50,54.
[4] 史军義,易同培,马丽莎,等. 中国观赏竹[M]. 北京:科学出版社, 2012.
[5] 刘昌来,熊 星,李天帅,等.基于转录组分析色膜覆盖下月月竹竹青变色机制[J/OL]. 植物生理学报. https://link.cnki.net/urlid/31.2055.Q.20231222.1158.003.
[6] 贾梦晗,杨 洋,张一含,等. 不同蓝光强度连续供光对生菜形态建成、光合特性及营养离子吸收的影响[J/OL]. 中国生态农业学报. http://link.cnki.net/urlid/13.1432.S.20240301.1458.002.
[7] DOU H, NIU G. Plant responses to light[M]. London:Academic Press,2020:153-166.
[8] THOMAS B, MURRAY B G, MURPHY D J. Encyclopedia of applied plant sciences[M]. New York:Academic Press,2016.
[9] 杨立文,付建新,亓 帅, 等. 高等植物开花时间的蓝光调控: 隐花色素介导的光信号传导[J]. 分子植物育种,2015,13(2):450-460.
[10] SUETSUGU N, WADA M. Signalling mechanism of phototropin-mediated chloroplast movement in Arabidopsis[J]. Journal of Plant Biochemistry and Biotechnology,2020,29(4):580-589.
[11] MATTHEWS J S, VIALET-CHABRAND S, LAWSON T. Role of blue and red light in stomatal dynamic behaviour[J]. Journal of Experimental Botany,2020,71(7):2253-2269.
[12] LANDI M, ZIVCAK M, SYTAR O, et al. Plasticity of photosynthetic processes and the accumulation of secondary metabolites in plants in response to monochromatic light environments:a review[J]. Biochimica et Biophysica Acta-Bioenergetics,2020,1861(2):148131.
[13] MUZZOPAPPA F, KIRILOVSKY D. Changing color for photoprotection: the orange carotenoid protein[J]. Trends in Plant Science,2020,25(1):92-104.
[14] MOUSTAKA J, TANOU G, GIANNAKOULA A, et al. Anthocyanin accumulation in poinsettia leaves and its functional role in photo-oxidative stress[J]. Environmental and Experimental Botany,2020,175:104065.
[15] LU Y, GAN Q, IWAI M, et al. Role of an ancient light-harvesting protein of PSI in light absorption and photoprotection[J]. Nature Communications,2021,12(1):679.
[16] NAIK J, MISRA P, TRIVEDI P K, et al. Molecular components associated with the regulation of flavonoid biosynthesis[J]. Plant Science,2022,317:111196.
[17] 魏 强,丁雨龙. 矢竹地下茎转录组测序及节间生长相关基因表达分析[J]. 南京林业大学学报 (自然科学版),2017,60(5):42-48.
[18] MA D, DONG S, ZHANG S, et al. Chromosome-level reference genome assembly provides insights into aroma biosynthesis in passion fruit (Passiflora edulis)[J]. Molecular Ecology Resources,2021,21(3):955-968.
[19] WEI Q, JIAO C, GUO L, et al. Exploring key cellular processes and candidate genes regulating the primary thickening growth of Moso underground shoots[J]. New Phytologist, 2017, 214(1): 81-96.
[20] WEI Q, GUO L, JIAO C, et al. Characterization of the developmental dynamics of the elongation of a bamboo internode during the fast growth stage[J]. Tree Physiology,2019,39(7):1201-1214.
[21] WEI Q, JIAO C, DING Y, et al. Cellular and molecular characterizations of a slow-growth variant provide insights into the fast growth of bamboo[J]. Tree Physiology,2017,38(4):1-14.
[22] 鞠 燁,江建平,尹增芳,等. 孝顺竹笋箨全长转录组测序分析[J]. 南京林业大学学报(自然科学版),2020,44(6):175-183.
[23] GROTEWOLD, SAINZ, TAGLIANI, et al. Identification of the residues in the Myb domain of maize C1 that specify the interaction with the bHLH cofactor R[J]. Proceedings of the National Academy of Sciences of the United States of America,2000,97(25):13579-13584.
[24] 孙铭阳,徐世强,顾 艳,等. 穿心莲全长转录组测序及特性分析[J]. 中国农学通报,2021,37(27):82-89.
[25] WEI H T, HOU D, ASHRAF M F, et al. Metabolic profiling and transcriptome analysis reveal the key role of flavonoids in internode coloration of Phyllostachys violascens cv. Viridisulcata[J]. Frontiers in Plant Science,2022,12:788895.
[26] QI J, WU B, FENG S, et al. Mechanical regulation of organ asymmetry in leaves[J]. Nature Plants,2017,3(9):724-733.
[27] KONDO S, TOMIYAMA H, RODYOUNG A, et al. Abscisic acid metabolism and anthocyanin synthesis in grape skin are affected by light emitting diode (LED) irradiation at night[J]. Journal of Plant Physiology,2014,171(10):823-829.
[28] 宋 哲,李天忠,徐贵轩,等. 光质对‘红富士苹果果实着色的影响[J]. 生态学报,2009,29(5):130-137.
[29] BAG P. Light harvesting in fluctuating environments: evolution and function of antenna proteins across photosynthetic lineage[J]. Plants,2021,10(6):1184.
[30] SAITOH A, TAKASE T, ABE H, et al. ZEITLUPE enhances expression of PIF4 and YUC8 in the upper aerial parts of Arabidopsis seedlings to positively regulate hypocotyl elongation[J]. Plant Cell Reports,2021,40:479-489.
[31] XIAO Y, CHU L, ZHANG Y, et al. HY5:a pivotal regulator of light-dependent development in higher plants[J]. Frontiers in Plant Science,2022,12:800989.
[32] 隋心意,赵小刚,陈鹏宇,等. 生菜Ls PHYB可变剪接体的克隆与高温诱导表达模式[J]. 中国农业科学,2022,55(9):1822-1830.
[33] 刘 皓,安晓芹,史宗源,等. 不同改良措施对连作色素万寿菊生长发育及根际土壤环境的影响[J]. 江苏农业科学,2023,51(6):136-143.
[34] 乔子纯,贺 琰,代红军,等. 外源油菜素内酯对美乐葡萄光合特性和果实品质的影响[J]. 南方农业学报,2022,53(8):2251-2260.
[35] 朱 璐,闻 婧,马秋月,等. 鸡爪槭金陵丹枫和金陵黄枫叶片呈色分析[J]. 江苏农业学报,2022,38(2):521-527.
[36] 申 敏,柴友荣. 基于RNA干扰抑制油菜种皮色素合成[J]. 江苏农业科学,2023,51(1):44-49.
[37] 刘 红,魏晓羽,马 辉,等. 几种兰属地生种花瓣花色素组成分析[J]. 江苏农业学报,2022,38(6):1657-1677.
[38] 赵杰堂. 激素调控植物花青素合成分子机制的研究进展[J].分子植物育種,2016,14(7):1884-1891.
[39] DHAKAREY R, YARITZ U, TIAN L, et al. A Myb transcription factor, Pg Myb308-like, enhances the level of shikimate, aromatic amino acids, and lignins, but represses the synthesis of flavonoids and hydrolyzable tannins, in pomegranate (Punica granatum L.)[J]. Horticulture Research,2022,9:uhac008.
[40] JUN J H, LIU C, XIAO X, et al. The transcriptional repressor MYB2 regulates both spatial and temporal patterns of proanthocyandin and anthocyanin pigmentation in Medicago truncatula[J]. The Plant Cell,2015,27(10):2860-2879.
[41] NAIK J, MISRA P, TRIVEDI P K, et al. Molecular components associated with the regulation of flavonoid biosynthesis[J]. Plant Science,2022,317:111196.
[42] PATRA G K, GUPTA D, ROUT G R, et al. Role of long non coding RNA in plants under abiotic and biotic stresses[J]. Plant Physiology and Biochemistry,2023,194:96-110.
[43] WIERZBICKI A T, BLEVINS T, SWIEZEWSKI S. Long noncoding RNAs in plants[J]. Annual Review of Plant Biology,2021,72:245-271.
[44] SUN Z, HUANG K, HAN Z, et al. Genome-wide identification of Arabidopsis long noncoding RNAs in response to the blue light[J]. Scientific Reports,2020,10(1):6229.
[45] YANG T, MA H, ZHANG J, et al. Systematic identification of long noncoding RNAs expressed during light-induced anthocyanin accumulation in apple fruit[J]. The Plant Journal,2019,100(3):572-590.
[46] WANG T, WANG H, CAI D, et al. Comprehensive profiling of rhizome-associated alternative splicing and alternative polyadenylation in moso bamboo (Phyllostachys edulis)[J]. The Plant Journal,2017,91(4):684-699.
(责任编辑:石春林)

