保肝颗粒对大鼠酒精性肝损伤的早期干预作用
朱正望, 高达, 郭桓博, 赵静涵, 王琳琳, 苗明三, 朱平生*
(1.河南中医药大学第一临床医学院, 郑州 450046; 2.河南中医药大学药学院, 郑州 450046)
酒精性肝病(alcoholic liver disease, ALD)是临床常见的一种肝病,随着经济社会的发展,ALD的发病率呈逐年上升趋势[1-2]。研究表明,进入人体的酒精90%以上在肝脏代谢,可导致肝细胞破坏,持续性的肝细胞损伤会引发肝炎、肝硬化甚至肝癌[3-4]。目前临床上主要是采取戒酒和药物治疗综合干预,但由于其临床症状为非特异性,也可无症状,发展过程较隐匿,不易被感知,故此在确诊时,肝损伤往往已较重,且患者早期用药依从性较差,这就使ALD的早期干预成为临床治疗上的难点[5-6]。因此,针对ALD的早发现、早干预对重型肝病的防治和保障大众健康具有十分重要的意义。
中医药在防治ALD方面发挥着重要作用,本研究中的保肝颗粒选用药食同源药材组方,能在不增加肝脏负担的前提下,发挥保肝作用,患者接受度好、依从性高,已获得国家发明专利(专利号:ZL 2016 1 1252370.X),具有深入研究的价值。近年来相关研究发现,中医药可以通过减少炎症、降低自由基的损伤、调节免疫功能、改善肝功能等来修复受损肝细胞,起到保护肝脏的作用,应用前景广阔[7-8]。但其研究多集中于中医药对ALD的治疗,鲜见从早期生物标志物入手研究ALD的早期发现及预防。前期实验研究发现,嘌呤核苷酸磷酸化酶(purine nucleotide phosphorylase, PNP)、谷氨酸脱氢酶(glutamate dehydrogenase, GLDH)、精氨酸酶1(arginase 1, Arg-1)和α-谷胱甘肽-S-转移酶(α-glutathione S-transferase, α-GST)作为早期生物标志物较ALT、AST等传统肝功能检测指标更加灵敏,对早期肝损伤的诊断有较高的价值[9]。因此,通过检测ALD大鼠传统肝功能指标、早期生物标志物、相关细胞因子以及脂质过氧化指标,动态观察保肝颗粒对ALD早期的干预作用。
1 材料与方法
1.1 实验动物
Wistar大鼠144只,SPF级,体重180~200 g,雌雄各半,购于济南朋悦实验动物繁育有限公司,实验动物许可证号:SCXK(鲁)2014-0007。河南中医药大学动物实验中心许可证号:SYXK(豫)2015-0005,本实验由河南中医药大学实验动物伦理委员会批准:DWLL16010005。
1.2 实验药物与试剂
保肝颗粒由茵陈30 g、栀子20 g、枸杞子30 g、五味子20 g、薏苡仁20 g、乌梅15 g、葛根30 g、大枣30 g、甘草9 g组成,由河南中医药大学制剂室制备;联苯双酯(万邦德制药集团有限公司,批号:A020141140);无水乙醇(天津市永大化学试剂有限公司,批号:20150724);丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、碱性磷酸酶(alkaline phosphatase, ALP)、总胆红素(total bilirubin, TBIL)试剂盒(上海复星长征医学科学有限公司,批号:D1507053、D1507073、D1506073、D1507013);超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)试剂盒(南京建成生物工程研究所,批号:20160121、20160130);肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-6(interleukin-6, IL-6)、PNP、GLDH、Arg-1、α-GST ELISA试剂盒(苏州卡尔文生物科技有限公司,批号:E20160701A、20160810)。
1.3 实验仪器
MULTIFUGE X3R高速冷冻离心机(赛默飞世尔科技有限公司),HH-S4恒温水浴锅(巩义市予华仪器有限责任公司),Cytation 3型酶标仪(美国BioTek仪器有限公司),UV-1901紫外可见分光光度计(上海奥析科学仪器有限公司),BS-2000全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司),如图1所示。

图1 实验仪器图片Fig.1 Experimental instrument picture
1.4 实验方法
1.4.1 动物分组与给药
将144只Wistar大鼠于实验室适应性喂养7 d,随机分为空白组、模型组、联苯双酯组、保肝颗粒低、中、高剂量组,每组24只,雌雄各半。每日禁食不禁水6 h后,联苯双酯组(3.75 mg/kg,相当于临床成人用量的10倍)按相应浓度灌胃给药,保肝颗粒低、中、高剂量组分别给予低、中、高(17、34、68 g/kg,相当于临床成人用量的5、10、20倍)剂量保肝颗粒混悬液灌胃,空白组和模型组给予等体积蒸馏水灌胃,10 mL/kg。
1.4.2 造模与取材
给药1 h后除空白组外,其余各组按10 mL/kg灌胃50%乙醇,再1 h后按前用量重复灌胃50%乙醇一次,空白组灌胃等体积蒸馏水,连续6 d。在实验开始的第2、3、4、6天酒精灌胃3 h后分别随机取每组大鼠6只,麻醉后腹主动脉取血;处死各组动物,解剖并剥离肝脏,取适量肝组织匀浆[10]。
1.4.3 肝功能指标检测
腹主动脉取血,3 500 r/min离心10 min,分离血清,采用全自动生化分析仪检测血清中ALT、AST、ALP、TBIL水平。
1.4.4 血清炎症因子检测
采用酶联免疫吸附法(ELISA)检测血清中TNF-α、IL-6水平,具体操作步骤按ELISA试剂盒说明书进行。
1.4.5 肝组织指标检测
称取适量肝右叶加预冷生理盐水,组织匀浆器研磨,配制成10%的肝组织匀浆,3 500 r/min离心10 min,取上清液,采用微板法检测肝组织匀浆中SOD水平,比色法检测MDA水平。
1.4.6 血清早期生物标志物检测
采用酶联免疫吸附法(ELISA)检测血清中PNP、GLDH、Arg-1、α-GST水平,具体操作步骤按ELISA试剂盒说明书进行。
实验流程如图2所示。
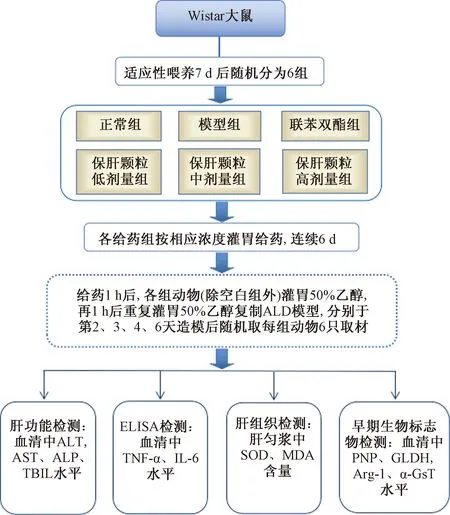
图2 实验设计路线图Fig.2 Experimental design roadmap
1.5 统计学方法
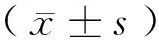
2 结果
2.1 保肝颗粒对酒精性肝损伤大鼠血清ALT、AST、ALP、TBIL的影响
与空白组比较,模型组大鼠血清中ALT、AST、ALP、TBIL水平在2、3、4、6 d明显升高(P<0.05,P<0.01),且随着时间的增加呈递增趋势;与模型组比较,联苯双酯组、保肝颗粒组大鼠血清中ALT、AST、ALP、TBIL水平均有不同程度的降低(P<0.05,P<0.01),表明保肝颗粒可明显改善酒精性肝损伤大鼠的肝功水平。结果如表1所示。

表1 保肝颗粒对酒精性肝损伤大鼠血清ALT、AST、ALP、TBIL水平的影响Table 1 Effects of Baogan Granules on serum levels of ALT, AST, ALP and TBIL in rats with alcoholic liver injury n=6)
2.2 保肝颗粒对酒精性肝损伤大鼠血清TNF-α、IL-6的影响
与空白组比较,模型组大鼠血清中TNF-α、IL-6水平在2、3、4、6 d均明显升高(P<0.01),说明酒精进入体内后,造成了肝脏的损伤,致使机体释放炎症因子;与模型组比较,联苯双酯组、保肝颗粒组大鼠血清中TNF-α、IL-6水平均有不同程度的降低(P<0.05,P<0.01),表明保肝颗粒可抑制机体炎症因子的释放,减轻炎症反应。结果如表2所示。
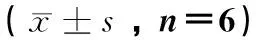
表2 保肝颗粒对酒精性肝损伤大鼠血清TNF-α、 IL-6水平的影响
2.3 保肝颗粒对酒精性肝损伤大鼠肝匀浆MDA、SOD的影响
与空白组比较,模型组大鼠肝匀浆中MDA水平在2、3、4、6 d不断升高,SOD水平明显降低(P<0.05,P<0.01);与模型组比较,联苯双酯组、保肝颗粒组大鼠肝匀浆中MDA水平在2、4、6 d明显降低,SOD水平在3、4、6 d明显升高(P<0.05,P<0.01),表明保肝颗粒可减少酒精性肝损伤模型大鼠肝脏脂质过氧化产物的生成,增加抗氧化活性。结果如表3所示。
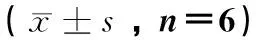
表3 保肝颗粒对酒精性肝损伤大鼠肝匀浆MDA、 SOD水平的影响
2.4 保肝颗粒对酒精性肝损伤大鼠血清PNP、GLDH、Arg-1、α-GST水平的影响
与空白组比较,模型组大鼠血清中PNP、GLDH、Arg-1、α-GST水平虽在2、3、4、6 d均升高(P<0.05,P<0.01),但在酒精灌胃后的第2天即有明显的升高,之后有下降趋势,说明PNP、GLDH、Arg-1、α-GST作为新型的早期生物标志物对酒精性肝损伤有较好的灵敏性;与模型组比较,联苯双酯组、保肝颗粒组大鼠血清中PNP、GLDH、Arg-1、α-GST水平均有不同程度的降低(P<0.05,P<0.01),表明保肝颗粒可以在酒精性肝损伤早期即起到明显的肝脏保护作用。结果如表4所示。
表4 保肝颗粒对酒精性肝损伤大鼠血清PNP、GLDH、Arg-1、α-GST水平的影响
3 讨论
古代中医文献中并没有ALD这一病名,可将其归为“胁痛”等范畴[11]。酒性湿热,过量饮酒可使湿热郁结,阻遏脾胃,使脾胃丧失其升清降浊之用,同时湿热煎灼日久易耗伤阴液,致使肝肾阴虚;或者酒入人体,损伤肝胆,使肝疏泄功能失常,气机逆乱[12]。因此,ALD的病位主要在脾胃肝胆,久则及肾。保肝颗粒由茵陈、栀子、枸杞子、五味子、薏苡仁、乌梅、葛根、大枣、甘草组成,方中茵陈清热祛湿退黄为君药;栀子清利肝胆两经之湿热,枸杞子补益肝肾,二者相合补泻兼施同为臣药;五味子、乌梅益气生津,薏苡仁健脾、渗湿利水,葛根升举中焦阳气、生津,共为佐药;甘草、大枣补益脾胃,调和诸药,用为使药;诸药合用共奏清热利湿、调和肝脾、养阴柔肝之功。现代药理研究表明,保肝颗粒中主要药物均有一定的保肝护肝作用,如茵陈对多种类型肝损伤具有保护作用,其肝保护机制与抗炎、抗氧化、调节胆汁酸代谢、抑制肝细胞凋亡等有关[13];栀子常用于自身免疫性疾病、肝损伤等治疗,其活性成分具有调节免疫、减少炎症因子产生和抗氧化等多种药理作用[14];枸杞子中的化学成分具有抗氧化、保肝、调节免疫等多种药理活性[15];五味子中的主要化学成分具有保肝降酶、减轻肝细胞脂质过氧化损伤、恢复受损肝细胞的作用[16];薏苡仁含有多种活性物质,具有抗炎、抗氧化、提高机体免疫等活性[17]。
乙醇因其主要在肝脏代谢,过量饮酒时超过肝脏代谢能力,酒精便在体内蓄积,具有肝毒性的乙醇和其代谢产物可直接损伤肝细胞及其细胞器,造成肝脏损伤[18-19]。AST、ALT一直是临床上用于检查肝脏疾病使用最多的指标,常用来评价肝功能的异常,当肝脏受到损伤时,细胞线粒体和胞浆内的AST、ALT进入血液,使血清中AST、ALT的活性升高[20]。同时,肝脏的损伤导致体内ALP、TBIL排泄障碍而反流入血,从而引起血清ALP、TBIL水平增高。本实验结果显示,模型组大鼠血清中AST、ALT、ALP、TBIL水平明显升高,给药后,保肝颗粒各剂量组均能不同程度的降低大鼠血清中AST、ALT、ALP、TBIL水平,对改善肝功能有显著的作用。
ALD的具体发病机制尚不完全清楚,“二次打击”学说认为,其与氧化应激和脂质过氧化、炎症因子的释放、线粒体功能障碍等多种因素密切相关,而氧化应激在ALD的发生、发展过程中起着关键作用[21-22]。生理状态下,机体氧化和抗氧化系统处于动态平衡状态,过量摄入酒精,乙醇在肝脏代谢过程中产生的ROS和乙醛可降低肝脏抗氧化系统的活性,破坏肝脏的氧化还原平衡,肝脏中活性氧生成增多,而氧化产物作为氧化应激反应的诱发因素,进而对肝细胞形成“二次打击”,引起肝细胞发生炎症、坏死,由此引起一系列肝脏的病理损伤[23]。MDA作为生物体脂质过氧化的标志物,可引起细胞肿胀、坏死[24]。SOD是细胞内抵抗氧化应激最重要的一种酶,能很好的清除自由基,对抗氧化应激,使机体免受氧化的损伤[25]。氧化应激下ROS的增加可导致TNF-α、IL-6等促炎细胞因子的释放,加重炎症反应,进一步损害肝功能,加速ALD的疾病进程,引起肝脏纤维化、肝硬化,甚至肝癌的发生[26]。研究发现,模型组大鼠血清中TNF-α、IL-6水平、肝匀浆中MDA水平明显升高,肝匀浆中SOD水平明显降低;保肝颗粒干预后,在不同的时间段内可以不同程度的降低大鼠血清中TNF-α、IL-6水平、肝匀浆中MDA水平,升高肝匀浆中SOD水平,提示保肝颗粒可通过改善ALD模型大鼠的氧化应激损伤起到保护肝脏的作用。
酒精造成的肝脏综合性影响不容忽视,发生肝损伤后,早期可通过及时服用相应药物予以纠正,若未在损伤早期进行干预,持续性的肝损伤易发展为肝纤维化、肝硬化甚至肝癌[27]。目前ALT、AST是临床上评价肝损伤的重要指标,然而这些指标常在肝细胞发生较重的实质性损伤后才会出现明显变化,且酒精性肝损伤患者早期一般无明显临床症状,因此能够更早的发现病变,尽早进行干预,对于防止病情发展有着重要的意义。PNP是嘌呤补救途径中的关键酶,只有当肝细胞受损时才能在血液中检测出来;GLDH是一种细胞线粒体酶,在肝组织中分布最多,肝损伤时血液中的GLDH升高;Arg-1主要分布于肝细胞核、微粒体,是肝脏中一种重要的水解酶;α-GST 是谷胱甘肽结合反应的关键酶,存在于肝小叶中心细胞,其分子量小,在肝损伤早期阶段就会透过细胞膜进入血液[28]。课题组前期研究发现,PNP、GLDH、Arg-1和α-GST可以作为肝损伤早期检测生物标志物,且较传统肝功能检测有较强的灵敏性[9]。本实验在前期研究的基础上进一步发现,ALD模型组大鼠血清中PNP、GLDH、Arg-1和α-GST在肝损伤时出现较早,且变化更为明显。
4 结论
通过动态观察ALD大鼠血清中肝功能指标、早期生物标志物、相关细胞因子以及肝组织中脂质过氧化指标,结果表明,保肝颗粒在酒精性肝损伤早期即可起到较好的保护作用,且其可以通过减少炎性因子释放、增强机体的抗氧化能力,从而减轻肝脏损伤,恢复肝脏功能。

