基于非靶向代谢组学的药膳鱼汤代谢产物差异分析
王益娟 周芳 焦文娟 赵甜甜 林以琳 张业辉 南海军 黄文


DOI:10.3969/j.issn.1000-9973.2024.05.025
引文格式:王益娟,周芳,焦文娟,等.基于非靶向代谢组学的药膳鱼汤代谢产物差异分析[J].中国调味品,2024,49(5):148-155.
WANG Y J, ZHOU F, JIAO W J, et al.Differential analysis of metabolites in medicinal diet fish soup based on non-targeted metabonomics[J].China Condiment,2024,49(5):148-155.
摘要:药膳鱼汤是一道滋补价值高的佳肴,关于其化学组成特征的研究相对较少。因此,该研究以鱼汤、药膳鱼汤为研究对象,利用超高效液相色谱-质谱联用(ultra performance liquid chromatography-mass spectrometry,UPLC-MS/MS)代谢组学技术,结合主成分分析(principal components analysis,PCA)、正交偏最小二乘-判别分析(orthogonal partial least squares-discrimination analysis,OPLS-DA)等多元统计学方法,探究药膳鱼汤的差异代谢物。采用变量投影重要性VIP>1且P<0.05的标准,筛选差异显著的代谢物,并进行代谢通路分析。结果显示,共鉴定出20类176个差异代谢物,其中包括35个氨基酸及其衍生物,38个脂肪酰类,25个有机酸及其衍生物,17个核苷酸及其衍生物,10个碳水化合物及其衍生物,以及18个黄酮化合物。KEGG功能通路富集分析筛选出6条代谢通路,包括氨基酸的生物合成、缬氨酸、亮氨酸和异亮氨酸的生物合成、核苷酸糖的生物合成、ABC转运蛋白、咖啡因代谢以及半胱氨酸和蛋氨酸代谢。非靶向代谢组学从整体水平上揭示了药膳鱼汤的代谢差异,为其鉴别和品质评价提供了方向。
关键词:药膳鱼汤;非靶向代谢组学;差异代谢物;通路分析
中图分类号:TS254.4 文献标志码:A 文章编号:1000-9973(2024)05-0148-08
Differential Analysis of Metabolites in Medicinal Diet Fish Soup
Based on Non-Targeted Metabonomics
WANG Yi-juan1,2, ZHOU Fang2, JIAO Wen-juan2, ZHAO Tian-tian2,
LIN Yi-lin3, ZHANG Ye-hui2*, NAN Hai-jun1*, HUANG Wen4
(1.School of Traditional Chinese Medicine, Guangdong Pharmaceutical University, Guangzhou 510006, China;
2.Key Laboratory of Agricultural Products Processing in Guangdong Province, Key Laboratory of
Functional Foods, Ministry of Agriculture and Rural Affairs, Sericultural & Agri-food Research
Institute, Guangdong Academy of Agricultural Sciences, Guangzhou 510610, China; 3.School
of Food Science and Engineering, South China University of Technology,
Guangzhou 510641, China; 4.Fisheries Research Institute, Guangdong
Academy of Agricultural Sciences, Guangzhou 510645, China)
Abstract: Medicinal diet fish soup is a delicacy with high nutritional value, but the research on its chemical composition characteristics is relatively few. Therefore, in this study, with fish soup and medicinal diet fish
收稿日期:2023-12-28
基金項目:广东省重点领域研发项目(2021B0202060001);广东省农业科学院水产协同中心项目(XT202303);佛山市市院合作水产预制菜研发中心(202401);揭阳市科技大专项(2022DZX018)
作者简介:王益娟(1991—),女,硕士,研究方向:功能性食品。
*通信作者:张业辉(1979—),男,研究员,博士,研究方向:水产品加工;
南海军(1974—),男,副教授,博士,研究方向:中药学。
soup as the research objects, ultra-performance liquid chromatography-mass spectrometry (UPLC-MS/MS) metabonomics technology combined with principal component analysis (PCA), orthogonal partial least squares-discrimination analysis (OPLS-DA) and other multivariate statistical methods is used to investigate the differential metabolites in medicinal diet fish soup. Metabolites with significant differences are screened based on the criteria of variable importance in projection (VIP)>1 and P<0.05, and metabolic pathway analysis is carried out. The results show that a total of 20 categories and 176 differential metabolites are identified, including 35 amino acids and their derivatives, 38 fatty acyls, 25 organic acids and their derivatives, 17 nucleotides and their derivatives, 10 carbohydrates and their derivatives, and 18 flavonoid compounds. Through KEGG functional pathway enrichment analysis, six metabolic pathways are screened, including the biosynthesis of amino acids, the biosynthesis of valine, leucine and isoleucine, the biosynthesis of nucleotide sugars, ABC transporters, the metabolism of caffeine, and the metabolism of cysteine and methionine. Non-targeted metabonomics reveals the metabolic differences of medicinal diet fish soup at the overall level, which has provided a direction for its identification and quality evaluation.
Key words: medicinal diet fish soup; non-targeted metabolomics; differential metabolites; pathway analysis
乌鳢,或称乌鱼、黑鱼,因其肉质鲜嫩,富含蛋白质、氨基酸、不饱和脂肪酸等多种营养物质而备受推崇。传统的食用方式是熬汤,尤其在术后康复阶段,被认为是一道具有高度滋补价值的佳肴[1]。黄芪和当归是常用的药食两用药材,富含皂苷、黄酮、多糖等生物活性成分。在乌鳢鱼汤中添加这些药食同源性物质,可以提升鱼汤的滋补效果[2-4]。当前,对乌鳢鱼汤的研究主要集中在风味物质、营养成分等特定物质含量的测定方面[5-6],而对鱼汤整体代谢物特征的差异鲜有报道。
代谢组学作为一种新型的应用于食品质量分析的工具,能够全面分析食品基质中的代谢物,并对其中各种小分子代谢物进行鉴定和定量分析。代谢组学借助于复杂的分析方法,鉴定食品基质中的差异代谢物,进而揭示涉及关键代谢物的生化途径[7]。目前,非靶向代谢组学技术在肉类研究领域取得了显著进展,特别是在探索肉类品质、揭示肉类与营养之间的关系以及分析肉制品生理变化等方面[8-11]。Wang等[12]采用非靶向代谢组学分析传统发酵鱼产品中代谢物和相关代谢途径的变化。Siddabasave等[13]运用超高效液相色谱联用的非靶向脂质学方法,全面分析和检测了11种食用鱼的未知脂质。
采用非靶向代谢组学技术,全面检测样品中的代谢物,反映药膳鱼汤中的总代谢物特征。本研究以鱼汤和药膳鱼汤为对象,运用超高效液相色谱-质谱非靶向代谢组学方法分析两者的代谢物组成。通过主成分分析和正交偏最小二乘-判别分析,筛选出差异显著代谢物,并对其进行关键代谢通路分析,以探究鱼汤和药膳鱼汤代谢物的差异。本研究旨在为药膳鱼汤营养成分和风味化合物的研究提供理论基础。
1 材料与方法
1.1 材料
乌鳢:市售;黄芪、当归:亳州经方堂药业有限公司。
1.2 试剂
甲醇、乙腈(均为色谱纯):美国Merck公司;乙酸(色谱纯):上海易恩化学技术有限公司;甲酸铵、氨水、甲酸(均为色谱纯):上海阿拉丁生化科技股份有限公司。
1.3 仪器与设备
Triple TOF 6600+质谱仪 美国SCIEX公司;LC-30A超高效液相色谱仪 日本Shimadzu公司;5424R离心机 德国Eppendorf公司;MU-G02-0448恒温金属混匀仪 杭州米欧仪器有限公司;CentriVap离心浓缩仪 美国Labconco公司;KQ5200E超声清洗仪 昆山市超声仪器有限公司。
1.4 方法
1.4.1 样品的制备
1.4.1.1 对照组鱼汤样品的制备
选取重量约为250 g的整条乌鳢,加入6倍量热水,100 ℃煮制3 h。
1.4.1.2 药膳组鱼汤样品的制备
黄芪、当归、乌鳢的质量比为10∶5∶250,加入6倍量制备好的黄芪当归热水,100 ℃煮制3 h。黄芪当归水的制作参考Benjakul等[14]的方法并稍加修改。收集鱼汤样品后冻干。
1.4.1.3 样品前处理
称量样品20 mg于离心管中,加入70 %甲醇-水内标提取液400 μL,涡旋3 min;冰浴超声10 min,继续涡旋1 min,于-20 ℃冰箱中静置30 min;4 ℃,12 000 r/min离心10 min,取上清液 300 μL于离心管中;4 ℃,12 000 r/min再离心3 min,移取上清液200 μL于衬管中,上机分析。
1.4.2 色谱条件
色谱柱:Waters ACQUITY Premier HSS T3色谱柱(1.8 μm,2.1 mm×100 mm);流动相A:0.1%甲酸-水;流动相B:0.1%甲酸-乙腈;柱温:40 ℃;流速:0.4 mL/min;进样量:4 μL。
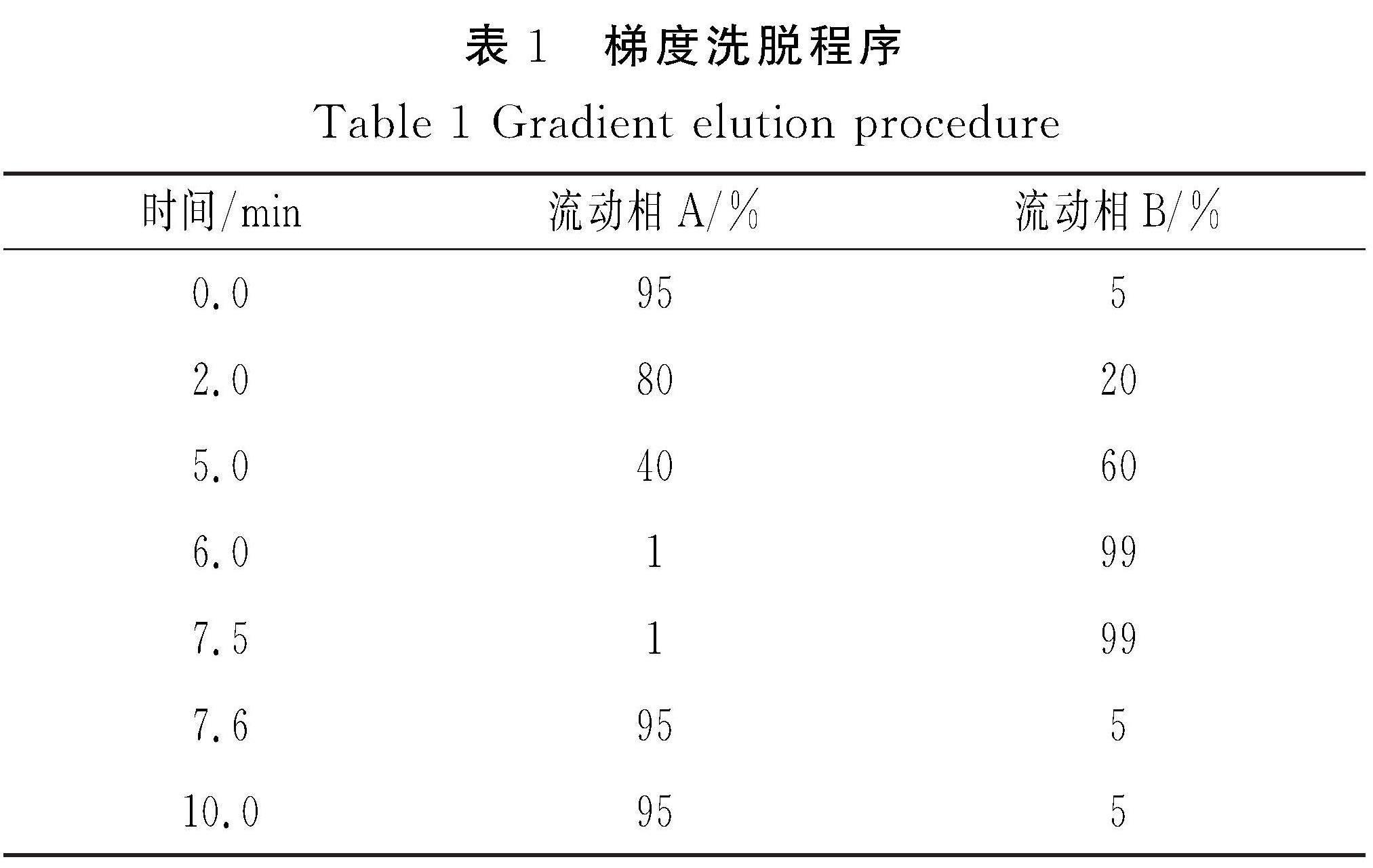
质谱条件:采用正负离子扫描模式对样品的质谱信号进行采集,扫描范围(m/z):70~1 050 u。离子源加热温度350 ℃,離子喷雾电压:+3 500 V/-4 500 V,20-40-60 V循环碰撞能,鞘气流速:40 psi,MS1、MS2分辨率分别为70 000,17 500。梯度洗脱程序见表1。
1.5 数据处理
原始数据经ProteoWizard转换为mzXML格式,使用XCMS程序进行峰提取、对齐和保留时间校正。采用支持向量回归(SVR)方法对峰面积进行校正,对样品中缺失率大于50%的峰进行过滤。筛选后的峰通过检索实验室自建数据库、整合公共库、AI预测库以及metDNA方法得到代谢物鉴定信息。以上数据分析在正离子模式下获得4 143个物质,在负离子模式下获得2 929个物质,后续分析及绘图使用在线网站(https://cloud.metware.cn)。
2 结果与分析
2.1 鱼汤、药膳鱼汤的主成分分析
主成分分析得分图可反映样品的相似性程度,样品越聚集,表明样品的相似性越强。由图1可知,质控样品(QC)的聚集性较高,表明仪器设备运行稳定、实验方法可靠、数据质量高。鱼汤组(CG)、药膳鱼汤组(EG)样品的聚集程度都较高,其中CG组样品分布于PCA图中左上角,EG组样品分布于右上角。正离子模式下第一主成分(PC1)和第二主成分(PC2)的方差贡献率分别为46.06%和13.47%,两者累计方差贡献率为59.53%。负离子模式下第一主成分(PC1)和第二主成分(PC2)的方差贡献率分别为67.07%和5.7%,两者累计方差贡献率为72.77%,包含样品中大部分代谢物信息。在正离子模式和负离子模式下,CG、EG样品点间距离较远,说明鱼汤和药膳鱼汤中代谢物有明显变化。
2.2 鱼汤、药膳鱼汤代谢物的正交偏最小二乘-判别分析
为解析样品中与分类变量相关的差异变量和可能存在关联的无差异变量,借助OPLS-DA模型剔除与分类变量不相关的变量,从而实现样品组间差异信息的可视化[15]。OPLS-DA在比较样品组间差异和明确导致这些差异的代谢物方面表现出色。在OPLS-DA得分图中,横坐标代表组间差异分量,样品点横向距离与组间差异呈正相关,距离越小表示样品组内代谢物组成差异越小。图2中A中括号内的百分比代表该分量在总方差中的占比。
OPLS-DA模型评估的预测参数包括R2X、R2Y和Q2。其中,R2X和R2Y分别表示所建模型对X和Y矩阵的拟合度,Q2表示模型的预测精度。这3个参数越接近于1,表示模型的稳定可靠性越强,当Q2>0.5时为有效模型,当Q2>0.9时为出色模型[16]。图2中B为OPLS-DA验证图,横坐标表示模型的R2Y和Q2值,纵坐标表示模型分类效果出现的频数。通过进行200次随机排列组合实验,Q2值为0.994,表明模型具有显著的预测能力,能够识别组别之间存在的显著差异代谢物。同时,模型没有过度拟合,因此可以用于后续的差异代谢物鉴定。
2.3 鱼汤、药膳鱼汤代谢物的火山图分析
火山图能够直观展示代谢物在鱼汤和药膳鱼汤样品组中代谢物含量差异的总体趋势。图中每个点代表一个代谢物,散点大小反映OPLS-DA模型的VIP值,散点越大,VIP值越大,表明筛选到的差异代谢物越可靠。采用VIP>1且P<0.05为筛选条件,图3中横坐标表示log2(差异倍数),纵坐标表示-log10(P值),黑色圆点为不显著代谢物,log2 FC>0为上调代谢物,log2 FC<0为下调代谢物。经筛选得到2 363个上调代谢物和1 028个下调代谢物。总体而言,上调差异代谢物多于下调差异代谢物。
2.4 差异显著代谢物筛选和分类
基于OPLS-DA结果,利用多变量分析中的VIP值初步筛选鱼汤和药膳鱼汤差异代谢物,设定VIP>1且P<0.05的标准。通过对一级质谱初步检测到的信号进行筛选,共获得415个代谢物,其中显著性差异代谢物176个,上调差异代谢物134个,下调差异代谢物42个。这些差异代谢物分布于多个化学类别中,包括氨基酸及其衍生物(8.43%)、脂肪酰类(9.15%)、有机酸及其衍生物(6.02%)、核苷酸及其衍生物(4.09%)、碳水化合物及其衍生物(2.41%)、黄酮类化合物(4.33%)、其他类(7.95%),见表2。
2.5 不同类别差异代谢物分析
通过对鱼汤和药膳鱼汤样品组中代谢物的定性与定量分析,共鉴定出176个差异代谢物(见表3)。这些代谢物涵盖20类化合物,包括氨基酸及其衍生物、脂肪酰类、有机酸及其衍生物、核苷酸及其衍生物、碳水化合物及其衍生物、黄酮类等。在这些代谢物中,氨基酸、脂肪酰类和有机酸类化合物是数量最丰富的3类差异代谢产物。
2.5.1 氨基酸
氨基酸是重要的营养物质和风味物质,共鉴定出35个差异代谢物,其中25个上调代谢物,10个下调代谢物。差异显著且VIP值较大的物质为DL-精氨酸、D-鸟氨酸、亮氨酸-亮氨酸-谷氨酸、H-色氨酸-丝氨酸-OH、L-脯氨酸、L-瓜氨酸等,均為上调趋势,这些化合物在生物体内展现出显著的生物活性[17-18]。DL-精氨酸是半必需氨基酸,其多样的生物学和代谢功能包括缓解内皮功能障碍、改善血脂水平以及促进伤口愈合等[19]。鸟氨酸是尿素循环的重要中间代谢产物,能够激发垂体释放生长激素,在能量代谢中发挥着重要作用[20]。脯氨酸是必需氨基酸之一,也是多种生物激素的前体物质。食品蛋白是功能肽的主要来源,小肽具有良好的溶解性、吸收性和功能性营养功效[21]。这些氨基酸和肽链在蛋白质合成、氮代谢、生长激素分泌、神经递质合成等生物过程中发挥着关键作用[22-23]。高温烹饪过程中,鱼肉蛋白降解为小肽和游离氨基酸,继而发生脱羧和脱氨反应,生成二氧化碳、胺、醛、硫化氢等化合物,为药膳鱼汤的口感提供了丰富的层次[24]。
2.5.2 脂肪酰类
鉴定出38个脂肪酰类差异代谢物,其中17个上调代谢物,21个下调代谢物,包括脂质、脂肪酸和脂肪酰类。排名前六的脂质差异代谢物为十八碳五烯酸、9,12,13-三羟基-十八碳单烯酸、十四烷二酸、9S-氢过氧化-10E,12Z,15Z十八碳三烯酸、6,9,12,15-十八碳四烯酸、肉碱C8-OH。十八碳五烯酸和9,12,13-三羟基-十八碳单烯酸是多不饱和脂肪酸,属于ω-3系列脂肪酸,能在人体内转化为更活跃的ω-3脂肪酸,促进二十碳五烯酸和二十二碳六烯酸的合成[25-26]。十四烷二酸则是一种长链脂肪酸,同时也是河豚汤中的独特化合物[27]。肉碱C8-OH是短链的肉碱衍生物,有助于提高运动表现并促进脂肪酸的利用,从而增加能量[28]。此外,脂肪的融化还能增加药膳鱼汤的口感和香味。
2.5.3 有机酸
鉴定得到25个有机酸差异代谢物,其中22个上调代谢物,3个下调代谢物,包括5-苯基戊酸、3-羟基肉桂酸、2-甲基-4-戊烯酸、咖啡酸、2-异丙基苹果酸和绿原酸。3-羟基肉桂酸,作为肉桂酸的衍生物,具有抗氧化、抗炎和抗微生物的性质,对心血管健康和代谢产生积极影响。绿原酸通过降血压、改善糖代谢、抗炎和抗氧化等机制对健康产生积极影响[29]。这些化合物还表现出强大的抗氧化性,能有效中和烹饪过程中产生的自由基,从而减少透明质酸的形成,降低高温下鱼肉中杂化胺的生成以及脂质和蛋白质的氧化[26]。研究指出,韭菜、欧芹及其混合物富含咖啡酸、绿原酸和阿魏酸等有机酸,添加这些物质能有效减少鱼肉烧烤后胆固醇氧化物的形成[30]。Wu等[31]研究发现,番茄酸汤中的有机酸可以影响熟牛肉中风味物质的形成和释放,减少醛类的含量,增加酯类、醇类、酮类和酸类的含量,从而改善熟牛肉的风味。将富含芝麻酸、咖啡酸、肉桂酸、阿魏酸和丁香酸等物质的菜籽油添加到植物性肉类中,可以提高其营养价值和保质期。
2.5.4 核苷酸
共鉴定出17个核苷酸差异代谢物,其中14个上调代谢物,3个下调代谢物,包括鸟苷、尿嘧啶核苷、2′-脱氧腺苷、腺苷-3′-5′-环单磷酸水合物、核黄素-5′-单磷酸酯等。鱼肉中的核苷酸在受热过程中转变为5-磷酸核糖,随后分解为5-甲基-4-羟基呋喃酮,同时释放硫化氢气体。释放的硫化氢与呋喃酮化合物发生强烈反应,产生浓郁的肉香味[32]。嘌呤核苷也是细胞不可或缺的成分,参与核酸的合成,充当辅酶和信号分子,参与能量转移过程[33]。
2.5.5 碳水化合物
鉴定出10个差异碳水代谢物,其中9个上调代谢物,1个下调代谢物,包括海藻糖、葡萄糖酸、异麦芽酮糖等。在烹饪过程中,还原糖与氨基酸发生美拉德反应。此外,糖类物质在高温下经历焦糖化过程,转变为二羰基化合物和三羰基化合物,如糠醛和羟甲基糠醛,这一反应是通过高温环境引发的糖分子结构的变化。在此基础上,产生了芳香族呋喃衍生物、羰基化合物、醇类、脂肪族碳氢化合物和芳香烃等挥发性物质[34],这些化合物对鱼汤的风味至关重要,赋予其独特的香气和口感。海藻糖是一种天然的非还原糖,具有出色的稳定性,对各种病因引起的细胞损伤和病理特征具有保护作用[35-36]。异麦芽酮糖具有缓慢持久的能量释放特性,对血糖控制和体力活动中能量的提供有益。氨基葡萄糖对软骨和关节的健康有益。
2.5.6 黄酮
药膳鱼汤中黄酮类化合物均为上调代谢物,其中排名前五的化合物包括6′-O-丙二酰甘氨酸、橙皮素、葛根素、芒柄花素、二氢黄豆苷元,这些化合物均具有抗炎、抗氧化、抗增殖的生物活性[37]。研究显示,膳食异黄酮具有抗糖尿病、抗氧化、抗炎等多种益处[38]。橙皮素,作为类黄酮的亚类,具备抗氧化、抗炎和神经保护作用[39]。葛根素具有抗菌、抗炎、抗氧化和增强免疫功能的特性[40]。二氢黄豆苷元是雌马酚的前体物质,对缓解更年期症状和降低患心血管疾病风险起到积极作用[41]。芒柄花黄素表现出抗氧化、抗高血压、抗感染、雌激素样以及其他药理学效应[42]。这些发现强调了药膳鱼汤作为富含黄酮类化合物的食物可能对健康产生多方面的积极影响。
2.6 差异代谢物通路分析
对差异代谢物进行KEGG数据库ID匹配,确定其参与的代谢通路,并通过富集分析辨别显著差异的通路。富集通路的结果见图4,颜色深浅表示富集的显著性,点的大小反映了在相应通路上富集差异显著代谢物的数量。P值排名前二十的通路包括氨基酸的生物合成(biosynthesis of amino acids)、缬氨酸、亮氨酸和异亮氨酸的生物合成(biosynthesis of valine,leucine and isoleucine)、核苷酸糖的生物合成(biosynthesis of nucleotide sugars)、ABC转运蛋白(ABC transporters)、咖啡因代谢(metabolism of caffeine)等。这些通路涉及氨基酸及其衍生物、有机酸及其衍生物、核苷酸及其衍生物、碳水化合物及其衍生物等多个生物学过程,涵盖蛋白质合成、能量转移和细胞信号传导等方面[43-44]。
由图4可知,氨基酸的生物合成占主導地位。氨基酸代谢途径见图5,鸟氨酸是尿素循环中重要的组成部分,也是瓜氨酸、精氨酸的前体物质。氨甲酰磷酸与鸟氨酸化合生成瓜氨酸和磷酸,瓜氨酸进一步转化为精氨酸,精氨酸分解为尿素和鸟氨酸。生成的中间代谢产物为丙酮酸,经缬氨酸、亮氨酸和异亮氨酸生物合成途径,降低了缬氨酸、亮氨酸的含量。
3 结论
利用非靶向代谢组学结合多元分析手段,对鱼汤和药膳鱼汤进行深入分析,共检测到7 072个代谢物。通过设定VIP>1且P<0.05的标准,筛出2 363个上调代谢物和1 028个下调代谢物。数据库匹配结果显示,差异显著代谢物主要包括氨基酸及其衍生物、脂肪酰类、有机酸及其衍生物、核苷酸及其衍生物、碳水化合物及其衍生物和黄酮类化合物。KEGG分析结果表明,这些差异代谢物主要富集在氨基酸的生物合成、缬氨酸、亮氨酸和异亮氨酸的生物合成、核苷酸糖的生物合成、ABC转运蛋白、咖啡因代谢、半胱氨酸和蛋氨酸代谢通路中。通过对鱼汤和药膳鱼汤的代谢产物进行综合分析,初步探讨了差异代谢物及其代谢途径,为深入研究药膳鱼汤的风味和营养成分提供了理论基础。
参考文献:
[1]陈胜军,路美明,相欢,等.乌鳢营养评价与加工保鲜技术研究进展[J].肉类研究,2023,37(2):40-45.
[2]MACHO-GONZLEZ A, BASTIDA S, GARCIMARTN A, et al. Functional meat products as oxidative stress modulators: a review[J].Advances in Nutrition,2021,12(4):1514-1539.
[3]NY V, HOUKA M, PAVELA R, et al. Potential benefits of incorporating Astragalus membranaceus into the diet of people undergoing disease treatment: an overview[J].Journal of Functional Foods,2021,77:104339.
[4]LU Q, LI R, YANG Y, et al. Ingredients with anti-inflammatory effect from medicine food homology plants[J].Food Chemistry,2022,368:130610.
[5]鄭佳楠,韩琳,王悦,等.热加工方式对鱼汤营养成分及食用品质的影响[J].中国食品学报,2023,23(6):222-231.
[6]高瑞昌,张伟,李欣,等.方便乌鳢鱼头汤喷雾干燥工艺优化及品质评价[J].南方水产科学,2022,18(2):158-164.
[7]NAZ S, VALLEJO M, GARCA A, et al.Method validation strategies involved in non-targeted metabolomics[J].Journal of Chromatography A,2014,1353:99-105.
[8]MAO X, BASSEY A P, SUN D, et al. Overview of omics applications in elucidating the underlying mechanisms of biochemical and biological factors associated with meat safety and nutrition[J].Journal of Proteomics,2023,276:104840.
[9]OKEKE E S, ITA R E, EGONG E J, et al. Metaproteomics insights into fermented fish and vegetable products and associated microbes[J].Food Chemistry: Molecular Sciences,2021,3:100045.
[10]GARLITO B, SENTANDREU M A, YUS V, et al. New insights into the search of meat quality biomarkers assisted by Orbitrap Tribrid untargeted metabolite analysis and chemometrics[J].Food Chemistry,2023,407:135173.
[11]李晓芹,方志娟,张玲,等.基于高分辨质谱的分析技术在食品检测中的应用[J].食品工业,2023,44(11):154-159.
[12]WANG Y, LI C, ZHAO Y, et al. Novel insight into the formation mechanism of volatile flavor in Chinese fish sauce (Yu-lu) based on molecular sensory and metagenomics analyses[J].Food Chemistry,2020,323:126839.
[13]SIDDABASAVE S G, YUSUKE M, DIVYANANI G, et al. Detection and characterization of lipids in eleven species of fish by non-targeted liquid chromatography/mass spectrometry[J].Food Chemistry,2022,393:133402.
[14]BENJAKUL S, CHANTAKUN K, KARNJANAPRATUM S. Impact of retort process on characteristics and bioactivities of herbal soup based on hydrolyzed collagen from seabass skin[J].Journal of Food Science Technology,2018,55(9):3779-3791.
[15]BLASCO H, BASZCZYN'SKI J, BILLAUT J C, et al. Comparative analysis of targeted metabolomics:dominance-based rough set approach versus orthogonal partial least square-discriminant analysis[J].Journal of Biomedical Informatics,2015,53:291-299.
[16]KANG C, ZHANG Y, ZHANG M, et al. Screening of specific quantitative peptides of beef by LC-MS/MS coupled with OPLS-DA[J].Food Chemistry,2022,387:132932.
[17]SHAO C, SU Y, MENG D, et al. Comprehensive metabolomic profiling of nutrients in fish and shrimp[J].Food Chemistry,2023,407:135037.
[18]WEI Z, DENG K, ZHANG W, et al. Interactions of dietary vitamin C and proline on growth performance, anti-oxidative capacity and muscle quality of large yellow croaker Larimichthys crocea[J].Aquaculture,2020,528:735558.
[19]VARGHESE T, DASGUPTA S, ANAND G, et al. Dietary arginine attenuates hypoxia-induced HIF expression, metabolic responses and oxidative stress in Indian major carp, Cirrhinus mrigala[J].Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology,2022,259:110714.
[20]YANG Z, DAN W, LI Y, et al. Untargeted metabolomics analysis of the anti-diabetic effect of red ginseng extract in Type 2 diabetes mellitus rats based on UHPLC-MS/MS[J].Biomedicine & Pharmacotherapy,2022,146:112495.
[21]SUN A, WU W, SOLADOYE O P, et al. Maillard reaction of food-derived peptides as a potential route to generate meat flavor compounds: a review[J].Food Research International,2022,151:110823.
[22]MADHU M, KUMAR D, SIROHI R, et al. Bioactive peptides from meat: current status on production, biological activity, safety, and regulatory framework[J].Chemosphere,2022,307:135650.
[23]RAMAKRISHNAN S R, JEONG C R, PARK J W, et al. A review on the processing of functional proteins or peptides derived from fish by-products and their industrial applications[J].Heliyon,2023,9(3):14188.
[24]RAMALINGAM V, SONG Z, HWANG I. The potential role of secondary metabolites in modulating the flavor and taste of the meat[J].Food Research International,2019,122:174-182.
[25]WHELAN J. Dietary stearidonic acid is a long chain (n-3) polyunsaturated fatty acid with potential health benefits[J].The Journal of Nutrition,2009,139(1):5-10.
[26]MAKI K C, RAINS T M. Stearidonic acid raises red blood cell membrane eicosapentaenoic acid[J].The Journal of Nutrition,2012,142(3):626-629.
[27]BI H, CAI D, ZHANG R, et al. Mass spectrometry-based metabolomics approach to reveal differential compounds in pufferfish soups: flavor, nutrition, and safety[J].Food Chemistry,2019,301:125261.
[28]DBROWSKA M, STAREK M. Analytical approaches to determination of carnitine in biological materials, foods and dietary supplements[J].Food Chemistry,2014,142:220-232.
[29]JIANG Z, HAN Z, ZHU M, et al. Effects of thermal processing on transformation of polyphenols and flavor quality[J].Current Opinion in Food Science,2023,51:101014.
[30]FERREIRA F S, DE OLIVEIRA V S, CHVEZ D W H, et al. Bioactive compounds of parsley (Petroselinum crispum), chives (Allium schoenoprasum L.) and their mixture (Brazilian cheiro-verde) as promising antioxidant and anti-cholesterol oxidation agents in a food system[J].Food Research International,2022,151:110864.
[31]WU W, WANG X, HU P, et al. Research on flavor characteristics of beef cooked in tomato sour soup by gas chromatography-ion mobility spectrometry and electronic nose[J].LWT-Food Science and Technology,2023,179:114646.
[32]RUAN J, WU Z, XU J, et al. Effects of replacement partial sodium chloride on characteristic flavor substances of bacon during storage based on GC×GC-MS and non-targeted metabolomics analyses[J].Food Chemistry,2023,428:136805.
[33]HU W K, LIU J G, ZHANG W, et al. Multi-omics analysis reveals the microbial interactions of S. cerevisiae and L. plantarum on Suanyu, Chinese traditional fermented fish[J].Food Research International,2023,174:113525.
[34]NI Z J, LIU X, XIA B, et al. Effects of sugars on the flavor and antioxidant properties of the Maillard reaction products of camellia seed meals[J].Food Chemistry:X,2021,11:100127.
[35]FOROUZANFAR F, HOSEINI A, SAHEBKAR A. Neuroprotective effects of trehalose following middle cerebral artery occlusion in rats[J].Interdisciplinary Neurosurgery,2023,34:101827.
[36]BHAT M, MIR I, SINGH L R, et al.Trehalose promotes structural disorderness of intrinsically disordered casein proteins with enhanced chaperone function[J].Journal of Molecular Liquids,2023,385:122270.
[37]NERI-NUMA I A, ARRUDA H S, GERALDI M V, et al. Natural prebiotic carbohydrates, carotenoids and flavonoids as ingredients in food systems[J].Current Opinion in Food Science,2020,33:98-107.
[38]ZHANG Y, XU D, XING X, et al. The chemistry and activity-oriented characterization of isoflavones difference between roots of Pueraria lobata and P. thomsonii guided by feature-based molecular networking[J].Food Chemistry,2023,422:136198.
[39]LIU Z, TU K, ZOU P, et al.Hesperetin ameliorates spinal cord injury by inhibiting NLRP3 inflammasome activation and pyroptosis through enhancing Nrf2 signaling[J].International Immunopharmacology,2023,118:110103.
[40]LU Y, GUO X, XU F, et al. Protective effects of puerarin on liver tissue in Salmonella-infected chicks: a proteomic analysis[J].Poultry Science,2024,103(1):103281.
[41]PEIROTN , GAYA P, MALANDETE J.Application of recombinant lactic acid bacteria and bifidobacteria able to enrich soy beverage in dihydrodaidzein and dihydrogenistein[J].Food Research International,2020,134:109257.
[42]MA X, WANG J. Formononetin: a pathway to protect neurons[J].Frontiers in Integrative Neuroscience,2022,16:908378.
[43]ZAKARIA F, AKHTAR M T, WAN NORHAMIDAH W I, et al. Centella asiatica (L.) Urb. extract ameliorates branched-chain amino acid (BCAA) metabolism in acute reserpine-induced stress zebrafish model via 1H Nuclear Magnetic Resonance (NMR)-based metabolomics approach[J].Comparative Biochemistry and Physiology.Toxicology & Pharmacology,2023,264:109501.
[44]LYU H, QU X, CHU Z, et al. Integration of transcriptomics and metabolomics reveals the effects of sea currents on overwintering of large yellow croaker Larimichthys crocea in cage culture[J].Aquaculture,2024,578:740054.

