种子活力性状无损速测技术研究进展
石睿 罗斌 张晗 侯佩臣 周亚男 王成
石 睿,罗 斌,张 晗,等. 种子活力性状无损速测技术研究进展[J]. 江苏农业科学,2024,52(7):1-10.
doi:10.15889/j.issn.1002-1302.2024.07.001
(1.北京市农林科学院智能装备技术研究中心/北京市农林科学院信息技术研究中心,北京 100097;2.江苏大学农业工程学院,江苏镇江 212013)
摘要:种子是农业生产中最重要的生产资料,其品质直接关系到整个生产活动的丰歉。活力是种子的重要评价指标,高活力的种子不仅田间表现优秀、抵抗逆境能力强,还更利于长时间储藏。传统的种子活力检测多在实验室内进行,采用的发芽试验等方法精度较高、科学性强,但有损检测且效率较低。近年来,光谱及成像技术以其快速、无损等优势,在种子检测领域中得到了广泛关注和应用。首先,归纳传统种子活力检测方法的检测原理和判定方法,并总结传统方法存在的共性问题;其次,综述无损速測技术在种子活力检测领域的应用和进展,对比分析各种技术的工作原理和检测策略,重点就近红外光谱技术和高光谱成像技术的应用展开讨论;最后,在此基础上结合种子活力的实际检测要求,探讨目前无损速测技术在种子活力检测应用领域存在的问题,总结当前无损速测检测技术呈现多技术融合、精选分级、高通用性和多元发展的发展趋势,以期为种子活力性状的无损速测技术提供参考。
关键词:种子;活力性状;近红外光谱;高光谱成像;X射线成像;图像处理;无损速测技术;研究进展
中图分类号:S330.2 文献标志码:A 文章编号:1002-1302(2024)07-0001-09
种子是农业生产中最重要的生产资料,其品质直接影响农业生产活动的产量和质量。种子活力是评价种子品质的重要指标之一,最先由国际种子检验协会(ISTA)提出,其将种子活力定义为决定种子和种子批在发芽和出苗期间的活性水平和行为的那些种子特性的综合表现[1-2]。影响种子活力的因素可分为内因和外因2个方面,内因主要是指种子品种及自身个体发育情况,外因则是在收获、加工过程中所受到的一系列机械损伤以及贮藏期间环境变化带来的影响[3]。选用高活力的种子进行播种,能更好地保证田间幼苗茁壮、出苗整齐和长势均匀,且面对逆境时幼苗抵抗能力强,同时高活力的种子贮藏价值也更高[4]。因此,如何选取高活力种子成为农业生产活动中的重要一环。传统的种子活力检测方法可分为直接测定和间接测定2种,直接测定即检测种子在逆境环境下的发芽和成苗能力,包括加速老化测定、冷冻测定等;间接测定即通过生理指标侧面反映种子活力,包括电导率测定、氯化三苯四氮唑(TTC)染色测定等。尽管这些传统方法评定结果直观、科学性强,但存在对操作人员专业能力要求高、试验周期长、对种子有破坏性等缺点,难以满足现代农业成批量、快速、无损检测的需要[5-6]。近年来,随着化学计量学和计算机技术的发展,许多研究人员开始将光谱及成像技术应用在种子活力检测领域。无损速测技术作为快速、无损的检测技术,不仅可以反映种子的内部信息和化学组成,还可以和化学计量学方法搭配建立活力预测模型,快速生成检测结果;此技术克服了传统检测方法的诸多缺点,在降低成本、提高效率的基础上,可以更好地满足现代农业生产的要求。本研究主要综述近年来无损速测技术在种子活力检测方面的研究进展,分析对比各技术的工作原理、检测策略和优缺点,重点就近红外光谱技术和高光谱成像技术展开谈论,并基于种子活力检测的发展需求和应用场景,展望无损速测技术在此领域未来的发展方向,以期推动无损速测技术在种子活力检测方面的应用和发展。
1 传统检测技术
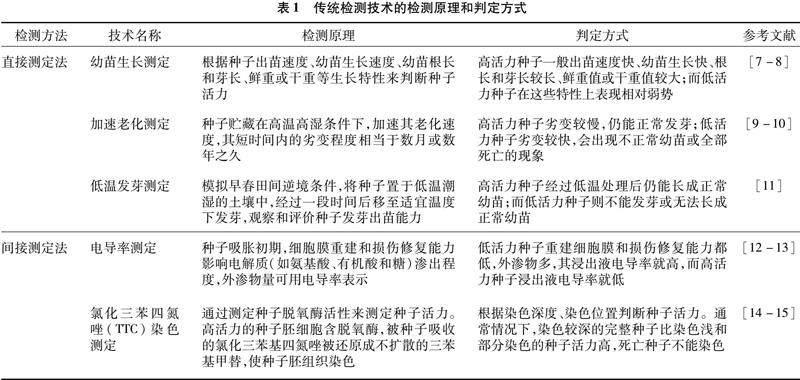
由于检测原理和判定方式不同,传统检测技术可大致分为直接测定法和间接测定法2类,目前5种主要传统检测技术的检测原理和判定方式见表1。虽然各项技术间有较大差别,但都需要由专业的操作人员完成,且需要一定的试验周期;同时这些技术会破坏种子的完整性,检测后的种子也无法继续应用到农业生产中,所以无损速测技术作为一种新型检测技术正逐步应用到种子活力检测领域。
2 无损速测技术
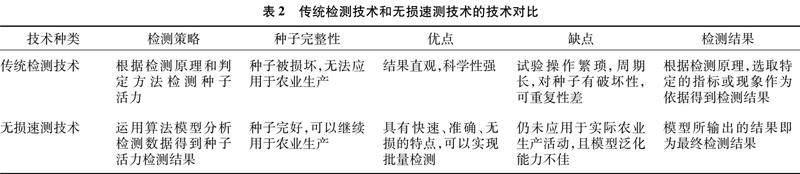
无损速测技术以先进的无损检测设备为基础,配合机器学习算法,通过建立预测模型完成种子活力性状的快速检测。由表2可知,传统检测技术需要根据不同的检测原理进行种子活力检测,试验结果科学直观,但试验过程纷繁复杂,需要专门的技术人员操作,且试验周期长,对种子造成的破坏不可逆。近年来,无损速测技术因其快速、无损的特点在种子活力检测方面发展迅速,通过所建立的算法模型可以快速实现种子活力的分类、分级,同时检测过程中几乎不会对种子造成损伤,所检种子可以继续投入到农业生产;但该技术目前大多停留在实验室阶段,还未大规模应用,同时所建立的算法模型大多只能满足特定种子品种的检测要求,泛化能力欠佳。
2.1 近红外光谱技术
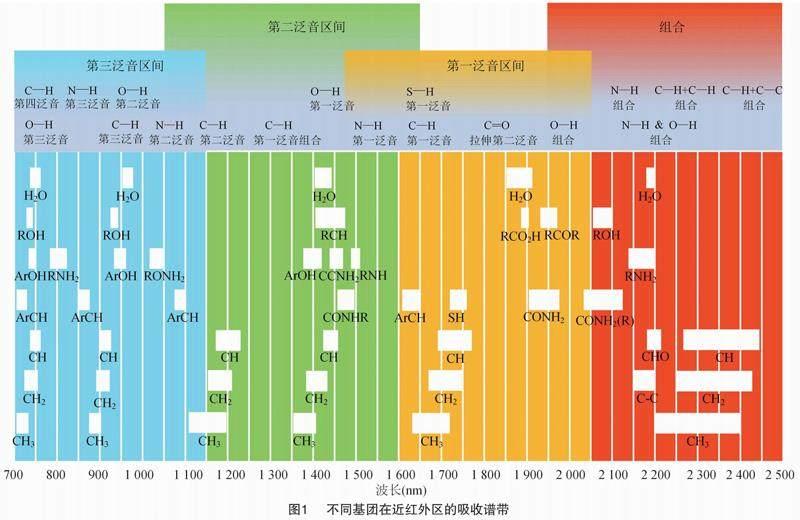
当近红外光透过物质时,分子振动的非谐振性使分子振动状态发生变化,此时物质吸收对应波长的光从而形成近红外光谱,其主要反映的是各种含氢基团基频振动的倍频和合频吸收情况[16-17]。由图1可知,种子中含有大量有机分子,各种有机分子在近红外区的光谱吸收特征因其所含基团种类和振动模式的不同而不同,故可利用近红外光谱对种子的活力开展定性和定量分析[18]。
白京等基于主成分分析(principal component analysis,PCA)算法建立有关玉米种子活力的支持向量机(support vector machine,SVM)检测模型,该分类模型校正集和预测集的准确率分别是9556%、86.68%[19]。Yasmin等以自然陈化4年的西瓜种子为对象,建立偏最小二乘法判别分析(partial least squares-discriminant analysis,PLS-DA)检测模型对有活力种子和无活力种子进行分类,其准确率分别为87.7%、82.0%[20]。
上述检测模型皆为二分类模型,即判断种子是否具有活力,也有学者尝试种子活力分级或剔除空种子,这些功能的实现都有助于满足种子活力检测的现实需求。Fan等针对3种老化程度的小麦种子,将PCA算法和连续投影(successive projections algorithm,SPA)算法2种特征波长提取算法分别同极限学习机(extreme learning machine,ELM)算法和随机森林(random forest,RF)算法结合,所建立的PCA-ELM和SPA-RF检测模型准确率分别为88.9%、88.5%[21]。Tigabu等尝试鉴别杉木活种子、死种子和空种子,建立的正交偏最小二乘判别分析(orthogonal projection to latent structures-discriminant analysis,OPLS-DA)模型在较短的近红外区域(780~1 100 nm)性能最优,平均分类准确率为100%[22]。
种子的生理生化指标也能反映其活力,通过建立有关指标的定量模型也可以完成种子活力的检测。李武等将发芽率、发芽指数和活力指数3个指标作为建模对象,利用偏最小二乘法回归(partial least squares regression,PLSR)算法建立有关3个指标的定量检测模型,该模型能够较好地筛选出高活力甜玉米种子[23]。曲歌用发芽率作为衡量种子活力的指标,将BP神经网络(back propagation neural network,BPNN)同偏最小二乘(partial least squares,PLS)算法相结合建立水稻种子活力检测模型,该模型的R2c、RMSEC、R2p、RMSEP和RPD分别为0.86、1.99、0.83、2.01、2.55[24]。
传统机器学习分类模型受算法原理影响,可能存在准确率不理想或丢失相关特征的情况,故有学者开始将近红外技术同深度学习算法结合,旨在提高模型的准确率。Liu等分别建立5种树木种子的PLS-DA、SVM和深度神经网络(deep neural network,DNN)分类模型,结果表明,所建的DNN模型性能最优[6]。
近红外光谱技术快速、无损、无污染的特点使它在种子活力检测领域发展迅速,产出了一大批科研成果,有着巨大的发展前景。但目前的研究所建立的算法模型以二分模型为主,多级分类模型较少;实际检测场景也以实验室为主。随着研究的深入,近红外光谱技术会同更多的算法相结合,近红外光谱数据也可以被更充分地挖掘和利用;同时,检测场景不再局限在实验室中,可以实现便捷、快速的种子活力检测,也可推动种子活力检测朝着成批量、产业化的方向发展。
2.2 高光谱成像技术
由图2可知,高光谱成像技术1次获取1个数据立方体[25-26],其包含每个窄波片段的图像信息以及单个像素点在连续波段下的光谱信息,具有“图谱合一”的特点[27]。图像信息可以反映样品的形状、缺陷等外在特征,而光谱信息因为不同物质反射率的不同,可以反映样品的组成结构、化学成分等内在特征[28]。基于这种优势,高光谱成像技术在种子活力检测方面有着极大的潜力。根据建立模型所使用的数据类型,高光谱成像技术在种子活力检测方面可分为单一特征分类和图谱结合分类。
2.2.1 单一特征分类
通过算法处理高光谱成像技术带来的庞大数据集,将光谱信息或图像信息作为模型的输入,用输出的分类值表示种子的活力等级。
2.2.1.1 传统机器学习算法
高光谱成像技术因其工作原理所产生的数据集通常十分庞大,为了有效利用庞大的数据集并建立可行高效的种子活力检测模型,传统机器学习分类算法成为最先被选用的建模方式。此方法基于每个種子的平均光谱数据并结合发芽试验结果完成模型的建立。Nansen等运用线性判别分析(linear discriminant analysis,LDA)算法建立3种澳洲本土植物种子[考氏相思(Acacia cowleana Tate)、橙黄佛塔树(Banksia prionotes L.F.)和美叶桉(Corymbia calophylla)]的活力检测模型,结果显示关于考氏相思和美叶桉的准确率可以超过85%,关于橙黄佛塔树的准确率约为80%[29]。Dumont等尝试区分挪威云杉的活种子、空种子和无活力种子,基于可见光及近红外波段(400~1 000 nm)光谱数据建立的SVM判别模型在仅选用3个特征波段的情况下准确率为93%[30]。He等运用多项式平滑(savitzky-golay,SG)算法结合ELM算法,以93.67%的准确率完成对3个不同年份水稻种子的快速分类[31]。
上述模型皆为定性分类模型,同时也有学者尝试用特定的指标量化种子活力概念,并建立相关的定量检测模型。Cui等将甜玉米种子的苗长和根长作为种子活力的评判标准,利用最高相关系数(highest correlation coefficient,HCC)[JP2]和核主成分回归(kernel principal component regression,KPCR)算法建立的根长预测模型相关系数为0.780 5,基于SPA算法建立的苗长预测模型相关系数为0607 4[32]。Zhang等将发芽率、发芽势和简单活力指数3个指标作为评估种子活力的重要参数,采用回归系数结合PLS-R算法分别建立有关小麦种子活力的3个定量检测模型,该模型预测集的R2分别为0.921、0.907、0.886,RMSE值分别为4.113%、5.137%、2.400%[33]。
2.2.1.2 运用深度学习算法建立模型
深度学习作为近年来新兴的人工智能算法,在处理庞大数据集方面具有独特的优势,更适合用于高光谱数据的处理;同时,深度学习算法可以实现基于一维光谱数据和二维光谱图像的建模,为高光谱成像技术在种子活力检测带来更多的可能。张林基于堆叠自动编码器(stacked auto-encoder,SAE)提取的深度光谱特征建立SVM分类模型,并使用改进灰狼优化算法(differential evolution-greywolf optimizer,DE-GWO)优化该模型,优化后的模型对3种活力等级的水稻种子分类准确率可达99.25%[34]。Ma等将PC评分图和SVM活力映射图作为卷积神经网络(convolutional neural network,CNN)模型的输入,建立有关日本芥菜种子活力的CNN模型分类准确率达90%[35]。Yang等直接将水稻种子的高光谱图像作为CNN模型的输入,准确率可达99.5%[36]。Zhang等建立深度森林(deep forests,DF)模型来区分6种不同霜害程度的水稻种子,该模型在小尺度样本中的性能明显优于作为对比的3种传统机器学习模型(决策树、K最近邻和SVM)[37]。Wu等针对实际生产中可能出现的样品数量不平衡问题,提出一种加权损失深度卷积神经网络(deep convolution neural network,DCNN),该模型区分3种活力等级水稻种子的准确率为97.69%[38]。
2.2.2 图谱结合分类
高光谱成像技术可以同时获得待测种子的光谱信息和图像信息,图谱结合分类法便是同时利用这2种信息检测种子活力。图谱结合分类可以分为像素级和对象级2种方法,像素级方法是通过图像中个别像素的光谱数据检测整个种子的活力,对象级则是综合整个种子像素的光谱数据检测种子活力。目前国内外学者普遍认为种子活力是一个有关整个种子的概念,因此采用对象级方法是一种更为合理、有效的方法[39]。
对象级方法有以下2种主流思路:一是利用整体图检测,即单个种子图像对应1个分类值;二是利用像素图检测,即单个种子图像的每1个像素都对应1个分类值[40]。有学者对这2种思路进行分析对比,结果见图3。Zhang等运用PLS-DA算法区分3种不同冻害程度的玉米种子,同时基于模型的分类值比较M2M(整体图)和M2P(像素图)2种方法的分类效果,结果显示,此情况下的M2P方法优于M2M方法[41]。
也有学者基于像素图开展了一系列的研究。如图4所示,Wakholi等将有关玉米种子活力的SVM分类模型回归系数同高光谱图像结合获得伪彩图,并使用阈值将其转化为二值图像,其中值为1的像素对应有活力,值为0的像素对应无活力[42]。Baek等利用PLS-DA算法对大豆种子图像每个像素进行分类,并结合阈值法获得二值图像;在单个种子图像中,代表活种子的像素数占总像素数的百分比大于预先设置的检出率时,该种子便被认定为有活力,此方案的准确率为95%[39]。
高光谱成像技术“图谱合一”的特点使其在种子活力检测方面有着巨大的优势。较前的研究多集中在光谱数据的研究上,基于每个种子的平均光谱,使用机器学习算法建立分类模型来检测种子活力。近年来,随着研究的不断深入,国内外学者开始使用深度学习算法处理高光谱成像技术带来的庞大立方体数据,深度学习算法在处理庞大数据方面的优势使得运用该类型算法所建立的分类模型较大多数传统机器学习算法模型具有更好的检测效果,且可以完成一定程度的种子活力分级;同时学者开始注重二维图像的利用,不论是基于单个像素[21]的光谱研究还是多个波段的图像研究,都开始将二维图像信息同一维光谱数据相结合,使种子活力检测效果有了明显的提升。高光谱成像技术所具有的成像功能也使检测结果更直观地体现,有利于实现流水线检测。综合來看,高光谱成像技术所具有的特点使它在种子活力检测方面有着极大的潜力,也使未来成批量检测种子活力的商业化成为可能。
2.3 X射线成像技术
X射线成像技术是医学诊断中最重要的技术之一,X射线的波长在0.01~10 nm之间,其中0.1~10 nm之间的部分被称为软X射线,由图5可见,软X射线穿透能力较低且能够揭示物体内部的情况,因此适用于种子活力检测[43]。Araújo等利用X射线检测种子干燥过程中产生的内部裂纹和自由空间,这些形态变化与种子活力降低密切相关[44]。Abud等认为,X射线成像技术可以有效地评估西兰花种子的内部形态,并将其与幼苗种子长度联系起来,从而可以完成种子活力检测[45]。Pinheiro等利用X射线成像技术结合图像处理软件,根据种子组织的物理完整性评估种子的活力[46]。de Medeiros等通过X射线图像获得有关种子的形态计量参数和组织完整性信息,并将这些特征同机器学习算法相结合,提出一种鉴定麻疯树种子发芽能力的LDA模型,对种子活力和幼苗活力的鉴定准确率分别为94.36%、89.72%;接着又运用CNN算法建立海甘蓝(Crambe abyssinica)种子活力鉴定模型,该模型准确率为82%[47-48]。X射线成像技术可以发现种子内部裂纹、直接损伤和虫蛀等情况,这些信息可以为种子活力检测提供重要依据。
2.4 自体荧光光谱成像技术
种子中含有大量的荧光化合物(即荧光团),这些[CM(21]化合物被特定波段的光激发后会发出荧光,这种荧光被称为自体荧光。荧光团包括叶绿素、木质素等化合物,这些化合物和种子活力密切相关。自体荧光光谱成像技术可以获取每个图像像素的高分辨率光谱,并提供同一物体在特定波段下的一组图像[49]。因此,利用自体荧光光谱成像技术结合机器学习算法可以建立各荧光团与其对应波长的联系,实现种子活力的检测。de Silva等以大豆种子为检测对象,运用365 nm/400 nm的激发/发射组合的自体荧光信号,分别运用人工神经网络(artificial neural network,ANN)、SVM和LDA算法建立种子活力判别模型,发现3个模型都可以很好地区别高活力种子和低活力种子,准确率达到99%[50]。如图6所示,Batista等运用不同的激发/发射组合分别提取R7.1(开始成熟)、R7.2(大量成熟)、R7.3(种子与母株分离)、R8(收获点)和R9(最终成熟)5个成熟阶段的大豆种子自体荧光信号,基于此运用RF、神经网络(neural network,NN)和SVM算法分别建立分类模型,发现利用叶绿素a(660 nm/700 nm)和叶绿素b(405 nm/600 nm)的激发/发射组合,可以很好地完成5个成熟阶段的分类[51]。
根据现有的科研成果可以发现自体荧光成像技术的检测效果很理想,具有很大的发展价值,但该技术在种子活力检测方面仍处于初步探索阶段,已有的科研成果较少,且相关检测设备昂贵,试验干扰因素多,操作要求也较严苛。
2.5 多技术融合检测方法
目前,多技术融合检测方法因其较高的检测精度正成为种子活力检测新的发展趋势。de Medeiros等同时使用近红外光谱技术和X射线技术,测得臂形草(Urochloa brizantha)种子的近红外光谱数据和X射线数据,同时将2类数据作为模型的输入,运用5种传统机器学习算法建立种子活力分类模型,并将这5种模型运用一种数据所建立的模型进行性能对比,发现此类融合技术在检测种子活力方面是可靠的,可以保证一定的准确率[52]。de Jesus Martins Bianchini等将多光谱技术和X射线技术融合,使用LDA算法建立有关麻疯树种子活力的分类模型,发现使用2种数据建立的模型性能明显优于使用单类型数据建立的模型,准确率可达98%,具有良好的分类效果[53]。多技术融合检测方法是近2年才开始运用的方法,目前科研成果较少。但此方法为种子活力检测提供了一个全新的视角,具有巨大的潜力,是一个值得尝试的新方向。
3 结论与展望
本研究综述了近年来无损速测技术在种子活力检测领域的研究进展,分析对比各种无损速测技术的检测原理和检测策略,阐述这些技术目前的优势和不足,重点就近红外技术和高光谱成像技术展开了讨论。总体而言,无损速测技术具有快速、无损、准确和高效的特点,可以更好地满足现代农业生产的要求,且近年来的众多研究成果也验证了该技术在种子活力检测领域的可行性。为使无损速测技术未来能更好地应用于种子活力检测,主要提出以下几点建议:第一,增强多技术融合。目前各类型无损速测技术的运用相对独立且逐渐模板化,可以尝试结合多种无损速测技术,利用算法将各类检测信息整合,加强有效信息的利用,进一步提高分类模型的准确率。第二,加强种子活力精选分级方面的研究。目前大多数研究仅能完成种子有无活力的区分,有关种子活力分级的研究报道较少,已报道的分级效果大多也不理想。但种子活力分级是现代农业生产的现实需求。因此,开发出效果更好的种子活力分级模型迫在眉睫。第三,丰富数据库,提高模型通用性。目前无损速测技术搭配化学计量学方法所建立的算法模型基本都只适用于单个品种种子,通用性和转移性很差。因此,丰富现有的种子活力特性数据库,研究模型转移算法,开发同时适用于多个品种的模型是无损速测技术在种子活力检测领域的一个重要发展趋势。第四,打破检测场地限制,实现多元化发展。目前相关研究大多局限在实验室内,且成熟的检测设备较少,可以开发不同的检测设备以满足各类使用场景,如便携式设备或适合成批量检测的流水线设备。
参考文献:
[1]ElMasry G,Mandour N,Al-Rejaie S,et al. Recent applications of multispectral imaging in seed phenotyping and quality monitoring:an overview[J]. Sensors,2019,19(5):1090.
[2]Wang D,Wang K,Wu J Z,et al. Progress in research on rapid and non-destructive detection of seed quality based on spectroscopy and imaging technology[J]. Spectroscopy and Spectral Analysis,2021,41(1):52-59.
[3]段潔利,王韬隐,付 函,等. 光谱及成像技术在种子活力检验中的应用研究进展[J]. 现代农业装备,2020,41(2):2-7.
[4]Priya T S R,Manickavasagan A.Characterising corn grain using infrared imaging and spectroscopic techniques:a review[J]. Journal of Food Measurement and Characterization,2021,15(4):3234-3249.
[5]李孝凡,王 成,宋 鹏,等. 种子活力无损检测方法研究进展[J]. 种子,2019,38(6):61-65.
[6]Liu W J,Liu J,Jiang J M,et al. Comparison of partial least squares-discriminant analysis,support vector machines and deep neural networks for spectrometric classification of seed vigour in a broad range of tree species[J]. Journal of Near Infrared Spectroscopy,2021,29(1):33-41.
[7]Wang W Q,Liu S J,Song S Q,et al. Proteomics of seed development,desiccation tolerance,germination and vigor[J]. Plant Physiology and Biochemistry,2015,86:1-15.
[8]Sharma A D,Rathore S V S,Srinivasan K,et al. Comparison of various seed priming methods for seed germination,seedling vigour and fruit yield in okra (Abelmoschus esculentus L. Moench) [J]. Scientia Horticulturae,2014,165:75-81.
[9]Demirkaya M. Relationships between antioxidant enzymes and physiological variations occur during ageing of pepper seeds[J]. Horticulture,Environment,and Biotechnology,2013,54(2):97-102.
[10]Qin P,Kong Z Y,Liao X H,et al. Effects of accelerated aging on physiological and biochemical characteristics of waxy and non-waxy wheat seeds[J]. Journal of Northeast Agricultural University,2011,18(2):7-12.
[11]任利沙,顾日良,贾光耀,等. 种子出苗率对玉米个体生长和群体产量的影响[J]. 中国农业大学学报,2017,22(4):10-15.
[12]Ma W G,Zhang Z H,Zheng Y Y,et al. Determination of tobacco (Nicotiana tabacum) seed vigour using controlled deterioration followed by a conductivity test[J]. Seed Science and Technology,2020,48(1):1-10.
[13]Lazar S L,Mira S,Pamfil D,et al. Germination and electrical conductivity tests on artificially aged seed lots of 2 wall-rocket species[J]. Turkish Journal of Agriculture and Forestry,2014,38:857-864.
[14]喻方圆,唐燕飞. 四唑染色法快速测定任豆种子生活力的研究[J]. 种子,2004,23(7):40-42.
[15]盛海平,汪为民,刘华开,等. 水稻种子生活力四唑测定值与发芽率间的相关性[J]. 种子,2000,19(2):30-31.
[16]Lestander T A,Geladi P.NIR spectral information used to predict water content of pine seeds from multivariate calibration[J]. Canadian Journal of Forest Research,2005,35(5):1139-1148.
[17]Kusumaningrum D,Lee H,Lohumi S,et al. Non-destructive technique for determining the viability of soybean (Glycine max) seeds using FT-NIR spectroscopy[J]. Journal of the Science of Food and Agriculture,2018,98(5):1734-1742.
[18]金文玲,曹乃亮,朱明东,等. 基于近红外超连续激光光谱的水稻种子活力无损分级检测研究[J]. 中国光学,2020,13(5):1032-1043.
[19]白 京,彭彦昆,王文秀. 基于可见近红外光谱玉米种子活力的无损检测方法[J]. 食品安全质量检测学报,2016,7(11):4472-4477.
[20]Yasmin J,Ahmed M R,Lohumi S,et al. Classification method for viability screening of naturally aged watermelon seeds using FT-NIR spectroscopy[J]. Sensors,2019,19(5):1190.
[21]Fan Y M,Ma S C,Wu T T. Individual wheat kernels vigor assessment based on NIR spectroscopy coupled with machine learning methodologies[J]. Infrared Physics & Technology,2020,105:103213.
[22]Tigabu M,Daneshvar A,Wu P F,et al. Rapid and non-destructive evaluation of seed quality of Chinese fir by near infrared spectroscopy and multivariate discriminant analysis[J]. New Forests,2019,51:395-408.
[23]李 武,李 妍,李高科,等. 高温老化下甜玉米种子活力近红外光谱检测技术研究[J]. 核农学报,2018,32(8):1611-1618.
[24]曲 歌. 基于近紅外光谱数据的水稻种子活力预测模型研究[D]. 大庆:黑龙江八一农垦大学,2019.
[25]Pang L,Men S,Yan L,et al. Rapid vitality estimation and prediction of corn seeds based on spectra and images using deep learning and hyperspectral imaging techniques[J]. IEEE Access,2020,8:123026-123036.
[26]Seo Y,Lee H,Bae H J,et al. Optimized multivariate analysis for the discrimination of cucumber green mosaic mottle virus-infected watermelon seeds based on spectral imaging[J]. Journal of Biosystems Engineering,2019,44(2):95-102.
[27]Zhou X,Sun J,Tian Y,et al. Development of deep learning method for lead content prediction of lettuce leaf using hyperspectral images[J]. International Journal of Remote Sensing,2020,41(6):2263-2276.
[28]Matzrafi M,Herrmann I,Nansen C,et al. Hyperspectral technologies for assessing seed germination and trifloxysulfuron-methyl response in Amaranthus palmeri (palmer amaranth) [J]. Frontiers in Plant Science,2017,8:474.
[29]Nansen C,Zhao G P,Dakin N,et al. Using hyperspectral imaging to determine germination of native Australian plant seeds[J]. Journal of Photochemistry and Photobiology(B:Biology),2015,145:19-24.
[30]Dumont J,Hirvonen T,Heikkinen V,et al. Thermal and hyperspectral imaging for Norway spruce (Picea abies) seeds screening[J]. Computers and Electronics in Agriculture,2015,116:118-124.
[31]He X T,Feng X P,Sun D W,et al. Rapid and nondestructive measurement of rice seed vitality of different years using near-infrared hyperspectral imaging[J]. Molecules,2019,24(12):2227.
[32]Cui H W,Cheng Z S,Li P,et al. Prediction of sweet corn seed germination based on hyperspectral image technology and multivariate data regression[J]. Sensors,2020,20(17):4744.
[33]Zhang T T,Fan S X,Xiang Y Y,et al. Non-destructive analysis of germination percentage,germination energy and simple vigour index on wheat seeds during storage by Vis/NIR and SWIR hyperspectral imaging[J]. Spectrochimica Acta(Part A:Molecular and Biomolecular Spectroscopy),2020,239:118488.
[34]張 林. 基于高光谱图像技术的水稻种子品种及活力等级检测研究[D]. 镇江:江苏大学,2021.
[35]Ma T,Tsuchikawa S,Inagaki T.Rapid and non-destructive seed viability prediction using near-infrared hyperspectral imaging coupled with a deep learning approach[J]. Computers and Electronics in Agriculture,2020,177:105683.
[36]Yang Y,Chen J P,He Y,et al. Assessment of the vigor of rice seeds by near-infrared hyperspectral imaging combined with transfer learning[J]. RSC Advances,2020,10(72):44149-44158.
[37]Zhang L,Sun H,Rao Z H,et al. Hyperspectral imaging technology combined with deep forest model to identify frost-damaged rice seeds[J]. Spectrochimica Acta(Part A:Molecular and Biomolecular Spectroscopy),2020,229:117973.
[38]Wu N,Weng S Z,Chen J X,et al. Deep convolution neural network with weighted loss to detect rice seeds vigor based on hyperspectral imaging under the sample-imbalanced condition[J]. Computers and Electronics in Agriculture,2022,196:106850.
[39]Baek I,Kusumaningrum D,Kandpal L M,et al. Rapid measurement of soybean seed viability using kernel-based multispectral image analysis[J]. Sensors,2019,19(2):271.
[40]Akbar F M,Mukasa P,Santosh L,et al. Online application of a hyperspectral imaging system for the sorting of adulterated almonds[J]. Applied Sciences,2020,10(18):65-69.
[41]Zhang J,Dai L M,Cheng F.Classification of frozen corn seeds using hyperspectral VIS/NIR reflectance imaging[J]. Molecules,2019,24(1):149.
[42]Wakholi C,Kandpal L M,Lee H,et al. Rapid assessment of corn seed viability using short wave infrared line-scan hyperspectral imaging and chemometrics[J]. Sensors and Actuators(B:Chemical),2018,255:498-507.
[43][JP2]de Medeiros A D,Bernardes R C,da Silva L J,et al. Deep learning-[JP]based approach using X-ray images for classifying Crambe abyssinica seed quality[J]. Industrial Crops and Products,2021,164:113378.
[44]Leo-Araújo F,Gomes F G Jr,de Silva A R,et al. Evaluation of the desiccation of Campomanesia adamantium seed using radiographic analysis and the relation with physiological potential[J]. Agronomy Journal,2019,111(2):592-600.
[45]Abud H F,Cícero S M,Gomes F G Jr.Radiographic images and relationship of the internal morphology and physiological potential of broccoli seeds[J]. Acta Scientiarum Agronomy,2018,40(1):34950.
[46]Pinheiro D T,Capobiango N P,de Medeiros A D,et al. Assessment of the physical and physiological quality of Piptadenia gonoacantha seeds (Mart.) J.F.Macbr.using image analysis[J]. Revista árvore,2020,44:e4426.
[47]de Medeiros A D,Pinheiro D T,Xavier W A,et al. Quality classification of Jatropha curcas seeds using radiographic images and machine learning[J]. Industrial Crops and Products,2020,146:112162.
[48][JP2]de Medeiros A D,Bernardes R C,da Silva L J,et al. Deep learning-[JP]based approach using X-ray images for classifying Crambe abyssinica seed quality[J]. Industrial Crops and Products,2021,164:113378.
[49]Galletti P A,Carvalho M E A,Hirai W Y,et al. Integrating optical imaging tools for rapid and non-invasive characterization of seed quality:tomato (Solanum lycopersicum L.) and carrot (Daucus carota L.) as study cases[J]. Frontiers in Plant Science,2020,11:577851.
[50]da Silva C B,Oliveira N M,de Carvalho M E A,et al. Autofluorescence-spectral imaging as an innovative method for rapid,non-destructive and reliable assessing of soybean seed quality[J]. Scientific Reports,2021,11:17834.
[51]BatistaB,Mastrangelo C B,de Medeiros A D,et al. A reliable method to recognize soybean seed maturation stages based on autofluorescence-spectral imaging combined with machine learning algorithms[J]. Frontiers in Plant Science,2022,13:914287.
[52]de Medeiros A D,da Silva L J,Ribeiro J P O,et al. Machine learning for seed quality classification:an advanced approach using merger data from FT-NIR spectroscopy and X-ray imaging[J]. Sensors,2020,20(15):4319.
[53]de Jesus Martins Bianchini V,Mascarin G M,Silva L C A S,et al. Multispectral and X-ray images for characterization of Jatropha curcas L. seed quality[J]. Plant Methods,2021,17(1):1-13.
基金項目:广东省重点领域研发计划(编号:2022B0202110003);“科技创新2030”重大项目(编号:2022ZD0115701)。
作者简介:石 睿(1998—),男,江苏无锡人,硕士研究生,主要从事种子活力无损检测讲究。E-mail:993499350@qq.com。
通信作者:王 成,博士,研究员,主要从事农业智能装备研究。E-mail:wangc@nercita.org.cn。

