鹅星状病毒RdRp蛋白对细胞因子转录水平的影响
饶丹 尹磊 吴佩 王媛媛 何书海 张宁 董建国

饶 丹,尹 磊,吴 佩,王媛媛,等. 鹅星状病毒RdRp蛋白对细胞因子转录水平的影响[J]. 江苏农业科学,2024,52(7):164-168.
doi:10.15889/j.issn.1002-1302.2024.07.022
(1.信阳农林学院动物科技学院,河南信阳 464000; 2.河南牧业经济学院,河南郑州 450046; 3.河南丰源和普农牧股份有限公司,河南漯河 462000)
摘要:为了解鹅星状病毒(GAstV)RdRp蛋白对细胞因子转录水平的影响,试验将构建的pCMV-RdRp真核质粒转染293细胞,并于转染后12、24、36 h收集细胞,提取核酸检测细胞内CCL2、CCL5、IL-1β、IFN-α、TNF-α、IFITM1和IFITM2的转录水平。结果发现,GAstV RdRp蛋白于12、24、36 h极显著抑制CCL2转录,12 h极显著促进CCL5表达,24、36 h极显著抑制CCL5表达(P<0.01);GAstV RdRp蛋白于24、36 h极显著促进IL-1β转录(P<0.01);GAstV RdRp蛋白于12 h极显著促进IFN-α的转录,于24、36 h极显著抑制IFN-α转录(P<0.01);GAstV RdRp蛋白于12、24、36 h显著或极显著抑制TNF-α转录(P<0.01);GAstV RdRp蛋白于24 h极显著抑制IFITM1转录(P<0.01),于36 h显著抑制转录(P<0.05),于12、36 h极显著促进IFITM2转录(P<0.01),于24 h极显著抑制IFITM2的转录(P<0.01)。表明GAstV RdRp蛋白过表达能够诱导IL-1β的转录,抑制CCL2、TNF-α和IFITM1的转录;GAstV RdRp蛋白早期促进CCL5和IFN-α的转录,后期抑制CCL5和IFN-α的转录;GAstV RdRp蛋白早期和晚期促进IFITM2转录,中期抑制IFITM2转录。
关键词:鹅星状病毒;细胞因子;转录;RdRp蛋白
中圖分类号:S852.65+7 文献标志码:A 文章编号:1002-1302(2024)07-0164-05
星状病毒(astrovirus,AstV)是一种无囊膜、单股正链RNA病毒。根据感染宿主能力不同,星状病毒可分为哺乳动物星状病毒和禽星状病毒[1]。禽星状病毒主要感染鸡、火鸡、鸭、鹅等,在不同的宿主引起的症状不同。2017年以来,一种以痛风为主要症状的传染性疾病在我国东南沿海和内陆省份主要养鹅地区暴发,研究显示这种感染主要是由鹅星状病毒(goose astrovirus,GAstV)引起,鹅场小鹅的死亡率超过50%[2-5]。尸检显示有严重的内脏和关节尿酸沉积症状,研究显示病鹅肾脏的病毒拷贝数最高,其次是脾脏和肝脏[6]。这种疾病给养鹅业造成了巨大的经济损失。
GAstV在2005年出现痛风症状的小鹅病料中被首次发现[7]。GAstV基因组共有3个开放阅读框(open reading frame,ORF):ORF1a、ORF1b和ORF2。星状病毒的ORF1a和ORF1b存在重叠区,ORF1a和ORF1b编码非结构蛋白(non-structural protein,NSP),包括跨膜区域(transmembrane,TM)、丝氨酸蛋白酶、卷曲螺旋(coiled-coil,CC)、病毒基因组连接蛋白(viral genome-linked protein,VPg)、核定位信号(nuclear localization signal,NLS)及RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase,RdRp)。ORF2编码衣壳蛋白(capsid protein,CP),其中,ORF1a编码多聚蛋白,ORF1b编码RNA依赖的RNA聚合酶(RdRp)蛋白[8]。RdRp能够催化mRNA合成,并通过互补RNA中间体复制RNA病毒基因组。同时,病毒需要以受控的方式生成这些RNA物种,与宿主细胞激烈竞争资源进行繁殖。流感病毒在RNA合成的每一步均利用宿主因子增强和调节RdRp活性[9]。猪细胞白介素-2增强剂结合因子2能够和猪繁殖与呼吸综合征病毒RdRp相互作用,抑制病毒复制[10]。这些研究表明,了解病毒RdRp调控病毒和宿主的机制,研制针对RdRp的药物,在预防和治疗病毒感染肿胀方面具有重要意义。AstV可感染多个宿主,目前对于AstV的RdRp蛋白调控宿主机制研究较少。[JP2]
细胞因子在病毒增殖中具有重要作用。研究显示,CCL2、CCL5、IL-1β和TNF-α能够影响HIV-1、[JP]甲型流感病毒、乙型肝炎病毒和猫传染性腹膜炎病毒的增殖[11-14]。且肾脏中IL-1β和 TNF-α 的表达水平与鹅星状病毒引起的痛风有关[15],而IFN和抗病毒蛋白具有重要的抗病毒特性。为研究鹅星状病毒的致病机制,本研究初步探索GAstV RdRp蛋白对CCL2、CCL5、IL-1β、IFN-α、TNF-α、IFITM1和IFITM2转录水平的影响,以期为开放抗病毒药物提供一定的理论依据。
1 材料与方法
1.1 试验材料
1.1.1 细胞和质粒
293细胞由信阳农林学院动物科技学院免疫病理实验室冻存;表达GAstV RdRp蛋白的真核质粒pCMV-RdRp-HA由信阳农林学院动物科技学院免疫病理实验室构建保存,本试验于2022年12月在信阳农林学院动物科技学院免疫病理实验室进行。
1.1.2 试验试剂
核酸提取试剂DNA/RNA Extraction Kit FT(Prepackaged)、反转录试剂盒(1st Strand cDNA Synthesis Kit+gDNA wiper)、荧光定量试剂AceQ qPCR SYBR Green Master Mix(High ROX Premixed),购自南京诺唯赞生物科技股份有限公司;细胞因子CCL2、CCL5、IL-1β、TNF-α、IFNα和抗病毒蛋白IFITM基因定量检测引物,由金唯智生物科技有限公司合成。
1.2 方法
1.2.1 细胞培养
从液氮中复苏293细胞,于5%二氧化碳的培养箱在含有10%胎牛血清和双抗的DMEM培养基中培养,并铺入12孔板中,待细胞密度达90%时进行转染。
1.2.2 质粒转染
每孔细胞使用50 μL无血清培养基稀释 0.6 μg 真核质粒pCMV-RdRp-HA。同时,将 1.2 μL LipofectamineTM 2000试剂加入50 μL无血清培养基。随后将两者混合,室温静置20 min,随后将混合物加入细胞培养孔中,分别于转染后12、24、36 h收集细胞于-80 ℃保存备用。
1.2.3 核酸的提取
使用FastPure Cell Total RNA Isolation Kit试剂盒提取细胞中的总RNA,具体操作如下:将细胞加入Buffer RL,漩涡振荡,转移至收集管中,直至无明显细胞团,12 000 r/min离心2 min。收集上清液,加入Buffer RL2(已加入无水乙醇),轻柔混匀,转移至RNA Pure Columns中(RNA Pure Columns已放入收集管中),12 000 r/min离心 1 min,弃废液。将剩余的液体全部加入吸附柱中,12 000 r/min 离心 1 min,弃废液,重复1次。向RNA Pure Columns中加入Buffer RW2(已加入无水乙醇),[JP]12 000 r/min离心1 min,弃废液,12 000 r/min离心2 min。向吸附柱中央部位悬空滴加100 μL RNase-free ddH2O。室温放置2 min,12 000 r/min离心1 min,洗脱RNA。提取的RNA放于-80 ℃保存备用。
1.2.4 细胞因子检测
将提取的RNA进行反转录,反转录体系如下:5×gDNA wiper Mix 2 μL,RNA 8 μL,5×RT Mix 2 μL,HiScript Ⅲ Enzyme Mix 2 μL,Random hexamers 1 μL,RNase-free ddH2O 5 μL。反應程序:37 ℃ 15 min,85 ℃ 5 s。随后采用染料法对细胞中的CCL2、CCL5、IL-1β、TNF-α和IFITM的转录水平进行定量检测。定量检测引物如下:CCL2F:5′-GCCTCCAGCATGAAAGTCTC-3′,CCL2R:5′-AGGTGACTGGGGCATTGAT-3′;CCL5F:5′-CTGCCTCCCCATATTCCTCG-3′,CCL5R:5′-CACACTTGGCGGTTCTTTCG-3′;IL-1βF:5′-[JP9]AGGCACAAGGCACAACAGGCT-3′,IL-1βR:5′-AACAACTGACGCGGCCTGCC-3′;TNF-αF:5′-CCCTCTGGCCCAGGCAGTCA-3′,TNF-αR:5′-ATGGGTGGAGGGGCAGCCTT-3′;IFITM1F:5′-TCAGGTCAAGGATAGTCTGGAG-3′,IFITM1R:5′-AGGTTGTGTATTCCCACACTGTA-3′;IFITM2F:5′-GGAGGGAGAAAACTCCTTGGA-3′,IFITM2R:5′-GGCCAGTAGGTTGCACATTGT-3′。反应程序:95 ℃ 30 s;95 ℃ 15 s,60 ℃ 15 s,40个循环。
1.2.5 数据处理
使用2-ΔΔCT方法计算检测基因的相对表达水平,采用GraphPad Prism 5软件进行统计分析。所有数据均以“平均值±标准差”表示。P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 GAstV RdRp蛋白影响CCL2、CCL5的转录
293细胞转染pCMV-RdRp真核质粒,转染后12、24、36 h收集细胞,检测细胞中CCL2和CCL5基因的转录水平。由图1可知,RdRp蛋白于12、24、36 h极显著抑制CCL2转录(P<0.01),12 h极显著促进CCL5表达(P<0.01),24、36 h极显著抑制CCL5表达(P<0.01)。
2.2 GAstV RdRp蛋白影响IL-1β的转录
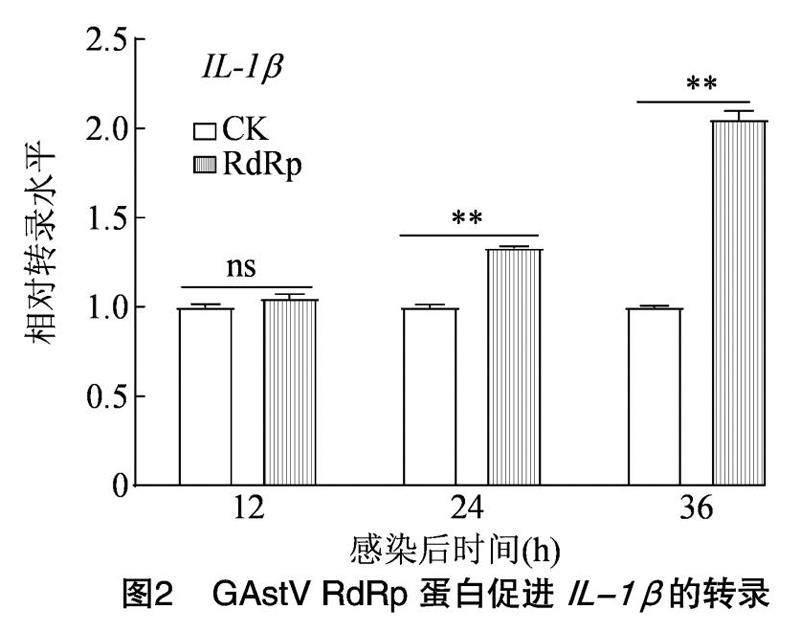
293细胞转染pCMV-RdRp真核质粒,转染后12、24、36 h收集细胞,检测细胞中IL-1β的转录水平。由图2可知,RdRp蛋白于24、36 h极显著促进IL-1β的转录(P<0.01)。
2.3 GAstV RdRp蛋白对IFN-α转录的影响
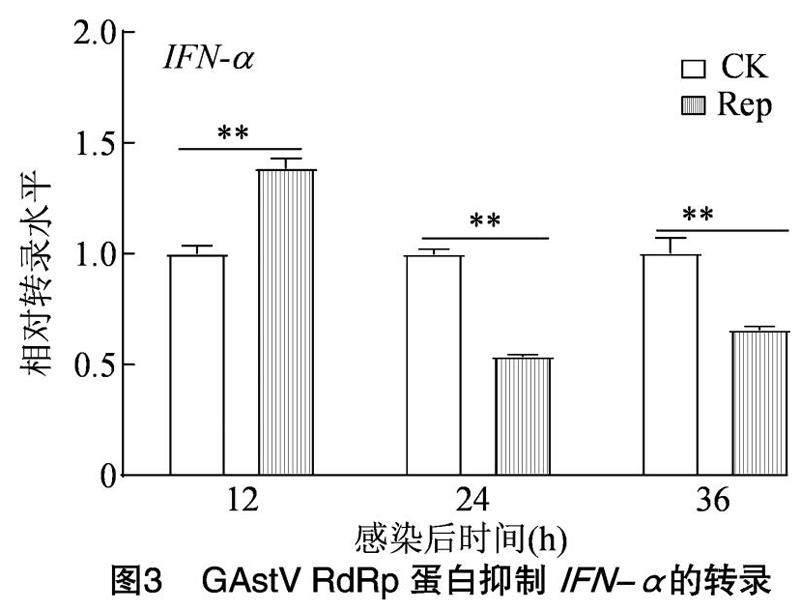
293细胞转染pCMV-RdRp真核质粒,转染后12、24、36 h收集细胞,检测细胞中IFN-α的转录水平。由图3可知,RdRp蛋白于12 h极显著促进IFN-α的转录(P<0.01), 于24、36 h极显著抑制IFN-α的转录(P<0.01)。
2.4 GAstV RdRp蛋白对TNF-α转录的影响
293细胞转染pCMV-RdRp真核质粒,转染后12、24、36 h收集细胞,检测细胞中TNF-α的转录水平。由图4可知,RdRp蛋白于12 h显著抑制TNF-α的转录(P<0.05),于24、36 h极显著抑制TNF-α转录(P<0.01)。
2.5 GAstV RdRp蛋白影响IFITM的转录
293细胞转染pCMV-RdRp真核质粒,转染后12、24、36 h收集细胞,检测细胞中IFITM1和IFITM2的转录水平。由图5可知,RdRp蛋白于 24 h 极显著抑制IFITM1转录(P<0.01),于36 h显著抑制IFITM1的转录(P<0.05),于12、36 h极显著促进IFITM2的转录,于24 h极显著抑制IFITM2转录(P<0.01)。
3 讨论与结论
自2016年末,我国许多养鹅地区频繁发生以雏鹅痛风为主要症状的疫病,发病率高达80%,死亡率在20%~70%之间,给我国养鹅业的发展造成了巨大经济损失[16]。痛风主要引起3周龄以内雏鹅
发病,病鹅肝脏、脾脏和肾脏等内脏器官表面及关节腔有大量的尿酸盐沉积。研究发现,引起该疫病的主要原因是一种新型星状病毒——鹅星状病毒,病毒具有广泛的组织嗜性,主要侵害肾脏[17]。
在痛风发生过程中,炎症反应发挥重要作用。病毒感染宿主后,往往通过自身蛋白调节宿主信号通路,影响细胞因子的表达,利于自身的增殖和扩散。趋化因子是白细胞(包括:单核细胞、T细胞和自然杀伤细胞)的趋化剂。CCL2在宿主的先天免疫反应中发挥重要作用,CCL2可吸引单核细胞和T淋巴细胞到病原体感染部分,进而引发一系列炎症反应。人类免疫缺陷病毒(HIV-1)感染人原代巨噬细胞诱导CCL2表达,HIV-1感染的巨噬细胞和外周血单核细胞中,CCL2 mRNA水平均升高[18]。丙型肝炎病毒core蛋白通过NF-kB通路诱导巨噬细胞中CCL2的表达[19]。与低毒力相比,感染高毒力的非洲猪瘟病毒能够诱导猪血液中CCL2的表达上调[20]。研究显示,CCL2和CCL5能够促进病毒增殖。CCL2有助于病毒自身蛋白Gag-p6介导的HIV-1的释放[11]。CCL5通过上调SAMHD1水平抑制甲型流感病毒的复制[12]。本研究显示,GAstV RdRp蛋白过表达能够抑制CCL2的表达,而对于CCL5,RdRp蛋白过表达后早期促进CCL5表达,后期抑制CCL5表达。同时,GAstV RdRp蛋白过表达后早期促进IFN-α转录,后期抑制IFN-α转录,且影响抗病毒蛋白IFITM1和IFITM2的转录水平。趋化因子在病毒感染宿主后,在宿主体内广泛扩散中发挥重要作用,而IFN和抗病毒蛋白具有重要的抗病毒特性。这些因子的改变是否会导致GAstV广泛的组织嗜性,利于病毒增殖有待进一步研究。
研究显示,许多病毒感染会导致炎症反应剧烈发生,产生的炎症因子进一步影响病毒的增殖。白细胞介素(IL)-1β是一种关键的先天细胞因子,对免疫激活和促进炎症过程至关重要。流感病毒H1N1感染导致儿童体内IL-1β的表达上调[21],禽流感病毒感染导致鸡巨噬细胞分泌IL-1β[22]。IL-1β 能够抑制体内乙型肝炎病毒的复制,而乙型肝炎病毒通过抑制NF-κB信号通路进而抑制由LPS激活的炎性小体的激活和IL-1β的产生,从而逃避宿主的先天性免疫反应[20]。犬流感病毒感染巨噬细胞后,诱导TNF-α的分泌和细胞死亡[23]。猫传染性腹膜炎病毒感染巨噬细胞,诱导TNF-α的分泌,上调Ⅱ型猫传染性腹膜炎病毒受体猫氨基肽酶N在猫巨噬细胞中的表达,利于病毒感染[14]。猪繁殖与呼吸综合征病毒感染巨噬细胞后诱导TNF-α的分泌,进而抑制猪瘟病毒的复制,致使临床上出现猪繁殖与呼吸综合征感染,导致猪瘟疫苗免疫失败[24]。在对患痛风雏鹅肾脏中相关炎性因子和炎性信号分子的表达水平进行研究时显示,肾脏中 IL-1β 和TNF-α的表达水平显著升高,导致雏鹅肾脏出现严重的炎性损伤[15]。本研究显示,GAstV RdRp蛋白显著诱导IL-1β的转录水平,抑制 TNF-α 的转录水平。TNF-α的转录水平下降是否会促进GAstV的增殖,而GAstV的增殖是否会导致病毒蛋白RdRp诱导IL-1β的产生,进而导致肾脏的损伤和尿酸盐沉积,其具体机制有待于进一步深入研究。
本研究显示,GAstV RdRp蛋白过表达能够诱导IL-1β的转录,抑制CCL2、TNF-α和IFITM1的转录;早期促进CCL5和IFN-α的转录,后期抑制CCL5和IFN-α的转录;早期和晚期促进IFITM2转录,中期抑制IFITM2转录。
参考文献:
[1]张 红,田秋丰,陈志峰,等. 鹅星状病毒病原学研究进展[J]. 家禽科学,2023,45(2):53-56.
[2]施朝辉. 仔鹅痛风病流行病学调查[J]. 中国畜禽种业,2019,15(11):168-169.
[3]岳 稳,张 瑞,黄 瑜,等. 扬州鹅关节痛风病例的诊断及病原鉴定[J]. 福建畜牧兽医,2020,42(6):25-26.
[4]章丽娇,黄欣梅,刘 飞,等. 新型鹅星状病毒AHQJ18株的分离鉴定[J]. 江苏农业学报,2019,35(5):1262-1264.
[5]李甜甜,王鉅华,朱国强,等. 鹅星状病毒的分离鉴定及其致病性研究[J]. 中国家禽,2020,42(10):116-120.
[6]Madeley C R,Cosgrove B P. Letter:viruses in infantile gastroenteritis[J]. Lancet,1975,2(7925):124.
[7]Liu C G,Sun M H,Liao M. A review of emerging goose astrovirus causing gout[J]. BioMed Research International,2022,2022:1635373.
[8]付新亮,江丹莉,侯展鹏,等. 致雏鹅痛风新型鹅星状病毒研究进展[J]. 中国预防兽医学报,2021,43(7):786-790.
[9]Peacock T P,Sheppard C M,Staller E,et al. Host determinants of influenza RNA synthesis[J]. Annual Review of Virology,2019,6(1):215-233.
[10]Wen X X,Bian T,Zhang Z B,et al. Interleukin-2 enhancer binding factor 2 interacts with the nsp9 or nsp2 of porcine reproductive and respiratory syndrome virus and exerts negatively regulatory effect on the viral replication[J]. Virology Journal,2017,14(1):125.
[11]Ajasin D O,Rao V R,Wu X H,et al. CCL2 mobilizes ALIX to facilitate Gag-p6 mediated HIV-1 virion release[J]. eLife,2019,8:e35546.
[12]Silva T,Temerozo J R,do Vale G,et al. The chemokine CCL5 inhibits the replication of influenza a virus through SAMHD1 modulation[J]. Frontiers in Cellular and Infection Microbiology,2021,11:549020.
[13]Yu X,Lan P X,Hou X B,et al. HBV inhibits LPS-induced NLRP3 inflammasome activation and IL-1β production via suppressing the NF-κB pathway and ROS production[J]. Journal of Hepatology,2017,66(4):693-702.
[14]Takano T,Hohdatsu T,Toda A,et al. TNF-alpha,produced by feline infectious peritonitis virus (FIPV)-infected macrophages,upregulates expression of type Ⅱ FIPV receptor feline aminopeptidase N in feline macrophages[J]. Virology,2007,364(1):64-72.
[15]Xi Y M,Yan J S,Li M Y,et al. Gut microbiota dysbiosis increases the risk of visceral gout in goslings through translocation of gut-derived lipopolysaccharide[J]. Poultry Science,2019,98(11):5361-5373
[16]金前跃,郭永刚,李俊朋,等. 鹅星状病毒XX株的分离鉴定及遗传特征分析[J]. 河南农业科学,2021,50(6):134-141.
[17]Zhu Q H,Sun D B. Goose astrovirus in China:a comprehensive review[J]. Viruses,2022,14(8):1759.
[18]Mengozzi M,de Filippi C,Transidico P,et al. Human immunodeficiency virus replication induces monocyte chemotactic protein-1 in human macrophages and U937 promonocytic cells[J]. Blood,1999,93(6):1851-1857.
[19]Song X T,Gao X,Wang Y D,et al. HCV core protein induces chemokine CCL2 and CXCL10 expression through NF-κB signaling pathway in macrophages[J]. Frontiers in Immunology,2021,12:654998.
[20]Fishbourne E,Hutet E,Abrams C,et al. Increase in chemokines CXCL10 and CCL2 in blood from pigs infected with high compared to low virulence African swine fever virus isolates[J]. Veterinary Research,2013,44(1):87.
[21]Chiaretti A,Pulitanò S,Barone G,et al. IL-1 β and IL-6 upregulation in children with H1N1 influenza virus infection[J]. Mediators of Inflammation,2013,2013:495848.
[22]Abdul-Cader M S,de Silva Senapathi U,Nagy E,et al. Antiviral response elicited against avian influenza virus infection following activation of toll-like receptor (TLR)7 signaling pathway is attributable to interleukin (IL)-1β production[J]. BMC Research Notes,2018,11(1):859.
[23]Powe J R,Castleman W L. Canine influenza virus replicates in alveolar macrophages and induces TNF-alpha[J]. Veterinary Pathology,2009,46(6):1187-1196.
[24]Chen D J,Liu X W,Xu S K,et al. TNF-α induced by porcine reproductive and respiratory syndrome virus inhibits the replication of classical swine fever virus C-strain[J]. Veterinary Microbiology,2019,234:25-33.
基金項目:信阳农林学院青年教师基金(编号:QN2021010);2023年度河南省重点研发与推广专项(科技攻关)资助项目(编号:232102111043);河南省高等学校青年骨干教师培养计划;信阳农林学院家禽重大疫病防控科技创新团队资助项目(编号:2022CXTD06)。
作者简介:饶 丹(1988—),女,江西南昌人,硕士,讲师,主要从事动物病毒学研究。E-mail:raodan2007@126.com。
通信作者:董建国,博士,副教授,主要从事动物病毒学研究。E-mail:dongjianguo213@163.com。

