长双歧杆菌婴儿亚种利用母乳低聚糖的分子机制及益生作用研究进展
陈禹含,李巧慧,李 岩,苏 倩,郭欢新,段勃帆,孟祥晨
(东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
母乳能为婴儿提供早期成长所需的所有营养物质以及有助于婴儿健康的许多生物活性物质,如母乳低聚糖(human milk oligosaccharides,HMOs)、生物活性肽、免疫球蛋白、细胞因子、核苷酸、脂肪酸和活细胞等[1-3]。一些生物活性分子由乳腺上皮细胞产生和分泌,一些则由母乳中的细胞产生,而另一些则来自母体血清[4]。研究表明,母乳微生物群、免疫因子(如分泌型免疫球蛋白A、抗菌肽和蛋白质)和HMOs可以塑造婴儿肠道菌群,促进免疫系统发育,增强肠道屏障,维持小肠和大肠中超过百万亿细菌的定植[5-6]。
HMOs在乳腺中合成,是母乳中最丰富的生物活性分子,也是母乳中第三大固体成分[7]。在初乳中HMOs的质量浓度约为20~25 g/L,在成熟乳中约为5~20 g/L。目前已知母乳中含有超过200 种的HMOs,其他哺乳动物的乳汁均达不到与母乳相同的HMOs丰度[8]。由于大多数HMOs对婴儿胃肠道中的胃酸和消化酶有抗性,所以HMOs可以直接到达婴儿结肠,影响婴儿肠道上皮细胞和免疫细胞反应,也可以通过改变宿主肠道菌群组成和产生代谢产物间接地调节婴儿的免疫系统[1]。研究发现,配方奶粉喂养的婴儿因缺乏HMOs而比母乳喂养的婴儿更容易患有一些儿童疾病,包括坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、肠易激综合症、肥胖、过敏和湿疹[9-10]。近年来,在配方奶粉中添加HMOs成为热点。一些母乳中大量存在的HMOs已被广泛研究并可以通过基因工程技术实现工业化生产。
低物种多样性和高变异性是婴儿肠道菌群的主要特征。在出生后的前6 个月,婴儿肠道菌群结构单一、种类少。属于放线菌门的厌氧革兰氏阳性菌——双歧杆菌,是利用HMOs的主要微生物,除此之外只有少数拟杆菌和乳杆菌可利用HMOs。婴儿肠道内的双歧杆菌已进化出一系列复杂的代谢途径利用HMOs,要完全降解具有不同分子结构的HMOs,需要一系列的糖苷酶和转运蛋白,这些酶和转运蛋白对吸收、代谢和利用HMOs至关重要。代谢HMOs的相关基因几乎只存在于婴儿肠道相关的细菌基因组中,而在其他环境的菌群基因组中几乎检测不到[11]。
双歧杆菌占母乳喂养婴儿肠道菌群的90%[11],在母乳喂养婴儿的肠道菌群中占主导地位,虽然HMOs主要被双歧杆菌利用,但这种能力并不是所有双歧杆菌都具有。两歧双歧杆菌(Bifidobacteriumbifidum)和长双歧杆菌婴儿亚种(B.longumsubsp.infantis)是利用HMOs种类最多的两个菌种,这两个(亚)菌种可以利用由不同基团修饰的不同结构的HMOs[12]。而长双歧杆菌长亚种(B.longumsubsp.longum)和短双歧杆菌(B.breve)只能利用乳糖-N-四糖(lacto-N-tetraose,LNT)、乳糖-N-二糖(lacto-N-biose,LNB)和乳糖-N-新四糖(lacto-N-neotetraose,LNnT),无法利用被岩藻糖或唾液酸修饰的HMOs[13]。研究表明,B.longumsubsp.infantis是HMOs的最活跃利用者,能够消耗总HMOs的64%,而其他菌种的利用率只在23%~43%[14]。并且B.longumsubsp.infantis优先消耗HMOs而不是其他碳水化合物[15],能够在以HMOs为唯一碳源的培养基上良好生长。本文针对B.longumsubsp.infantis能够广泛利用HMOs这一优势,综述其代谢HMOs所需的糖苷酶及转运体,根据其作用位点关联相应结构的HMOs,描述B.longumsubsp.infantis对HMOs的利用方式,并总结B.longumsubsp.infantis代谢HMOs对婴儿产生的益生作用,以期为探究HMOs与肠道菌群的互作机制以及该机制对婴儿肠道发育和成熟的作用奠定基础。
1 HMOs的组成和结构
HMOs的组分及丰度受母体影响极大,不同地域、不同个体以及同一个体的不同哺乳期之间都有差异[7]。HMOs分子结构和丰度取决于乳腺细胞中α-1,2-岩藻糖基转移酶(α-1,2-fucosyltransferase,FUT2)和α-1,3/4-岩藻糖基转移酶(α-1,3/4-fucosyltransferase,FUT3)的表达[16]。FUT2负责通过α-1,2键连接L-岩藻糖(L-fucose,Fuc)和D-半乳糖(D-galactose,Gal)末端,形成H-抗原双糖结构(fucal-2Galβ1-4GlcNAc-R)结构或H-抗原结构[17]。FUT3通过1型链上的α-1,4键连接Fuc和N-乙酰葡糖胺(N-acetylglucosaminide,GlcNAc)。岩藻糖基转移酶基因的表达由分泌基因(Secretor,Se)和路易斯(Lewis,Le)血型特征决定[18]。FUT2和FUT3分别由Se基因和Le基因编码。根据Se和Le基因的表达,母乳分泌可分为4 种类型:FUT2与FUT3均活跃(Se+Le+)、FUT2活跃但FUT3不活跃(Se+Le-)、FUT3活跃但FUT2不活跃(Se-Le+)以及FUT2与FUT3均不活跃(Se-Le-)。因此,Se阳性的母亲乳汁中2’-岩藻糖基乳糖(2’-fucosyllactose,2’-FL)含量丰富。相反,Se阴性母亲的乳汁不含有α-1,2-岩藻糖基化的HMOs;Le阴性的女性不分泌含有α-1,4岩藻糖基化的HMOs,如乳糖-N-岩藻五糖II(lacto-N-fucopentaose II,LNFP II)。
HMOs一般由5 种糖基组成,分别为D-葡萄糖(D-glucose,Glc)、Gal、GlcNAc、Fuc以及唾液酸(N-乙酰神经氨酸(N-acetylneuraminic acid,NeuAc/Neu5Ac))(图1A),聚合度(degree of polymerization,DP)在3~32之间[1]。HMOs的核心结构由Gal和Glc组成(即乳糖结构),常被Fuc、GlcNAc和NeuAc修饰[19]。如果HMOs的结构中含有NeuAc,则被定义为酸性低聚糖。HMOs的主链可以被唾液酸化或岩藻糖基化,形成三糖结构,如2’-FL,3-岩藻糖基乳糖(3-fucosyllactose,3-FL),3’-唾液酸乳糖(3’-sialyllactose,3’-SL)和6’-唾液酸乳糖(6’-sialyllactose,6’-SL)(图1B、C)。HMOs的还原末端乳糖基可通过由β-1,3或β-1,6键连接的乳糖-N-二糖(Galβ1-3GlcNAc-,LNB,I型链)或N-乙酰乳糖胺(N-acetyl-D-lactosamine,Galβ1-4GlcNAc-,LacNAc,II型链)进行延伸。含II型链HMOs的含量比I型链少。I型或II型链可以通过β-1,4糖苷键进行组合,形成LNT和LNnT,或是在不同环节中通过α-1,2、α-1,3或α-1,4键被岩藻糖基化,进而通过α-2,3或α-2,6键唾液酸化,从而形成各种结构的异构体[20],如乳糖-N-岩藻五糖(lacto-Nfucopentaose,LNFP)I、LNFP II、LNFP III、乳糖-N-二岩藻六糖(lacto-N-difucohexaoses,LNDFH)I、LNDFH II、唾液酸乳糖-N-四糖(LS-tetrasaccharide,LST)a、LST b和二唾液酸乳糖-N-四糖(disialyllacto-Ntetraose,DSLNT)(图1D)。乳糖还可以通过β-1,3、β-1,4和β-1,6键连接半乳糖残基,形成半乳糖基乳糖(galactosyllactose,GL),如3’-半乳糖基乳糖(3’-GL)、4’-半乳糖基乳糖(4’-GL)和6’-半乳糖基乳糖(6’-GL)(图1E)。GL通常存在于人类初乳中,成熟乳中含量很低。通过β-1,6键连接形成有分支结构的HMOs被称为iso-HMO,没有分支的线性结构HMOs被称为para-HMO[20](图1G)。仅含Glc、Gal和GlcNAc的中性核心结构HMOs占总HMOs的42%~55%,中性岩藻糖基化HMOs占总HMOs的35%~50%,唾液酸化HMOs占总HMOs的12%~14%[21-22]。
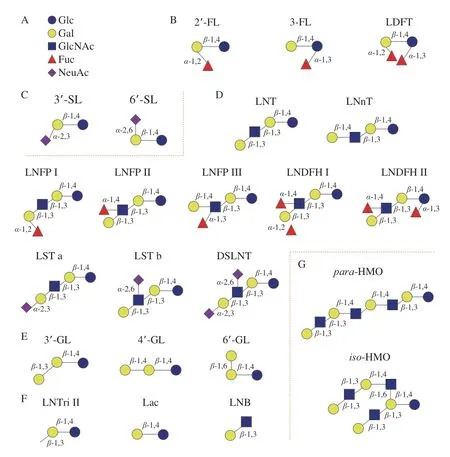
图1 HMOs的组成和结构[1,11]Fig.1 Composition and structure of HMOs[1,11]
目前,仍有许多种结构未知的HMOs,开发利用更先进的新型分析技术,如基质辅助激光解吸电离质谱和多维核磁共振光谱等,将更有助于HMOs结构的分析和测定[23-24]。糖基的连接方式扩展了HMOs的多样性,也造成了利用HMOs难度增加,仅有能够表达相关糖苷酶及转运体的细菌才能代谢HMOs。
2 B.infantis对HMOs的利用方式
双歧杆菌是婴儿肠道菌群中代谢HMOs最活跃的物种之一。经鉴定,该属菌株中存在许多能够表达与代谢HMOs相关糖苷酶和转运蛋白的基因。双歧杆菌已经进化出两种利用HMOs的方式:一种依赖转运蛋白(细胞内消化);另一种依赖胞外糖苷酶(细胞外消化)[11]。B.bifidum和一些B.longumsubsp.longum菌株缺乏完整的HMOs转运蛋白,因此利用胞外糖苷酶在细胞外分解HMOs获取单糖或双糖,其余HMOs降解物被转运蛋白运输进细胞内进一步降解,而B.longumsubsp.infantis会通过特定的转运蛋白将完整的HMOs运输至细胞内降解[11,25-29](表1)。2008年,随着B.longumsubsp.infantis标准菌株ATCC 15697完整基因组序列的公开,在该菌株中发现了几个能够反映B.longumsubsp.infantis对婴儿宿主潜在适应性的基因,包括与HMOs分解代谢相关的基因簇、细胞外溶质结合蛋白和预测对HMOs有活性的渗透酶[30]。表2列举了B.longumsubsp.infantis含有的利用HMOs的糖苷酶和转运体基因。

表1 不同双歧杆菌利用HMOs的方式Table 1 Ways of different bifidobacteria to utilize HMOs

表2 与B.longum subsp.longum代谢HMOs相关的酶和转运蛋白Table 2 Enzymes and transporters related to HMO metabolism in B.longum subsp.longum
2.1 参与利用HMOs的酶
为驱动双歧支路,双歧杆菌进化出了几种对HMOs具有高特异性的糖苷酶和磷酸化酶。研究人员通过对所有已公开的B.longumsubsp.infantis全基因组序列进行分析,挖掘出了多种参与利用HMOs的糖苷酶基因,这些与HMOs代谢有关的基因家族高度保守,涵盖了水解HMOs结构上几乎全部连接键的功能[31]。
2.1.1 岩藻糖苷酶
负责去除HMOs中岩藻糖的酶被命名为岩藻糖苷酶,共有两种:1,2-α-L-岩藻糖苷酶和1,3/4-α-L-岩藻糖苷酶。1,2-α-L-岩藻糖苷酶对Fucα1-2Gal-O-R高度敏感[33],因此能灵敏识别2′-FL和LNFP I。此外,该酶还对LDFT、LNDFH I和3-FL也有一定的活性[34]。1,3/4-α-L-岩藻糖苷酶的独特之处是它需要一个支链半乳糖残基水解岩藻糖苷键。该酶采用了由半乳糖残基与活性位点结合而触发的诱导拟合催化机制[11],可作用于LNFP II和LNFP III。
2.1.2 唾液酸酶(neuraminate exonuclease,NanH2)
NanH2是将NeuAc从核心结构中分离出来的酶。NanH2作用于唾液酸化HMOs中的α-2,3和α-2,6糖苷键。B.longumsubsp.infantis产生的NanH2对这两种键的水解能力几乎相同[26]。研究表明,B.longumsubsp.infantis可以进一步代谢酶解产生的Fuc和NeuAC[35]。
2.1.3β-半乳糖苷酶
经岩藻糖苷酶和NanH2去除修饰物后,可以水解HMOs的核心结构。对Gal起作用的酶有两种。通过搜索双歧杆菌的基因组,Yoshida等[27]发现了LNTβ-1,3-半乳糖苷酶,它可以特异性地将LNT水解为Gal和LNTri II,对LNT活性最强,其次是Lac、LNB和LNnT。此外,B.longumsubsp.infantis还能产生β-1,4-半乳糖苷酶[36],HMOs中的Lac和II型链(Galβ1-4GlcNAc-O-R)是β-1,4-半乳糖苷酶的敏感靶点。
2.1.4β-N-乙酰氨基葡萄糖苷酶
B.longumsubsp.infantisATCC 15697产生的3 种β-N-乙酰氨基葡萄糖苷酶(Blon_0459、Blon_0732和Blon_2355)对LNTri II的水解能力很强。研究证明Blon_0459和Blon_0732可以利用去掉末端Gal残基后的LNH,且对LNH中β-1,6键连接的GlcNAc残基也有活性[28]。
2.1.5 GNB/LNB磷酸化酶
GNB/LNB 磷酸化酶是一种胞内酶,能够可逆地磷酸化GNB/LNB,生成α-半乳糖1-磷酸(α-Dgalactose1-phosphate,Gal1P)和N-乙酰半乳糖胺(N-acetylgalactosamine,GalNAc)/GlcNAc[11]。在相同底物的GNB/LNB代谢过程中,磷酸化生成的Gal1P无需消耗ATP就可以转化为果糖6-磷酸,这可以节省ATP的消耗[37]。Sakanaka等[11]对婴儿肠道相关双歧杆菌基因组进行tblastn分析,发现在B.longumsubsp.infantis中编码GNB/LNB磷酸化酶的基因流行率大于75%。
2.2 相关转运体
仅有糖降解基因的存在,并不能保证双歧杆菌在HMOs存在时的生长能力。如,干酪乳杆菌BL23(LactobacilluscaseiBL23)含有1 种可以水解2′-FL的α-岩藻糖苷酶基因,但它不能在2′-FL上生长[38],原因可能是L.caseiBL23缺乏2′-FL跨膜转运蛋白[15]。
B.longumsubsp.infantis通过几种SBPs的介导,可以将完整的HMOs分子导入细胞内。B.longumsubsp.infantisATCC 15697是一个具有强大HMOs利用能力的典型菌株,该菌株具有编码几种细胞内HMOs相关糖苷酶和用于腺苷三磷酸结合盒转运蛋白(ATP-binding cassette transporter,ABC)的SBPs的基因簇。Ward等[39]采用聚糖阵列通过对B.longumsubsp.infantisATCC 15697基因组SBPs的特异性分析,揭示了该菌株利用HMOs的转运方式。当环境中有HMOs存在时,菌株相关转运体的基因表达水平提高了数倍[40]。但相比于对糖苷酶的了解,目前对转运蛋白的探究较为缺乏,只有LNB、FL和LNnT的转运蛋白得到了表征。
2.2.1 GNB/LNB转运体
GNB/LNB转运体负责转运由乳酸-N-生物酶在细胞外释放出来的LNB和由α-N-乙酰半乳糖氨酶从黏蛋白O-聚糖释放出来的GNB[41-42]。目前,对该转运体在B.longumsubsp.infantis中发挥作用的方式还有待研究。但Sakanaka等[11]进行的tblastn分析结果表明,B.longumsubsp.infantis中编码FL2-BP和GNB/LNB-BP的基因存在率高于FL1-BP和NahS。不同于全基因组测序只能在菌株中找到已知利用HMOs的基因的同源性,基因组文库筛选和转录组分析不依赖于数据库中已有的特征基因,可以发现和表征隐含的利用HMOs的基因[13,43]。
2.2.2 FL转运体
FL转运蛋白最早由Garrido[43]和Matsuki[44]等发现,该转运体可以将2’-FL、3-FL、LDFT和LNFP I转运进细胞内部。B.longumsubsp.infantisATCC 15697拥有两个同源的FL转运蛋白,其SBPs具有60%的一致性。通过生化和结构分析,明确了这两个转运蛋白的功能重合,但又不完全相同[29]。Sakanaka等[11]从B.longumsubsp.infantisATCC 15697中鉴定出这两种岩藻乳糖转运体(FL transporter-1和FL transporter-2),发现FT-transporter-2可以导入复杂的HMOs(2’-FL、3-FL、LDFT和LNFP I),而FT-transporter-1负责转运简单岩藻糖基化的HMOs(2’-FL和3-FL)。
2.2.3 LNnT转运体
James等[36]通过对在HMOs上生长的细胞转录组分析结果进行一系列靶向基因敲除,然后在添加了几种HMOs的培养基中监测突变体的生长情况,结果显示NahS(LNnT-BP)是负责转运LNnT的SBP。
2.3 B.longum subsp.infantis对HMOs的代谢途径
如图2所示,B.longumsubsp.infantis将整个HMOs分子通过SBPs运输到细胞质中,细胞内糖苷酶及磷酸化酶参与HMOs的酶解过程,在细胞内释放出单糖[25]。对B.longumsubsp.infantis的蛋白组学分析表明,这些被降解后形成的单糖通过双歧支路进入到婴儿肠道的中枢代谢途径,最终产生短链脂肪酸(short chain fatty acids,SCFAs)等代谢产物[45]。

图2 已知B.longum subsp.infantis对HMOs的利用途径[11]Fig.2 Utilization pathways of HMOs by B.longum subsp.infantis[11]
由于与HMOs代谢相关的基因簇存在明显差异,通常HMOs的利用方式和代谢途径高度依赖于特定的双歧杆菌种类或菌株,双歧杆菌的特定种或菌株对特定类型的HMOs利用能力也各不相同[46]。如B.longumsubsp.infantisJCM 1260因利用HMOs的基因簇缺失,所以在HMOs中生长能力较弱[14]。消化结构复杂的HMOs往往涉及多个基因簇的表达,高度相似的同源序列之间的微小差异也会导致相关酶和转运体的差异表达[1]。然而,到目前为止,并不是所有参与HMOs降解的基因都已被确认[13]。Lawson等[46]分离出的双歧杆菌菌株能够在HMOs上生长,但缺乏利用HMOs的已知基因簇,这表明存在未定性的代谢HMOs的基因。B.longumsubsp.infantis利用HMOs的途径仍有待探索。
3 B.longum subsp.infantis代谢HMOs产生的有益代谢产物
细菌代谢产物与宿主之间的互作是肠道菌群发挥益生作用的机制之一。HMOs经肠道菌群发酵可以产生一些潜在的有益代谢产物。当HMOs被肠道菌群分解代谢时,核心结构乳糖会随着修饰基团的水解而释放,经双歧支路及Leloir半乳糖代谢途径产生能量并用于生命活动[47]。同时,乳糖经双歧支路还会产生包括SCFAs在内的多种有益代谢产物,能够促进婴儿健康。被水解下来的各种糖基在胞代谢的途径至今仍处于推测阶段,研究十分有限。
3.1 SCFAs
B.longumsubsp.infantis可发酵HMOs产生SCFAs等,使肠道处于低pH值环境,有利于益生菌的生长,抑制潜在的病原体[48]。SCFAs是研究最透彻的代谢产物之一,主要包括乙酸、丙酸和丁酸。它们通常以高浓度存在于结肠中,并被肠上皮细胞吸收[1]。SCFAs可以通过调节细胞基因表达、分化、增殖和凋亡等过程改变细胞功能,激活G蛋白偶联受体,抑制组蛋白去乙酰化酶活性以及其他与缺氧诱导因子稳定相关的信号传导通路[1]。SCFAs还可以通过增加黏液蛋白的产生和增强肠道细胞水平的屏障功能直接影响肠道健康,同时通过促进富含调节性T细胞的肠道相关淋巴组织群体以调节免疫系统[48-49]。乙酸和丙酸都被认为可以降低婴儿哮喘的发生[50],丁酸可以通过促进肠上皮细胞产生黏蛋白及改善紧密连接的完整性,进一步维持肠道屏障功能[51]。研究表明,SL和2’-FL在发酵过程中会产生不同的SCFAs谱,但SCFAs的总体浓度均有所提高[1]。B.longumsubsp.infantis代谢藻糖基化HMOs产生了甲酸[52]。Perdijk等[53]建立了体外发酵模型,发现SL与GOS相比可以大大提高丙酸的浓度。Frese等[54]的研究显示,补充了B.longumsubsp.infantis的母乳喂养婴儿粪便中,乳酸、乙酸、丁酸和甲酸的数量增加。
3.2 芳香氨基酸衍生物
B.longumsubsp.infantis通过芳香乳酸脱氢酶的作用,在婴儿肠道中产生大量芳香乳酸,如色氨酸衍生的吲哚-3-乳酸(indole-3-lactic acid,ILA)[55]。色氨酸是人体必需氨基酸,一般由膳食蛋白质降解产生,小肠可以吸收大部分膳食来源的色氨酸,一小部分可到达结肠并被肠道菌群分解代谢转化为各种分解代谢物[56]。体外分析证实,与乳糖相比,B.longumsubsp.infantis在HMOs上生长时产生的ILA数量明显更多[57]。ILA是一种抗炎分子,可结合芳香烃受体和羧酸受体,调节单核细胞对脂多糖的反应,并阻断炎症细胞因子如白细胞介素-8的转录[55]。ILA途径可以维持新生儿免疫的炎症/抗炎平衡,阻止炎症细胞因子的产生,减轻炎症损伤[58]。这些发现表明B.longumsubsp.infantis介导的氨基酸代谢途径对早期免疫发育至关重要。
3.3 1,2-丙二醇(1,2-propanediol,1,2-PD)
岩藻糖基化的HMOs被转运进B.longumsubsp.infantis细胞后分解为L-岩藻糖,随后经一系列酶的作用,被转化为磷酸二羟丙酮和乳醛,磷酸二羟丙酮随后可以通过双歧支路进入中枢糖酵解途径,而乳醛在厌氧条件下通过氧化还原酶转化为1,2-PD[59]。研究认为,1,2-PD或许可以作为B.longumsubsp.infantis代谢岩藻糖基化HMOs的标志物,并且1,2-PD可以通过B细胞受体介导的信号通路促进B细胞的活化[59]。
4 B.longum subsp.infantis代谢HMOs产生的益生作用
由于母乳喂养不足,婴儿早期肠道菌群容易失调,从而导致一些免疫介导的疾病发生。通过研究发现,给母乳喂养的婴儿补充B.longumsubsp.infantis可以促进肠道的健康发育[54,60],B.longumsubsp.infantis可以通过多种方式影响婴儿肠道。但目前对HMOs介导的肠道菌群与婴儿肠道互作知之甚少。
4.1 改善肠道菌群结构
由于缺乏必要的酶和转运载体,大部分肠道细菌无法消化HMOs,这为专门消耗HMOs的有益细菌的生长提供了选择性的营养优势。作为代谢HMOs的主要微生物,B.longumsubsp.infantis已经进化出复杂的代谢HMOs途径,在定植能力上比其他肠道细菌更具有竞争优势。例如,与未补充B.longumsubsp.infantis母乳喂养的婴儿粪便相比,补充了B.longumsubsp.infantisEVC001组粪便样品表现出革兰氏阴性菌和拟杆菌丰度降低的趋势,并且内毒素水平降低了4 倍[54]。这表明B.longumsubsp.infantis通过占据肠道生态位点及防止病原体侵入肠道,在肠道免疫功能中起到关键作用[59]。此外,B.longumsubsp.infantis代谢HMOs产生的如SCFAs等代谢产物,可以通过交叉喂养作用间接刺激其他有益菌的生长,改善肠道菌群结构。
4.2 缓解免疫介导性疾病
肠道菌群及其代谢产物通过多种途径调节免疫系统,对宿主的免疫稳态起重要作用[61]。通常情况下肠道菌群介导的免疫平衡状态既能抵抗外来细菌又能保持自身耐受性,当肠道菌群发生改变时,可能会导致免疫反应失调,进而引起自身免疫性疾病。一项研究表明,在HMOs中生长的B.longumsubsp.infantis可以通过T细胞刺激肠道上皮细胞的活性,促进Caco-2细胞中抗炎细胞因子IL-10以及Caco-2细胞和HT-29细胞中黏附分子和紧密连接蛋白的表达[62]。与在葡萄糖和乳糖上生长的细胞相比,HMOs 3-FL促进了B.longumsubsp.infantisATCC 15697在HT-29和Caco-2细胞系上的黏附[63]。具有较强的黏附性是菌株在肠道内定植并发挥免疫调节作用的重要前提。B.longumsubsp.infantis通过利用HMOs产生代谢物,在宿主体内传递信号至免疫细胞,如吞噬细胞和T、B淋巴细胞等,对宿主免疫反应进行调节[64]。这对免疫介导性疾病起到关键作用。
Huda等[65]的研究表明B.longumsubsp.infantis可能通过增强免疫记忆提高对病毒疫苗的保护作用,也有研究显示LNT增加了新生儿轮状病毒菌株的感染性[66]。Masi等[67]发现DSLNT与降低未满月婴儿患坏死性小肠炎的几率有关。B.longumsubsp.infantis可以对炎症因子和抗菌物质的表达进行调控,并通过降低肠道屏障通透性及提高紧密连接蛋白的表达以降低NEC的发病率[68]。Seppo等[69]的研究表明,在肠道菌群中含高水平B.longumsubsp.infantis的婴儿患特应性疾病的概率更低。Henrick等[70]发现B.longumsubsp.infantisEVC001能够通过上调免疫调节因子——半乳糖凝集素-1以减少肠道中由辅助型T细胞(T helper cell,Th)2和Th17分泌的细胞因子,从而缓解母乳喂养婴儿全身性炎症和免疫失衡。
5 结语
HMOs的组成远比其他哺乳动物乳汁中的低聚糖种类更丰富、结构更复杂。B.longumsubsp.infantis已进化出利用不同HMOs的独特方式维持肠道微生物群的平衡。已知其通过多种特异性糖苷酶与转运体将HMOs转运至胞内水解,并通过双歧支路将水解后的单糖运送至中枢代谢途径,但仍有许多与代谢HMOs相关的功能性基因没有被发掘。B.longumsubsp.infantis通过利用HMOs产生有益代谢产物、改善肠道菌群结构以及介导免疫性疾病,从而促进婴儿肠道发育、维持肠道健康。然而,对代谢物的研究大多聚焦在SCFAs,并未阐明B.longumsubsp.infantis代谢不同HMOs的潜在标志物及代谢物中如氨基酸衍生物等其他发挥免疫调节作用的特定分子。
由于母乳资源的特殊性,提取具有特定分子结构的HMOs并将其应用于婴幼儿配方奶粉始终是一个难题。近年来,通过细胞工程、化学酶法和化学合成等方法,2’-FL、3’-SL、6’-SL、LNT、LNnT和双岩藻糖基乳糖的工业化生产取得了重大技术突破。在婴儿食品中补充天然提取或人工合成的HMOs化合物已经得到美国、欧盟、澳大利亚和其他地区监管机构的批准[71]。随着技术的提高,更多的HMOs将可能被用于工业化生产。基因组筛选技术的快速进步扩大了筛选利用HMOs基因的范围,更有助于全面认识HMOs的代谢过程。目前,已开展将HMOs作为益生元加入到婴儿配方奶粉或将双歧杆菌与HMOs作为合生元一起加入到各种饮料中的研究。未来,仍需深入挖掘利用HMOs的基因,综合评估婴儿肠道内双歧杆菌的益生特性,通过基因组学、代谢组学、蛋白质组学和糖组学等多种技术进一步研究双歧杆菌代谢HMOs的分子机制,探究婴儿肠道菌群与HMOs的互作机制,并通过体内外实验进行验证。

