不同富硒方式对甘薯叶蛋白抗氧化活性的影响
高 琦,段文瀚,彭 雪,王 宁,卢雅婷,张 倩,薛友林,*
(1.辽宁大学轻型产业学院,辽宁 沈阳 110036;2.中共辽宁省委党校,辽宁 沈阳 110161)
甘薯在我国是一种重要的农作物,具有丰富的营养成分[1-2]。人们对甘薯的利用目前大多集中于其块根,但甘薯叶也颇具研究价值。在粗蛋白含量方面,甘薯叶高于甘薯块根[3],约为芹菜、黄瓜的4 倍。甘薯叶含有丰富的胡萝卜素、VB1、VB2、VC以及铁、钙、镁等矿质元素[4-5],目前已有很多利用甘薯叶研制出的保健饮料或茶在售[6-7]。此外,甘薯茎、叶等地上部分还可取代面包中10%~15%的淀粉,具有改善食品特性的潜质[8-9]。同时甘薯叶中蛋白质含量高、必需氨基酸种类丰富、氨基酸比例较好[10]。甘薯叶的抗氧化性往往与其中酚类、花青素等多种成分的含量正相关,其对于癌症、哮喘、糖尿病、心血管疾病等的预防具有重要的作用[11]。因此,科学地开发新型甘薯叶产品具有一定的意义。植物叶蛋白是世界上最大的可再生资源之一,具有很高的开发价值[12]。从绿叶中提取的叶蛋白是一种优质的新型蛋白资源,未来在饲料、医疗等多个方面具有很广的应用前景[13]。甘薯叶也含有丰富的蛋白质,其粗蛋白含量约为21.1%~25.1%。不同种甘薯叶的营养物质含量差异较大,一般绿叶尖甘薯叶粗蛋白质、VC、Ca、Na含量高于紫绿色甘薯叶,而紫绿色甘薯叶的叶绿素和类胡萝卜素含量高于绿叶尖甘薯叶[9]。本实验采用叶尖颜色为绿色的甘薯叶,因此具有较多的粗蛋白与维生素,经提取后可作为添加剂用以丰富产品口感、提高营养价值,这种可再生蛋白资源的开发可以提高资源利用率,为可持续发展与资源的合理利用提供可行方案[14]。
硒对于人体有着重要的作用,在免疫、抗氧化、解毒等[15]方面均有重要作用。对于成人,世界卫生组织设定的每日硒摄入量为30~40 μg[16],而很多地区居民的硒摄入量不达标,我国国土面积近72%的地区为贫硒地带,其中30%的地区严重缺硒,因此很多地区克山病等疾病发病率很高。在免疫方面,硒能够提高机体巨噬细胞对病原体的吞噬作用,增强杀菌能力,还能提升机体淋巴细胞的分化能力。在抗氧化方面,硒能通过参与硒蛋白合成的方式在生物体内发挥抗氧化作用,如参与谷胱甘肽过氧化酶、硫氧还蛋白还原酶的合成。此外,硒还具有预防克山病、抗肿瘤和解毒等功效[17]。研究表明,施硒具有影响植物生长的效果。控制合适的施硒浓度,不仅能提高水稻的硒含量,还具有促进水稻增产的作用[18]。此外,施硒可抑制猕猴桃果实中有害元素的积累,能对其营养成分含量、香气、风味及外观特性等多个方面产生积极影响[19]。研究表明,对红富士苹果外源富硒可提高其VC含量,并使其口感更为甜美[20]。在甘薯方面,施硒可以使甘薯硒含量显著提高[21],并能提高甘薯块可溶性蛋白含量及甘薯产量[22]。
本研究采用叶面喷淋与土壤灌注两种方法对甘薯进行富硒,并设定富硒质量浓度梯度,待植株成熟采摘其叶片,提取其叶蛋白,测定甘薯叶总硒含量、蛋白硒含量及叶蛋白的多项抗氧化活性指标,以期解释不同富硒方式对甘薯叶蛋白产生的影响。
1 材料与方法
1.1 材料与试剂
实验使用甘薯种植于辽宁省沈阳市沈北新区华实生态基地石佛寺实验田,实验中对甘薯采用叶面喷淋与土壤灌注两种方式进行富硒。叶面富硒方法为先种植甘薯,之后在甘薯叶面喷洒亚硒酸钠溶液;土壤富硒则是以亚硒酸钠作为外源硒对土壤施硒,富硒质量浓度分别为0、0.4、0.8、1.2、1.6、2.0 mg/mL。本实验以穴播方式种植甘薯,在5月中旬进行种植,于7、8、9月分3 次分别对不同试验田中的叶面与土壤每次施硒约333 mL(共1.0 L),施硒地块面积为162 m2。于当年10月10日收获甘薯植株,共历时148 d。试验田每个方块3 m×3 m,共18 个方块。将每个方块分为17 垄,共种植3 行。每个方块种植50 株幼苗,株距为0.3 m[23]。
盐酸、氢氧化钠 天津永大化学试剂有限公司;磷酸、体积分数95%乙醇溶液、十二烷基硫酸钠、丙烯酰胺天津市大茂化学试剂厂;考马斯亮蓝 上海蓝季科技发展有限公司;没食子酸 上海研恬生物科技有限公司;芦丁、福林-酚试剂、甘氨酸 北京博奥拓达科技有限公司;低分子质量标准蛋白 北京索莱宝科技有限公司。
1.2 仪器与设备
UV-250紫外-可见分光光度计 岛津国际贸易(上海)有限公司;MC-SP2115多功能电磁炉 广东美的生活电器制造有限公司;MD8H型微波消解仪、AFS-9800型双道原子荧光分光光度计 上海奥普乐仪器有限公司;TG16G台式高速离心机 长沙英泰仪器有限公司;GZX-9076MBE电热鼓风干燥箱 上海博迅实业有限公司医疗设备厂;FB124电子电子分析天平 上海舜宇恒平科学仪器有限公司;SZ-500A-3超高速多功能粉碎机 永康市善竹贸易有限公司;PHS-3CB型pH计上海越平科学仪器有限公司。
1.3 方法
1.3.1 样品前处理
采摘新鲜的富硒甘薯叶,除去其表面的泥土污垢等杂质,按不同富硒质量浓度及不同富硒方式进行分类包装,并在-20 ℃冰箱中保藏。
1.3.2 富硒甘薯叶蛋白提取
利用甘薯叶中大部分蛋白可溶于稀碱溶液的性质,将新鲜的甘薯叶去除叶柄,加入0.3%的亚硫酸氢钠溶液进行打浆,离心以去除不溶性物质。取上清液,用稀盐酸调节pH值至4.5,此时甘薯叶蛋白达到等电点絮凝沉淀,经离心分离便可得到蛋白沉淀物,再以稀氢氧化钠溶液复溶,经过冷冻干燥可得到甘薯叶可溶性分离蛋白粉[23]。
1.3.3 甘薯叶硒含量测定
称取0.1 g干叶,将叶片放置于聚四氟乙烯消化瓶中,在瓶中加入6.0 mL的混合酸(由5.0 mL的纯硝酸溶液与1.0 mL的纯氢氟酸溶液混合而成)后密封,将瓶放入微波消化仪中进行消化操作,在10 min内升温至90 ℃,在7 W条件下(后同)消化10 min,继续升温至130 ℃消化10 min,冷却。冷却后加入5.0 mL浓盐酸,200 ℃加热至溶液清亮无色并有白烟出现,继续加热至剩余2~3 mL,冷却至室温,定容至25 mL。消化完成后,使用原子荧光光谱法对待测液中的硒含量进行检测。
1.3.4 甘薯叶蛋白硒含量测定
取0.1 g甘薯叶蛋白样品,按1.3.3节方法进行消化,升温至100 ℃,在7 W条件下消化5 min,后续升温至120 ℃,再次在7 W条件下消化8 min。将反应后的溶液定容至20 mL,最终以荧光光谱法测定硒含量。
1.3.5 甘薯叶蛋白总酚含量测定
总酚含量测定参照Zhang Lihua等[24]的方法,称取0.010 g没食子酸标准品定容于50 mL容量瓶中,分别吸取0.0、0.5、1.0、1.5、2、2.5、3.0 mL移入试管中加水稀释至10 mL,吸取1 mL稀释液,依次加入2 mL 10%福林-酚试剂、4 mL质量分数7.5%碳酸钠溶液,加水定容至25 mL,于45 ℃条件下避光反应1 h,于765 nm波长处测量吸光度,绘制标准曲线。
取0.2 g不同富硒质量浓度的甘薯叶蛋白样品(叶面富硒后的未富硒(0 mg/mL)、低硒(0.4 mg/mL)、高硒样品(2.0 mg/mL),后同)于离心管中,加入5 mL 50%(体积分数,下同)乙醇溶液,55 ℃密封水浴浸提3 h,之后于10 000 r/min条件下离心10 min,取上清液保存,即为样品提取液。
吸取样品提取液1 mL,再次进行上述操作后,代入标准曲线方程,计算得甘薯叶蛋白样品中总酚含量,结果以没食子酸当量表示,单位为mg/g。
1.3.6 甘薯叶蛋白总黄酮含量测定
总黄酮含量测定参照张一鸣等[25]的方法,称取0.010 g芦丁,于体积分数50%乙醇溶液中溶解并定容至100 mL容量瓶中,制成0.1 mg/mL的芦丁标准溶液。分别吸取刚配制好的芦丁溶液0.0、2.0、4.0、6.0、8.0、10.0 mL于6 个大试管中,用50%乙醇溶液补至10 mL后,加入0.8 mL质量分数5% NaNO2溶液摇匀,静置6 min,加入0.8 mL质量分数10% Al(NO3)3溶液后摇匀,静置6 min后加入10 mL 1 mol/L NaOH溶液,摇匀后静置15 min,于分光光度计510 nm波长处测量吸光度,绘制标准曲线。吸取1.3.5节所制备样品提取液1 mL,再次进行上述操作后,代入标准曲线方程,计算得甘薯叶蛋白样品中总黄酮含量,结果以芦丁当量表示,单位为mg/g。
1.3.7 甘薯叶蛋白抗氧化活性测定
1.3.7.1 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力测定
参考van Amsterdam等[26]的方法,将2 mL不同富硒质量浓度的蛋白样品(未富硒样品,叶面富硒后的低硒、高硒样品,土壤富硒后的低硒、高硒样品,下同)加入2 mL 0.06 mg/mL DPPH-乙醇溶液中,避光30 min后测定吸光度,并与VC和亚硒酸钠进行对比。未添加样品的空白组吸光度记为A1,添加样品或VC或亚硒酸钠的实验组吸光度记为A2,DPPH自由基清除率按照式(1)计算:
1.3.7.2 羟自由基清除能力测定
在试管中加入0.5 mL 9 mmol/L水杨酸-乙醇溶液、0.5 mL 9 mmol/L硫酸亚铁溶液、5 mL过氧化氢溶液和1 mL不同富硒质量浓度的蛋白样品,充分混匀后37 ℃恒温水浴20 min,并在510 nm波长处测吸光度,用纯水做对照实验[27],并与VC和亚硒酸钠进行对比。添加样品或VC或亚硒酸钠的实验组吸光度记为A1,不加过氧化氢的空白组吸光度记为A2,不加样品的空白组吸光度记为A0,羟自由基清除率按照式(2)计算:
1.3.7.3 超氧阴离子自由基清除能力测定
分别配制不同富硒质量浓度的蛋白样品溶液1 mL,与4.5 mL Tris-HCl缓冲溶液(0.05 mol/L pH 8.2)、1 mL去离子水混合,25 ℃水浴20 min,加入0.5 mL 25 mmol/L的邻苯三酚溶液,25 ℃水浴5 min,加入1 mL 8 mol/L HCl,在320 nm波长处测吸光度Ax,用0.5 mL的蒸馏水代替邻苯三酚溶液,所测得吸光度记为A0;取1 mL蒸馏水代替样品溶液作为对照组,所测得吸光度记为Ax0,并分别以VC和Na2SeO3作为阳性对照和阴性对照,超氧阴离子自由基清除率按照式(3)计算[28]:
1.3.8 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
根据Backman等[29]的方法稍作修改,配制15%的分离胶和5%的浓缩胶。选择富硒质量浓度为0、0.4、2.0 mg/mL的甘薯叶蛋白进行SDS-PAGE。样品添加样品缓冲液和β-巯基乙醇后用涡旋振荡器混匀,之后将样品和Marker(分子质量14.4~97.4 kDa)置于沸水中煮沸6 min,冷却后进行电泳,样品的上样量为15 μL,Marker上样量为10 μL。电泳电压设置为80 V,待样品和Marker指示条带进入分离胶时,上调电压至120 V,直至电泳结束,将凝胶染色1 h左右随后脱色(更换3 次脱色液),照胶成像。
1.4 数据处理与分析
使用Excel 2010、SPSS 25.0软件对数据进行统计分析,结果采用±s表示。相关性分析采用双变量Spearman检验,P<0.05为差异有统计学意义。
2 结果与分析
2.1 不同富硒方式对甘薯叶总硒含量及叶蛋白硒含量的影响
叶面富硒与土壤富硒之后,甘薯叶的总硒含量都有所提高(图1A),其中叶面富硒情况下甘薯叶的总硒含量在多数情况下高于土壤富硒。相较于土壤富硒,叶面富硒的叶总硒含量受富硒质量浓度变化影响更为明显,变化幅度更大。在富硒质量浓度达到1.6 mg/mL时,叶面富硒后的总硒含量最大,为4.37 mg/g,而1.2 mg/mL条件下,土壤富硒的总硒含量达到最大,为1.66 mg/g。由此可见,甘薯叶在富硒质量浓度增加到极限值后便不会继续提高,其极限富硒质量浓度为1.2~1.6 mg/mL,叶面富硒甘薯叶极限硒含量为4.37 mg/g,土壤富硒样品极限硒含量仅为1.66 mg/g。相比之下,花生叶的极限富硒质量浓度也在1.6 mg/mL左右[30];葡萄则无极限富硒质量浓度,在2.0 mg/mL范围内硒含量不断提升[31]。研究表明甘薯施硒过量会导致甘薯中硒含量反而降低[32],本实验与该研究结果基本相符。而叶面富硒相较于土壤富硒,受过量施硒的影响更小。

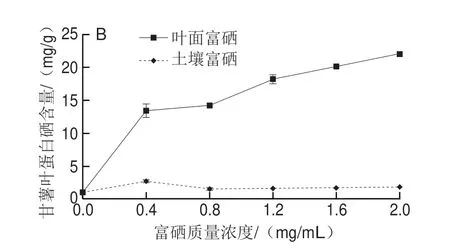
图1 不同富硒质量浓度两种富硒方式甘薯叶总硒含量(A)与叶蛋白硒含量(B)Fig.1 Total Se (A) and protein-bound Se contents (B) in Se-enriched sweet potato leaves with two Se application methods at different concentrations
如图1B所示,在蛋白硒含量方面,叶面富硒后甘薯叶的蛋白硒含量总体缓慢上升,而土壤富硒后蛋白硒含量则受富硒质量浓度影响很小。在富硒质量浓度为2.0 mg/mL时,蛋白硒含量最高,为22.00 mg/g。而对于土壤富硒,在富硒质量浓度为0.4 mg/mL时,蛋白硒含量最高,为2.71 mg/g。在富硒质量浓度为1.6 mg/mL时,两种富硒处理组蛋白硒含量分别达到20.10 mg/g与1.68 mg/g。综上,叶面富硒对甘薯叶蛋白硒含量有显著提升,即叶面富硒更有利于硒与蛋白质的结合。
2.2 不同富硒方式对甘薯叶蛋白总酚、总黄酮含量的影响
如表1所示,对不同富硒质量浓度甘薯叶蛋白的总酚、总黄酮含量进行测定,用于后续分析富硒过程中总酚与总黄酮含量是否会对叶蛋白抗氧化活性产生影响。

表1 叶面富硒甘薯叶蛋白总酚、总黄酮含量Table 1 Contents of total polyphenols and flavonoids in leaf proteins from sweet potato with foliar Se application
2.3 不同富硒方式对甘薯叶蛋白抗氧化活性的影响
2.3.1 DPPH自由基清除能力
DPPH自由基因具有良好的接受电子与氢自由基形成稳定化合物的能力,其清除能力能够较好地反映物质的抗氧化活性[33]。由图2可知,VC对DPPH自由基具有很强的清除能力,而相比之下无机硒(亚硒酸钠)的清除能力则较低。随着蛋白溶液质量浓度的增大,未施硒对照组的DPPH自由基清除率逐渐增大,在溶液质量浓度为0.2 mg/mL时,其DPPH自由基清除率达到(48.67±4.36)%。

图2 叶面富硒(A)与土壤富硒(B)甘薯叶蛋白在不同质量浓度条件下的DPPH自由基清除率Fig.2 DPPH radical scavenging capacity of various concentrations of leaf proteins from sweet potato with foliar (A) and soil (B) application
在两种方式富硒后,甘薯叶蛋白对DPPH自由基的清除率都相较无硒对照组更高,在溶液质量浓度为0.2 mg/mL时,土壤富硒后高硒质量浓度溶液的DPPH自由基清除率达到(92.87±1.03)%,叶面高硒质量浓度溶液的DPPH自由基清除率也达到(91.22±0.64)%。因此,富硒能够提高甘薯叶蛋白的DPPH自由基清除率。从富硒质量浓度角度看,叶面富硒与土壤富硒在高富硒质量浓度时的DPPH自由基清除能力均强于低富硒质量浓度时的清除能力。
2.3.2 羟自由基清除能力
如图3所示,随着蛋白溶液质量浓度的增大,几组样品羟自由基清除能力均不同程度增强。VC的羟自由基清除能力最强,在蛋白溶液质量浓度为0.2 mg/mL时,达到(98.71±0.43)%,无机硒(亚硒酸钠)的羟自由基清除能力也很强,在蛋白溶液质量浓度为0.2 mg/mL时达到(87.93±0.01)%。而甘薯叶蛋白也具有一定的羟自由基清除能力,在0.2 mg/mL质量浓度条件下,未富硒甘薯叶蛋白的羟自由基清除率为(12.25±0.57)%。在施硒处理后,甘薯叶蛋白的羟自由基清除率小幅度增加。且在高硒情况下,羟自由基的清除率高于低硒时的清除率。在0.2 mg/mL质量浓度条件下,叶面高硒质量浓度溶液羟自由基清除率为(14.07±0.20)%,土壤高硒质量浓度溶液的羟自由基清除率为(17.49±0.85)%。综上,无机硒对甘薯叶蛋白的羟自由基清除能力有一定影响,通过富硒可以使甘薯叶蛋白羟自由基清除能力提升。

图3 叶面富硒(A)与土壤富硒(B)甘薯叶蛋白在不同质量浓度条件下的羟自由基清除率Fig.3 Hydroxyl radical scavenging capacity of various concentrations of leaf proteins from sweet potato with foliar (A) and soil (B)Se application
2.3.3 超氧阴离子自由基清除能力
如图4所示,VC的超氧阴离子自由基清除能力在各种样品中最强,在0.2 mg/mL质量浓度条件下,其清除率为(89.92±0.48)%,而无机硒(亚硒酸钠)对于超氧阴离子自由基的清除能力很弱,在0.2 mg/mL时仅为(6.54±0.40)%,富硒后的甘薯叶蛋白的超氧阴离子自由基清除能力相比未施硒的叶蛋白都有所提升,在溶液质量浓度0.20 mg/mL条件下,相比未富硒甘薯叶蛋白,高硒甘薯叶蛋白的超氧阴离子自由基清除率提升了19.17%。这说明在硒与蛋白结合后,能够提高甘薯叶蛋白的抗氧化活性,超氧阴离子自由基清除能力是通过与蛋白结合而提升。

图4 叶面富硒(A)与土壤富硒(B)甘薯叶蛋白在不同质量浓度条件下的超氧阴离子自由基清除率Fig.4 Superoxide anion radical scavenging capacity of various concentrations of leaf proteins from sweet potato with foliar (A) and soil Se (B) application
由图4可知,高硒叶蛋白的超氧阴离子自由基清除能力均高于低硒叶蛋白。叶面高硒质量浓度样品在0.2 mg/ mL 时超氧阴离子自由基清除率为(83.48±0.69)%,而土壤高硒质量浓度样品在0.2 mg/ mL 时超氧阴离子自由基清除率为(88.29±2.41)%,均高于无机硒组。
2.4 SDS-PAGE分析结果
由图5可以看出,3 个质量浓度蛋白所得条带之间无明显差异。电泳条带在28~40 kDa范围内比较集中。可以看出富硒后甘薯叶蛋白出现了8 条较明显的条带,说明甘薯叶蛋白中蛋白质种类丰富。研究表明,甘薯叶蛋白在53 kDa存在条带,且为主要条带,此条带对应1,5-二磷酸羧化酶[34-35],是植物光合作用中固定二氧化碳的酶,本实验中53 kDa处的蛋白与上述研究结果相符。
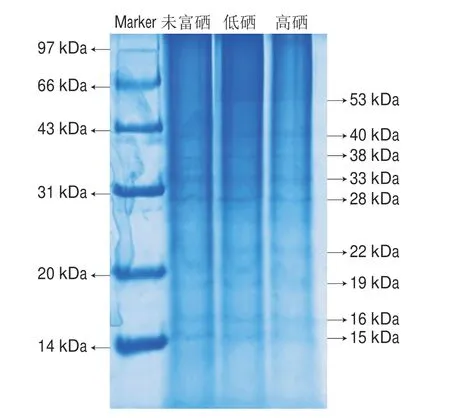
图5 叶面富硒甘薯叶蛋白的SDS-PAGE图Fig.5 SDS-PAGE patterns of leaf proteins from sweet potato with foliar Se application
2.5 相关性分析
通过对硒含量的测定,已得出叶面富硒后甘薯叶蛋白中硒含量更高的结论,因此选取叶面富硒的甘薯叶蛋白在质量浓度为0.15 mg/mL时的抗氧化活性与甘薯叶蛋白中主要成分含量进行相关性分析。由表2可知,叶蛋白中各组分含量与抗氧化活性间有不同程度的相关性。DPPH自由基清除率与各组分含量均无显著相关性;羟自由基清除率与叶硒含量极显著相关,并与叶蛋白中总多酚含量显著相关;超氧阴离子自由基清除率与叶蛋白硒含量、总黄酮含量极显著相关,与蛋白质含量显著相关。总之,对甘薯叶蛋白抗氧化活性影响更强的因素为硒含量,而总多酚、总黄酮含量也对甘薯叶蛋白抗氧化活性有一定影响。有研究表明,土壤中的亚硒酸根部分会被植物根部转化为有机硒化合物而留在根部,部分会通过被动运输运至其他组织中,在叶片中,亚硒酸根会参与硒代半胱氨酸(SeCys)与硒代蛋氨酸(SeMet)等有机硒化物的合成[36]。此外,硒也能够促进植物多酚类与花青素的积累[37],具体机理尚待进一步研究。综上,富硒会影响植物中蛋白合成等多个代谢过程,从而对代谢产物含量产生影响,进而影响叶蛋白的抗氧化活性。从相关性分析也可得出,甘薯叶蛋白的抗氧化活性的变化是富硒对多种物质含量影响共同导致的。
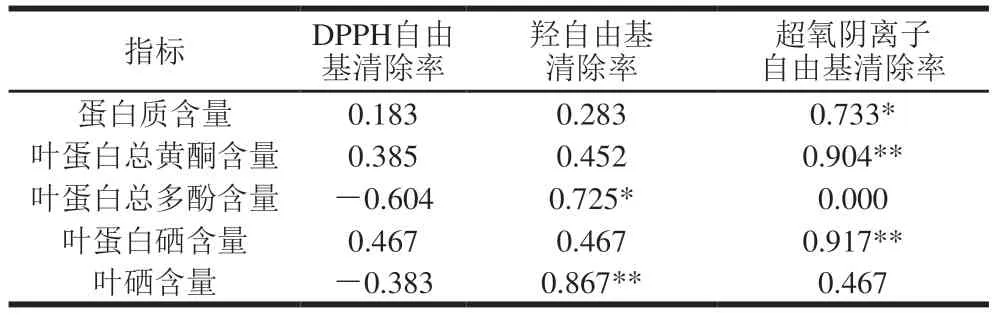
表2 甘薯叶蛋白中各组分含量与其抗氧化活性的相关性分析Table 2 Correlation analysis between components in and antioxidant activity of sweet potato leaf proteins
3 结论
相对于土壤富硒,叶面富硒是更为有效的富硒方式。叶面富硒后,甘薯叶蛋白的总硒含量与蛋白硒含量都高于土壤富硒,即叶面富硒后,既能提升甘薯叶中硒含量,也能让硒更好地与甘薯叶蛋白结合。而在抗氧化活性方面,叶面与土壤富硒后的甘薯叶蛋白DPPH自由基清除能力、羟自由基清除能力、超氧阴离子自由基清除能力均高于未富硒样品,高富硒质量浓度样品在超氧阴离子自由基与羟自由基清除方面也强于低富硒质量浓度样品。因此,富硒可以更好地提升甘薯叶蛋白的抗氧化活性。从SDS-PAGE结果分析,不同富硒质量浓度对甘薯蛋白种类无显著影响。在实际生产甘薯时,高富硒质量浓度能让甘薯叶蛋白具有更好的抗氧化活性,叶面施硒可显著提升甘薯叶硒含量,叶面富硒效果更佳,是值得推广的富硒方式。

