热激处理对鲜切百合鳞茎片贮藏品质的影响
陈佳妮,罗耀华,孔 慧,丁 可,葛 帅,丁胜华
(湖南大学生物学院隆平分院,湖南省农业科学院农产品加工研究所,果蔬贮藏加工与质量安全湖南省重点实验室,洞庭实验室,湖南 长沙 410125)
百合(Liliumspp.)是百合科(Liliaceae)百合属的多年生草本球茎植物,具有观赏、食用和药用价值。目前,百合属大约有110 种百合,其中50%左右分布在中国。因此,中国也被认为是百合的全球多样性中心[1-2]。作为百合的主要食用器官,百合鳞茎具有减轻咳嗽、缓解哮喘、改善睡眠、降低血糖、提高免疫力和预防阿尔茨海默病等多种生理功效,深受消费者喜爱[3-4]。但在运输、贮藏、销售过程中,百合鳞茎易受到机械损伤和微生物污染,导致百合鳞茎发生酶促褐变、功效成分损失,营养品质和商品价值降低,造成巨大的经济损失[5]。鲜切果蔬又称最少加工果蔬,即新鲜果蔬经分级、清洗、去皮、切分、包装和冷藏等处理后,直接供消费者食用的产品。新鲜的百合鳞茎颜色鲜亮、肉质肥厚、口感鲜嫩,适合鲜切加工,具有广阔的消费前景。
百合鳞茎富含多种酚类物质,如槲皮素、芦丁、山柰酚等[6],极易被过氧化物酶(peroxidase,POD)、多酚氧化酶(polyphenol oxidase,PPO)、苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)等酶催化,从而发生褐变。POD可催化百合鳞茎片的酚类化合物发生氧化反应,导致酶促褐变。百合鳞茎的细胞膜遭到破坏时,PPO从结合态转变为游离态,催化酚类化合物反应生成醌,随后产生难溶的棕色聚合物,即引起百合鳞茎褐变。此外,鲜切百合鳞茎切分后,发出受伤信号并激活苯丙烷代谢途径,诱导PAL催化苯丙氨酸脱氨形成肉桂酸,再经过一系列反应生成酚类化合物,因此,PAL可间接影响酶促褐变底物的含量[7]。鲜切百合鳞茎片在切口边缘处褐变较为严重,肉片表面出现紫红色色变。褐变会伴随营养成分损失和组织结构软化,这会加重鲜切百合鳞茎片的品质劣变,缩短其货架期。
目前,为有效延缓鲜切百合鳞茎片的品质劣变以及抵御病原菌侵染从而延长货架期,研究者们采用了气调包装[8]、涂膜处理[9]、熏蒸处理[10]等手段。例如,Huang Hao等[11]研究了UV-C处理对鲜切百合鳞茎品质的影响,与对照组相比,4 ℃贮藏处理组的PPO和POD活性分别降低了约26%和18%,而总酚(total phenolics,TP)含量提高了13%。UV-C处理下调了α-淀粉酶、β-淀粉酶和淀粉磷酸化酶的活性,导致淀粉含量、总可溶性糖含量较高。Li Xu等[12]研究发现,鲜切百合鳞茎片通过改性气调包装(10% O2+5% CO2+85% N2)处理,抑制了贮藏期间PAL、PPO、POD的活性和酚类物质的氧化。同时,通过延缓鳞茎细胞膜中不饱和脂肪酸与饱和脂肪酸比例的降低,减慢了细胞结构的降解速率。魏丽娟等[13]研究了二氧化氯对4 ℃贮藏条件下兰州百合鳞茎片的品质影响,结果表明,贮藏15 d内,二氧化氯显著抑制了百合鳞茎片的褐变并提高了其抗氧化活性(P<0.05)。但过度使用化学保鲜剂可能会增加食品安全风险和环境压力。因此,亟需开发一种操作简单、绿色安全、能有效防止百合鳞茎片品质劣变的保鲜技术。
热激处理(heat shock treatment,HT)作为一种安全、简便、高效的处理方法,在延缓果蔬褐变、保持果蔬质地、延长贮藏期等方面具有重要作用,已广泛运用于鲜切果蔬保鲜[14]。据报道,鲜切大白菜经55 ℃热水处理3 s,贮藏10 d后仍保持良好的色泽,感官品质显著高于对照组(P<0.05)[15]。Vilaplana等[16]将有机香蕉于40 ℃热水中浸泡20 min,结果表明HT降低了有机香蕉的质量和硬度损失,促进了采后有机香蕉炭疽病的防控,对其理化和感官品质没有负面影响。Endoa等[17]报道青梅经HT后,可将贮存货架期延长一周,HT抑制了贮藏期间丙二醛(malondialdehyde,MDA)和过氧化氢的积累,能够有效稳定抗坏血酸含量并提高总抗氧化能力。此外,有研究表明,50 ℃条件下使用HT对柑橘处理3 min,降低了果实贮藏的呼吸速率和MDA含量,将贮藏90 d后的腐烂率降低到4.00%左右[18]。然而,目前关于HT对鲜切百合鳞茎片品质特性和贮藏期的影响报道较少。因此,本实验以新鲜的兰州百合(Liliumdavidiivar.unicolorCotton)为材料,采用55 ℃热水对鲜切百合鳞茎片处理2 min,并将其置于4 ℃、相对湿度为90%~95%的冷库保藏,研究热激对鲜切百合鳞茎片贮藏期间品质特性的影响,以期为延缓鲜切百合鳞茎片品质劣变提供技术支撑。
1 材料与方法
1.1 材料与试剂
兰州百合于2021年3月采自甘肃省兰州市,挑选大小均匀、无明显机械损伤和病虫害的新鲜兰州百合,采收后立即运送至实验室,于4 ℃、相对湿度为90%~95%的冷库保藏。
硫代巴比妥酸、聚乙烯吡咯烷酮、聚乙二醇、愈创木酚、氢氧化钠、乙二胺四乙酸、邻苯二酚、无水乙酸钠、考马斯亮蓝、蒽酮、三氯乙酸、乙酸乙酯、海藻酸钠、曲拉通X-100(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
Color Quest XE全自动色度分析仪 美国HunterLab公司;UV-1800紫外-可见分光光度计 岛津仪器(苏州)有限公司;CT3质构仪 美国Brookfield工程实验室公司;HT7700透射电子显微镜 日本日立公司。
1.3 方法
1.3.1 原料预处理
选用无明显病害、无机械损伤和大小匀称的新鲜百合,将新鲜百合鳞茎分瓣得鲜切百合鳞茎片,用自来水清洗并沥干水分后,随机分为两组,CK组(未经任何处理直接装入聚乙烯保鲜袋并封口)和HT组(将百合鳞茎片置于50 ℃水中完全浸没2 min,再取出沥干并装袋),两组都置于4 ℃、相对湿度为90%~95%的冷库中贮藏40 d,每10 d取样测定。
1.3.2 质量损失率、腐烂率和硬度测定
1.3.2.1 质量损失率
以入冷库时间为0 d,每10 d随机选取6 袋百合鳞茎片进行称量,以第0天样品质量作为初始质量(m0),取样日样品质量记为m1,按式(1)计算质量损失率:
1.3.2.2 腐烂率
参考巩慧玲等[19]的方法测定,腐烂率按照式(2)计算:
1.3.2.3 硬度
硬度参考杨剑婷等[20]的方法进行测定,CT3质构仪选用TA44探头,测前速率、测试速率、返回速率分别设定2、3、3 mm/s,数据采集速率100 pps。挑选6 个大小均匀的样品,每个样品重复测定3 次,取平均值。
1.3.3 颜色、褐变度测定
1.3.3.1 颜色
采用XE自动色度分析仪测定鳞茎片的外观颜色,分别记录L*(亮度)、a*(红-绿度)和b*(黄-蓝度)值,颜色以白度[21]表示,按照式(3)计算:
1.3.3.2 褐变度
随机取2 g鳞茎片,加入10 mL 95%的乙醇溶液后匀浆,4 000×g离心20 min,取上清液在420 nm波长处测定吸光度,褐变度以A420nm×10表示[22]。
1.3.4 MDA含量和相对电导率(relative electric conductivity,REC)测定
1.3.4.1 MDA含量
根据文献[23]方法稍作修改,用硫代巴比妥酸法测定。随机称取2 g(m)鳞茎片,加入质量分数5%的三氯乙酸溶液10 mL,冰浴匀浆。4 ℃、12 000×g离心25 min,收集上清液,低温避光保存备用。取4 mL上清液,分别加入4 mL 0.67%硫代巴比妥酸,混合后于沸水浴中煮沸20 min,取出冷却后再次离心,分别测定上清液在450、532、600 nm波长处的吸光度,以三氯乙酸为空白对照,重复3 次。MDA含量按式(4)计算:
1.3.4.2 REC
按Zhang Zhengke等[24]的方法进行测定。随机取鳞茎片数片,使用打孔器打20 个直径8.8 mm、厚度1 mm的圆片,冲洗干净后加40 mL去离子水。常温静置30 min后用电导率仪测定浸出液的电导率,记为C0,再将鳞茎片及浸出液沸水浸提10 min,冷却后补充去离子水至40 mL,测定此时的电导率,记为C1,按式(5)计算REC:
1.3.5 TP、可溶性糖和可溶性蛋白含量测定
1.3.5.1 TP含量
参考丁胜华等[25]的方法,采用Folin-Ciocalteu比色法测定。
1.3.5.2 可溶性糖含量
采用蒽酮比色法[26]测定。
1.3.5.3 可溶性蛋白含量
采用考马斯亮蓝染色法[26]测定。
1.3.6 褐变相关酶活性测定
取30 g百合鳞茎片置于液氮速冻5 min,转入预冷磨粉机粉碎10 s后制成粉末。准确称取5 g粉碎样品,加入提取缓冲液(含1 mmol聚乙二醇、4%聚乙烯基吡咯烷酮和1% Triton X-100)中,离心(4 ℃、12 000×g、30 min)收集上清液,用于褐变相关酶活性测定。
1.3.6.1 POD活性
POD活性测定参考Wang Mengwei等[27]的方法并稍作修改。取0.5 mL酶提取液加入3 mL 25 mmol/L愈创木酚溶液和200 μL 0.5 mol/L H2O2溶液迅速混合,同时开始计时,在470 nm波长处每1 min记录一次吸光度,POD活性单位为ΔOD470nm/(min·g)。
1.3.6.2 PPO活性
PPO活性测定参考Wang Xinyu等[28]的方法,并稍作修改。将200 μL酶提取液加入混合有4 mL 50 mmol/L、pH 5.5乙酸-乙酸钠缓冲液和1 mL 50 mmol/L邻苯二酚的溶液中,立即开始计时。在420 nm波长处每1 min记录一次吸光度,PPO活性单位为ΔOD420nm/(min·g)。
1.3.6.3 PAL活性
PAL活性测定参考Wang Mengwei等[27]的方法,并略作修改,将混有3 mL 50 mmol/L、pH 8.8硼酸缓冲液和0.5 mL 20 mmol/LL-苯丙氨酸的溶液于37 ℃保温10 min后,加入0.5 mL酶提取液,迅速在290 nm波长处测定吸光度作为初始值,然后将反应管置于37 ℃保温1 h,保温结束再次测定吸光度作为终止值,PAL活性单位为ΔOD290nm/(h·g)。
1.3.7 细胞壁超微结构观察
取百合鳞茎片中部组织(约3 mm2)用体积分数2.5%戊二醛溶液固定,在4 ℃条件下过夜。按照文献[29]方法略作修改进行固定、脱水和包埋。固定时,先用0.1 mol/L磷酸盐缓冲液漂洗,每次10 min,漂洗3 次,再用体积分数1%锇酸溶液固定1 h,漂洗3 次。用梯度丙酮溶液(50%、70%、90%、100%)脱水,每次20 min。包埋时,样品用包埋剂(丙酮-Epon812,体积比1∶1)在37 ℃条件下浸润12 h,然后转移至纯Epon812中过夜。之后,样品在37 ℃条件下加热过夜,然后在60 ℃条件下加热48 h。最后用EM UC6超薄切片机将样品切割成超薄片(厚度6 nm),用质量分数3%醋酸铀溶液和硝酸铅染色,用于透射电镜观察。
1.4 数据统计与分析
以上实验均重复测定3 次,采用Excel 2010软件进行平均值和标准误差计算,采用SPSS Statistics 26软件进行显著性检验(P<0.05)以及指标间的相关性分析,采用Origin 2022软件绘图。
2 结果与分析
2.1 HT对鲜切百合鳞茎片质量损失率、腐烂率和硬度的影响
呼吸作用和蒸腾作用都是果蔬的重要生命活动,并为其提供生理活动所需要的物质和能量,与果蔬的质量损失和组织软化密切相关。图1A中,CK组和HT组质量损失率均呈上升趋势,但HT组的质量损失速度慢于CK组。10 d时,CK组和HT组质量损失很小,分别为0.07%、0.04%。10~30 d,两组的质量损失速度加快,HT组的质量损失显著小于CK组(P<0.05)。贮藏40 d,CK组和HT组的质量损失率分别达到0.85%、0.66%,无显著差异(P>0.05)。总体上,HT组质量损失率低于CK组可归因于百合鳞茎片经HT后,表皮细胞结构和呼吸作用相关酶遭到破坏,减弱了蒸腾作用和呼吸作用[30]。Kantakhoo等[31]也发现HT可延缓红甜椒贮藏期间质量损失变化。

图1 不同处理鲜切百合鳞茎片贮藏过程中质量损失率(A)、腐烂率(B)和硬度(C)的变化Fig.1 Effects of different treatments on mass loss (A),decay rate (B)and firmness (C) of fresh-cut lily bulbs during storage
果蔬贮藏期间由于微生物污染而容易腐烂变质,如图1B所示,百合鳞茎片的腐烂率随贮藏时间延长呈现上升趋势。贮藏10 d时,CK和HT组的腐烂率分别增加到5.44%、2.11%,CK组的腐烂率显著高于HT组(P<0.05),是HT组的2.58 倍。贮藏中后期(10~40 d),CK组的腐烂率显著高于HT组(P<0.05)。贮藏结束时(40 d),HT组的腐烂率为10.56%,CK组增长至23.44%,HT组显著低于CK组(P<0.05)。这说明HT显著抑制了鲜切百合鳞茎片在贮藏过程的腐败。Olesen等[32]也报道了采用52 ℃热水浸泡荔枝1 min后,腐烂速率显著慢于对照组(P<0.05)。在热水处理果蔬过程中,微生物对果蔬的吸附性下降,使其表面微生物数量减少,因此,贮藏过程中由微生物引起的腐败速度减缓[33]。
果蔬硬度随水分流失和组织软化而下降[34]。图1C中,CK组和HT组在贮藏期间的硬度均呈下降趋势。水分含量、膜渗透性和组织结构等变化引起的膨胀效应会使果蔬组织软化。与此同时,促进软化的酶会导致其硬度下降,如聚半乳糖醛酸酶[35]。贮藏0~20 d,两组的硬度无显著差异(P>0.05),而30~40 d,CK组的硬度显著低于HT组(P<0.05)。贮藏结束时(40 d),CK组、HT组硬度分别为1 848.09、1 772.43 g,表明HT减缓了鲜切百合鳞茎片的软化。HT组软化速率减慢,可能是HT钝化了聚半乳糖醛酸酶等细胞壁降解酶,降低了细胞壁的降解速率,从而维持了贮藏期间的细胞结构,保持了鲜切百合鳞茎片的硬度。
2.2 HT对鲜切百合鳞茎片白度和褐变度的影响
果蔬颜色直观地反映了果蔬的新鲜度,因此,果蔬颜色会影响消费者的购买欲望。如图2A所示,鲜切百合鳞茎片在贮藏过程中,HT组白度基本稳定,而CK组总体呈下降趋势。CK组和HT组在0 d时的初始白度分别是79.97、79.71,无显著差异(P>0.05)。贮藏结束时(40 d),CK组和HT组的白度分别为77.15、79.65,差异显著(P<0.05)。HT组的白度在贮藏期间变化非常小,40 d时白度为0 d时的99.92%,而CK组40 d时白度是0 d时的96.47%。这一结果与腐烂情况结果相印证,表明HT抑制了鲜切百合鳞茎片的白度变化,较好地保持鲜切百合鳞茎片的色泽。Djioua等[36]的研究也发现HT能有效维持鲜切芒果的颜色。

图2 不同处理对鲜切百合鳞茎片贮藏过程中白度(A)和褐变度(B)的影响Fig.2 Effects of different treatments on whiteness value (A) and browning degree (B) of fresh-cut lily bulbs during storage
褐变情况会影响鲜切果蔬的适销性和保质期。百合中的内源酶,如PPO、POD和PAL,是催化其发生褐变反应的主要物质[7,37]。图2B中,CK组和HT组褐变度在贮藏期间均呈增长趋势。两组的初始褐变度分别为1.00、1.03,无显著差异(P>0.05)。0~30 d,两组的褐变度均无显著差异(P>0.05),但HT组褐变情况优于CK组。40 d时,两组褐变度分别是2.96、1.55,HT组褐变度显著低于CK组(P<0.05),说明HT组鲜切百合鳞茎片的褐变受到抑制。上述结果与前文腐烂情况和白度分析结果相印证。综上,HT显著延缓了鲜切百合鳞茎片的贮藏品质劣变。Grzegorzewska等[15]的研究表明,大白菜经HT后,在短期贮藏时间内保持最佳的感官品质,适销性有所提高。这与百合鳞茎片经HT后的结果类似。
2.3 HT对鲜切百合鳞茎片MDA含量和REC的影响
MDA是多不饱和脂肪酸氧化的次级最终产物,可反映果蔬细胞的损伤程度,因此细胞膜的脂质过氧化情况可通过MDA含量反映[38]。如图3A所示,CK组和HT组的MDA含量随贮藏时间延长呈上升趋势。贮藏0 d时,HT和CK组的MDA含量无显著差异(P>0.05),分别为0.07 μmol/g和0.06 μmol/g。贮藏10 d时,CK组和HT组MDA含量分别为0.14 μmol/g和0.08 μmol/g,CK组显著高于HT组(P<0.05);10~30 d时,两组的MDA含量持续增加,而HT组的MDA含量始终显著低于CK组(P<0.05)。贮藏40 d时,CK组和HT组MDA含量分别增至0.18、0.13 μmol/g,差异显著(P<0.05)。与初始含量相比,贮藏40 d时CK组和HT组的增长率分别为170.49%、104.49%,表明HT抑制了膜脂过氧化反应。据报道,经HT后,香蕉[39]和西葫芦[34]在贮藏期间的MDA呈现较低的水平,说明HT可减缓果蔬在贮藏过程中细胞膜的损伤,抑制果蔬衰老。
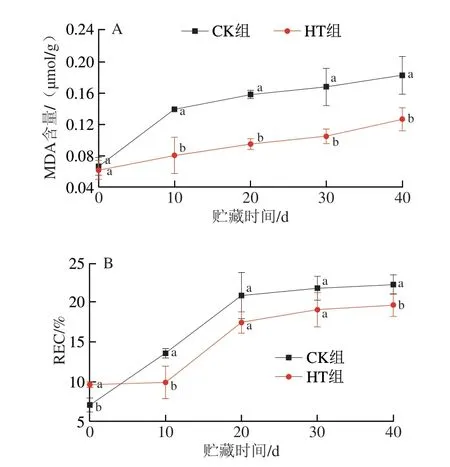
图3 不同处理对鲜切百合鳞茎片贮藏过程中MDA含量(A)和REC(B)的影响Fig.3 Effects of different treatments on MDA content (A) and REC (B) of fresh-cut lily bulbs during storage
果蔬细胞膜遭到破坏时,膜通透性会增大,电解质外泄速度加快,导致电导率增加,因此,通常以REC表示细胞膜渗透率及细胞受到损伤的程度[40]。如图3B所示,REC随贮藏时间延长逐渐增大,说明随时间延长,鲜切百合鳞茎片细胞膜损伤加剧。CK组、HT组的初始REC分别是7.03%、9.62%,两者差异显著(P<0.05),这是由于HT过程会对果蔬组织结构造成一定的损伤。贮藏前10 d,HT组的REC无明显变化,10 d时,HT组REC显著低于CK组(P<0.05)。10~20 d,CK组从13.58%增至20.90%,HT组的REC从9.89%增至17.52%。REC增长速度加快,说明在此贮藏时间内,膜通透性显著增大。20~30 d,CK组与HT组无显著差异(P>0.05)。贮藏结束时(40 d),CK组和HT组的REC分别为22.31%、19.71%,CK组显著高于HT组(P<0.05)。结果表明,在贮藏过程中,HT能保持了鲜切百合鳞茎片细胞膜结构的相对完整性,并抑制了电解质的外泄。Nasef[41]研究了55 ℃热水处理5 min对黄瓜品质的影响,发现热水处理组在贮藏期结束时的电导率显著低于对照组(P<0.05),表明HT保持了细胞膜完整性,减轻了黄瓜的冷害。
2.4 HT对鲜切百合鳞茎片TP、可溶性蛋白、可溶性糖含量的影响
酚类物质在酚酶作用下发生的氧化反应可影响鲜切果蔬的感官品质和褐变情况[42]。如图4A所示,两组的TP含量随贮藏时间延长而增加。贮藏过程,HT组的TP含量均显著低于CK组(P<0.05)。CK组在贮藏开始和结束时的TP含量分别为3.48 mg/g和4.69 mg/g,增长率为34.65%;而HT组的TP含量分别为3.25 mg/g和3.51 mg/g,增长率仅为8.07%。这一结果表明,HT组处理可降低鲜切百合中的TP含量。TP含量与果蔬褐变程度密切相关,通常褐变度越大,消耗的酚类物质越多。然而,研究表明,PAL活性受到抑制后,果蔬TP含量积累速度减慢,间接抑制了褐变反应[43]。因此,HT组TP含量速率减慢可归因于HT有效抑制了PAL活性。

图4 不同处理对鲜切百合鳞茎片贮藏过程中TP含量(A)、可溶性蛋白含量(B)和可溶性糖含量(C)的影响Fig.4 Effects of different treatments on the contents of total phenolics (A),soluble sugar (B) and soluble protein (C) in fresh-cut lily bulbs during storage
果蔬中的蛋白质通过参与果蔬生理活动影响果蔬的品质和营养成分[44]。如图4B所示,贮藏过程中鲜切百合鳞茎片的可溶性蛋白含量呈波动增长趋势。贮藏开始时(0 d),CK组和HT组的可溶性蛋白含量分别为6.42 mg/g和6.90 mg/g,无显著差异(P>0.05),HT组可溶性蛋白含量大于CK组,这可能是HT促进了百合鳞茎片可溶性蛋白含量的产生。在10 d时,两组可溶性蛋白含量分别升至7.44、7.92 mg/g,HT组显著高于CK组(P<0.05)。而20 d时,CK组和HT组分别降至6.89 mg/g和7.17 mg/g。在30 d时,CK组和HT组分别升高到7.45 mg/g和7.88 mg/g,组间无显著差异(P>0.05)。贮藏结束时(40 d),CK组和HT组的可溶性蛋白含量分别为7.21 mg/g和7.62 mg/g,HT组显著高于CK组(P<0.05),相比于贮藏开始(0 d),HT组增加了10.29%。以上结果可能与鲜切百合贮藏过程中的代谢调控有关。
糖类能为果蔬的生理代谢活动提供能量,同时,果蔬中的糖类不仅会影响果蔬的滋味,还能反映果蔬的贮藏特性和成熟度。由图4C可知,贮藏期间百合鳞茎片的可溶性糖含量呈先上升后下降的趋势。CK组、HT组初始可溶性糖质量分数分别为11.64%、12.83%,差异显著(P<0.05)。这可能是HT诱导鲜切百合可溶性糖的产生所致[45]。贮藏10 d时,HT组可溶性糖含量显著大于CK组(P<0.05)。两组的可溶性糖含量都在20 d达到最大值,分别为16.36%、17.15%,无显著差异(P>0.05)。此后,可溶性糖含量降低,贮藏结束时(40 d),CK组和HT组可溶性糖质量分数分别降至14.04%、14.78%,无显著差异(P>0.05),但高于贮藏初期的可溶性糖含量。这些结果可能是鲜切果蔬在不同贮藏时间糖类的产生及消耗速度不同所致[46]。
2.5 HT对鲜切百合鳞茎片细胞壁超微结构的影响
果蔬质地与其细胞壁组成特性有关,细胞壁结构被破坏后,胞内物质流出,造成果蔬表面干瘪及硬度下降,从而破坏其感官品质。同时,果蔬对微生物的抵抗能力也会下降[47]。图5所示为鲜切百合鳞茎片在冷藏期间的细胞壁结构情况。贮藏0 d时,CK组和HT组保持完整的细胞壁结构。随冷藏时间延长,两组百合鳞茎片的细胞壁呈现不同程度的变化。CK组在贮藏10 d时观察到质膜的溶解。贮藏20 d时,CK组发生质壁分离,部分物质随着质膜的轻微溶解流出,可能引起鲜切百合鳞茎片褐变,导致营养成分被降解。而HT组于40 d时发现质膜轻微溶解,比CK组延迟30 d。这可能是百合鳞片经HT后,细胞壁降解酶失活或减少,使得细胞壁降解速度减慢,维持了百合鳞茎片的组织结构。此外,HT过程中,部分黏附于鲜切百合鳞茎片的微生物被除去,减轻了微生物对HT组细胞结构的破坏。以上结果与MDA含量和REC等的变化情况相符,表明HT可有效抑制鲜切百合鳞片细胞壁的降解,避免组织结构的软化,保持鳞茎片的质构特性。相关研究表明,黄瓜[48]和蜜柚[49]在HT后,细胞壁的降解显著减缓。

图5 百合鳞茎片贮藏期间的透射电子显微镜照片(×10 000)Fig.5 Transmission electron micrographs of lily bulbs during storage (× 10 000)
2.6 HT对鲜切百合鳞茎片褐变相关酶活性的影响
POD能将酚类化合物氧化为醌类,产生深色物质使果蔬变黑,影响果蔬的颜色、质地和营养品质等[50]。如图6A所示,CK组和HT组的POD活性均随冷藏时间延长而呈增长趋势。贮藏初期(0~10 d),CK组和HT组的POD活性无显著差异(P>0.05)。CK、HT组在20 d时的POD活性分别为2.45 ΔOD470nm/(min·g)和3.58 ΔOD470nm/(min·g),CK组的POD活性显著大于HT组(P<0.05)。贮藏后期(30~40 d),HT组的活性有所增大,但仍显著低于CK组(P<0.05)。40 d 时,CK 组、HT 组的POD 活性分别上升至7.42 ΔOD470nm/(min·g)和3.90 ΔOD470nm/(min·g),HT组活性下降了95.26%。CK组较高的POD活性反映了冷藏期间组织损伤的加剧,而HT组中POD活性下降有助于保持果实的品质[45]。上述结果与与褐变度分析结果一致,说明HT降低了POD活性并抑制了鲜切百合鳞茎片的褐变。Kahramanoğlu等[18]在柑橘相关研究中也报道了类似结果。

图6 不同处理对贮藏期百合鳞茎片的POD(A)、PPO(B)和PAL(C)活性的影响Fig.6 Effects of different treatments on the activities of POD (A),PPO (B),and PAL (C) in lily bulbs during storage
PPO是导致果蔬酶促褐变的关键酶,其活性部位由两个铜原子组成,具有催化酚类物质发生氧化还原反应的能力[51-52]。图6B显示,两组PPO活性总体先增强后减弱。0 d时,CK组和HT组的PPO活性分别为0.22 ΔOD420nm/(min·g)和0.24 ΔOD420nm/(min·g),HT组的PPO活性显著高于CK组(P<0.05)。这与REC 0 d时的结果相符,鲜切百合受到HT作用,会损伤部分组织结构,这一胁迫诱导PPO活性增大。CK、HT组的PPO活性在10 d达到最大值,分别为0.50 ΔOD420nm/(min·g)和0.37 ΔOD420nm/(min·g),HT组显著低于CK组(P<0.05)。随后在10~40 d,两组的PPO活性总体呈下降趋势,但CK组PPO活性显著高于HT组(P<0.05)。两组的PPO活性出现转折趋势可能与鲜切百合PPO的主要酚类底物有关,PPO活性随相应底物浓度增大而增强,当相应底物浓度减小时,PPO活性减小[53]。40 d时,CK组、HT组PPO活性分别下降到0.28 ΔOD420nm/(min·g)和0.23 ΔOD420nm/(min·g),HT组显著低于CK组(P<0.05),此时,HT组PPO活性比CK组降低了21.74%。虽然HT组PPO的初始活性较大,但HT可能破坏了编码PPO的基因,影响了贮藏后期的基因表达,从而抑制了总PPO活性并减缓了鲜切百合鳞茎片的褐变[52]。Tsouvaltzis等[54]也发现HT可使鲜切土豆的PPO活性显著降低。此外,鲜切石榴假种皮经HT后也观察到类似的现象[55]。
PAL是参与植物苯丙烷途径的限速酶,与多种次生代谢物的生物合成有关,如酚类物质和木质素的合成[56]。鲜切果蔬在切割后,PAL会诱导并导致多酚的积累,间接引发褐变[57]。由图6C可知,CK组和HT组PAL活性呈现先增大后减小的趋势。贮藏初期(0~10 d),CK组的PAL活性显著高于HT组(P<0.05)。贮藏20 d时,CK组和HT组的PAL活性达到峰值,分别为0.46 ΔOD290nm/(h·g)和0.47 ΔOD290nm/(h·g),两者无显著差异(P>0.05)。前20 d,PAL活性的增大可能是乙烯的积累诱导了PAL合成[52]。20~40 d,两组PAL活性逐渐减弱,但HT组活性显著低于CK组(P<0.05)。推测PAL活性的降低与其活性可通过自身产物的反馈抑制调节有关[52]。贮藏结束时(40 d),CK组和HT组的PAL活性分别降至0.34 ΔOD290nm/(h·g)和0.24 ΔOD290nm/(h·g),差异显著(P<0.05),后者与前者相比,PAL活性减少了41.65%。这一结果可能是由于HT影响了PAL相关基因的表达[58],进而抑制了鲜切百合鳞茎片PAL活性和酚类物质积累。
2.7 鲜切百合鳞茎片品质参数的相关性分析
为探明鲜切百合鳞茎片贮藏期各项品质指标间的关系,对鲜切百合鳞茎片的品质指标采用Pearson分析法进行相关性分析。由图7可知,鲜切百合鳞茎片腐烂率与质量损失率、褐变度、MDA含量、REC、TP含量和POD活性均呈显著正相关(P<0.05);硬度与质量损失率、腐烂率、褐变度、MDA含量、REC、TP含量和POD活性呈显著负相关(P<0.05)。以上结果证明,鲜切百合鳞茎片的品质指标之间的相关性强,与前文各指标分析结果相印证。
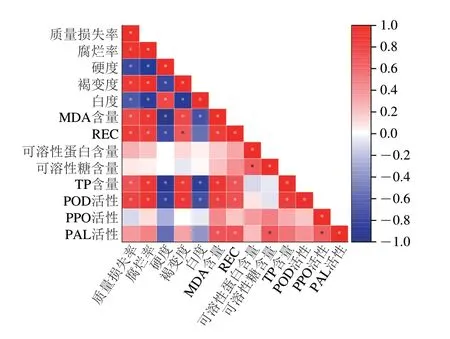
图7 鲜切百合鳞茎片品质参数的相关性分析Fig.7 Correlation analysis among quality parameters of fresh-cut lily bulbs
3 结论
通过研究HT对鲜切百合鳞茎片贮藏期间品质的影响,结果显示,HT能够有效维持鲜切百合鳞茎片贮藏期间的色泽和质构特性,显著抑制其TP、MDA和REC的升高(P<0.05),减缓可溶性糖、可溶性蛋白等胞内物渗出,降低贮藏期间的质量损失率和腐烂率。与此同时,HT通过抑制POD、PPO、PAL等褐变酶的活性,减少了鲜切百合鳞茎片贮藏期间酶促褐变反应发生,显著降低了其褐变度并保持了较高的白度,从而维持了贮藏期间的品质特性。此外,通过透射电镜图像观察到HT组质膜的降解比CK组晚30 d,表明HT可降低与质膜降解相关酶的活性,并有效延长鲜切百合鳞茎片的贮藏货架期。Pearson相关性分析结果进一步证明鲜切百合鳞茎片贮藏品质指标之间的相关性强。本实验仅探究了单一温度、单一时间HT对鲜切百合鳞茎片的影响,最佳HT条件还需进一步优化,同时,HT对褐变相关酶的调控作用机制尚不明确,需进一步研究,以为HT在鲜切百合鳞茎片的应用提供理论依据。

