脯氨酰内肽酶水解不同来源畜禽骨胶原蛋白的特性分析
周娇娇,郭玉杰,齐立伟,张鸿儒,李 娟,张春晖
(中国农业科学院农产品加工研究所,农业农村部农产品加工综合性重点实验室,北京 100193)
我国每年因屠宰加工产生1 700万 t骨副产物,以鸡骨、猪骨、牛骨为主[1]。目前畜禽骨资源整体利用率不足总产量的10%,大部分被废弃,造成了极大的资源浪费和严重的环境污染[2]。畜禽骨中富含胶原蛋白,约占其总蛋白质的90%[3],是制备功能性骨源食品的重要原料,应用潜力巨大。畜禽骨胶原蛋白主要以I型胶原蛋白为主,由两条α1和一条α2链组成右手超螺旋结构,分子质量高达300 kDa[4],无法直接被人体吸收利用。实验室前期研究表明,以骨胶原蛋白为原料制备功能活性肽是实现骨蛋白深加工、资源化、功能化及高效利用的主要方法[1,5]。Ye Mengliang等[6]研究发现,将胶原蛋白水解后获得的牦牛骨胶原蛋白肽具有促进成骨细胞增殖的作用。目前,制备骨胶原蛋白肽的方法主要包括酶解法、发酵法和化学法(酸水解和碱水解)。与化学法相比,酶法制备骨胶原蛋白肽的条件温和、水解过程对氨基酸破坏较小、安全性高。与发酵法相比,酶法不用进行复杂的菌株筛选过程[7]。利用蛋白酶水解胶原蛋白制备生物活性肽,不仅可以保持水解物的营养质量,还能获得确定的肽类特征。
目前用于骨胶原蛋白肽的商品酶有碱性蛋白酶、中性蛋白酶、风味蛋白酶、木瓜蛋白酶和胰蛋白酶等。白恩侠等[8]用2.5%的胰酶酶解高温蒸煮后的牛骨溶液,经分离除杂后制得分子质量小于7 000 Da的骨小肽。刘振锋等[9]使用碱性蛋白酶和木瓜蛋白酶分步水解鱿鱼皮获得分子质量基本小于3 000 Da的胶原蛋白肽。但采用商品酶水解胶原蛋白的效果受底物结构影响较大,蛋白酶水解法只会分解胶原蛋白中特定结构的肽键,导致胶原蛋白水解不彻底[10]。脯氨酰内肽酶(prolyl endopeptidase,PEP)(EC 3.4.21.26)又称脯氨酰寡肽酶,是一种新型丝氨酸肽酶家族水解酶,属于蛋白内切酶,能够特异性识别底物肽链中的脯氨酸残基并进行酶解切割。畜禽骨胶原蛋白氨基酸组成中脯氨酸占比高达15%,仅次于甘氨酸[11]。脯氨酸属于亚氨基酸,常见的蛋白内切酶无法水解脯氨酸形成的肽键,导致骨胶原蛋白底物水解效率较低[12]。PEP能够特异性水解脯氨酸羧基端肽键,从而特异性得到大量小分子肽[13]。目前,有关PEP在食品领域的应用主要集中在奶酪、烘焙和啤酒生产过程。康超[14]研究发现添加PEP可以降低奶酪的苦味;烘焙过程中PEP能够加速面粉中富含脯氨酸的谷蛋白降解,从而降低面包中谷蛋白免疫原性;在啤酒酿造过程中添加PEP能够水解谷蛋白使啤酒澄清[15-16]。基于骨胶原蛋白氨基酸组成中脯氨酸含量高这一特点,PEP非常适合作为酶解骨胶原蛋白的候选用酶,但是目前有关PEP在胶原蛋白酶解方面的研究鲜见报道。
本研究以牛骨胶原蛋白(bovine bone collagen,BBC)、猪骨胶原蛋白(porcine bone collagen,PBC)、鸡骨胶原蛋白(chicken bone collagen,CBC)为原料,解析不同骨胶原蛋白氨基酸序列特点,预测PEP潜在的酶解作用位点,通过PEP对3 种骨胶原蛋白进行酶解,测定3 种骨胶原蛋白水解液的分子质量分布,观察水解前后胶原蛋白结构变化,探究PEP对不同物种来源骨胶原蛋白的水解效应,以期为骨胶原蛋白肽的酶法制备提供参考。
1 材料与方法
1.1 材料与试剂
三氟乙酸 国药集团化学试剂有限公司;乙腈(质谱级)美国Thermo Fisher Scientific公司;乙氨酸-乙氨酸-酪氨酸-精氨酸、杆菌肽 北京索莱宝科技有限公司;抑肽酶、甘氨酰肌氨酸、细胞色素c 上海源叶生物科技有限公司;PEP 西格玛奥德里奇(上海)贸易有限公司。
1.2 仪器与设备
Alpha 2-4 LD plus冷冻干燥器 德国Martin Christ公司;Allegra X-12型台式高速冷冻离心机 美国Beckman Coulter公司;1260-II高效液相色谱系统美国Agilent公司;TSK gel G2000 SWXL色谱柱(7.8 mm×300 mm)日本Tosoh公司;XSR205DU型分析天平 瑞士梅特勒-托利多公司;Merlin Compact场发射扫描电镜 德国蔡司公司。
1.3 方法
1.3.1 不同骨胶原蛋白的氨基酸序列分析
3 种骨胶原蛋白的氨基酸序列信息从UniProt数据库(https://www.uniprot.org/)下载获得。其中,BBC的α1链编号为P02453,BBC的α2链编号为P02465;PBC的α1链编号为A0A287A1S6,PBC的α2链编号为F1SFA7;CBC的α1链编号为P02457,CBC的α2链编号为P02467。
使用蛋白质数据库ExPASy(https://web.expasy.org/protparam/)的ProtParam工具对3 种骨胶原蛋白两条链的理化性质进行预测,包括总平均亲水性、分子质量、不稳定指数和脂肪族氨基酸指数。
通过BIOPEP-UWM数据库(http://www.uwm.edu.pl/biochemia/index.php/pl/biopep)中的“enzyme action”程序对已知氨基酸序列的3 种骨胶原蛋白通过PEP进行虚拟水解。
1.3.2 不同骨胶原蛋白酶解样品制备
实验室前期分别将牛骨、猪骨、鸡骨经碱处理、脱脂脱钙、酶解、透析、冷冻干燥制得不同来源的胶原蛋白,3 种胶原蛋白均具有完整的三螺旋结构,且不溶于水[7]。为增大胶原蛋白与酶的接触面积,将胶原蛋白剪成5 mm×5 mm×5 mm大小后置于pH 8.0的磷酸盐缓冲液中,配制成质量分数为0.5%的溶液,按酶底质量比1∶50分别加入PEP,在55 ℃水浴进行酶解。分别在0、0.5、1、2、3、4、5、6 h取样。水解结束后,将水解液于100 ℃沸水浴加热5 min灭酶,在4 ℃、8 000 r/min条件下离心20 min,上清液经冷冻干燥机冻干后,保存于-20 ℃以备后续分析。
1.3.3 不同骨胶原蛋白水解度测定
参考叶孟亮[7]的方法并稍加改进。分别向0.6 mL 0、0.5、1、2、3、4、5、6 h取样的酶解液加0.4 mL体积分数1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液,调整至适宜的氨基浓度。取混合后酶解液0.25 mL,依次加入2 mL磷酸缓冲盐、2 mL体积分数为0.1%的2,4,6-三硝基苯磺酸振荡混匀,放入50 ℃恒温水浴60 min,再依次向各管加入4 mL 0.1 mol/L HCl溶液终止反应,振荡使之混匀,冷却至室温,于420 nm波长处测定吸光度。以亮氨酸浓度(0~5.0 mmol/L)绘制标准曲线,用所测得水解液游离氨基浓度代替被裂解的肽键数[17]。按下式计算水解度:
式中:c2为水解后水解液中的肽键浓度/(mmol/L);c1为水解前水解液中的肽键浓度/(mmol/L);ρ0为胶原蛋白溶液的质量浓度/(g/L);htot为骨胶原蛋白中总肽键数(8.41 mmol/g)。
1.3.4 不同骨胶原蛋白水解产物的分子质量分布测定
采用高效液相色谱测定3 种骨胶原蛋白分别在0、2、4、6 h水解液的分子质量分布。试样液经0.22 µm微孔滤膜过滤,采用TSK gel G2000 SWXL色谱柱(7.8 mm×300 mm);柱温:40 ℃;流动相为三氟乙酸-乙腈-超纯水(体积比0.1∶45∶54.9)。将样品的进样体积设置为10 μL,恒定梯度洗脱速率为0.5 mL/min。标准品分别为Gly-Sar(146 Da)、Gly-Gly-Tyr-Arg(451 Da)、杆菌肽(1 422 Da)、抑肽酶(6 511 Da)和细胞色素c(12 327 Da)。
1.3.5 不同骨胶原蛋白水解物的浊度测定
参考Gruppi等[18]的方法,先将样品进行涡流处理以防止立即分离,然后使用SynergyTMHT平板阅读器在室温条件下读取313 nm波长处的吸光度,表示溶液的浊度(200 µL样品体积)。
1.3.6 不同骨胶原蛋白水解前后微观结构观察
采用扫描电子显微镜对水解0 h和水解4 h骨胶原蛋白的微观结构进行扫描观察。将水解后的胶原蛋白底物进行冷冻干燥,干燥后将其碾成粉末,粘贴在双面碳胶带上,再进行真空喷金处理,然后对其进行微观结构观察,放大倍数设置为1 000。
1.3.7 不同骨胶原蛋白水解产物的SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDSPAGE)分析
用SDS-PAGE检测水解前后胶原蛋白的蛋白图谱。样品溶解在0.5 mol/L乙酸溶液中,配制成10 mg/mL的溶液,再用高浓度NaOH溶液将样品溶液pH值调至中性,加入等体积的上样缓冲液混匀,100 ℃水浴5 min,冷却至室温,4 ℃、8 000 r/min离心2 min,取上清液即为制备好的样品。准确移取20 µL样品,标准蛋白Marker上样量为5 µL。电泳采用体积分数为4%的浓缩胶和体积分数为7.5%的分离胶,浓缩胶电压为80 V,分离胶电压为120 V。电泳结束后采用考马斯亮蓝快速染色液染色2 h,然后用考马斯亮蓝快速脱色液进行脱色,至背景无色,最终在凝胶成像系统上进行成像拍照。
1.3.8 红外光谱分析
采用红外光谱对水解前后胶原蛋白进行特征官能团分析,分析胶原蛋白二级结构变化。将KBr与干燥样品(质量比100∶1)置于玛瑙研钵中压成1 mm薄片,并在4 000~400 cm-1范围内以4 cm-1的分辨率在传输模式下进行分析[5]。
1.3.9 圆二色光谱分析
将样品溶于0.5 mol/L乙酸溶液中,配制成质量浓度为0.1 mg/mL的溶液,在4 ℃平衡48 h,以0.1 mol/L乙酸溶液作空白对照,分别在190~260 nm范围内进行扫描,在25 ℃使用光程1 mm的石英池记录圆二色光谱[19]。
1.3.10 X射线衍射(X-ray diffraction,XRD)分析
XRD具体参数:在Cukα射线下,X光管电压40 kV,管电流40 mA,5°~60°范围内,扫描频率为2°/min,扫描步宽为0.02°,叠扫3 次,测定XRD图谱[20]。
1.4 数据处理与分析
采用Origin 2022b软件制图。数据均采用SPSS 20.0软件进行单因素方差分析,采用LSD检验对数据进行差异显著性分析,在95%置信区间被认为具有统计学意义(P<0.05)。
2 结果与分析
2.1 3 种不同来源畜禽骨胶原蛋白序列分析
畜禽骨胶原蛋白以I型胶原蛋白为主,氨基酸序列具有典型的(Gly-X-Y)n结构,其中X通常为脯氨酸[21]。3 种骨胶原蛋白中脯氨酸氨基酸含量均相对较高,其中,BBC脯氨酸占比18.5%,PBC脯氨酸占比18.7%,CBC脯氨酸占比18.5%[21]。从表1可以看出,3 种骨胶原蛋白均由两条链构成(α1链和α2链)。BBC的α1链由1 463 个氨基酸组成,分子质量为138.94 kDa,α2链由1 364 个氨基酸组成,分子质量为129.06 kDa;PBC的α1链由1 466 个氨基酸组成,分子质量为139.30 kDa,α2链由1 356 个氨基酸组成,分子质量为129.09 kDa;CBC的α1链由1 452 个氨基酸组成,分子质量为137.57 kDa,α2链由1 363 个氨基酸组成,分子质量为128.99 kDa。3 种骨胶原蛋白的不稳定指数均小于40。脂肪族氨基酸指数是蛋白质脂肪侧链氨基酸占蛋白质总氨基酸的百分比,由丙氨酸、缬氨酸、异亮氨酸、亮氨酸的含量所决定,在一定程度上反映蛋白质的稳定性,脂肪族氨基酸指数越高,蛋白质稳定性越好[22]。由表1可知,3 种骨胶原蛋白的α2链稳定性均高于α1链。
表1 3 种骨胶原蛋白的理化特性Table 1 Physicochemical properties of three bone collagen proteins
运用ProtScale工具(https://web.expasy.org/protscale)分别对骨胶原蛋白两条链的亲疏水状况进行预测分析,如图1所示,BBC的α1链氨基酸最大和最小预测值分别为2.633和-3.200,α2链氨基酸最大和最小预测值分别为2.467和-2.733;PBC的α1链氨基酸最大和最小预测值分别为2.633和-3.200,α2链氨基酸最大和最小预测值分别为2.467和-2.844;CBC的α1链氨基酸最大和最小预测值分别为2.978和-3.133,α2链氨基酸最大和最小预测值分别为2.689和-3.133。正值越大代表疏水性越强,负值绝对值越大代表亲水性越强。该结果表明胶原蛋白的3 条单链均能溶于水中,这为后面3 种骨胶原蛋白的酶解实验提供了依据。
图1 牛骨I型胶原蛋白α1链(A)和α2链(B)、猪骨α1链(C)和α2链(D)、鸡骨α1链(E)和α2链(F)疏水性测定结果Fig.1 Hydrophobicity determination of α1 chain (A) and α2 chain (B) in type I BBC,α1 chain (C) and α2 chain (D) in PBC,and α1 chain (E) and α2 chain (F) in CBC
2.2 PEP对3 种骨胶原蛋白的潜在酶切位点预测分析
通过BIOPEP-UWM数据库对3 种骨胶原蛋白的α1链和α2链分别进行PEP酶切位点预测分析,得到理论水解度、酶切位点数和肽段总数[21]。由表2可知,3 种骨胶原蛋白的理论水解度无明显差异,均在18%左右。BBC、PBC、CBC产生的肽段总数分别为517、524和521,表明PEP有潜力作为酶解骨胶原蛋白制备小分子活性肽的候选用酶。
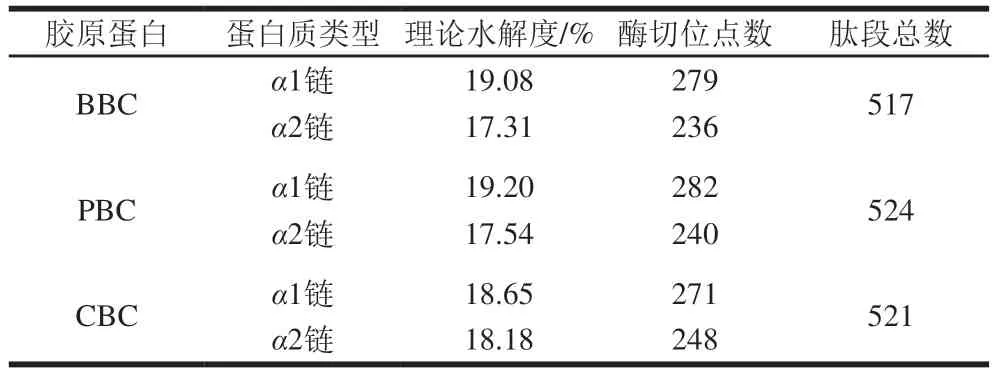
表2 3 种骨胶原蛋白的理论水解度和酶切位点数Table 2 Theoretical hydrolysis degree and number of enzymatic cleavage sites of three collagens
2.3 PEP对不同骨胶原蛋白水解度的影响
蛋白水解度的增加意味着肽链长度不断减小[23]。3 种骨胶原蛋白水解度随时间变化关系如图2所示。加入PEP后3 种骨胶原蛋白水解度在0~2 h显著增加(P<0.05),在3~6 h,CBC和BBC增加趋于平缓,PBC水解度在3~4 h仍显著增加,4 h后也趋于平缓,直至6 h。这可能由于PEP可切割脯氨酸残基的N-末端肽段数目不断减少,酶在反应体系中的活性逐渐降低以及底物和水解产物之间的竞争性抑制作用[24]。最终BBC、PBC和CBC在PEP水解4 h后水解度分别达到22.81%、51.35%和29.81%。相较于其他酶对胶原蛋白的水解,PEP在胶原蛋白降解方面更具优势,如吴敏等[25]使用中性蛋白酶和胰蛋白酶分步水解BBC,其水解度为18.34%;Wu Wenmin等[26]用碱性蛋白酶与中性蛋白酶同时水解PBC,其水解度为13.97%;周婷等[27]在超声辅助碱性蛋酶水解鸡爪胶原蛋白的优化条件下,鸡爪胶原蛋白的水解度达28.65%;符群[28]分别通过碱性蛋白酶单酶水解和碱性蛋白酶、风味蛋白酶复合酶解水解CBC,水解度分别为12.96%和19.68%。PEP对胶原蛋白进行水解得到的实际水解度比理论水解度高,可能是因为理论水解度是根据底物胶原蛋白的氨基酸序列结合PEP的底物特异性预测可能的酶解位点,推测出可能产生的肽段并计算其理论水解度,但是在对不同胶原蛋白实际酶解实验中,除了要考虑底物的氨基酸序列外,还需考虑胶原蛋白的氨基酸修饰、酶解位点在二级结构和三级结构中的位置等影响因素,这些都将会对其水解度产生影响。3 种骨胶原蛋白的水解度进一步证实了PEP酶解骨胶原蛋白的应用潜力。
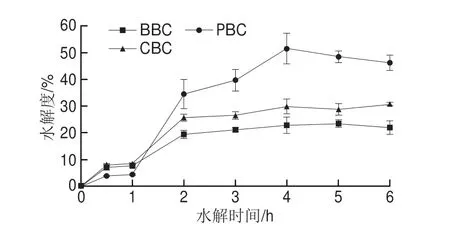
图2 不同来源骨胶原蛋白水解度Fig.2 Hydrolysis degrees of bone collagens from different sources
2.4 不同骨胶原蛋白酶解产物的分子质量分布分析
蛋白肽的分子质量与其功能活性密切相关,因此骨胶原蛋白酶解产物的分子质量分布是评价其品质的重要指标[29]。胶原蛋白肽分子质量与生物利用度直接相关[30]。由3~9 个氨基酸残基组成的短链肽被称为低聚肽(分子质量范围为180~1 000 Da),人体消化吸收率高[31]。从图3可以看出,3 种不同来源骨胶原蛋白的分子质量差异较小,分子质量分布呈先集中后分散的趋势。其中,BBC水解前分子质量主要集中在10 000 Da以上,比例为56.77%,其次为500 Da以下,比例为19.71%;水解后胶原蛋白的分子质量多集中于500 Da以下,水解2 h的比例为84.52%,水解4 h为88.77%,水解6 h为90.13%。PBC水解前分子质量也主要集中在10 000 Da以上,比例为50.37%,其次为5 000~10 000 Da,比例为19.03%;水解后胶原蛋白的分子质量同样多集中于500 Da以下,水解2 h的比例为81.53%,水解4 h为86.09%,水解6 h为87.76%。CBC水解前分子质量多集中于10 000 Da以上,比例为51.51%,其次为500 Da以下,比例为20.33%,水解后胶原蛋白的分子质量多集中于500 Da以下,水解2 h的比例为81.05%,水解4 h为85.67%,水解6 h为87.42%。水解0 h与水解2、4、6 h的谱图差异明显,水解0 h的样品分子质量多集中在5 000 Da以上,水解后样品分子质量多集中在500 Da以下,说明通过PEP可以有效获得低分子质量的胶原蛋白肽。胡颀[32]通过对牛骨进行高温高压处理后再用胰酶酶解得到样品分子质量小于1 500 Da的部分占68.76%。叶孟亮[7]采用不同酶对BBC进行酶解,结果表明木瓜蛋白酶酶解液低分子质量(<3 kDa)肽组分所占比例最大,为84.6%,其次为复合蛋白酶(81.8%)、中性蛋白酶(80.5%)、碱性蛋白酶(77.3%)和风味蛋白酶(77.1%)。与胶原蛋白肽的传统酶法制备相比[6,20],PEP在获得低分子质量胶原蛋白肽上更有优势。而低分子质量肽在吸收性和消化稳定性上更有优势,低分子质量肽特别是二/三肽进入人体后,可以不被肠道消化降解直接被人体吸收。此外,三肽的吸收效率可能是五肽的1 000 倍以上[33]。

图3 3 种骨胶原蛋白肽分子质量分布Fig.3 Molecular mass distribution of peptides from three bone collagens
2.5 PEP酶解作用对不同骨胶原蛋白表观浊度的影响
溶液的浊度取决于蛋白质浓度、未溶解颗粒的存在情况、颗粒大小和单位体积的颗粒数[17]。如图4所示,与水解0 h相比,3 种骨胶原蛋白溶液的浊度基本都显著增加;当水解时间达到2 h后,浊度增长随时间变化不显著,但BBC在水解4 h和PBC在水解5 h时浊度下降,可能是实验过程中测量误差所致。3 种骨胶原蛋白中,BBC的浊度整体偏高,CBC次之,PBC最低。胶原蛋白溶液浊度增加可能与PEP作用下蛋白疏水域的暴露有关。水解胶原蛋白使其分散在溶液中导致浊度增加[34]。浊度的大小与蛋白颗粒的大小有关,蛋白颗粒越大,溶液的浊度越大,因此BBC溶液中的蛋白颗粒最大,CBC次之,PBC最小,进一步说明PEP更容易将PBC降解。


图4 不同来源骨胶原蛋白水解前后表观浊度变化Fig.4 Changes in apparent turbidity before and after hydrolysis of bone collagen peptides from different sources
2.6 PEP酶解作用对不同骨胶原蛋白微观结构的影响
如图5所示,3 种骨胶原蛋白在水解前片段均较大,且在形状上存在一定差异。其中,BBC表面光滑,存在许多尖锐的尖端;PBC、CBC表面相对粗糙,且与PBC相比,CBC呈更大的块状,表面分散着一些较小的片段。经PEP消化后,BBC尖端消失,产生大量小片段和颗粒;PBC产生大量的圆球状颗粒堆叠在一起,CBC呈小片段均匀分布。研究结果表明,水解后3 种骨胶原蛋白的片段均明显减小,相较于水解前分布更加均匀。说明PEP能够对3 种骨胶原蛋白进行有效的降解。水解后3 种骨胶原蛋白片段大小与浊度结果一致(水解后胶原蛋白的片段越大,浊度越大)。以上结果表明,PEP对PBC水解效果最好,CBC次之,BBC最差。造成这种差异的原因可能是在相同酶解条件下,不同种源畜禽骨蛋白一级结构末端肽的长度和序列不同,从而形成多肽片段的大小和数量不同。

图5 不同来源骨胶原蛋白水解前后的微观结构Fig.5 Microstructure of bone collagens from different sources before and after hydrolysis
2.7 不同骨胶原蛋白酶解前后SDS-PAGE对比分析
如图6所示,3 种骨胶原蛋白均具有典型的I型胶原蛋白特征:能够观察到α1链、α2链,在CBC的条带中还可以观察到β带[35]。水解后3 种骨胶原蛋白的条带均消失,表明大分子质量的胶原蛋白在PEP作用下发生降解。胶原蛋白降解为多肽后,因其酶解产物分子质量较小,导致蛋白条带完全消失[36]。
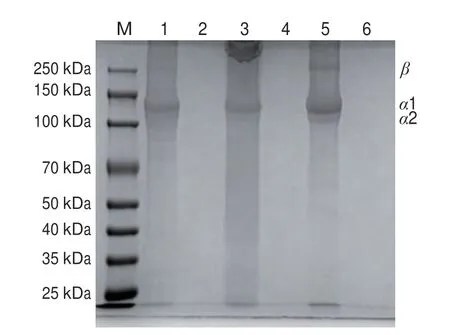
图6 不同来源骨胶原蛋白水解前后SDS-PAGEFig.6 SDS-PAGE patterns of bone collagen proteins from different sources before and after hydrolysis
2.8 不同骨胶原蛋白酶解前后红外光谱分析
红外光谱中酰胺带特征吸收峰可以反映胶原蛋白的三股螺旋构象[37],BBC、PBC和CBC水解前后的红外光谱如图7所示。3 种骨胶原蛋白均含有酰胺A、B、I、II、III带的特征波段[35]。酰胺A带的特征红外吸收与N—H拉伸振动有关,通常在3 400~3 440 cm-1之间观测到。当肽键上的N—H基团与羰基形成氢键时,位置转移到较低的波数,通常在3 300 cm-1左右[38]。3 种骨胶原蛋白水解后均向较低波数轻微移动,其中BBC的酰胺A带由3 485 cm-1移到3 435 cm-1,PBC由3 425 cm-1移到3 417 cm-1,CBC由3 485 cm-1移到3 425 cm-1,表明胶原蛋白在水解过程中N—H基团参与了氢键的形成。酰胺B带与CH2基团的不对称拉伸有关,通常在2 920 cm-1附近[38]。3 种骨胶原蛋白水解前后的酰胺B带均在2 920 cm-1附近。1 640~1 660 cm-1范围内酰胺I带的吸收峰是由C=O基团沿多肽主链的拉伸振动引起,酰胺I带决定着胶原蛋白中的分子有序程度[38],是多肽二级结构的标志[39]。酰胺I带向较低波数方向移动,这与分子序降低有关[40]。酰胺II带是由N—H的弯曲振动、C—N的拉伸振动、β-折叠和无规卷曲的叠加产生[41]。酰胺III带的吸收峰(1 235~1 240 cm-1)涉及胶原分子间相互作用和三螺旋结构,这也是由甘氨酸和脯氨酸的CH2基团摇摆振动引起[35]。在1 240 cm-1附近的酰胺III带表明存在三螺旋结构。酰胺III带与1 450 cm-1附近的峰强度比越接近于1,所提取的胶原蛋白的三螺旋结构越完整[35]。而在水解后的3 种骨胶原蛋白均未在1 240 cm-1附近位置出现吸收峰,说明胶原蛋白降解后三螺旋结构已经被破坏[38]。此外,水解后的胶原蛋白在877 cm-1附近出现了新峰,可能是芳香族氨基酸引起[42]。水解后的胶原蛋白均在较低波数(800~1 200 cm-1)处出现中等强度的峰,可能为酶解时加入的PEP所产生。

图7 不同来源骨胶原蛋白水解前后傅里叶变换红外光谱Fig.7 Fourier transform infrared spectra of bone collagen proteins from different sources before and after hydrolysis
2.9 不同骨胶原蛋白酶解前后圆二色光谱分析
圆二色光谱可以反映蛋白质的立体结构信息,其圆二色性表现为生色基团和折叠结构的总和[43],正吸收峰的强度可以反映胶原蛋白三螺旋结构的完整性。如果完全破坏三螺旋结构,则正吸收峰可能消失,负吸收峰可能红移[41]。由图8可以看出,水解前的3 种骨胶原蛋白均在221 nm波长处出现正峰,此处出现的正吸收峰是左旋聚脯氨酸构型的典型特征。正峰强度绝对值与负峰强度的比值(RPN)用于判断三螺旋构象是否存在,若RPN<1,则可以判断提取的胶原蛋白具有三螺旋结构[35]。RPN与胶原蛋白的螺旋程度呈正相关,反映了胶原蛋白肽分子中的螺旋区域与非螺旋区域的相对含量[44]。如图8所示,3 种骨胶原蛋白均在221.2 nm波长处有正峰,分别在197.6、197.3 nm和197.8 nm波长处有负峰,它们的RPN分别为0.893、0.892和0.894,均小于1,说明3 种骨胶原蛋白均具有天然的三螺旋结构。水解后的PBC、CBC在220 nm波长处的正峰完全消失,BBC在220 nm波长处的椭圆度降低,圆二色光谱变得平滑,这均说明3 种骨胶原蛋白水解后发生了变性,三螺旋结构减少。
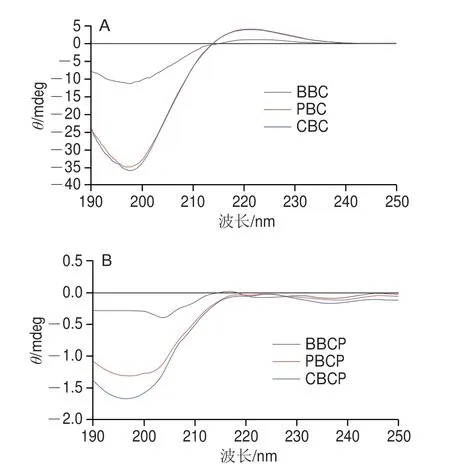
图8 不同来源骨胶原蛋白水解前后的圆二色光谱Fig.8 Circular dichroism spectra of bone collagen proteins from different sources before and after hydrolysis
2.10 不同骨胶原蛋白酶解前后XRD分析
如图9所示,未水解的胶原蛋白有3 个主要峰,第1个峰在2θ为10°附近出现,这是由胶原蛋白分子内部晶体结构引起。第2个宽峰出现在2θ为20°附近,这是由于胶原蛋白内部无定形区域的弥散散射引起。利用布拉格方程计算重复间距的最小值(d)[45]。水解前BBC、PBC和CBC的第1个相对尖峰的d值分别为3.76、3.82 Å和3.80 Å,显示了分子链之间的距离。第1个尖峰与胶原蛋白的三重螺旋结构有关[46]。水解后3 种骨胶原蛋白在第1个峰的位置没有出现峰,可能是水解后三螺旋结构被破坏,导致峰消失。水解后3 种骨胶原蛋白的衍射峰强度较高,可能是酶解过程中添加的PEP对信号产生了干扰[20]。

图9 不同来源骨胶原蛋白水解前后的XRDFig.9 XRD patterns of bone collagen proteins from different sources before and after hydrolysis
3 结论
以牛骨、猪骨、鸡骨的胶原蛋白为原料,首先对3 种骨胶原蛋白序列进行分析,预测虚拟酶解位点,发现3 种骨胶原蛋白均可以被PEP降解。通过PEP对3 种骨胶原蛋白进行降解,探究PEP酶解骨胶原蛋白制备胶原蛋白肽的效果。通过扫描电镜以及SDS-PAGE分析表明大分子胶原蛋白被降解成小片段分散在溶液中,水解度测定结果表明PEP对3 种不同来源骨胶原蛋白均有显著水解效应,且对PBC的水解效果最好,水解度高达51.35%。3 种骨胶原蛋白水解液分子质量多分布在500 Da以下,且同一水解时间的分子质量分布情况差异不显著。通过二、三级结构分析可知,PEP在对胶原蛋白进行降解时胶原蛋白的三螺旋结构被破坏,三螺旋结构解开后更多的酶切位点暴露,从而更易获得低分子质量的胶原蛋白肽。本研究可为PEP酶解胶原蛋白获得生物活性肽提供依据。

