阿托伐他汀联合依洛尤单抗治疗极高风险动脉粥样硬化心血管疾病患者效果的研究
郝敬严 刘菁晶 杨瑞飞 卢宇杰 王雅洁 王群 张健 刘霖泽 林文华


【摘要】 目的:评估阿托伐他汀联合依洛尤单抗治疗极高风险动脉粥样硬化心血管疾病(ASCVD)患者的效果,应用光学相干断层扫描(OCT)测量粥样斑块变化,探讨依洛尤单抗对血管炎症因子的影响。方法:将泰达国际心血管病医院2021年1月—2023年1月冠脉造影检查(CAG)结果为冠状动脉中度狭窄(50%~70%)和低密度脂蛋白胆固醇(LDL-C)升高符合条件的极高风险ASCVD患者60例,按1∶1随机分配到依洛尤单抗组(依洛尤单抗+阿托伐他汀)或标准治疗组(阿托伐他汀),在基线和36周随访时,采用OCT评估靶血管斑块稳定性。结果:治疗36周后,依洛尤单抗组和标准治疗组LDL-C水平均显著降低,依洛尤单抗组低于标准治疗组(P<0.000 1)。与标准治疗组相比,依洛尤单抗组最小纤维帽厚度(FCT)差值[(9.41±2.23)μm vs. (21.66±4.46)μm,P<0.001]、靶血管病变最小腔内面积差值[0.13(0.09, 0.19) mm2 vs. 0.23(0.16, 0.27) mm2,P<0.001]均显著更大,最大脂质弧度差值显著更小[(-8.12±2.40)° vs. (-18.13±3.60)°,P<0.001]。依洛尤单抗组脂蛋白磷脂酶A2(LpA2)更低(P=0.001),而两组C反应蛋白水平(CRP)差异无统计学意义(P=0.574)。此外,标准治疗组中有4例患者发生靶血管血运重建,而依洛尤单抗组发生1例非致死性急性心肌梗死(P=0.098)。未发现药物不良反应事件。结论:阿托伐他汀联用依洛尤单抗可大幅降低血脂LDL-C水平,并明显改善粥样斑块的特征和表型。依洛尤单抗可显著降低血管特异性炎症标志物LpA2水平,或可为ASCVD二级预防及治疗提供新方向。
【关键词】 动脉粥样硬化性心血管疾病 低密度脂蛋白胆固醇 依洛尤单抗 阿托伐他汀 光学相干成像 C反应蛋白 脂蛋白磷脂酶A2
动脉粥样硬化性心血管疾病(ASCVD)为主的心血管疾病(CVD)是我国城乡居民第1位死亡原因,占死因构成的40%以上[1]。低密度脂蛋白胆固醇(LDL-C)已被临床研究充分证实是ASCVD的致病性危险因素[2]。他汀类药物能有效降低LDL-C,是治疗冠状动脉疾病的基石,然而有报道认为,单用他汀类药物调脂效果有限,仍存在LDL-C不达标的问题[3-4]。前蛋白转化酶枯草杆菌蛋白酶9抑制剂(PCSK9i),如依洛尤单抗可减少肝内低密度脂蛋白受体(LDLR)降解,促进LDL-C清除[5],使LDL-C水平降低50%~70%,在联用他汀类药物治疗基礎上进一步减少主要不良心血管事件(MACE)发生,从而改善ASCVD患者临床预后[6-7]。因此,目前指南建议对他汀类药物治疗后LDL-C仍未达标的高危ASCVD患者使用PCSK9抑制剂[8-9]。虽然有研究通过血管内超声(IVUS)检查结果表明PCSK9抑制剂联合他汀类药物可明显减小动脉粥样硬化斑块体积[10],由于IVUS无法测量纤维帽厚度(FCT)等反映斑块特征的指标[11],因此尚不清楚他汀联合PCSK9抑制剂是否能进一步改善FCT。光学相干断层扫描(OCT)是评估FCT微小变化的金标准[12],且目前尚未有研究通过OCT来证实依洛尤单抗对极高风险ASCVD患者斑块易损性的影响。因此,本研究旨在通过OCT成像评估PCSK9抑制剂对冠状动脉狭窄50%~70%的极高风险ASCVD患者斑块稳定性的影响。
1 资料与方法
1.1 一般资料
连续选取泰达国际心血管病医院2021年1月—2023年1月收治的行冠脉造影检查和OCT检查的患者为研究对象,共收集60例患者。纳入标准:(1)冠脉造影时年龄20~80岁;(2)入院诊断为极高风险ASCVD,即2018年美国血脂指南提出的2次以上严重事件或1次严重事件+多个高风险因素[13];(3)冠状动脉造影检查提示存在冠脉狭窄50%~70%,无介入治疗;(4)已接受阿托伐他汀钙20 mg/d治疗(4周内)LDL-C仍≥1.8 mmol/L。排除标准:(1)已知对依洛尤单抗过敏,或不能耐受;(2)不受控的高血压(SBP≥180 mmHg;DBP≥110 mmHg)及不受控制糖尿病;(3)严重肝肾功能、凝血功能障碍;(4)严重认知障碍或合并精神类疾病;(5)肿瘤患者或预期寿命≤1年。在36周开放标签治疗期间,采用1︰1随机化方法将患者分配到依洛尤单抗组(依洛尤单抗+阿托伐他汀钙)或标准治疗组(单药阿托伐他汀钙)。本研究通过泰达国际心血管病医院临床研究伦理委员会审批同意(临研审[2020]-0528-5),患者或者患者家属知情同意本研究,患者同意参加试验并签署知情同意书。
1.2 方法
1.2.1 治疗方法 依洛尤单抗组采用依洛尤单抗+阿托伐他汀钙,标准治疗组单用阿托伐他汀钙。具体药物用法如下:阿托伐他汀钙片(生产厂家:北京嘉林药业股份有限公司,批准文号:国药准字H20093819,规格:20 mg)口服,20 mg/d,1次/d,依洛尤单抗(生产厂家:Amgen Manufacturing Limited,注册证号:国药准字SJ20180021,规格:1 mL∶140 mg)每2周140 mg皮下注射一次。主管医生可根据患者LDL-C水平考虑增加他汀类药物的剂量或添加其他非他汀类药物降脂治疗。抗血栓治疗和其他相关用药完全由主管医生决定。随访结束时对同一血管进行冠状动脉造影和OCT成像分析。
1.2.2 病历资料收集 (1)一般资料:年龄、性别、身高、体重等。(2)临床病史:PCI病史、陈旧性心肌梗死病史、糖尿病、高血压病、吸烟史等。(3)血清样本指标:血清总胆固醇(TC)、LDL-C、高密度脂蛋白胆固醇(HDL-C)、甘油三酯(TG)、C反应蛋白(CRP)、脂蛋白磷脂酶A2(LpA2)等化验指标在基线和第36周采集。(4)所有入组患者将在研究期间监测和评估MACE发生情况。
1.2.3 OCT操作 在两组中,病变靶血管在治疗期结束时[即(36±2)周]进行OCT成像检查。OCT图像采集和分析将由光学相干断层成像术(OCT-C7XR系统)完成。OCT图像使用专用图像后处理系统进行离线分析,所有影像学分析均由对研究方案不知情的研究者进行。基线和治疗36周后的系列OCT图像将被在屏幕上并排显示,基于与标志物(例如主干、分叉、钙化、支架)的距离匹配靶病变。在OCT图像分析之前将应用校准。使用国际血管内光学相干断层成像标准和验证工作组制定的共识标准进行斑块组织特征分析,以测量最小腔内面积、最小FCT和最大脂质弧度值。
1.3 观察指标及评价标准
(1)观察血清TC、LDL-C、HDL-C、TG、CRP、LpA2等化验指标36周治疗后数值变化。(2)记录基线和36周随访期间斑块最小FCT、最小腔内面积、最大脂质弧度的变化值。最小纤维帽厚度选取在连续图像中的3个候选帧中纤维帽厚度最小值。最大脂质弧度定义为在目标斑块的横断面OCT图像上信号差、边界扩散区域内最大的弧。对于每个靶病变,使用自动测量算法和额外的手动校正来确定最小腔内面积。(3)记录主要不良心脏事件(定义为死亡、心肌梗死、卒中和缺血驱动的靶病变血运重建的复合结果),以及随访期间的药物不良反应。
1.4 统计学处理
使用SPSS 22.0统计软件进行数据处理,呈正态分布的计量资料采用(x±s)表示,组间比较采用独立样本t检验;非正态分布的计量资料采用M(P25,P75)表示,组间比较采用秩和检验;计数资料采用率(%)表示,组间比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 基线资料
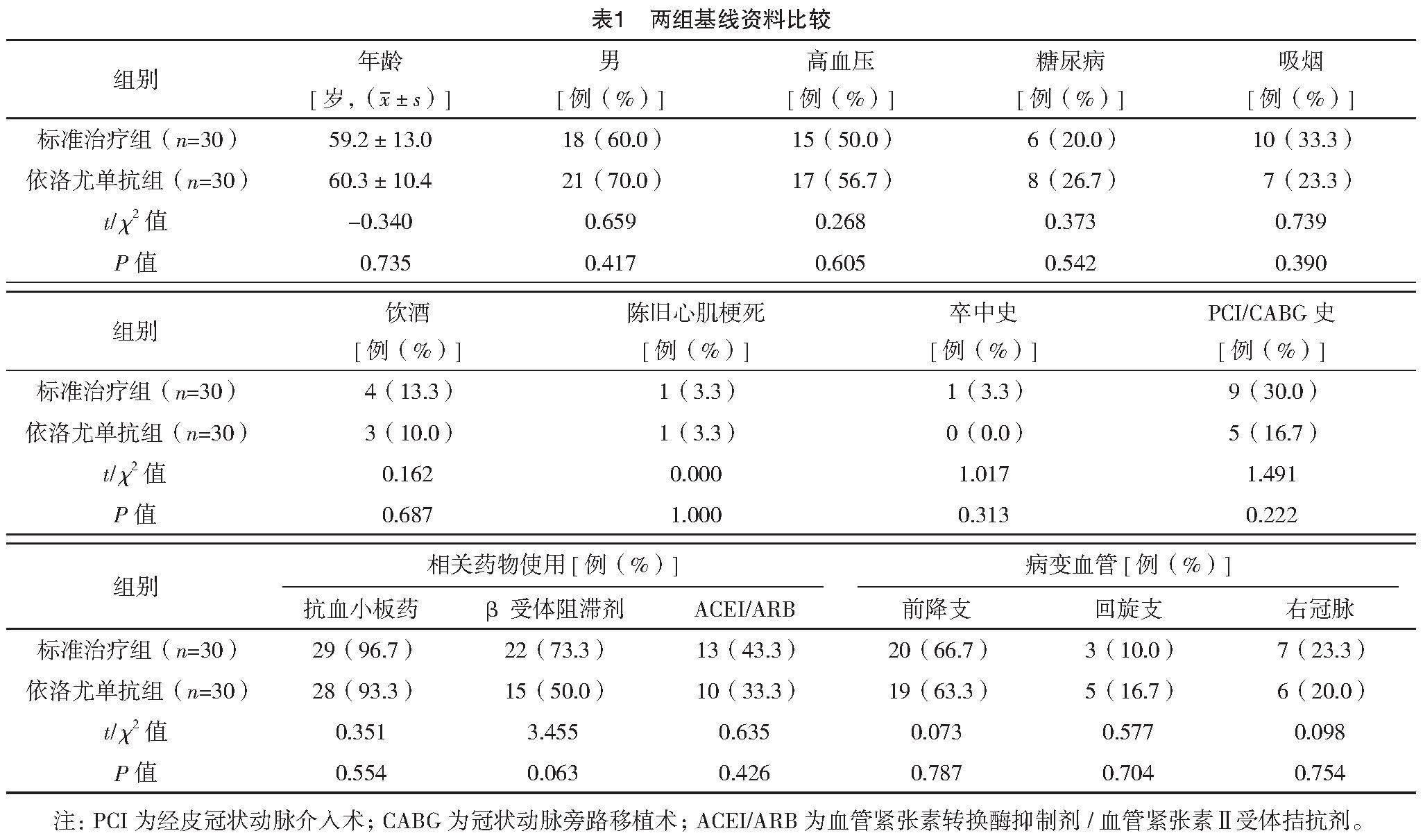
研究纳入60例患者主要为合并高血压(53.3%,32/60)的男性受试者。几乎所有受试者服用抗血小板药物(95%,57/60),且靶血管病变主要位于前降支(65%,39/60)。两组基线资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。
2.2 血脂及炎症指标
基线时两组TC、TG、LDL-C、HDL-C血脂指标,以及CRP、LpA2炎症因子差异均无统计学意义(P>0.05)。经治疗36周后,两组LDL-C、TC水平均降低,与标准治疗组相比,依洛尤单抗组均更低(P<0.000 1),而HDL-C、TG等血脂指标较治疗前差异均无统计学意义(P>0.05)。此外,与标准治疗组相比,依洛尤单抗组LpA2水平更低,差异有统计学意义(P=0.001),而兩组CRP水平都有所下降,但两组差异无统计学意义(P=0.574)。见表2。
2.3 斑块稳定性
基线时最小FCT、靶血管病变最小腔内面积、最大脂质弧度差异均无统计学意义(P>0.05);两组36周后,与标准治疗组相比,依洛尤单抗组最小FCT、靶血管病变最小腔内面积均显著更大,而最大脂质弧度显著更小,此外,依洛尤单抗组治疗前后最小FCT差值、最小腔内面积差值及最大脂质弧度差值均优于标准治疗组,差异均有统计学意义(P<0.05)。见表3。
2.4 两组治疗不良事件发生情况
依洛尤单抗或标准治疗组均未记录到心源性死亡事件。而在标准治疗组中随访时有4例患者发生靶血管血运重建,而依洛尤单抗组发生1例非致死性急性心肌梗死,差异无统计学意义(P=0.098),见表4。未监测到患者出现药物不良反应及脑卒中等事件。
3 讨论
本研究结果表明,他汀类药物联合依洛尤单抗可进一步降低血LDL-C水平。相关研究指出,LDL-C每降低1 mmol/L可使心血管事件风险降低23%,且与LDL-C初始水平无关[14]。然而,流行病学研究表明,尽管使用他汀类药物治疗,大量患者LDL-C未能降低到目标值[15]。目前,抑制前蛋白转化酶枯草杆菌蛋白酶9型(PCSK9)的单克隆抗体已成为有效降低LDL-C水平约60%的新型治疗选择[16-17]。FOURIER研究、ODSSEY研究、GLAGOV研究等随机多中心试验清楚地证明,使用PCSK9抑制剂(PCSK9i)可显著降低高风险稳定型冠心病(SCAD)或急性冠状动脉综合征(ACS)患者的不良事件发生率[5,16-18]。值得注意的是,在他汀基础上应用PCSK9i降低心血管事件可能是由于降脂改变罪犯血管斑块易损性从而导致事件降低。
然而,关于PCSK9抑制剂对动脉粥样硬化斑块稳定性影响的证据是有限的。GLOGAV研究应用IVUS初步探索了依洛尤单抗对动脉粥样硬化的影响,研究对全球197个中心968例冠脉造影确诊的CAD患者在他汀治疗基础上随机接受依洛尤单抗420 mg每月1次或安慰剂皮下注射76周,观察到依洛尤单抗诱发斑块消退,动脉粥样硬化体积(PAV)和总动脉粥样硬化体积(TAV)在依洛尤单抗组明显减少,显著优于单药他汀治疗组[18]。而ODYSSEY J-IVUS试验表明,对日本206例ACS患者应用IVUS检查,比较阿利西尤单抗抑制PCSK9对冠状动脉粥样硬化进展的影响,随访36周并未观察到斑块显著性消退[10]。尽管在这两项研究中,他汀联合PCSK9抑制剂被证明可以减少PAV,尚缺乏PCSK9抑制剂对斑块稳定性如纤维帽厚度影响的相关研究。ALTAIR研究对日本经皮冠状动脉介入治疗(PCI)的患者通过OCT观察发现阿利西尤单抗治疗相较于他汀类药物(瑞舒伐他汀10 mg/d)治疗的患者纤维帽厚度明显增加[19]。本研究首次以极高风险ASCVD患者为研究对象,研究结果与之前研究结果相似,并通过OCT成像证明依洛尤单抗组的FCT显著增加。此外,与标准治疗组相比,依洛尤单抗联合阿托伐他汀治疗与最小管腔面积显著增加和最大脂质弧度显著减少有关,提示依洛尤单抗联合他汀类药物不仅可以提供显著的LDL-C降低效果,而且在提高斑块稳定性方面具有重要作用。
盡管他汀类药物已证明具有显著的CRP降低作用[20],但PCSK9抑制剂是否对CRP水平具有类似作用仍存在争议。一项孟德尔随机化研究发现,PCSK9浓度降低与CRP水平升高之间存在强烈关联[21]。而在本研究中,与标准治疗组相比,接受依洛尤单抗与阿托伐他汀联合治疗的患者CRP水平无统计学差异,可能与不同亚群CRP的差异有关,需要在大样本研究中进一步评估。LpA2是一种由巨噬细胞和单核细胞产生的酶,在促炎磷脂的代谢和促动脉粥样硬化代谢物的产生中起着至关重要的作用[22]。有研究发现,LpA2在不稳定斑块中的活性比具有小脂核和厚纤维帽的稳定斑块中的活性高得多[23],提示LpA2的活性与斑块稳定性显著相关。本研究结果表明,依洛尤单抗联合阿托伐他汀可显著降低血清LpA2水平,而依洛尤单抗与血清LpA2水平下降是否具有相关性尚需进一步研究证实 。
此外,本研究尚存在一定的不足与局限性:(1)本次研究中研究对象均来源于泰达国际心血管病医院,属于单中心研究,可能出现选择偏倚;(2)降脂治疗时间相对较短,PCSK9抑制剂对斑块及患者临床预后的长期影响尚无法评估;后续将进一步收集病例,延长随访时间验证该结论;(3)本研究尚缺乏大样本数据分析,以至于未能观察到依洛尤单抗联合他汀治疗与降低心血管不良事件发生率、改善心血管预后存在直接关联。
综上所述,对于采用标准降脂治疗LDL-C仍无法达标的ASCVD患者,联用依洛尤单抗单抗不仅可以更大限度地降低LDL-C,而且对增加斑块的稳定性具有积极作用。依洛尤单抗可显著降低血管特异性炎症标志物LpA2水平,或可为冠心病二级预防及治疗提供新方向。
参考文献
[1]马丽媛,王增武,樊静,等.《中国心血管健康与疾病报告2021》要点解读[J].中国全科医学,2022,25(27):3331-3346.
[2] ZHAO D,LIU J,WANG M,et al.Epidemiology of cardiovascular disease in China: current features and implications[J].Nat Rev Cardiol,2019,16(4):203-212.
[3] GAO F,ZHOU Y J,HU D Y,et al.Contemporary management and attainment of cholesterol targets for patients with dyslipidemia in China[J/OL].PLoS One,2013,8(4):e47681.https://pubmed.ncbi.nlm.nih.gov/23593110/.
[4] NICHOLLS S J,NISSEN S E,PRATI F,et al.Assessing the impact of PCSK9 inhibition on coronary plaque phenotype with optical coherence tomography: rationale and design of the randomized, placebo-controlled HUYGENS study[J].Cardiovasc Diagn Ther,2021,11(1):120-129.
[5] ROBINSON J G,FARNIER M,KREMPF M,et al.Efficacy and safety of alirocumab in reducing lipids and cardiovascular events[J].N Engl J Med,2015,372(16):1489-1499.
[6] SABATINE M S,GIUGLIANO R P,KEECH A C,et al.Evolocumab and clinical outcomes in patients with cardiovascular disease[J].N Engl J Med,2017,376(18):1713-1722.
[7] BHATT D L,STEG P G,MILLER M,et al.Cardiovascular risk reduction with icosapent ethyl for hypertriglyceridemia[J].N Engl J Med,2019,380(1):11-22.
[8] ARNETT D K,BLUMENTHAL R S,ALBERT M A,et al.2019 ACC/AHA guideline on the primary prevention of cardiovascular disease: a report of the American College of Cardiology/American Heart Association Task Force on clinical practice guidelines. circulation[J].Circulation,2019,140(11):596-646.
[9] MICHOS E D,MCEVOY J W,BLUMENTHAL R S.Lipid Management for the Prevention of Atherosclerotic Cardiovascular Disease[J].N Engl J Med,2019,381(16):1557-1567.
[10] AKO J,HIBI K,TSUJITA K,et al.Effect of Alirocumab on coronary atheroma volume in Japanese patients with acute coronary syndrome - the ODYSSEY J-IVUS trial[J].Circ J,2019,83(10):2025-2033.
[11] KOLODGIE F D,BURKE A P,FARB A,et al.The thin-cap fibroatheroma:a type of vulnerable plaque: the major precursor lesion to acute coronary syndromes[J].Curr Opin Cardiol,2001,16(5):285-292.
[12] KIM Y,JOHNSON T W,AKASAKA T,et al.The role of optical coherence tomography in the setting of acute myocardial infarction[J].J Cardiol,2018,72(3):186-192.
[13] GRUNDY S M,STONE N J,BAILEY A L,et al.2018AHA/ACC/ASPC/NLA/PCNA guideline on the management of blood cholesterol: a report of the American College of Cardiology/American Heart Association Task Force on clinical practice guidelines[J].Circulation,2019,139(25):1082-1143.
[14] FULCHER J,O'CONNELL R,VOYSEY M,et al.Efficacy and safety of LDL-lowering therapy among men and women:meta-analysis of individual data from 174, 000 participants in 27 randomised trials[J].Lancet,2015,385(9976):1397-1405.
[15] XING Y,LIU J,HAO Y,et al.Prehospital statin use and low-density lipoprotein cholesterol levels at admission in acute coronary syndrome patients with history of myocardial infarction or revascularization: findings from the Improving Care for Cardiovascular Disease in China (CCC) project[J].Am Heart J,2019,212:120-128.
[16] SABATINE M S,GIUGLIANO R P,KEECH A C,et al.Evolocumab and clinical outcomes in patients with cardiovascular disease[J].N Egl JMed,2017,376(18):1713-1722.
[17] SABATINE M S,GIUGLIANO R P,KEECH A,et al.Rationale and design of the further cardiovascular outcomes research with PCSK9 inhibition in subjects with elevated risk trial[J].Am Heart J,2016,173:94-101.
[18] NICHOLLS S J,PURI R,ANDERSON T,et al.Effect of Evolocumab on progression of coronary disease in statin-treated patients:the GLAGOV randomized clinical trial[J].JAMA,2016,316(22):2373-2384.
[19] OTAKE H,SUGIZAKI Y,TOBA T,et al.Efficacy of Alirocumab for reducing plaque vulnerability:study protocol for ALTAIR,a randomized controlled trial in Japanese patients with coronary artery disease receiving rosuvastatin[J].J Cardiol,2019,73(3):228-232.
[20] PURI R,NISSEN S E,LIBBY P,et al.C-reactive protein,but not low-density lipoprotein cholesterol levels,associate with coronary atheroma regression and cardiovascular events after maximally intensive statin therapy[J].Circulation,2013,128(22):2395-2403.
[21] SCHMIDT A F,HUNT N B,GORDILLO-MARA??N M,et al.Cholesteryl ester transfer protein as a drug target for cardiovascular disease[J].Med Rxiv,2021,12(1):5640.
[22] HUANG F,WANG K,SHEN J.Lipoprotein-associated phospholipase A2:the story continues[J].Med Res Rev,2020,40(1):79-134.
[23] MAIOLINO G,BISOGNI V,ROSSITTO G,et al.Lipoprotein-associated phospholipase A2 prognostic role in atherosclerotic complications[J].World J Cardiol,2015,7(10):609-620.

