流式细胞技术在抗生素抑菌实验中的应用
蒋海霞, 许 杰
(上海交通大学生命科学技术学院,上海 200240)
0 引 言
在抗生素抑菌能力研究中,快速检测靶标细菌的生长或活力状态至关重要[1]。目前检测细菌生长和活力的经典方法主要是平板抑菌圈法和细菌细胞透性检测法(包括膜电势测量法和Ca2+浓度测量法等)[2-4]。尽管这些方法比较成熟,但是存在耗时长、误差大、操作繁琐等问题,难以满足抗生素抑菌能力实验中快速、准确地检测细菌生长状态的要求,因此寻找可用于抗生素抑菌检测的新方法很有必要。
流式细胞仪(FCM)已广泛应用于分子生物学、遗传学、生物化学、免疫学、药理学、营养学、肿瘤医学和临床检验等领域[5-6]。流式细胞仪具有灵敏、精确、高效、样品前处理简单等优势,可快速采集多参数数据[7]。目前流式细胞仪在真核细胞凋亡方面的检测已经比较成熟,可以实现对活细胞和死细胞的有效区分[8]。原核细胞和真核细胞存在固有差异(如细胞的大小、细胞壁组成、细胞核的有无、染色质状态等),而流式细胞技术在区分原核细胞(如细菌)生长状态方面的研究还相对较少。近年来,随着各类荧光染料的出现与流式细胞仪等技术的发展,通过流式细胞仪检测不同荧光信号来分析细菌等微生物成为可能。李森[9]通过系统分析影响流式细胞仪定量检测结果的各种因素,优化进样浓度、进样速率、SYBR GreenⅠ和碘化丙啶(PI)染料浓度、染色温度和染色时间,建立了适用于水环境样品细菌活性分析的快速定量检测方法。邓颖[10]通过研究染料荧光团SYTO 9 和PI 的细菌染色特性、染色浓度和染色时间,评估流式细胞仪定量检测大肠杆菌活性的效果。以上研究表明,利用流式细胞技术可实现细菌死活状态的检测,但是流式细胞技术在抗生素抑菌实验中的研究几乎没有相关文献。
黄单胞菌属病原细菌可以侵染超过400 种植物,是我国目前防治的重点病害微生物之一[11]。申嗪霉素(Shenqinmycin)是假单胞菌Pseudomonas 代谢产物吩嗪-1-羧酸(Phenazine-1-Carboxylic Acid,PCA)的商业名称,由上海交通大学生命科学技术学院与上海农乐生物制品股份有限公司自主研发、具有广谱抗菌活性的一种新型微生物源杀菌剂(农用抗生素),前期研究表明申嗪霉素在黄单胞菌的防治中起到较好的作用[12-13]。因此,以申嗪霉素对黄单胞菌抑菌效果为例,利用流式细胞技术开发细菌凋亡的快速检测方法,尤其精准分析细菌的活力状态,为抗生素等药物抑菌机理检测提供支持。
1 材料与方法
1.1 申嗪霉素溶液配制和处理时间
采用甲醇配制申嗪霉素母液(200 mg/mL),以最大水溶度进行梯度稀释:20、2、0.2、0.02 mg/mL,分别加入对数生长期的黄单胞菌培养液里,1 和2 h后分别取样检测。
1.2 细菌样品准备
取不同质量浓度申嗪霉素、处理1 h和2 h后的黄单胞菌培养菌液,采用分光光度计检测,在光密度值为1 的基础上再稀释10 倍,重悬的菌液颗粒含量为1 ×107个/mL。
1.3 样本制备
样本采用碧云天Annexin-V-FITC 凋亡检测试剂盒进行染色处理。按照产品说明书将处理后的细菌离心,采用磷酸盐缓冲液(PBS)洗涤一次,再将试剂盒中组分Annexin-V-FITC 和PI 按照20∶1比例重悬,室温避光孵育15 min后上机检测。
1.4 流式细胞技术检测方法及参数设置
本实验测试仪器是美国Beckman Coulter 公司的Cytoflex流式细胞仪。
鉴于原核细胞的体积较小,设置反映细胞直径大小的前向散射光(FSC)和侧向散射光(SSC)的信号值为对数放大,同时设置FSC信号阈值为5 ×103。建立双参数FSC-A和SSC-A散点图以及双参数FITC-A和PE-A散点图(硫氰酸荧光素,FITC;藻红蛋白,PE;面积,A),采用未经染色的对照样品调节光电倍增管电压,将Annexin-V-FITC和PI分别单独染色的对照样品调节荧光补偿(通过互补矩阵里的参数设置),得到合适的流式细胞图。在双参数FSC-A 和SSC-A 散点图中找到细菌最集中的区域设门P1,圈出所需分析的细菌(见图1,FSC-A 和SSC-A 表示散射光强度的相对值)。收集1 ×104个细菌进行流式分析。FITC 通道检测波长为530/30 nm,PE 通道检测波长为586/15 nm,FITC 通道收集Annexin-V-FITC 绿色荧光,PE 通道收集PI红色荧光,获得FITC-A和PE-A散点图。
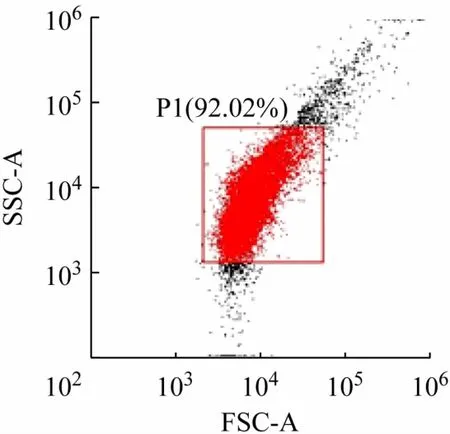
图1 基于FSC-A和SSC-A散点图的细菌设门
2 结果与分析
2.1 对照设置和染色分析
在细菌凋亡早期,细胞膜内侧的磷脂酰丝氨酸外翻到细胞表面,Annexin-V-FITC与之结合呈现阳性,此时细胞膜还是完整的,PI 无法穿透细胞膜染色而呈现阴性;在细菌凋亡晚期,细胞膜的完整性已经丧失,Annexin-V-FITC和PI 都可以对细胞染色而呈现双阳性;已经死亡的细菌因细胞膜已经被破坏、Annexin-VFITC无法结合磷脂酰丝氨酸而呈现阴性,PI可以对细胞染色而呈现阳性。因此,取未经染色的菌体PBS 悬液作为双阴性对照,经申嗪霉素处理(20 mg/mL 处理1 h)的细菌用Annexin-V-FITC单独染色作为单阳性对照,质量分数75%乙醇处理30 min 的细菌用PI 单独染色作为另一单阳性对照。FITC-A 和PE-A 散点图(FITC-A 和PE-A 代表荧光强度的相对值)分析结果表明:未经染色双阴性细菌位于四象限的左下象限Q1-LL[见图2(a)],经申嗪霉素处理和Annexin-VFITC染色为阳性的细菌位于四象限的右下象限Q1-LR[见图2(b)],经质量分数75%乙醇处理30 min和PI染色为阳性的细菌位于四象限的左上象限Q1-UL[见图2(c)]。结果表明,流式细胞技术能够较好地区分凋亡不同阶段或不同状态的黄单胞菌。

图2 对照组的FITC-A和PE-A散点图分析
2.2 时间和梯度分析
为了进一步探究流式细胞仪在检测黄单胞菌凋亡中的灵敏度和准确度,采用2 个处理时间和4 个梯度质量浓度的双因素叠加分析(见图3)。横向对比不同质量浓度的抑菌效果。结果表明:处理1 h 后,随着申嗪霉素质量浓度的逐渐增加(0.02 ~20 mg/mL),Annexin-V-FITC和PI 双阳性的细胞位于四象限的右上象限Q1-UR,凋亡晚期的坏死细胞百分比逐渐增加,从4.30%、6.18%、12.81%增加到20.61%[见图3(a)~(d)];处理2 h后得到类似的结论,凋亡晚期的坏死细胞百分比从18.82%、23.43%,29.64%增加到37.95%[见图3(e)~(h)]。这表明申嗪霉素质量浓度越高,抑菌(黄单胞菌)能力越强。

图3 实验组的FITC-A和PE-A散点图
进一步两两纵向分析相同质量浓度和不同处理时间下的效果[见图3(a)、(e),图3(b)、(f),图3(c)、(g),图3(d)、(h)]。结果表明:相同申嗪霉素质量浓度时,随着处理时间的增加,Annexin-V-FITC 和PI 双阳性细胞凋亡晚期的坏死细胞百分比相应增加,0.02 mg/mL下为4.30% ~18.82%[见图3(a)、(e)],0.2 mg/mL 下为6.18% ~23.43%[见图3(b)、(f)],2 mg/mL下为12.81% ~29.64%[见图3(c)、(g)],20 mg/mL下为20.61% ~37.95%[图3(d)、(h)]。以上数据表明,相同质量浓度下,随着处理时间的延长,申嗪霉素抑菌(黄单胞菌)能力越强。
3 讨 论
经典的平板抑菌圈法检测申嗪霉素对黄单胞菌的抑菌效果难以量化[14-15],而且也难以快速、准确地检测细菌的生长状态。本研究基于细胞凋亡过程中细胞膜完整性和通透性的改变所导致的Annexin-V-FITC和PI染色差异,提出通过流式细胞技术建立细胞凋亡的快速检测方法,可以有效地解决细胞凋亡快速检测问题。
本研究重点分析时间和浓度双层因素下,流式细胞技术检测申嗪霉素对黄单胞菌抑制的变化。相同处理时间下,申嗪霉素质量浓度越高,凋亡晚期的坏死细胞越多,但是死亡细胞的比例(Q1-UL)变化不明显(见图3)。以处理时间1 h 和2 h 为例,随着申嗪霉素质量浓度(0.02 ~20 mg/mL)的逐渐增加,Annexin-VFITC阴性而PI 阳性的细胞位于四象限的左上象限Q1-UL,死亡细胞百分比变化不明显(见图3)。相同申嗪霉素质量浓度下,随着处理时间的增加(1 h 和2 h),死亡细胞百分比(Q1-UL)明显增加(见图3)。本研究进一步量化了不同质量浓度和不同处理时间下申嗪霉素对黄单胞菌的抑菌效果,也为实际用药量和作用时间提供了数据支撑。
4 结 语
流式细胞仪在动物细胞研究领域使用频率很高,但在微生物领域使用较少。上海交通大学生命科学技术学院仪器共享与技术服务平台依托微生物代谢国家重点实验室,进一步拓展了流式细胞仪在微生物研究领域的应用,以期为抗生素等药物抑菌机理研究检测技术提供支持。

