铜藻多酚的提取工艺及其稳定性和抑制酪氨酸酶活性
何袅袅,蔡树芸,阎光宇,杨婷,陈伟珠,,洪专,,张怡,张怡评,*
(1.自然资源部第三海洋研究所海洋生物资源开发利用工程技术创新中心,福建厦门 361005;2.福建农林大学食品科学学院,福建福州 350001;3.厦门海洋职业技术学院海洋生物学院,福建厦门 361100)
铜藻又名柱囊马尾藻、海柳麦、玉海藻等[1]。鲜铜藻藻体为黄褐色,质地脆嫩,气味腥臭,味咸淡,属于暖温带性海藻,主产于浙江、广东、福建等地。铜藻资源非常丰富,在每年的4~5 月份铜藻大量繁殖,生物量为35.81~1 568.44 g/m2,不充分的利用会导致资源浪费和金潮等环境问题[2]。据了解,铜藻中含有丰富的多酚[3]、褐藻胶[4]、褐藻多糖、岩藻黄质[5]等活性成分,还含有丰富的矿物质和多种人体必需氨基酸[6]。铜藻多酚是铜藻中一类重要的活性成分,具有抗氧化[7]、清除金属离子[8]、抗肿瘤[9-10]、降血糖血脂[11-12]等多种生物活性,在保健食品及医药领域具有十分广阔的应用前景,经济价值很高。但是目前对铜藻多酚提取技术的研究还很少,多酚的传统提取方法为浸提法和热回流提取法[13-15],与传统提取方法比较,采用超声波辅助提取,提取时间缩短,溶剂用量减少,可以明显提高铜藻多酚的提取效率。
目前铜藻多酚提取工艺的研究大多数采用干铜藻为原料,在烘干过程中损失了部分多酚。本试验以新鲜铜藻为原材料,通过超声波辅助提取法对铜藻多酚进行提取,从而提高多酚的提取量及提取率[16]。本试验以铜藻多酚提取率作为指标,考察乙醇体积分数、超声时间和液料比3 个因素对铜藻多酚提取率的影响[17],开展铜藻多酚提取工艺的单因素及响应面优化试验,探讨光照、温度和pH 值3 个因素对铜藻多酚稳定性的影响规律,同时研究铜藻多酚对酪氨酸酶活性的抑制作用,旨在为铜藻资源开发和利用提供重要理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
福建泉州海域采集的新鲜铜藻,经王初生研究员(自然资源部第三海洋研究所)鉴定为铜藻(Sargassum horneri)。乙醇(≥95%):安徽安特食品股份有限公司;福林酚、碳酸钠(纯度均≥99%):国药集团化学试剂有限公司;焦性没食子酸(≥99%):西陇科学股份有限公司;左旋多巴、左旋酪氨酸、酪氨酸酶(33 U/mL):上海麦克林生化科技有限公司。
1.1.2 仪器与设备
KQ-500E 超声清洗机:昆山市超声仪器有限公司;UH5300 紫外-可见分光光度计:日本岛津公司;Hei-VAP ExpertValue G3 旋转蒸发仪:德国Heidolph 公司;HH-ZK 水浴锅:巩义市予华仪器有限责任公司;infinite F50 酶标仪:瑞士TECAN 公司。
1.2 试验方法
1.2.1 标准曲线的制作及铜藻多酚含量的测定
1.2.1.1 没食子酸标准曲线绘制
精密称量焦性没食子酸12.71 mg,用蒸馏水溶解并定容至10 mL。取0.5 mL 的没食子酸储备液,用去离子水稀释、定容至100 mL。在1.25 mL 的福林酚试剂中加入适量的没食子酸溶液,反应3 min;而后加入4 mL 0.1 g/mL 碳酸钠溶液,用去离子水定容至10 mL,在30 ℃的恒温水箱中避光30 min,然后用紫外-可见分光光度计测定760 nm 处的吸光度。
1.2.1.2 铜藻多酚含量测定
采用福林酚法检测铜藻中多酚的含量。取适量铜藻多酚待测液,加入1.25 mL 福林酚试剂反应3 min,加入4 mL 0.1 g/mL 碳酸钠溶液,去离子水定容至10 mL。在30 ℃恒温水浴锅内避光反应30 min,然后用紫外-可见分光光度计测定760 nm 处的吸光度。
1.2.2 单因素试验
1.2.2.1 乙醇体积分数对铜藻多酚提取率的影响
称取1 g 新鲜的铜藻,使用超声波辅助提取法,超声时间为40 min,液料比为40∶1(mL/g),研究乙醇体积分数(0%、20%、40%、60%、80%、100%)对铜藻多酚提取率的影响,重复进行3 次试验。
铜藻多酚提取率(R,mg/g)计算公式如下。
式中:C为多酚浓度;mg/mL;V为提取液体积,mL;m为铜藻质量,g。
1.2.2.2 超声时间对铜藻多酚提取率的影响
称取1 g 新鲜铜藻,使用超声波辅助提取法,乙醇体积分数为40%、液料比40∶1(mL/g),探究超声时间(10、20、30、40、50、60 min)对铜藻多酚提取率的影响,重复进行3 次试验。
1.2.2.3 液料比对铜藻多酚提取率的影响
称取1 g 新鲜铜藻,使用超声波辅助提取法,乙醇体积分数40%、超声时间为50 min,探究液料比[20∶1、30∶1、40∶1、50∶1、60∶1(mL/g)]对铜藻多酚提取率的影响,重复进行3 次试验。
1.2.3 响应面优化试验
采用Design-Expert 8.0.6 软件,对试验数据进行回归分析,以研究影响因素的水平和效应。具体的影响因素和水平见表1。

表1 响应面试验因素与水平Table 1 Experimental factors and levels of response surface
1.2.4 铜藻多酚稳定性测定
1.2.4.1 光照对铜藻多酚保留率的影响
参考文献[18],将铜藻多酚分别置于避光和自然光下的室内保存30 d。在相同条件下,取样品于处理后的1、2、3、7、14、21、30 d,并测定铜藻多酚含量,计算其保留率,比较不同光照条件对铜藻多酚保留率的影响。铜藻多酚保留率(R,%)的计算公式如下。
式中:A为铜藻多酚减少质量,mg;B为铜藻多酚初始质量,mg。
1.2.4.2 温度对铜藻多酚保留率的影响
参考文献[19],将铜藻多酚置于25、60、100 ℃的环境中,并进行避光保存。在相同温度下连续采样9 d,并测定铜藻多酚的含量,计算铜藻多酚的保留率,比较不同温度条件对铜藻多酚保留率的影响。
1.2.4.3 pH 值对铜藻多酚保留率的影响
参考文献[20],将铜藻多酚置于pH3、4、5、6、7、8的条件下,避光保存。在相同温度下,于处理后的1、2、3、7、14、21 d 取样,并测定铜藻多酚的含量,计算铜藻多酚的保留率,比较不同pH 值对铜藻多酚保留率的影响。
1.2.5 铜藻多酚对酪氨酸酶活性抑制作用研究
参考文献[21]并略作改动,反应体系组成见表2。

表2 反应体系组成Table 2 Composition of reaction system μL
分别以左旋酪氨酸和左旋多巴为底物,将磷酸盐缓冲液(0.2 mol/L,pH6.8),酪氨酸酶溶液和铜藻多酚溶液(铜藻多酚浓度300、400、500、600、700 μg/mL)添加到96 孔板中,37 ℃恒温10 min。随后,加入底物,37 ℃恒温5 min。使用酶标仪测量475 nm 处的吸光度。酪氨酸酶活性抑制率计算公式如下。
式中:X为酪氨酸酶活性抑制率,%;Aa为空白组吸光度;Ab为空白对照组吸光度;Ac为试验对照组吸光度;Ad为试验组吸光度。
1.3 数据处理
利用Design-Expert 8.0.6 软件对各影响因素进行统计学方差分析,绘出3D 曲面图,采用Origin 2019b软件绘图。
2 结果与分析
2.1 铜藻多酚提取单因素试验结果分析
2.1.1 乙醇体积分数对铜藻多酚提取率的影响结果
在液料比为40∶1(mL/g)、超声时间为40 min 条件下,乙醇体积分数对铜藻多酚提取率的影响如图1所示。

图1 乙醇体积分数对铜藻多酚提取率的影响Fig.1 Influence of ethanol volume fraction on the extraction amount of polyphenols from Sargassum horneri
从图1 可以看出,铜藻多酚的提取率随乙醇体积分数的提高而先上升后下降。在40% 的乙醇体积分数下,提取率最大,随着乙醇含量的增大,提取率逐渐降低。因此,以20%,40%,60% 的乙醇体积分数进行响应面优化试验。
2.1.2 超声时间对铜藻多酚提取率的影响结果
以40%乙醇体积分数,液料比40∶1(mL/g),研究超声时间对铜藻多酚提取率的影响如图2 所示。

图2 超声时间对铜藻多酚提取率的影响Fig.2 Influence of ultrasonic time on the extraction amount of polyphenols from Sargassum horneri
从图2 中可以看出,在10~50 min 的超声波处理下,铜藻多酚提取率随着超声时间的延长而增加,在50 min 时达到最大值,60 min 后稍有降低。这可能与铜藻多酚的耐热性能有关,随着超声波处理时间的延长,萃取温度也随之升高,铜藻多酚溶出增加,超声50 min 后,由于温度过高,铜藻多酚被破坏损失,从而造成铜藻多酚的提取率含量下降。因此选用40、50、60 min进行响应面优化试验。
2.1.3 液料比对铜藻多酚提取率的影响
以40% 乙醇作为提取溶剂,超声时间50 min,液料比对铜藻多酚提取率的影响如图3 所示。
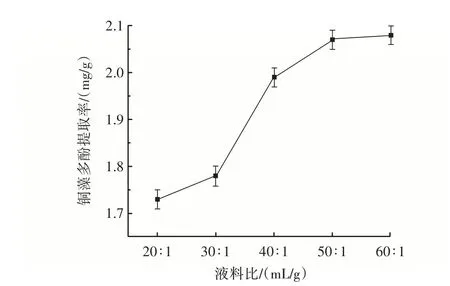
图3 液料比对铜藻多酚提取率的影响Fig.3 Influence of solid-liquid ratio on the extraction amount of polyphenols from Sargassum horneri
由图3 可知,随着提取溶剂量的增加,铜藻多酚的提取率逐渐增大,可能是提取溶剂量的增加,溶剂和原料间的浓度差增大,物质扩散速度加快,提取率逐渐提高。由于液料比过大不利于节能环保和降低成本,因此,选择40∶1、50∶1、60∶1(mL/g)的液料比进行优化试验。
2.2 铜藻多酚提取响应面优化试验结果
响应面优化试验设计与结果如表3 所示。
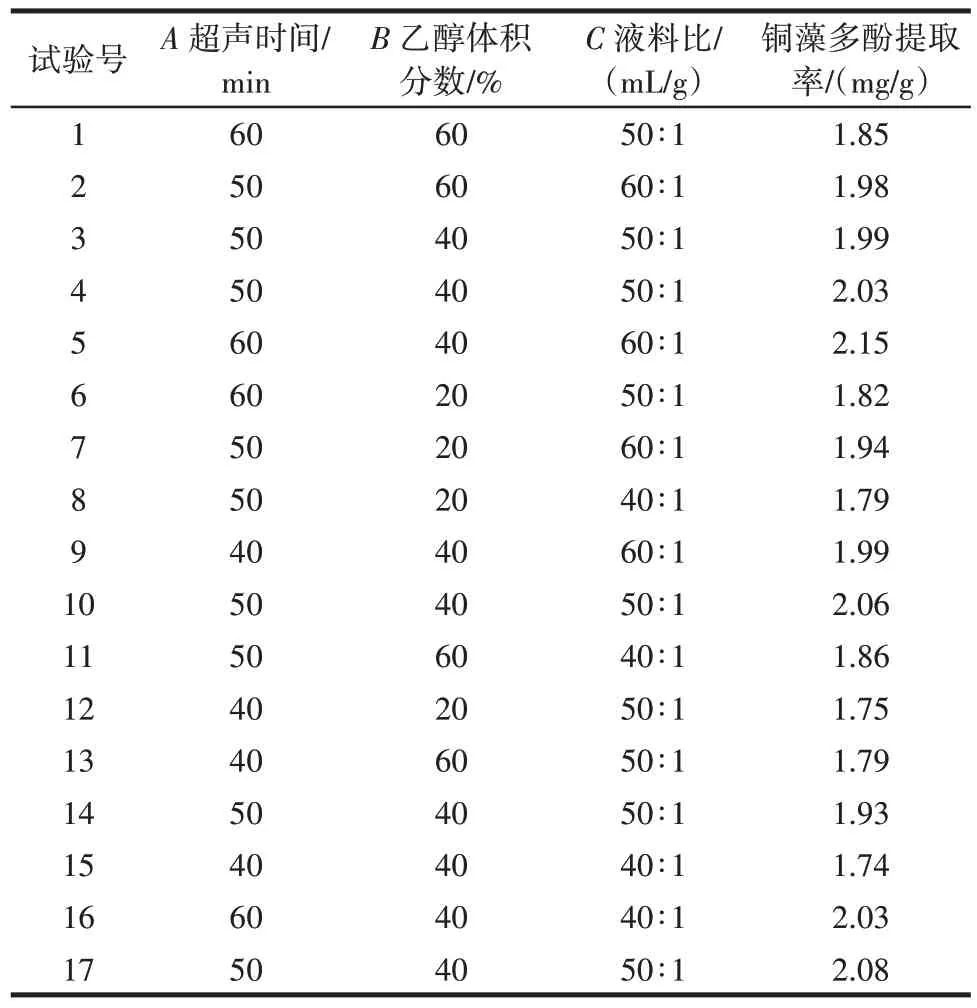
表3 Box-Behnken 试验设计与结果Table 3 Box-Behnken experimental design and results
通过Design-Expert 8.0.6 软件对表3 中的试验数据进行多元回归分析,得到回归方程:y=2.02+0.073A+0.023B+0.080C-0.003AB-0.032AC-0.008BC-0.065A2-0.15B2+0.025C2(R2=0.998 6)。
对上述回归模型进行方差分析,结果如表4 所示。
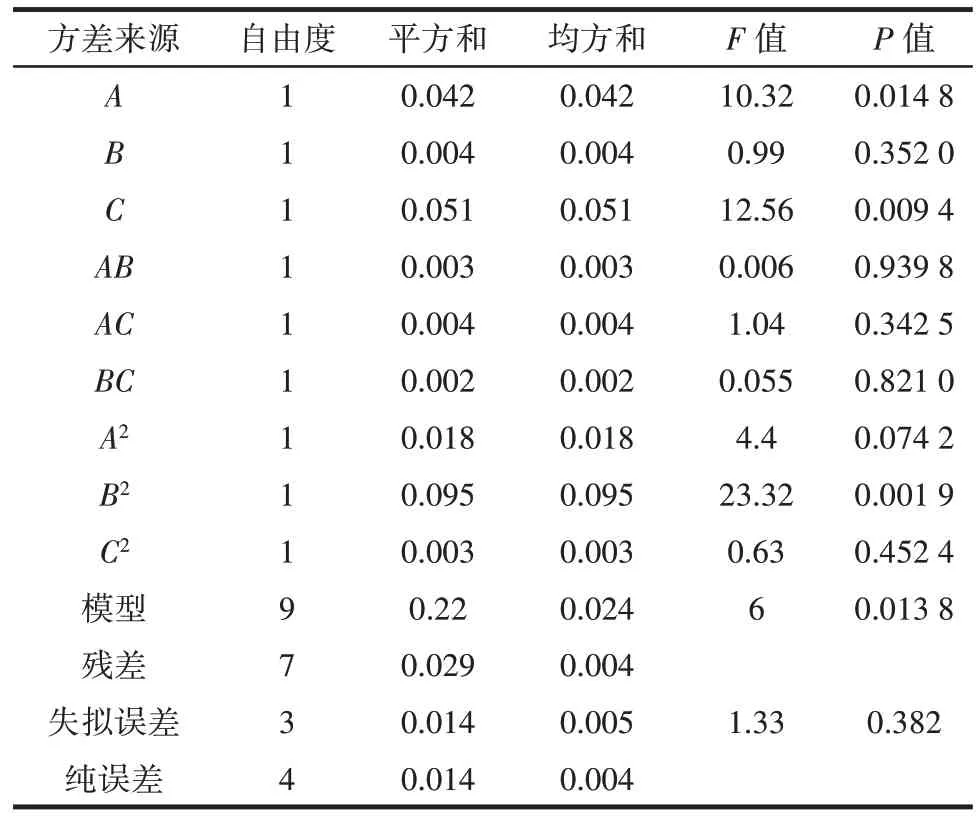
表4 回归模型方差分析Table 4 Analysis of variance in regression model
由表4 可知,A对铜藻多酚提取率影响显著(P<0.05),C、B2对铜藻多酚得率的影响极显著(P<0.01);AB、AC、BC、A2、C2对铜藻多酚得率的影响均不显著(P>0.05)。由F值可以看出,3 个因素对铜藻多酚提取率的影响顺序为液料比(C)>超声时间(A)>乙醇体积分数(B),超声波辅助提取铜藻多酚的试验模型显著(P<0.05),表明回归模型指标显著;R2=0.998 6,且失拟误差不显著(P>0.05),说明该模型拟合程度良好,可以对试验结果进行分析和预测。
由响应面法分析绘制的各因素交互作用的等高线和响应面如图4~图6 所示。
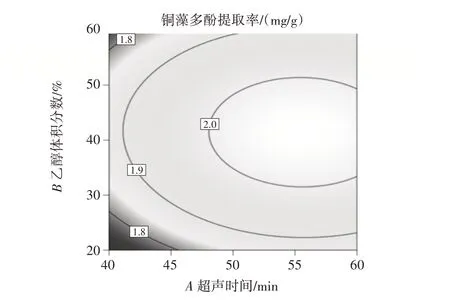
图4 乙醇体积分数和超声时间对铜藻多酚提取率影响的等高线和响应面Fig.4 Contour diagram and response surface diagram of the effects of ethanol volume fraction and ultrasonic time on the yield of polyphenols from Sargassum horneri
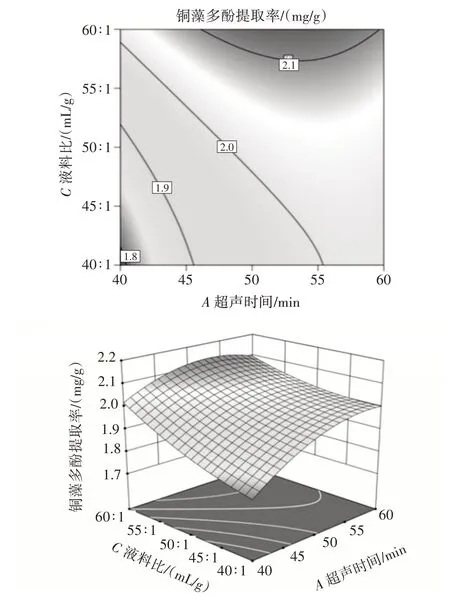
图5 超声时间和液料比对铜藻多酚提取率影响的等高线和响应面Fig.5 Contour diagram and response surface diagram of the effects of ultrasonic time and liquid-solid ratio on the yield of polyphenols from Sargassum horneri

图6 乙醇体积分数和液料比对铜藻多酚提取率影响的等高线和响应面Fig.6 Contour diagram and response surface diagram of the effects of ethanol volume fraction and liquid-solid ratio on the yield of polyphenols from Sargassum horneri
从图4~图6 可以看出,响应面的曲面倾斜度越大,坡度也较大,说明超声时间和乙醇体积分数、超声时间和液料比、乙醇体积分数和液料比的交互作用对铜藻多酚提取率有影响。
运用Design-Expert 8.0.6 软件对试验结果进行分析,得出铜藻多酚提取工艺的最佳条件:乙醇体积分数40.94%、提取时间53.05 min、液料比60∶1(mL/g)。该条件下铜藻多酚的提取率为2.129 mg/g。为了方便试验的实际操作,修正工艺条件为乙醇体积分数40%、提取时间53 min、液料比60∶1(mL/g),进行验证,试验重复3 次,铜藻多酚提取率为(2.07±0.24)mg/g,理论值与实际值非常接近,说明所得回归方程能够真实有效地反映各因素对铜藻多酚提取率的影响,此模型可靠。
2.3 铜藻多酚稳定性研究
2.3.1 光照对铜藻多酚保留率的影响
光照对铜藻多酚保留率的影响见图7。
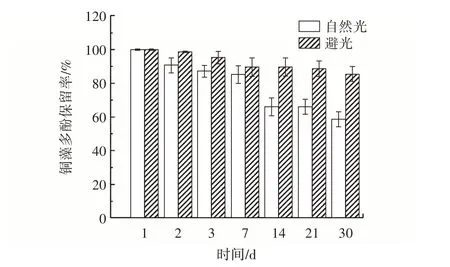
图7 光照对铜藻多酚保留率的影响Fig.7 Effect of light on polyphenol retention rate of Sargassum horneri
由图7 可知,在30 d 的试验过程中,铜藻多酚保留率呈现出明显的变化趋势。铜藻多酚对光照敏感,避光条件下铜藻多酚保留率几乎没有变化,但是自然光照条件下铜藻多酚保留率明显下降,在第30 天下降了40%左右。在避光条件下,铜藻多酚的含量相对稳定,保留率较高。然而,在室内自然光的照射下,铜藻多酚的含量逐渐减少,保留率呈下降趋势。特别是在处理时间较长的情况下,光照条件对铜藻多酚的稳定性影响更为明显。这一试验结果为铜藻多酚的保存提供了重要的参考,为进一步的研究提供了基础。因此,铜藻多酚在应用和保存的过程中应注意避光。
2.3.2 温度对铜藻多酚保留率的影响
温度对铜藻多酚保留率的影响见图8。
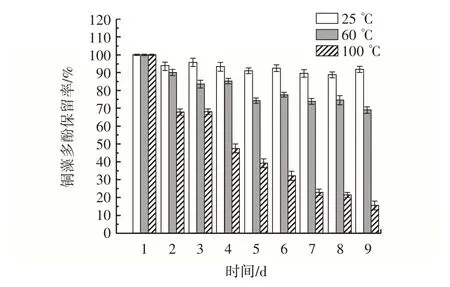
图8 温度对铜藻多酚保留率的影响Fig.8 Effect of temperature on polyphenol retention rate of Sargassum horneri
从图8 可以看出,铜藻多酚的保留率随温度的升高而减小。当温度为25 ℃时,铜藻多酚的保留率几乎没有变化。当温度升高到60 ℃时,铜藻多酚的持留率略有降低。当温度上升到100 ℃时,铜藻多酚的保留率明显下降,直至9 d 时,其保留率下降了85%左右。结果表明,随着温度的提高,铜藻多酚的保留率下降。铜藻多酚在贮藏过程中以低温贮藏效果最好。
2.3.3 pH 值对铜藻多酚保留率的影响
pH 值对铜藻多酚保留率的影响见图9。
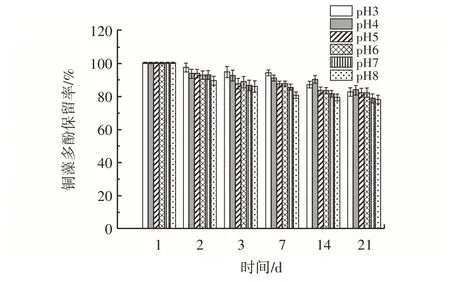
图9 pH 值对铜藻多酚保留率的影响Fig.9 Effect of pH value on polyphenol retention rate of Sargassum horneri
从图9 可以看出,铜藻多酚在酸性环境中具有更高的稳定性。pH 值为4 时,其稳定性最好。这可能与多酚类物质在碱环境中的水解作用有关。结果表明,在pH3~8 条件下,21 d 内铜藻多酚保留率降低了17.55%、16.41%、18.01%、18.20%、21.36%、22.18%。
2.4 铜藻多酚对酪氨酸酶活性抑制作用
铜藻多酚对酪氨酸酶活性抑制作用见图10。

图10 铜藻多酚对酪氨酸酶活性抑制作用Fig.10 Inhibitory effect of Sargassum horneri polyphenols on tyrosinase activity
由图10 可知,铜藻多酚对酪氨酸酶活性有强烈的抑制作用,当铜藻多酚浓度在300~700 μg/mL 时,其对酪氨酸酶活性的抑制效果会随其浓度增加而增强,呈现出明显的剂量效应。在相同浓度的铜藻多酚溶液中,当底物为左旋酪氨酸时,其对酪氨酸酶活性的抑制效果较好。当底物分别为左旋酪氨酸和左旋多巴时,铜藻多酚浓度为700 μg/mL 时,对酪氨酸酶活性的抑制率为92.68% 和39.18%。此外,铜藻多酚浓度为700 μg/mL时,以左旋酪氨酸为底物时,其对酪氨酸酶活性的抑制效果略高于Lee 等[22]研究中木瓜对酪氨酸酶的抑制率,说明铜藻多酚对酪氨酸酶活性有明显的抑制效果。
3 结论
以铜藻多酚的提取率为考察指标,利用响应面方法对超声辅助萃取铜藻多酚进行了优化。优选出最佳工艺条件为乙醇体积分数40%、超声时间53 min、液料比60∶1(mL/g)。对铜藻多酚的稳定性进行了研究,结果表明,在较低贮藏温度下,当pH 值为4 时,铜藻多酚在溶液中的保留率最大。在700 μg/mL 的铜藻多酚条件下,左旋酪氨酸、左旋多巴对酪氨酸酶的抑制作用高达92.68%、39.18%。综上,从铜藻中分离得到的铜藻多酚对酪氨酸酶有明显的抑制作用,对丰富铜藻资源的开发和利用具有重要的科学意义。

