没食子酸-磷脂复合物的制备与表征及其对核桃油氧化稳定性的影响
杜伊晗,何强,董怡
(四川大学轻工科学与工程学院,四川成都 610065)
核桃多酚具有多种健康功效与生物活性,主要存在于核桃内种皮中,但它们大多为水溶性多酚,难以随油被提取,大多残留在副产物核桃饼粕中,故核桃油中多酚含量较低[1]。对作为核桃油副产物的核桃多酚加以利用,不仅可以减少原料浪费,还可获得良好的生态效益和经济效益,近年来受到广泛关注。
没食子酸,亦称五倍子酸或棓酸,其结构如图1a所示,是核桃多酚的重要组成成分。没食子酸具有以抗炎、抗突变、抗氧化性为代表的多种生物活性,安全无毒[2],可作为天然食品抗氧化剂[3]。然而,较差的脂溶性限制了没食子酸在食品中的应用。

图1 没食子酸(a)和磷酸甘油酯(b)的化学结构Fig.1 Chemical structure of gallic acid and phospholipid
磷脂即含磷酸基团的脂类化合物,是脂质中非常重要的一部分,广泛分布于动植物细胞中,对维持正常生命活动有至关重要的作用[4],对人体还有护肝等健康作用,添加于食物中可提高食物的营养价值[5,6]。磷脂结构如图1b 所示,其分子具有双亲性,连接磷酸基团的一端具有亲水性,长烃基链一端则具有疏水性。
在一定条件下,磷脂的磷酸端与植物多酚可相互作用结合形成多酚磷脂复合物,在保持多酚良好生物活性的同时改善多酚的脂溶性,可有效提高多酚的生物利用度[7],拓展多酚的应用范围。多酚磷脂复合物作为一种具有良好脂溶性的多酚类新型产品,已在化妆品与药品行业得到广泛应用[8],关于其生物活性与在食品中的应用的研究却较少。
本研究以没食子酸和大豆卵磷脂为原料,制备没食子酸-磷脂复合物,并通过研究没食子酸-磷脂复合物的脂溶性、体外抗氧化活性以及对核桃油氧化稳定性的影响,为没食子酸-磷脂复合物的开发应用提供理论基础。
1 材料与方法
1.1 材料与仪器
鲜榨核桃油,云南源临尚品食品有限公司;没食子酸(纯度99%)、大豆卵磷脂(磷脂酰胆碱>90%,分子量:758.06),上海源叶生物科技有限公司;其他试剂均为分析纯。
DF-101T 集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;KQ3200DE 数控超声波清洗器,昆山市超声仪器有限公司;UV-6000PC 紫外分光光度计,上海元析仪器有限公司;Synergy H1 多功能微孔板检测仪,美国伯腾仪器有限公司;SHA-C 水浴恒温振荡器,金坛市科析仪器有限公司;1260 Infinity Ⅱ高效液相色谱仪,美国安捷伦;IRTracer-100 傅立叶红外光谱仪,日本岛津。
1.2 实验方法
1.2.1 没食子酸-磷脂复合物的制备
采用溶剂蒸发法制备没食子酸-磷脂复合物:按一定摩尔比称取适量没食子酸和大豆卵磷脂,溶解于无水乙醇中,一定温度下持续搅拌一定时间,后旋转蒸发除去溶剂,加入适量二氯甲烷复溶,并使用0.45 μm 微孔滤膜过滤除去未与磷脂复合的游离没食子酸沉淀,再将滤液旋转蒸发除去溶剂,即得到没食子酸-磷脂复合物产物。
1.2.2 复合物制备条件优化
1.2.2.1 复合率测定
根据紫外全扫描光谱结果,没食子酸-磷脂复合物与游离没食子酸具有相同的特征吸收峰,且峰高并不会受复合影响,故使用紫外分光光度法测定复合物中没食子酸含量。
以没食子酸无水乙醇溶液为标品,绘制吸光度标准曲线。将产物溶于10 mL 无水乙醇中,使用紫外分光光度计测定产物中没食子酸含量,计算没食子酸复合率。
式中:
D——复合率,%;
W0——投入没食子酸质量,mg;
W1——产物中没食子酸质量,mg。
1.2.2.2 复合条件的优化
复合方法的选择:按摩尔比1:4 将没食子酸与大豆卵磷脂溶解于无水乙醇中,没食子酸浓度为0.5 mg/mL,溶液分别于55 ℃下静置或搅拌,反应4 h,旋转蒸发除去溶剂,提纯得复合物产物,测定所得产物的复合率。
原料摩尔比:分别按摩尔比2:1、1:1、1:2、1:4、1:6将没食子酸与大豆卵磷脂溶解于无水乙醇中,使没食子酸质量浓度均为0.5 mg/mL,将溶液于55 ℃下搅拌反应4 h,旋转蒸发除去溶剂,提纯得复合物产物,测定所得产物的复合率。
复合温度:按摩尔比1:4 称取没食子酸与大豆卵磷脂,溶解于无水乙醇中,使没食子酸质量浓度为0.5 mg/mL,将溶液分别于25、35、45、55 ℃下搅拌反应4 h,旋转蒸发除去溶剂,提纯得复合物产物,测定所得产物的复合率。
没食子酸质量浓度:按摩尔比1:4 称取没食子酸与大豆卵磷脂,溶解于无水乙醇中,使没食子酸质量浓度分别为0.5、1.0、2.0、2.5 mg/mL,将溶液于45 ℃下搅拌反应4 h,旋转蒸发除去溶剂,提纯得复合物产物,测定所得产物的复合率。
复合时间:按摩尔比1:4 称取没食子酸与大豆卵磷脂,溶解于无水乙醇中,使没食子酸质量浓度为1.0 mg/mL,将溶液于45 ℃下搅拌,分别反应2、3、4、5 h,后旋转蒸发除去溶剂,提纯得复合物产物,测定所得产物的复合率。
制备条件的验证:根据单因素实验优化所得的最优制备条件,制备3 批没食子酸-磷脂复合物,测定复合率。
1.2.3 没食子酸-磷脂复合物的结构表征与性能评价
1.2.3.1 紫外全吸收光谱
以无水乙醇为溶剂,配制一定质量浓度的没食子酸-磷脂复合物溶液;分别以复合物溶液中没食子酸与磷脂的质量浓度为基准,配置相同质量浓度的没食子酸溶液、大豆卵磷脂溶液和没食子酸磷脂物理混合物溶液;测定各溶液在200~400 nm 范围内的吸收光谱。
1.2.3.2 差示量热扫描
取适量的没食子酸、大豆卵磷脂、没食子酸-磷脂复合物以及对应的物理混合物2 mg,以空坩埚为参比,升温速率定为10 ℃/min、温控范围50~300 ℃、N2流速为30 mL/min,对各待测物质进行差示热量扫描分析。
1.2.3.3 红外光谱
分别以没食子酸、大豆卵磷脂、没食子酸-磷脂复合物及对应的物理混合物为样品,进行红外光谱分析。取样品适量混合溴化钾压片,波数范围为400~4 000 cm-1,分辨率为1 cm-1。
1.2.3.4 HPLC 测定油水分配系数
分别取过量的没食子酸、没食子酸-磷脂复合物于具塞试管中,加入10 mL 蒸馏水或脂性有机溶剂,密封后于20 ℃避光条件下振摇24 h,后取出,4 000 r/min 离心10 min,取上清液加流动相稀释混匀,按HPLC 条件进样测定,以外标法计算没食子酸在不同溶剂中的溶解度。本实验使用的脂性有机溶剂为二氯甲烷。
HPLC 条件:色谱柱:Shiseido C18(4.6 mm×250 mm,5 μm),柱温:30 ℃,检测波长268 nm,梯度洗脱(流动相A 为色谱甲醇,流动相B 为0.1%磷酸水溶液),洗脱时间20 min,流速1 mL/min,进样量10 μL。
梯度洗脱:0~10 min 内,流动相A 从100%变为50%,流动相B 从0%变为50%;10~15 min 内,流动相A 变为100%,并保持5 min。
1.2.3.5 体外抗氧化能力
分别对没食子酸、没食子酸-磷脂复合物及大豆卵磷脂的体外抗氧化能力进行测定。根据Vayalil等[9]的方法,测定DPPH 自由基清除能力。参考蔡如玉等[10]的方法,测定ABTS+自由基清除能力。参考Josué 等[11]和常强等[12]的方法,并做适当修改,测定氧自由基吸收能力(ORAC)。
1.2.4 没食子酸-磷脂复合物对核桃氧化稳定性的影响
1.2.4.1 核桃油样品的制备及加速氧化试验
样品的添加量为质量分数0.02%(以没食子酸当量计,大豆卵磷脂以没食子酸-磷脂复合物中的大豆卵磷脂当量为标准计),将没食子酸、没食子酸-磷脂复合物和大豆卵磷脂样品分别溶于核桃油中,分装(每瓶30 g)后于60 ℃下恒温保存。每12 h 振荡一次,并改变其在恒温箱中位置。分别在第0、3、6、9 和12 天取样,进行各项指标的检测。以未添加任何物质的核桃油为空白组。
1.2.4.2 氧化指标测定
参照《GB5009.37-2003 食用植物油卫生标准的分析方法》中比色法,进行核桃油过氧化值的测定。参照《GB5009.37-2003 食用植物油卫生标准的分析方法》,测定核桃油的酸价。
1.2.4.3 核桃油脂的同步荧光测定
参照冯苏敏[13]的方法并做适当修改。荧光分光光度计预热20 min,使用四面透光石英比色皿,激发狭缝与发射狭缝皆为5 nm,间隔为10 nm,激发波长范围为200~800 nm,发射波长为210 nm,扫描速度为1 200 nm/min,光电倍增管PMT 为700 V,进行同步激发-发射荧光扫描(注:用正己烷洗净比色皿,再测量下个样品)。
1.2.4.4 色泽
参照《GB/T 22460-2008 动植物油脂罗维朋色泽的测定》和曹君[14]的方法测定油脂色泽,分别以L*值、a*值及b*值表示。
1.2.5 数据处理
所有试验均进行三次平行操作,数据以平均值±标准差(SD)表示,用SPSS 软件对数据进行统计分析,OriginPro 2022b 软件绘图。在P<0.05 时差异显著。所有样品均至少设置3 个重复。
2 结果与讨论
2.1 没食子酸-磷脂复合物的制备条件优化
使用静置和搅拌两种方式进行复合物的制备,搅拌制备的复合物复合率93.66%,显著高于静置组75.96%(P<0.05),搅拌使没食子酸和大豆卵磷脂更充分接触,反应更加充分,故选择搅拌的方法进行复合物的制备。
没食子酸与大豆卵磷脂摩尔比对复合率的影响结果如图2a 所示。随着大豆卵磷脂占比的增大,复合率逐渐上升,投料比1:4 时达到最高93.84%,而大豆卵磷脂比例更大时复合率降低,这可能是由于大豆卵磷脂过量,使没食子酸和大豆卵磷脂接触面积较小,遮蔽了大豆卵磷脂上复合作用位点,导致复合率下降。投料比与复合物的复合过程密切相关,可能会影响到没食子酸与大豆卵磷脂复合的结构,1:4 时复合率最高说明该比例下形成的复合物结构最稳定,即选择1:4 为最佳投料比。
复合温度对复合率的影响结果如图2b 所示。复合率随着温度的上升而逐渐上升,在45 ℃时达到峰值76.06%,后逐渐下降;可能是由于复合物不稳定,过高的温度易导致其分解,出现复合率下降的现象,故选择45 ℃作为最佳复合温度。
如图2c 所示,当没食子酸质量浓度为1 mg/mL时,复合率达86.33%,显著高于其他质量浓度的复合率,可能由于溶液中的底物反应须经碰撞发生,适当的底物浓度可提供良好的反应环境而有利于反应的发生[15],故选择1 mg/mL 为没食子酸的最佳制备质量浓度。
复合时间对复合率的影响结果如图2d 所示。反应时间为3 h 组的复合率最高,可达94.08%,2 h组复合率为91.85%;然而2 h 组与3 h 组无显著差异,说明在2 h 时反应已接近完全,为节约时间,选择2 h 为最适宜的复合时间。
综上所述,优化所得最佳制备条件为:将没食子酸与大豆卵磷脂按摩尔比1:4 溶于无水乙醇,使没食子酸质量浓度为1 mg/mL,在45 ℃下搅拌反应2 h。按优化所得的没食子酸-磷脂复合物最优制备条件制备3 批复合物,所得平均复合率为94.65%。
2.2 复合物结构表征与性能评价
2.2.1 光谱特征
如图3a 所示,磷脂在213 nm 处具有最大吸收峰,没食子酸、没食子酸-磷脂复合物及对应物理混合物的吸收图谱形状则十分相近,均在227 nm 和268 nm 处有两个最大吸收峰出现,且峰高基本一致,说明与大豆卵磷脂复合并不会影响没食子酸的紫外吸收,复合前后没食子酸的发色团的结构未发生改变,而大豆卵磷脂中的发色团则发生了变化。因此可使用紫外分光光度计测定复合物溶液中没食子酸含量;且由于磷脂在213 nm 处有吸收峰,易对没食子酸在227 nm 处的吸收峰造成干扰,选择268 nm处作为没食子酸的最大吸收波长,进行没食子酸含量的测定。

图3 没食子酸、大豆卵磷脂及其物理混合物和没食子酸-磷脂复合物的紫外全吸收光谱(a)和红外光谱(b)Fig.3 UV absorption spectrum (a) and Infrared spectrum (b)of gallic acid,soy lecithin,their physical mixture and gallic acid phospholipid complex
如图3b 所示,没食子酸红外光谱图中有-OH的特征峰(3 500 cm-1,3 280 cm-1处),C-O 特征峰(1 670 cm-1处),苯环骨架振动峰(1 430,1 540,1 610 cm-1处),HCR=CRH 苯环峰(687 cm-1)处,以及酚羟基的特征峰(1 030 cm-1);而大豆卵磷脂红外光谱图中的特征吸收峰有不饱和C 上H 的伸缩振动峰(3 010 cm-1),饱和C 上H 的伸缩振动(2 920 和2 850 cm-1处),C=O 碳氧双键特征峰(1 730 cm-1处)。
没食子酸与大豆卵磷脂的物理混合物的红外光谱为没食子酸和大豆卵磷脂两者特征峰的并集,既有没食子酸中-OH 的特征峰(3 500 cm-1),也有大豆卵磷脂中P-O-C 的特征峰(1 060 cm-1处),但峰强度减弱,且-OH 的特征峰(3 280cm-1处)消失,可能为没食子酸被大豆卵磷脂部分包裹遮蔽导致的。而没食子酸-磷脂复合物的红外光谱与物理混合物的光谱相近,也保留了没食子酸和大豆卵磷脂的部分特征峰,但峰强度较物理混合物更低,可能由于复合物中大豆卵磷脂对于没食子酸的包裹程度更高。此外,复合物光谱还发生了几处改变:没食子酸中苯环邻二取代的特征峰(735 cm-1处)以及-OH 的特征峰(3 280 cm-1处)消失;3 500 cm-1处同样代表-OH 的特征峰大幅减弱,且平移至3 460 cm-1处,可能为氢键导致的波动[16]。原存在于大豆卵磷脂中代表P-O-C 的1 060 cm-1处特征峰消失,1 170 cm-1处特征峰出现波数变小的平移,说明大豆卵磷脂中此结构有所改变,推测是该结构与没食子酸的羟基间发生相互作用,形成了氢键的结果[17]。即大豆卵磷脂的极性端与没食子酸的极性端相结合,形成没食子酸-磷脂复合物,这与前人研究[18]结果相符。
综合紫外与红外光谱分析,复合物中无新化学键生成,但没食子酸中苯环上中间位置的-OH 可能与大豆卵磷脂中的P-O-C 结构形成了氢键,标志并验证了复合物的形成。
2.2.2 差示量热扫描
没食子酸、大豆卵磷脂、没食子酸-磷脂复合物及其物理混合物的差示量热扫描图如图4 所示,没食子酸在263 ℃处有明显吸热峰,此峰对应其熔点;而大豆卵磷脂为非晶体,无固定熔点,其在230 ℃有吸热峰,在289 ℃、332 ℃处有放热峰;没食子酸与大豆卵磷脂的物理混合物的图谱基本为两者的DSC 图谱的简单叠加,没食子酸原在263 ℃的吸热峰以及大豆卵磷脂在230 ℃的吸热峰合并为一个吸热峰,移至了238 ℃处,可能是由于混合物“熔点降低”的现象,混合物的熔点会低于两纯净物熔点的平均值。而没食子酸-磷脂复合物的图谱不同于没食子酸、大豆卵磷脂和混合物的图谱,原没食子酸和大豆卵磷脂单体的吸热峰未合并,而是出现小范围的平移,且在255 ℃、270 ℃出现了新的吸收峰,具有其独特的特征曲线,故认为复合物是不同于没食子酸、大豆卵磷脂及两者物理混合物的新物质。


图4 没食子酸、大豆卵磷脂、两者物理混合物和没食子酸-磷脂复合物的差示量热扫描图Fig.4 DSC of gallic acid,soy lecithin,their physical mixture and gallic acid phospholipid complex
2.2.3 复合物的油水分配系数
分别测定没食子酸及其复合物在水相和有机相中的溶解度,计算油水分配系数,结果如表1 所示。与没食子酸相比,复合物在水中的溶解度降低,但其在有机相中的溶解度明显增加,油水分配系数出现了明显的增大,结合红外光谱结果推断,没食子酸极性基团与大豆卵磷脂的极性基团通过氢键结合且被磷脂脂肪链包裹,呈现亲脂性外层[19],使复合物可溶于低极性溶剂,因而显著提高了没食子酸的脂溶性,拓展了其应用范围。
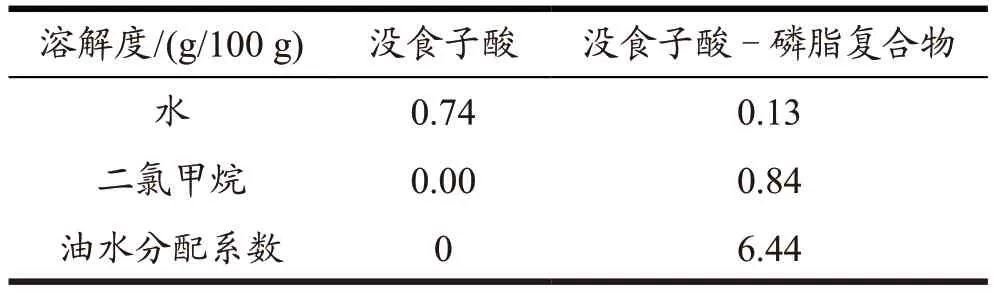
表1 没食子酸及其复合物的油水分配系数Table 1 The oil-water partition coefficients of gallic acid and gallic acid phospholipid complex
2.2.4 体外抗氧化能力
分别测定相同没食子酸当量浓度下不同物质对DPPH、ABTS+以及氧自由基吸收能力(ORAC),结果如表2 所示。大豆卵磷脂对于DPPH 和ABTS+两种自由基的清除能力均较弱,远低于另外两组;没食子酸与复合物对于DPPH 和ABTS+两种自由基的清除率无显著差异。样品的ORAC 值越高,即相对应Trolox 的当量越大,说明其氧自由基吸收能力越强。由表2 可知,没食子酸-磷脂复合物的氧自由基吸收能力与没食子酸无显著差异,而大豆卵磷脂几乎无氧自由基吸收能力。综上,与磷脂复合并未影响没食子酸的抗氧化能力,没食子酸-磷脂复合物依旧具有较强的抗氧化能力,有作为抗氧化剂的潜力。

表2 没食子酸、大豆卵磷脂及其复合物的体外抗氧化能力Table 2 The in-vitro antioxidant activity of gallic acid,phospholipid and gallic acid phospholipid complex
2.3 核桃油加速氧化
2.3.1 氧化指标
如图5a 所示,各组核桃油的过氧化值均随储藏时间而增加,表明加速氧化储藏期间,油脂初级氧化阶段生成的氢过氧化物大量积累,油脂氧化持续发生;没食子酸-磷脂复合物组的核桃油在第0 天的过氧化值明显高于其他各组,这可能是由于复合物所含的磷脂在复合物制备过程中发生轻微氧化[19],引入部分氢过氧化物,导致核桃油的过氧化值升高。而储藏12 d 后空白组、大豆卵磷脂组、没食子酸、没食子酸-磷脂复合物组酸价的增加量分别为0.025 5、0.025 0、0.023 0、0.013 0 meq/kg,其中没食子酸组增量小于空白组,复合物组的增量显著低于其余三组(P<0.05),表明没食子酸和复合物对核桃油氧化具有抑制作用,其中复合物的抑制能力显著强于游离没食子酸。12 d 储藏期内,各组核桃油的过氧化值均未超过GB2716-2018《食品安全国家标准植物油》所要求的0.25 meq/kg。

图5 加速氧化实验期间核桃油氧化指标变化Fig.5 Changes of walnut oil during accelerated oxidation experiments
各组核桃油酸价随储藏时间变化如图5b 所示,没食子酸组和没食子酸-磷脂复合物组的核桃油在第0 天的酸价明显高于另外两组,这可能是由于没食子酸结构中有羧基,呈酸性,导致油脂酸价上升,但未影响油脂中游离脂肪酸含量;而在整个储藏过程中,空白、大豆卵磷脂、没食子酸、复合物各组均随储藏时间增加而上升,是因为随时间变化油脂氧化程度升高,导致氧化产物游离脂肪酸含量升高;其中没食子酸组在第3 天的酸价有所下降,可能是由于没食子酸氧化降解速度大于油脂氧化生成脂肪酸的速度,导致油脂酸性略有降低,但不显著。12 d 储藏期内,各组增量分别为0.169 6、0.173 4、0.136 5、0.109 4 mg/g,增量大小顺序为:复合物组<没食子酸组<空白组<大豆卵磷脂组(P<0.05),说明大豆卵磷脂对核桃油酸价升高并无抑制作用,而没食子酸及其复合物可有效抑制核桃油酸价的升高,复合物的抑制效果优于没食子酸。12 d 储藏期内各组核桃油酸价均未超过GB2716-2018《食品安全国家标准植物油》所要求的3.0 mg/g。
综上,大豆卵磷脂对于核桃油氧化稳定性无显著影响,而复合物有效提高了核桃油的氧化稳定性,且表现出比没食子酸更优的抗氧化效果。而由于没食子酸-磷脂复合物与没食子酸相比,脂溶性增加,但体外抗氧化能力无显著差异,故认为是没食子酸-磷脂复合物通过提高没食子酸在核桃油中的溶解度,使其作用浓度更高,表现出更强的抗氧化效果,且与大豆卵磷脂复合在一定程度上增强了没食子酸的稳定性,延长了其在核桃油中的作用时间[21],在储藏期内充分发挥了其抗氧化作用,更有效地提高核桃油的氧化稳定性。
2.3.2 同步荧光光谱
储藏期间各组核桃油同步荧光光谱如图6 所示。由空白组荧光光谱(图6a)可知,核桃油在256、356、386、439 和667 nm 处有明显吸收峰,认为是核桃油的特征吸收峰[22]。研究显示,植物油同步荧光光谱中荧光强度的减弱通常与植物油中酚类抗氧化物质及色素的氧化降解有关,荧光强度的增强与植物油中不饱和脂肪酸降解所产生的氧化产物有关[23]。
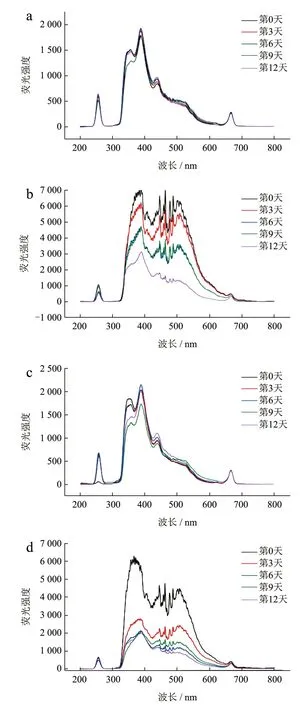
图6 加速氧化实验期间核桃油同步荧光光谱变化Fig.6 Changes in synchronous fluorescence spectra of walnut oil during accelerated oxidation experiments
在储藏过程中,空白组(图6a)386 nm 处吸收峰的荧光强度逐渐减弱,可能是由于油脂氧化时,脂肪酸里的C=O 键断裂[24],荧光基团的数量随之改变,导致荧光强度出现波动;而439 nm 处吸收峰荧光强度随储藏时间增长而增强,通常与油脂氧化产物:游离脂肪酸、氢过氧化物、酮醛类物质的产生有关[14],说明储存过程中,核桃油持续发生氧化,氧化产物随氧化进程积累。大豆卵磷脂组(图6c)同步荧光光谱形状及变化趋势与空白组相似,认为大豆卵磷脂对核桃油荧光光谱影响较小,即对核桃油氧化稳定性影响较小。
复合物组(图6d)荧光光谱与没食子酸组(图6b)较相似,除了与空白组(图6a)相同的256、356、386 和649 nm 处核桃油的特征吸收峰,还在361~381 nm 和421~507 nm 处有吸收峰群,认为可能是没食子酸的特征吸收峰;没食子酸组和复合物组的361~381 nm 和421~507 nm 处吸收峰群随时间变化峰值逐渐下降,可能是没食子酸在氧化过程中发生降解,含量降低,其特征吸收峰荧光强度随之下降[25]。
所有组别核桃油均在256 nm 和670 nm 处有吸收峰。有研究表明,256 nm 附近吸收峰为生育酚的荧光吸收峰[26],且其随着储藏时间延长出现轻微波动,可能是由于生育酚在多不饱和脂肪酸含量高的油脂中可作为共同氧化底物[14],随油脂氧化部分消耗;而670 nm 处的吸收峰属于叶绿素类特征吸收峰的荧光区[27],且其荧光强度不随储藏时间而变化,表明核桃油中含有少量叶绿素,且未参与油脂氧化。
2.3.3 色泽
各组核桃油色泽随储藏时间变化,如图7 所示。
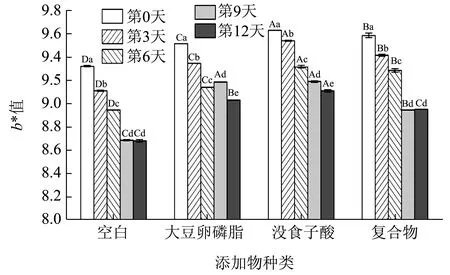
图7 加速氧化实验期间核桃油色泽变化Fig.7 Changes in color of walnut oil during accelerated oxidation experiments
加入没食子酸和复合物的核桃油L*值较低,说明没食子酸的加入导致了核桃油的澄清度一定程度的降低。从第0 天到第12 天,所有样品的L*值逐渐上升,即随时间变化,油脂氧化程度升高,油脂的清亮程度随之升高,但这种变化在肉眼上不易察觉。
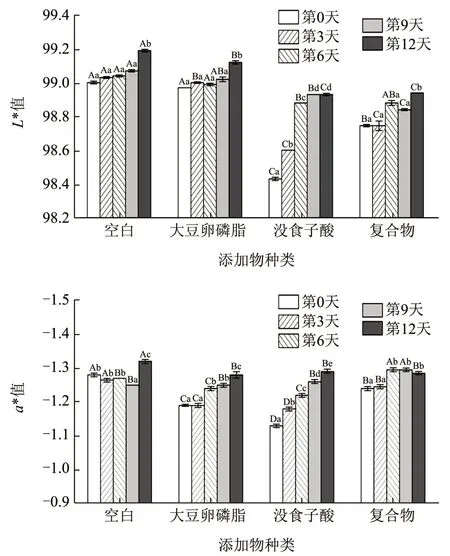
从第0 天到第12 天,所有样品的a*值均为负值,表明核桃油颜色偏绿;空白组a*绝对值逐渐下降后又上升,大豆卵磷脂和没食子酸组a*绝对值逐渐上升,说明核桃油变绿;可能是氧化造成色素的变化,复合物组有先上升后下降的波动,但整个加速氧化过程中,a*值的总体变化较小,在肉眼上很难察觉。
所有样品组的b*值从第0 天到第18 天均逐渐下降,说明油脂黄色变淡,可能是由于黄色色素随氧化进程而被分解,但数值变化量较小,此变化肉眼几乎无法察觉。计算储藏前后b*值的差值可知,大豆卵磷脂、没食子酸及其复合物均可以有效减缓油脂b*值的下降趋势。
2.3.4 相关性分析
计算各指标间的相关系数,如表3 所示。

表3 各组别核桃油不同指标间相关性分析Table 3 Correlation coefficients between indicators of walnut oil in various groups
所有组别中AV 与b*值的相关系数均为负数且绝对值均大于0.8,即油脂的酸价与黄蓝色度两者呈负相关。所有组别中,POV 值与b*的相关系数均为负值,认为两者呈负相关,且大豆卵磷脂与没食子酸组的相关系数绝对值大于0.9,空白组相关系数的绝对值大于0.8,认为油脂的黄蓝色度与过氧化值呈负相关。故油脂黄蓝色度可以作为油脂氧化程度的判断指标,油脂b*值越小,偏黄色程度降低,油脂的氧化程度越高。
由于没食子酸抗氧化性强于常见的抗氧化剂维生素C[28],而没食子酸-磷脂复合物和没食子酸相比,能更有效地提高核桃油的氧化稳定性,且对油脂色泽影响较为轻微,故没食子酸-磷脂复合物抗氧化性能较强,非常具有作为油脂抗氧化剂的潜力。
3 结论
本实验采用大豆卵磷脂为原料,使用溶剂蒸发法制备没食子酸-磷脂复合物。以复合率为指标,使用单因素试验方法优化并获得了一种没食子酸-磷脂复合物的制备工艺:以无水乙醇为溶剂,按没食子酸质量浓度1 mg/mL,没食子酸:大豆卵磷脂摩尔比为1:4 投料,在45 ℃下搅拌反应2 h;该工艺下所得复合物复合率可达94.65%。通过对该工艺下制备所得的复合物进行表征,验证了复合物的形成;复合物的油水分配系数较没食子酸明显提高,表现出良好的脂溶性,且其体外抗氧化活性强,与没食子酸无显著差异。加速氧化实验结果表明,没食子酸-磷脂复合物能有效抑制核桃油氧化,提高了核桃油的氧化稳定性;且在储藏期间(12 d)较游离没食子酸具有更好的抗氧化效果,具有做抗氧化剂的潜力。这可能是由于复合物增加了没食子酸在油中的溶解度,使其作用浓度更高,且复合结构增加了其稳定性,延长了没食子酸在油中的作用时间。综上,没食子酸-磷脂复合物脂溶性良好,抗氧化能力强,极具作为抗氧化剂的潜力,在脂类食品基质中具有良好应用前景。
致谢
特别感谢由云南源临尚品食品有限公司慷慨提供的鲜榨核桃油样品。

