大曲耐热细菌富集及其在小曲白酒中的应用
应超,任志强,2,曾波,黄治国,2,张运祺,卫春会,2*
(1.四川轻化工大学酿酒生物技术及应用四川省重点实验室,四川宜宾 644000)(2.中国轻工业酿酒生物技术及智能制造重点实验室,四川宜宾 644000)
酒曲是白酒发酵生产的主要动力来源,它决定了白酒的质量,想酿造出好酒,第一步就是要做好曲。近年来白酒企业对白酒酿造用曲中微生物群落结构组成和功能的研究日益增多[1],目前曲药使用最多的是大曲和小曲。大曲是由小麦为主要原料制成的含有多种微生物菌群和功能酶的曲块,是酿造浓香型大曲酒的糖化发酵剂,为酿造过程提供一些风味物质或风味前体物质[2]。小曲是用米粉或米糠为主要原料,在控制温湿度的条件下,接一定量的母曲培养而成的体积较小的酒曲。小曲作为一种复合的糖化和发酵剂,主要依赖于其中含有的微生物群落,如酵母菌、霉菌、细菌,虽存在多种微生物,但也存在酒体单薄的问题[3]。而且曾祖训等[4]在对川法小曲清香白酒的研究中发现,川法小曲酒还存在着高级醇含量高的问题。
白酒的生产是利用群体微生物组合发酵的过程,优质的功能微生物菌群是发酵的关键之一[5]。郑自强等[6]将从大曲中筛选出的高产糖化酶菌株制备成霉菌麸曲,通过固态发酵酿造性能测试发现其有突出的发酵能力,显著提高了出酒率。刘小改等[7]从大曲中筛选出具有产香功能的细菌菌株,将其应用于麸曲白酒酿造,发现其发酵液中挥发性香气成分丰富,具有较强产香能力。大曲高温制曲的工艺富集了大量耐热细菌,保证了酿酒的糖化、生香、发酵过程,对白酒风味有积极作用[8]。而目前鲜有利用大曲中耐热细菌菌群应用到小曲白酒酿造过程中的的研究。Xia 等[9]对大曲微生物群落进行解析发现,嗜热芽孢杆菌属和芽孢杆菌属,在大曲中表现出较高的相对丰度,并且发现大曲不同微生物群落在不同参数培养过程中表现出不同的能力。周平等[10]从中高温大曲中分离出一株耐热能力较好的NR2 细菌,通过发酵特性研究,发现白酒风味物质的形成与NR2 细菌的代谢特性有关。耐热细菌是白酒酿造的重要功能菌群,其为白酒酿造过程提供蛋白酶、淀粉酶、纤维素酶等丰富的酶系,也对白酒风味物质的产生有重要的影响[11,12]。其中地衣芽孢杆菌尤为重要,是小曲白酒中的重要产香功能微生物,理论上将大曲中的耐热细菌运用到小曲白酒酿造中能提升其酒体质量。
本研究围绕着大曲中耐热细菌菌群在小曲白酒酿造中的应用开展试验,通过制成不同高温条件下的富集液,筛选出目的耐热细菌菌群。因为大曲富集液量少且不易保存,而麸皮因其含有充足的营养物质,是制曲、培菌最优良的原料,通过将功能耐热细菌菌群制成麸曲结合16S rDNA 测序技术对功能菌群进行鉴定,通过改变水分质量分数对功能麸曲培养进行优化,并通过小曲酒固态酿造试验,探究大曲中不同高温条件下的耐热细菌富集液制备的功能麸曲对小曲白酒的影响,为应用研究提供理论基础。
1 材料与方法
1.1 材料与试剂
大曲样品:取自川南某浓香型酒厂某制曲车间。
麸皮和糯高粱:市售。
试剂及耗材:葡萄糖(分析纯)、NaCl(分析纯)、胰蛋白胨、酵母提取物、琼脂粉,北京双旋微生物培养基制品厂;乙酸、乳酸、乙酸正丁酯(均为色谱纯),天津光复精细化工研究所;无水乙醇(色谱纯),南京化学试剂股份有限公司;甲醇(色谱纯),北京迪科马科技有限公司;固相微萃取头(30/50 cm DVB/CAR/PDMS),美国Supelco。
1.2 仪器与设备
JE2002 电子分析天平,上海浦春计量仪器有限公司;CI54DS 立式自动压力蒸汽灭菌锅,致微仪器有限公司;LS-1201 生化培养箱,上海三发科学仪器有限公司;JJ-CJ-2FD 超净工作台,苏州净化设备厂;Labserv-LS-0610 电热恒温干燥箱,上海一恒科仪器有限公司;5430R 高速冷冻离心机,德国Hettich 公司;7890A-5975B 气相色谱-质谱联用仪,美国Agilent 公司。
1.3 培养基
LB 培养基(Luria-Bertani,LB):胰蛋白胨10 g,酵母粉5 g,氯化钠10 g,蒸馏水定容至1 L,pH 值(7.3±0.1),121 ℃蒸汽灭菌20 min。
1.4 试验方法
1.4.1 样品采集
样品采集自中国西南部长江流域一个浓香型酒厂,从该企业随机采集六块具有大曲典型感官特征的同批次大曲。
1.4.2 微生物群落分析
样品DNA 的提取,根据改良的CTAB 法[13]进行总DNA 提取,并通过NanoDrop 2000 进行检测,判断DNA 是否存在RNA 和蛋白质污染,检测DNA 提取质量采用体积分数1%琼脂糖凝胶电泳。参照电泳初步定量结果,将产物送到上海美吉生物技术有限公司进行PCR-DGGE 高通量测序,用于后续分析。
1.4.3 耐热细菌的富集
大曲耐热细菌最适温度在55 ℃左右,最高温度一般不会超过70 ℃,所以本实验富集55、60、65 ℃三个温度下的耐热细菌。分别称取三份粉碎后的大曲样品10.0 g,在无菌条件下加入到带有90 mL 无菌水的锥形瓶中,摇匀,分别置于设置温度为55、60、65 ℃的恒温水浴摇床,振荡培养24 h,制成大曲富集液。
1.4.4 大曲中耐热细菌的应用
1.4.4.1 麸曲的制作
麸曲的制作工艺流程[14]如下:
麸皮→加水→拌曲→蒸麸→冷却→接种→拌匀→培养→干燥→粉碎→保存
原料处理:称取麸皮原料于容器中,按需加入无菌水,让麸皮充分吸水,混合均匀后,使用蒸汽处理30~60 min。
麸曲制作:将大曲高温富集液,按一定的添加量,接种于蒸煮后的麸皮中,自然升温至顶温,在该温度范围保持1~5 d,至麸曲微黄,有光泽,略带氨味,进行通风干燥至质量分数8%~12%的含水量,粉碎,制成耐热细菌麸曲。
1.4.4.2 麸曲细菌生物量
麸曲培养完成后,采用稀释平板计数法[15]进行细菌计数,操作步骤如下:
(1)称取1 g 粉碎曲样加到含有100 mL 无菌水的250 mL 无菌三角瓶中,无菌封口膜封口,4 ℃水浴摇床震荡30 min。
(2)吸取100 μL 菌液到1.5 mL 无菌EP 管,加入900 μL 无菌水,取稀释倍数为104~107进行计数。
(3)吸取100 μL 稀释菌液在LB 培养基上进行涂布,倒置培养24 h,菌落计数,每组3 个平行。有效结果区间为30~300 CFU。
以细菌生物量说明耐热微生物是否能够利用麸皮得以生存和繁殖,并以生物量对麸曲质量进行评判,生物量越大越有利于实际生产节约成本。
1.4.4.3 含水量对耐热细菌的影响
按照麸曲的制作工艺,将润料后的麸曲含水质量分数分别控制在45%、50%、55%、60%、65%、于35 ℃、湿度90%的条件下培养,每天观察其生长情况,5 d 后装入托盘,低温干燥后粉碎并计算麸曲中的生物量,确定麸曲制作最佳含水量[16]。
1.4.4.4 酿酒试验
工艺流程为:
高粱→挑选→清洗、去杂→粉碎→润粮→初蒸→闷粮→复蒸→摊凉→下曲→25 ℃培菌→密封→30 ℃发酵→蒸馏
参照小曲清香型白酒酿造工艺[17],结合实验室环境及条件,以高粱为原料,5 L 保温桶为发酵容器,每桶3 kg 高粱,添加质量分数0.5%某市售小曲,添加质量分数0.3%耐热细菌麸曲,发酵15 d,发酵结束蒸馏后,参照《酿酒分析与检测》中的方法测定出酒率[18]。
下曲:由于麸曲主要以细菌为主,缺乏霉菌和酵母的作用,淀粉可能无法正常进行糖化发酵。因此添加市售小曲,并按曲与粮重之比接种下曲,设计质量分数0.5%某市售小曲和质量分数0.3%的耐热细菌麸曲为试验组,质量分数0.5%某市售小曲和质量分数0.3%蒸煮过后的麸皮为对照组。
1.4.5 挥发性风味物质成分测定
1.4.5.1 气相色谱质谱条件
气相色谱条件:DB WAX(60 m×0.25 mm×0.25 μm)色谱柱,载气为高纯He,流量1 mL/min,不分流,进样口温度230 ℃,升温程序:初始温度为40 ℃,保留1 min,然后以5 ℃/min 升温至230 ℃,保持30 min。
质谱条件:电子离子源(EI),70 eV 电子能量,采集模式为全扫描,质量范围20~550 u,离子源温度230 ℃,四级杆温度150 ℃,接口温度230 ℃[19]。
1.4.5.2 样品测定
取样液900 μL 于进样瓶中,加入2 mg/mL 的2-辛醇内标溶液、3 mg/mL 的乙酸戊酯内标溶液各50 μL,混匀,上机进样。
1.4.6 数据处理
试验结果用平均值±标准差表示,采用Origin、Excel 作图以及SPSS 19.0 软件对试验数据进行方差分析,每组试验均重复3 次。
2 结果与分析
2.1 大曲、大曲富集液及麸曲菌群结构
2.1.1 大曲、大曲富集液及麸曲菌群的α-多样性
多样性分析主要研究样本的群落多样性,对样品微生物群落进行多样性指数分析,可以获得环境群落中物种的丰富度、多样性等信息[20-22]。本研究分析了大曲、大曲富集液及麸曲菌群的α-多样性,结果如表1 所示,所有样品序列数均超过30 000 条,大曲、大曲富集液及麸曲的序列数无显著差异,检测结果能够体现各样品群落多样性的真实情况。从样品物种丰富度(Ace 指数、Chao 指数)可以看出,大曲物种丰富度最高,65 ℃的大曲富集液物种丰富度最低,在不同高温的大曲富集液制成的麸曲当中,来源于大曲55 ℃菌群的麸曲物种丰富度最高。从样品群落多样性(Shannon 指数、Simpson 指数)可以看出,大曲以及麸曲的群落多样性更高,其中大曲群落多样性最高,65 ℃的大曲富集液群落多样性最低,与物种丰富度结果保持一致。样品群落的多样性结果为:大曲>麸曲>大曲富集液,而且随着温度升高,大曲富集液与麸曲群落多样性降低。表明了大曲中的微生物多样性最高,富集液经过了高温的处理使得大部分微生物无法生长与繁殖导致丰富度降低,而麸曲的物种丰富度增加,受到制曲原料以及环境影响,具体原因还需要进一步研究。
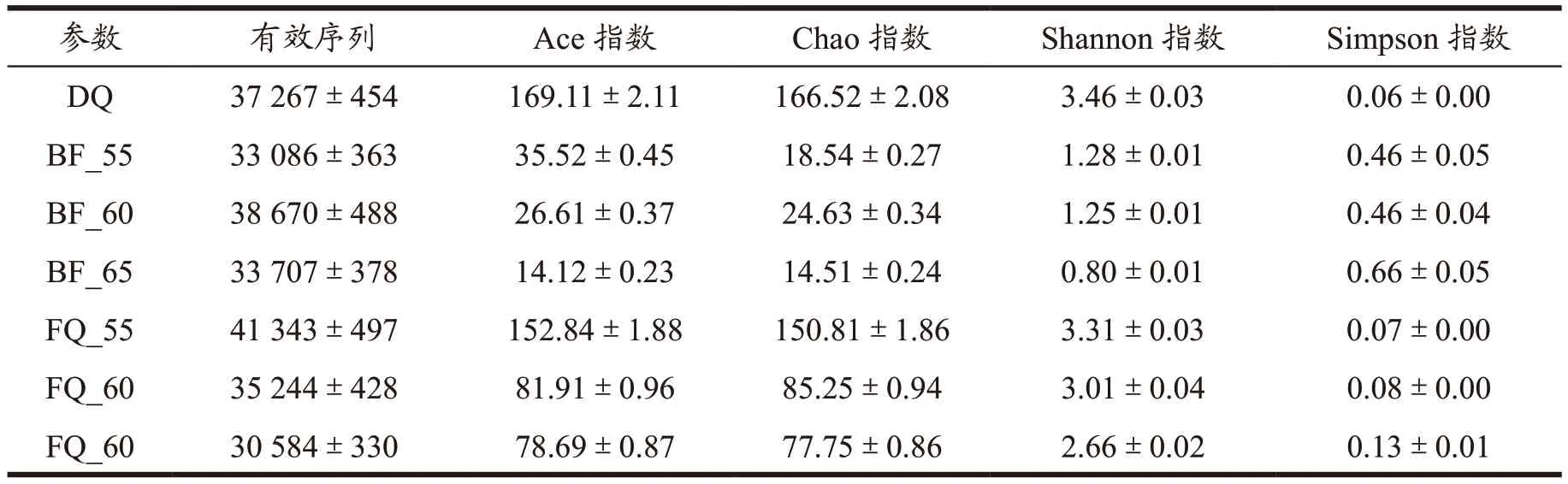
表1 大曲、大曲富集液及麸曲菌群α多样性Table 1 Daqu,Daqu enrichment liquid and α diversity of bran koji flora
2.1.2 大曲、大曲富集液及麸曲菌群的物种组成分析
Venn 可以统计多个样品中所特有和共有物种的数量,可以直观地显示样品物种组成的相似性和重叠性。本研究在属水平上对大曲、大曲富集液及麸曲菌群的物种组成分析。由图1a 所示,大曲中有最多的物种组成,有51 个独有的属,麸曲中有30 个独有的属,大曲富集液有5 个独有的属,它们共同拥有两个属,按物种多样性的数量排序为:大曲>麸曲>大曲富集液,经过高温的富集处理后物种数快速下降,而制作成的麸曲物种组成增加,原因可能是受原料和环境因素的影响。由图1b 所示,在属水平上对不同温度下的大曲富集液和麸曲分析,大曲富集液随着富集温度的升高它的物种组成数逐渐降低,且65 ℃条件下的大曲富集液没有独有的属,耐热细菌麸曲也随着温度的升高独有的属逐渐降低,它们共同拥有1 个属。
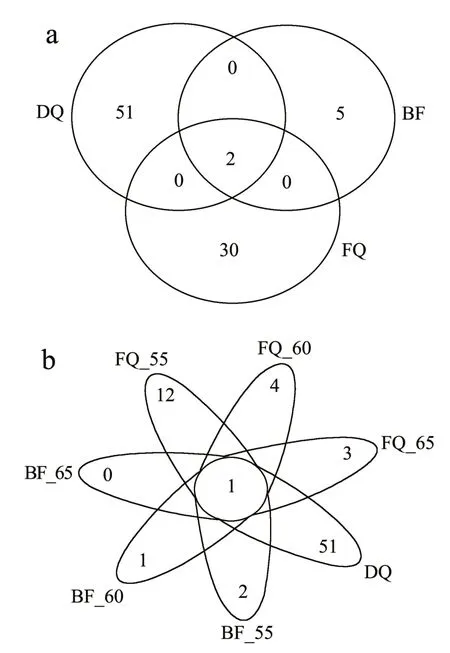
图1 大曲、大曲富集液及麸曲群落结构Venn图Fig.1 The Venn diagram of Daqu,Daqu enrichment liquid and bran community structure
2.1.3 大曲、大曲富集液及麸曲菌群Bar 图分析
根据群落Bar 图,可以直观看出各样本在某一分类学水平上含有何种微生物,以及样本中各微生物的相对丰度。对大曲、大曲富集液及麸曲的群落Bar 图分析,得到排名前4 的门、前20 的属及前23 的种。
基于门水平对样品进行分析,由图2 可知,其中占主导地位的都是Firmicutes(厚壁菌门),其中Firmicutes 在大曲富集液中最多,相对丰度为99.78%~99.90%,麸曲中Firmicutes 相对丰度为77.24%~77.18%,并随着富集温度的升高相对丰度含量逐渐上升,而大曲Firmicutes 相对最少,相对丰度为64.42%。Firmicutes 是一大类细菌,大多数为革兰氏阳性,细胞壁由一层厚厚的肽聚糖组成,厚壁菌大多能产生芽孢,能抵抗脱水和极端环境。Proteobacteria(变形菌门)在麸曲中最多,相对丰度为20.03%~28.33%,随着富集温度的升高其相对丰度逐渐降低,在高温大曲中相对丰度为17.39%,在大曲富集液中含有极少量,Proteobacteria 是细菌中最大的一门,包括很多病原菌,所有的Proteobacteria 细菌为革兰氏阴性菌,其外膜主要由脂多糖组成,Actinobacteria(放线菌门)在高温大曲中相对丰度为16.85%,在麸曲中相对丰度为0.55%~2.66%,并随富集温度上升相对丰度含量逐渐上升,在大曲富集液中含有极少量。
进一步进行属水平分析,由图3 可知大曲样品中,主要以Bacillus(芽孢杆菌属)相对丰度11.71%、Weissella(魏斯氏菌属)相对丰度18.46%、Thermoactinomyces(高温放线菌属)相对丰度16.20%及Rhodococcus(红球菌属)相对丰度17.39%为主。随着高温富集,大曲富集液中Bacillus占到主导地位相对丰度为96.24%~99.76%,制作为麸曲Bacillus占比有所下降,相对丰度为45.34%~63.14%。

图3 群落结构Bar图(属水平)Fig.3 Bar diagram of community structure (genus level)
最后,为验证大曲耐热细菌菌群是否复刻到麸曲当中,基于种水平对大曲与麸曲样品菌群结构进行比较分析,由图4 可知,主要以无法归类Bacillus(芽孢杆菌)和Weissella(魏斯氏菌)等细菌为主。Bacillus是酿酒过程中的重要的功能菌,为白酒酿造过程提供蛋白酶、淀粉酶、纤维素酶等丰富的酶系,这些酶系推动原料分解,形成丰富的氨基酸与糖类,对白酒风味物质的产生有重要的影响[23,24]。Bacillus较大,该菌的重要特征是能够产生对不利条件具有特殊抗性的芽孢,分布极为广泛。Weissella是一种重要的乳酸菌,广泛分布于发酵制品中,有研究表明,Weissella具有良好的发酵特性,能够缩短食品发酵进程,可发酵糖类、碳水化合物产生乳酸、醋酸、二氧化碳和乙醇等物质,有助于提高发酵制品的品质,改善发酵制品的风味[25,26]。Weissella无芽孢形成,最适的生长pH 值为3.0~9.5,在兼性厌氧环境中生长情况最佳[27]。经过高温富集、接种处理后,使原来大曲中的Bacillus相对丰度从11.65%提升麸曲中的45.24%~63.14%,且在一定范围内随着富集温度的升高,细菌占比越大,说明将大曲中的功能耐热细菌成功的复刻到了麸曲当中,并占到了主导地位。

图4 群落结构Bar图(种水平)Fig.4 Bar diagram of community structure (species level)
2.2 水分质量分数对麸曲中耐热细菌的影响
在制曲过程中,含水量是麸曲制作中非常重要的参数,适宜的含水量可以促进微生物生长和代谢,提高麸曲的品质和发酵效果,而过高或过低的含水量则会影响微生物的生长和代谢,导致麸曲的质量下降或者无法发酵成功[28]。生物量可以反映微生物在麸曲中的数量和代谢活性,进而反映出麸曲中微生物的生长状态和发酵能力,故将耐热细菌菌群接种到麸皮当中,以生物量为指标,探究水分质量分数对麸曲中耐热细菌菌群的影响,结果如图5 所示,随着含水量的增加麸曲中整体细菌数呈先增后缓慢下降的趋势,在相同的水分质量分数,麸曲细菌数随着富集温度的升高而增加,而且在水分质量分数为45%时细菌数均为最低值,与55%及以上水分质量分数呈现显著差异(P<0.05),说明水分质量分数在相对较低时,培养效果一般,对细菌生物量影响较大。55 ℃的耐热细菌麸曲在水分质量分数为50%时细菌数达到最大值,60 ℃以及65 ℃的耐热细菌麸曲在水分质量分数为55%时细菌数达到最大值,当水分质量分数大于55%时细菌数呈现出缓慢下降的趋势,且变化趋势不大,说明在含水量较大时,在一定范围内,水分质量分数对麸曲中的细菌生长影响不大,55 ℃的耐热细菌麸曲细菌数在水分质量分数为45%时与其他水分质量分数存在显著差异(P<0.05),在水分质量分数为50%时细菌数达到最大为5.61×1010CFU/g。60 ℃的耐热细菌麸曲的细菌数在水分质量分数为55%时达到最大为7.26×1010CFU/g,65 ℃的耐热细菌麸曲的细菌生物量在水分质量分数为55%时达到最大为8.52×1010CFU/g。将BF_55、BF_60 以及BF_65 在水分质量分数为55%时做出的麸曲命名为FQ_55、FQ_60 以及FQ_65,对比于大曲中的细菌数8.72×106CFU/g,FQ_65 细菌数提升接近1 万倍,并以此麸曲展开酿造试验。
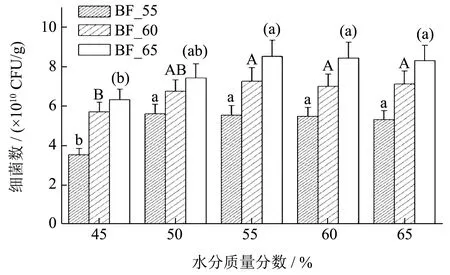
图5 不同水分质量分数条件下麸曲中细菌数Fig.5 The number of bacteria in bran koji under different moisture content conditions
2.3 耐热细菌在小曲酒酿造中的应用
2.3.1 耐热细菌麸曲对小曲酒出酒率的影响
对于大曲耐热细菌制作而成的麸曲功能的探究,需进一步设计更接近实际生产的试验来进行验证。故本试验将大曲中的耐热细菌群落应用到小曲白酒的生产过程中,以期提高小曲白酒的质量。各组出酒率结果如图6 所示,整体出酒率在38%~40%之间,能达到良好的酿造效果,说明了该酿造工艺的可行性。添加不同温度富集液制作的麸曲,对小曲酒的原料出酒率有一定的提高,随着富集温度的升高出酒率呈现逐渐升高的趋势。其中添加不同耐热细菌麸曲的小曲白酒出酒率均与对照组达到显著水平(P<0.05),使用65 ℃的耐热细菌麸曲出酒率最高,为39.67%,相较对照组出酒率提高了3.7%。说明在小曲酒发酵过程中添加适当的富集于大曲中的耐热细菌,可以提高小曲白酒的出酒率。耐热细菌使小曲白酒出酒率增加的主要原因是大量细菌分解原料中的淀粉,将淀粉转化为可被酵母菌利用的糖类物质。此外,大曲中的优势细菌还可以分解原料中的其他复杂有机物质,可以生成有机酸,调节发酵液中的pH 值和其他环境因素,为酵母菌提供更适宜的生长环境,帮助酵母菌更好地生长和发酵,从而提高了出酒率。因此,耐热细菌在小曲白酒酿造过程中发挥着重要的作用,对提高白酒的出酒率起到了关键的作用。

图6 不同耐热细菌麸曲对小曲酒出酒率影响Fig.6 Effect of different heat-resistant bacteria bran on liquor yield of Xiaoqu liquor
2.3.2 耐热细菌麸曲对小曲酒高级醇和总酯的影响
高级醇与酯类物质都是小曲白酒中重要的香味成分,也是呈味物质,直接影响白酒的品质,因此对小曲白酒中高级醇以及酯类含量的控制至关重要。对小曲白酒中高级醇以及总酯含量测定,结果如表2 及图7 所示,小曲白酒中高级醇主要以异戊醇为主,相比于对照组,添加不同耐热细菌的麸曲,对小曲酒中的高级醇和总酯含量有一定的影响。随着富集温度的升高,小曲酒中高级醇含量逐渐降低,而酯类物质呈现逐渐上升的趋势。其中用65 ℃耐热细菌麸曲酿造的小曲白酒,高级醇含量最低,为0.96 mg/mL,较对照组高级醇含量降低27.27%,酯含量最高,为0.97 mg/mL,较对照组酯含量增加23.07%,与对照组均达到显著水平(P<0.05)。原因可能是原料中的淀粉会被细菌和酵母分解为糖类物质,随后,酵母菌会将这些糖类物质转化为酒精和二氧化碳。在这个过程中,细菌会释放出一些有机酸等物质,这些物质与酒精和其他物质发生酯化反应,从而形成了酯类物质,使小曲白酒中酯类物质的增加。小曲白酒中高级醇含量的降低,可能与细菌的代谢过程有关。细菌和酵母对于不同种类的有机物质的代谢能力是不同的,一些细菌更擅长将糖类物质转化为酒精,而减少了对于一些高级醇的生成。王亚平等[29]探究影响高级醇生成的因素,发现随着大曲用量的增加,高级醇含量明显下降,黄治国等[30]将从大曲中筛选出的2 株芽孢杆菌通过做成麸曲的形式,应用到小曲白酒酿造过程中,发现能有效降低小曲白酒中的高级醇含量,与试验结果相符。因此,在小曲酒发酵过程中,添加适当大曲中的耐热细菌,可以适当降低小曲酒中的高级醇,提高酯类物质的含量,进一步可以达到合理的醇酯比,从而提高小曲白酒的品质。

图7 耐热细菌对小曲酒中高级醇及总酯含量影响Fig.7 Effects of heat-resistant bacteria on contents of higher alcohols and total esters in Xiaoqu liquor
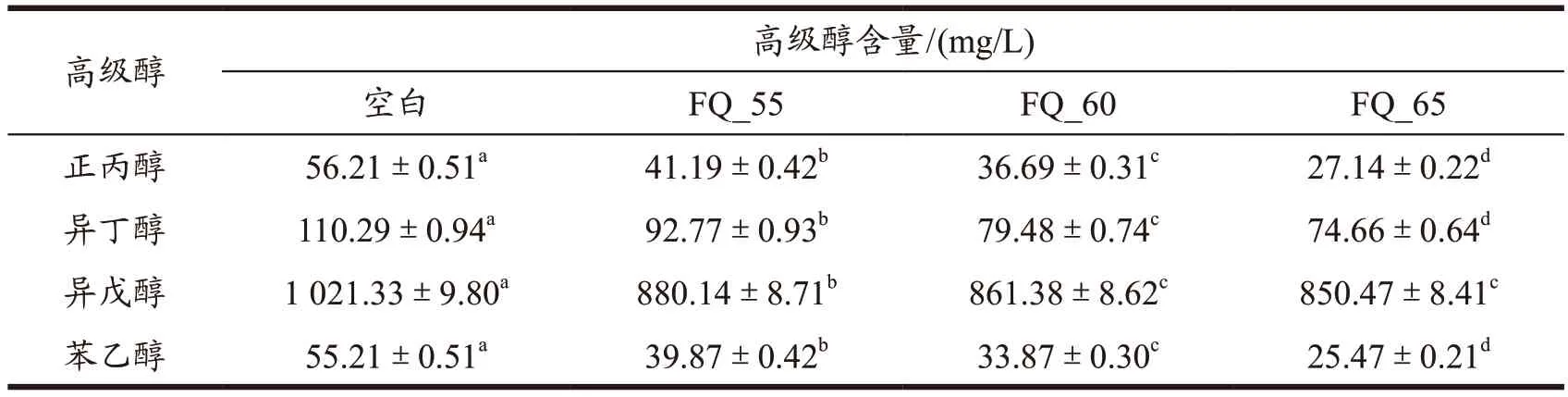
表2 不同耐热细菌对小曲酒中高级醇含量影响Table 2 Effects of different heat-resistant bacteria on the content of higher alcohols in Xiaoqu liquor
3 结论
本研究是从大曲中分离富集三种高温条件下的微生物菌群,并在55%含水质量分数条件下,制成了三种细菌生物量可达5.61×1010CFU/g~8.31×1010CFU/g 的麸曲FQ_55、FQ_60 和FQ_65,对比大曲中的细菌数8.72×106CFU/g 有显著提升。将样品通过16S rDNA 测序技术对样品菌群进行比较分析,发现经过高温富集并接种至麸曲后,使原来大曲中Bacillus(芽孢杆菌)相对丰度从11.65%最大提升到麸曲中的64.22%。说明大曲中的优势耐热细菌被成功复刻到了麸曲中,并占主导地位。通过小曲酒酿造试验发现,三种耐热细菌麸曲的产酒能力均大于对照组,且在一定范围内随着富集温度的升高而增强。另外,细菌生物量最高的FQ_65 所酿造的小曲白酒相较于对照组,出酒率提高了3.7%,高级醇含量降低27.27%,酯含量增加23.07%,而且在一定范围内,富集温度越高对小曲白酒质量提升越大。研究表明,将中高温大曲中的耐热细菌通过麸曲为媒介应用到小曲白酒生产过程中,制作出的麸曲具有丰富的细菌生物量,应用于小曲白酒可以降低高级醇,增加酯类物质,可提升小曲酒质量小曲酒酿造过程中使用大曲优势耐热细菌菌群,在一定范围内可以提高小曲白酒质量,为小曲白酒的质量提升及生产工艺的改善提供理论基础。

