放线菌酮对小球藻的毒性效应及其机制研究
李光鑫 高强 尤明涛 孙卫玲 沈宏 祁得林 杨希


摘 要:为探究抗生素对藻类的毒性效应与机制,以放线菌酮(cycloheximide,CHX)为潜在污染物,以小球藻为受胁迫对象,通过检测小球藻细胞密度、叶绿素a(chlorophyll a)、活性氧(reactive oxygen species,ROS)、丙二醛(malondialdehyde,MDA)和PSⅡ最大光化学量子产量(optimal/maximal quantum yield of PSⅡ,Fv/Fm)等生长及生理生化指标,探究抗生素对藻类的毒性效应.研究结果表明CHX对于小球藻的96 h EC50为1.229 mg/L.在该质量浓度下作用96 h后,CHX对小球藻细胞密度的抑制率为49.7%,使叶绿素a的含量降低了36.2%,对Fv/Fm的抑制率为13.0%.此外,与对照相比,CHX暴露使小球藻的ROS和MDA分别上升了533.7%和618.6%.因此,CHX对小球藻的毒性效应主要体现为生长抑制,其可能的机制是引起氧化应激(如产生ROS和MDA),进而抑制细胞的光合作用(降低Fv/Fm).
关键词:放线菌酮;小球藻;毒性效应;Fv/Fm
中图分类号:Q178.1 文献标志码:A文章编号:1000-2367(2024)03-0043-07
抗生素(antibiotics)是现代医疗的重要药物,是通过与细菌靶标的特异性作用来抑制或杀死细菌的有机分子[1].中国是抗生素的生产和使用大国,每年的使用量高达21万t,其中约18万t被用于农业和医药领域,出口约3万t[2].美国每年使用的2.27万t抗生素中50%被用于人类疾病治疗,另外50%被用于畜牧和水产养殖行业[3].在2000至2015年间,全球抗生素消费量就已经增加了65%,据推测2030年全球抗生素消费量将比2015年高出200%[4].然而,研究表明抗生素在人畜体内不能被完全吸收,约有30%~90%以尿液、粪便的形式排出体外[5-6];同时,大多数抗生素具有良好的水溶性,容易通过地表水进入湖泊、河流等水环境中[7].抗生素结构稳定,在水体中很难被生物降解,从而导致其在水体中呈“假持久性”,随时间积蓄从而加剧其对于水生态系统的污染[8].因此,研究抗生素对水生生物的毒性效应具有重要意义.放线菌酮(cycloheximide,CHX)又叫环己亚胺,是从链霉菌(Streptomyces griseus)中提取出的.放线菌酮可以作用于80 s核糖体,对真核生物的信使RNA翻译合成过程起到抑制作用,而对已经合成的蛋白质无影响[9].因此,放线菌酮通常不用于医疗目的,常用于农业生产中,可以加快叶柄自然脱落从而便于果实采摘[10],也可以用于防止植物的褐化[11-12].随着农业生产中的广泛应用,放线菌酮不可避免地随着灌溉和降雨等过程进入水生态系统,对水生态系统具有潜在的威胁.
作为水生态系统的初级生产者,藻类对污染物的响应敏感,是毒理学研究中常用的受试生物[13].小球藻
收稿日期:2023-04-07;修回日期:2023-05-06.
基金项目:国家自然科学基金(51879001).
作者简介:李光鑫(1996-),男,山东临沂人,青海大学硕士研究生,研究方向为微生物生态学,E-mail:liguangxinlgx@foxmail.com.
通信作者:杨希,E-mail:yangxi1405@foxmail.com.
引用本文:李光鑫,高强,尤明涛,等.放线菌酮对小球藻的毒性效应及其机制研究[J].河南师范大学学报(自然科学版),2024,52(3):43-49.(Li Guangxin,Gao Qiang,You Mingtao,et al.The research of toxic effects and mechanisms of cycloheximide on Chlorella sp.[J].Journal of Henan Normal University(Natural Science Edition),2024,52(3):43-49.DOI:10.16366/j.cnki.1000-2367.2023.04.07.0001.)
是由贝耶林克首次分离到的一种绿色微藻[14].小球藻自被发现以来由于其生長周期短、易培养等特点[15],常用于毒理学研究[16].本文选取放线菌酮作为潜在污染物,以小球藻作为受试对象,探究放线菌酮毒性效应,为评估其对水环境中水生生物毒性风险提供科学依据.
1 材料与方法
1.1 实验材料
本实验所用的藻种小球藻(Chlorella sp. FACHB-9)来自中国科学院水生生物研究所藻种库,所用培养基为BG-11[17].实验所用标准品CHX购买自上海安谱实验科技股份有限公司.
1.2 实验方法
CHX半数效应浓度(EC50)的确定:参照YOU等[18]的方法将CHX母液加入BG-11培养基中与小球藻进行共培养.CHX的质量浓度梯度设置为0.00、0.05、0.10、0.25、0.50、1.00、5.00 mg/L.藻种初始浓度设为105~106 mL-1,每组3个平行,光照强度2 500 lx,光暗时间比12 h∶12 h.培养96 h后取1 mL藻液通过流式细胞仪进行计数.
实验设计:预先配制CHX母液(100 mg/L),以EC50质量浓度添加至1 L BG-11培养基中,同时将处在对数生长期的小球藻按照初始浓度1×106 mL-1 接种至相同体系中.在光照强度为2 500 lx,光照周期比为12 h∶12 h条件下按照藻类抑制标准方法连续培养96 h[19].对照组和对照组各设置3个平行.实验开始后每8 h摇瓶1次,每隔24 h检测藻细胞数、叶绿素a、PSⅡ最大光化学量子产量(maximal photochemical efficiency,Fv/Fm)、活性氧(reactive oxygen species,ROS)与丙二醛(malondialdehyde,MDA).
藻细胞数测定:本实验采用流式细胞仪(CytoFLEX LX,China)进行藻细胞计数,流式细胞仪在使用前需要运行开机流程,按照提示在上样器中放入含有去离子水的流式管.待运行完开机流程后设置流式细胞仪工程文件.流式细胞仪的工程文件共需设置两个点图和一个直方图.第1个点图X轴设置为FSC-A,Y轴设置SSC-A.第2个点图X轴设置为PC690-5.5A,Y轴设置PC690-5.5H.直方图X轴设置为PC690-5.5A,Y轴设置为Count.取1 mL稀释好的藻样过滤加入流式管中,将流式管置于流式细胞仪的上样器,流速设为低速(10 μL/min),设置进样体积为10 μL,待进样结果稳定后进行记录,结果直接在流式细胞仪上读出,使用完毕后按照提示对流式细胞仪进行清洗.藻数计算公式为:藻细胞数=细胞仪上显示的活体微藻数/(体积×1 000×稀释倍数).
叶绿素a含量测定:取5 mL藻样,8 000 r/min离心10 min加入体积分数95%乙醇重悬,4 ℃避光24 h后8 000 r/min离心10 min,取上清测定A663与A645,A为吸光度.用公式C叶绿素a/(mg·L-1)=12.7A663-2.69A645计算[20].
PSⅡ最大光化学量子产量测定:采用文献[21]方法,测定使用的叶绿素荧光仪(PHYTO-Ⅱ-D,Germany)在室温下进行,取2 mL藻样暗适应30 min后,测定其Fv/Fm值.
ROS与MDA测定:采用WANG等[22]所用的化学荧光法测定ROS水平.用DCFH-DA(2,7-dichlorofuorescin diacetate)活性氧探针进行标记,通过多功能酶标仪测定485 nm吸光值.MDA采用硫代巴比妥酸(TBA)比色法测定[23].
1.3 数据处理
本实验结果均为平均值±标准差表示,使用SPSS 25.0软件进行单因素方差分析(one way ANOVA)事后多重比较采用Bonferroni检验,使用GraphPad 8软件进行绘图和线性回归分析,置信水平为0.95,“*”代表P<0.05差异轻微显著,“**”代表P<0.01为差异显著,“***”代表P<0.001为差异极显著.
2 结果
2.1 流式细胞仪测定结果
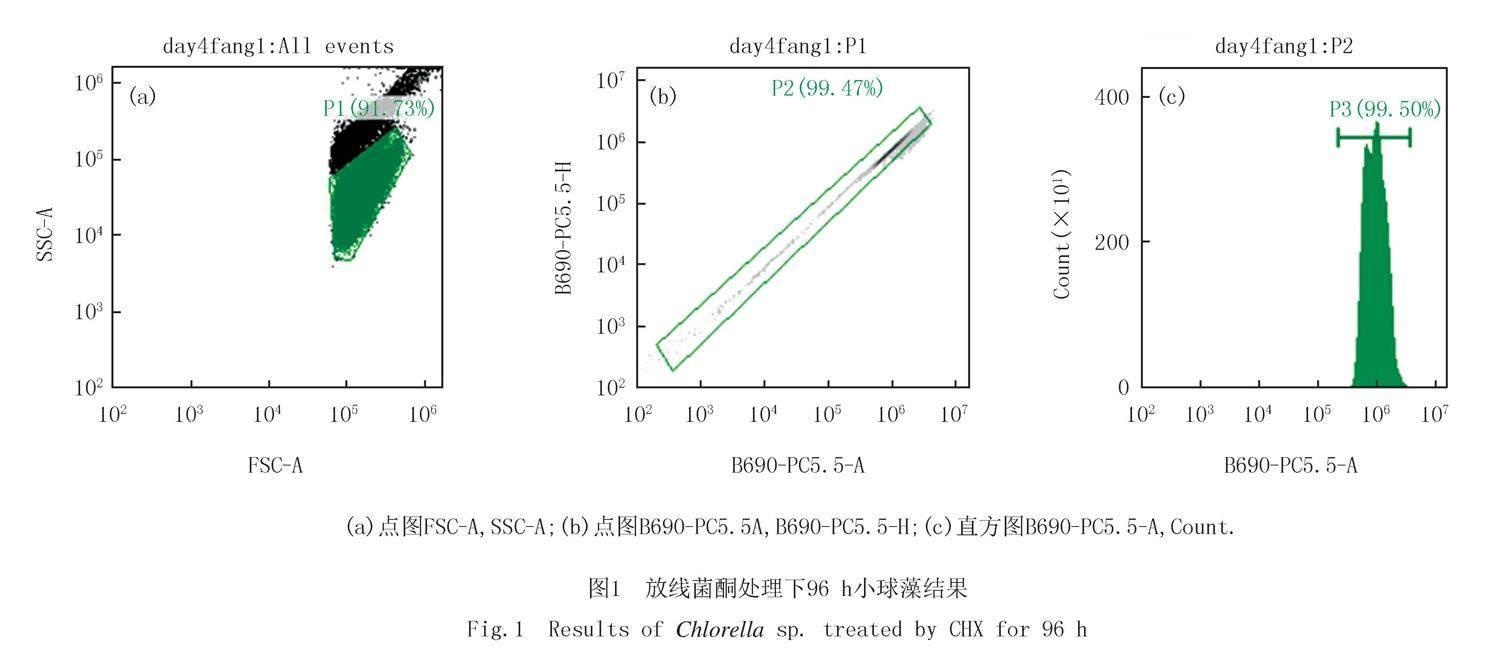
如图1所示,该结果为放线菌酮处理下96 h小球藻细胞数流式细胞仪计数结果,如图1(a)所示通过FSC-A,SSC-A两束激光筛选细胞门类同时可以去除细胞碎片,非荧光颗粒和非藻类颗粒.P1表示生长状态良好的细胞.可以看出生长状态良好的细胞占总藻细胞数的91.73%.如图1(b)所示筛选完毕的藻细胞通过激光通道B690PC5.5A去除集群的小球藻细胞.P2表示非黏连的细胞,P2占P1的99.47%.如图1(c)所示去黏连完成的细胞通过激光通道B690-PC5.5A进行藻细胞的定量计数,P3为筛选完成的藻细胞数所占P2的比例.
2.2 CHX对小球藻存活率和细胞密度的影响
图2(a)为小球藻96 h存活曲线,可以看出CHX质量浓度越高小球藻存活率越低,这表明放线菌酮对小球藻存在剂量-毒性效应,通过Graphpad 8计算得出CHX对小球藻的96 h EC50为1.229 mg/L.EC50质量浓度是毒理学常用的剂量浓度,因此本实验选择1.229 mg/L作为后续实验的CHX质量浓度.图2(b)为放线菌酮对小球藻细胞密度的影响,暴露组在24、48、72、96 h的藻细胞密度均低于对照组(P<0.001),表明小球藻的生长受到了放线菌酮的持续抑制,抑制率分别为44.2%、54.3%和49.7%.
2.3 CHX对小球藻叶绿素a的影响
小球藻培养24、48、72、96 h后测得的小球藻培养物叶绿素a质量浓度如图3(a)所示.培养24~48 h后,处理组和对照组的叶绿素a质量浓度没有显著差异(P>0.05);培养72 h后,处理组的叶绿素a质量浓度显著低于对照组(P<0.05),此时放线菌酮对叶绿素a的抑制率为29.5%.CHX暴露96 h后,处理组的叶绿素a极显著低于对照组(P<0.001),抑制率为36.2%.实验结果表明,放线菌酮对小球藻的生長(以叶绿素a质量浓度表示)具有时间毒性效应.图3(b)显示,在CHX暴露条件下,小球藻细胞密度和叶绿素a质量浓度之间具有极显著的正向线性关系(P<0.001),表明细胞密度和叶绿素a都可以作为小球藻的生物量指标,而且CHX暴露情况下叶绿素a的降低是由于细胞密度降低引起的.
2.4 CHX对Fv/Fm的影响
小球藻培养24、48、72、96 h后测得的Fv/Fm如图4所示.培养24 h后处理组的Fv/Fm显著低于对照组(P<0.01),48 h和96 h处理后极显著低于对照组(P<0.001),这表明CHX抑制了小球藻的光合作用.与对照相比,CHX暴露24、48、72、96 h后小球藻Fv/Fm的抑制率分别为7.4%、8.1%、10.9%和13.0%,抑制率随着暴露时间延长而升高.
2.5 CHX对ROS的影响
小球藻培养24、48、72、96 h后测得的ROS如图5所示.在24、48、72 h处理组ROS极显著高于对照组(P<0.001).这表明CHX可以刺激小球藻产生ROS.在96 h处理组ROS显著高于对照组(P<0.01),说明在96 h时CHX对小球藻ROS的刺激有所降低.但在整个实验期间CHX可以持续刺激小球藻产生ROS.
2.6 CHX对MDA的影响
小球藻培养24、48、72、96 h后测得的MDA如图6所示.在24 h CHX组显著高于对照组的MDA含量(P<0.01),在48、72 h处理组MDA极显著高于对照组(P<0.001),暴露96 h后,处理组的MDA含量显著高于对照组(P<0.01).综上所述,在试验期间CHX可以刺激小球藻产生MDA.
3 討 论
根据生长速率常数,小球藻生长周期可分为4个阶段,分别是延滞期、对数生长期、平稳期和衰退期[24].本实验根据生长速率常数将实验阶段选在了延滞期和对数生长期.结果表明放线菌酮可抑制小球藻生长.藻类通过吸收水体中的营养盐和光能为整个生态系统提供能量,叶绿素a可以衡量这一过程[25].研究表明,放线菌酮抑制了叶绿体基因的表达,阻碍了叶绿体的合成[26].放线菌酮可通过干扰生物合成易位阻断真核生物翻译进程,但对已经合成的蛋白质无作用[27].本研究发现,24、48 h对照组藻细胞数增长缓慢,说明放线菌酮组小球藻本身存在的叶绿体并未被破坏,因此放线菌酮组叶绿素a和对照组叶绿素a没有差异(P>0.05).而在72、96 h,对照组藻数增长迅速,说明放线菌酮破坏叶绿体基因的表达,导致72、96 h处理组小球藻叶绿素a含量低于对照组.处理组小球藻生物量和叶绿素a具有极显著的正相关线性关系(P<0.001).说明叶绿素a含量的降低是由于小球藻生物量下降引起的,即CHX对小球藻的叶绿素a的抑制是由于细胞数下降引起的,并非抑制其合成.
本研究中发现放线菌酮可抑制小球藻的PSⅡ最大光化学量子产量,且随着暴露时间增强.表明放线菌酮可能破坏了小球藻的光合系统,降低了PSⅡ的供体和受体,导致小球藻PSⅡ最大光化学量子产量下降,与放线菌酮可降低高等植物PSⅡ的供体和受体、反应中心密度、PSⅡ中的量子产生和电子传输的发现一致[28-29].
活性氧广泛存在于藻组织中,传统观点认为活性氧主要由藻细胞线绿体和叶绿体代谢产生,活性氧可以作为信号分子引起超敏反应,活性氧的存在对生物体有利,但在藻细胞内过多产生会引起DNA的损伤[30].研究表明替加环素对蛋白核小球藻活性氧的产生具有促进作用[31].本研究发现放线菌酮同样对小球藻的活性氧产生具有促进作用,这表明小球藻抗氧化物酶无法消除藻内过量的活性氧,导致活性氧升高.有研究表明,当小球藻受到环境的刺激时会产生大量自由基,包括超氧化物自由基(-O2-)、羟基自由基(-OH)和过氧化氢(H2O2),为了清除这些自由基,小球藻抗氧化系统会分泌酶系和非酶系抗氧化剂.这些自由基在植物体内累积会攻击细胞膜产生丙二醛,过量的丙二醛与细胞膜结合会加剧膜的损伤,因此丙二醛可用来评价细胞损伤[32].本研究结果与以上研究结果相同,说明小球藻受到放线菌酮的胁迫后活性氧与细胞内脂质发生氧化反应,产生了大量丙二醛.
综上所述,放线菌酮可通过抑制小球藻细胞数增长导致叶绿素a含量下降,此外还可降低PSⅡ最大光化学量子产量,同时刺激小球藻产生ROS,并提高MDA含量,导致小球藻细胞出现氧化损伤和脂质过氧化.
参 考 文 献
[1] 崔二苹,高峰,陈红,等.再生水利用对环境中抗生素抗性基因影响的研究进展[J].灌溉排水学报,2017,36(2):32-38.
CUI E P,GAO F,CHEN H,et al.Research progress on the influence of reclaimed water utilization on antibiotic resistance genes in the environment[J].Journal of Irrigation and Drainage,2017,36(2):32-38.
[2]LUO Y,MAO D Q,RYSZ M,et al.Trends in antibiotic resistance genes occurrence in the Haihe River,China[J].Environmental Science & Technology,2010,44(19):7220-7225.
[3]KMMERER K,HENNINGER A.Promoting resistance by the emission of antibiotics from hospitals and households into effluent[J].Clinical Microbiology and Infection,2003,9(12):1203-1214.
[4]KLEIN E Y,VAN BOECKEL T P,MARTINEZ E M,et al.Global increase and geographic convergence in antibiotic consumption between 2000 and 2015[J].Proceedings of the National Academy of Sciences of the United States of America,2018,115(15):E3463-E3470.
[5]SARMAH A K,MEYER M T,BOXALL A B A.A global perspective on the use,sales,exposure pathways,occurrence,fate and effects of veterinary antibiotics(VAs)in the environment[J].Chemosphere,2006,65(5):725-759.
[6]FARKAS M H,BERRY J O,AGA D S.Chlortetracycline detoxification in maize via induction of glutathione S-transferases after antibiotic exposure[J].Environmental Science & Technology,2007,41(4):1450-1456.
[7]ZHAO J A,WANG Z Y,WHITE J C,et al.Graphene in the aquatic environment:adsorption,dispersion,toxicity and transformation[J].Environmental Science & Technology,2014,48(17):9995-10009.
[8]高會,李冰,姚子伟.海洋环境中抗生素存在与环境行为研究进展[J].环境化学,2023,42(3):779-791.
GAO H,LI B,YAO Z W.Advances in research on the presence and environmental behavior of antibiotics in the marine environment[J].Environmental Chemistry,2023,42(3):779-791.
[9]夏洪宇,孔稳稳,徐蕊,等.利用放线菌酮提高黄素单氧化酶FMOGS-OX1亚细胞定位的准确性[J].生物技术通报,2017,33(5):83-88.
XIA H Y,KONG W W,XU R,et al.Improving the accuracy of FMOGS-OX1 subcellular localization using cycloheximide[J].Biotechnology Bulletin,2017,33(5):83-88.
[10]文才艺,吴元华,李洪连.新型农用抗生素TS99理化性质及其稳定性的研究[J].河南农业大学学报,2007,41(1):99-102.
WEN C Y,WU Y H,LI H L.Studies on physical and chemical properties and stability of newtype agriantibiotic TS99[J].Journal of Henan Agricultural University,2007,41(1):99-102.
[11]HEROLD M B,BAGGS E M,DANIELL T J.Fungal and bacterial denitrification are differently affected by long-term pH amendment and cultivation of arable soil[J].Soil Biology and Biochemistry,2012,54:25-35.
[12]XU C J,RU Z W,LI L,et al.The Effects of Polyphenol Oxidase and Cycloheximide on the Early Stage of Browning in Phalaenopsis Explants[J].Horticultural Plant Journal,2015,1(3):178-180.
[13]YU C,LI C,ZHANG Y,et al.Effects of environment-relevant concentrations of antibiotics on seawater Chlorella sp.biofilm in artificial mariculture effluent[J].Algal Research,2023,70:103008.
[14]BEIJERINCK M W.Culturversuche mit zoochlorellen,Lichenengonidien and anderen niederen Algen[J].Botanische Zeitung,1890,47:725-739.
[15]CHEN Y X,LIU X Y,WU L X,et al.Physicochemical characterization of polysaccharides from Chlorella pyrenoidosa and its anti-ageing effects in Drosophila melanogaster[J].Carbohydrate Polymers,2018,185:120-126.
[16]CHALEW T E,HALDEN R U.Environmental exposure of aquatic and terrestrial biota to triclosan and triclocarban[J].Journal-American Water Works Association,2009,45(1):4-13.
[17]CHENG D J,LI X Y,YUAN Y Z,et al.Adaptive evolution and carbon dioxide fixation of Chlorella sp.in simulated flue gas[J].Science of the Total Environment,2019,650:2931-2938.
[18]YOU M T,YOU X Q,HU J R,et al.Carbon nanotubes influence the toxic effects of chloramphenicol and tetracycline on Cyanobacterium Synechocystis sp.in different ways[J].Environmental Science:Nano,2021,8(3):634-646.
[19]中華人民共和国国家质量监督检验检疫总局.化学品:藻类生长抑制试验GB/T 21805-2008[S].北京:中国标准出版社,2008.
[20]SARTORY D P,GROBBELAAR J U.Extraction of chlorophyll a from freshwater phytoplankton for spectrophotometric analysis[J].Hydrobiologia,1984,114(3):177-187.
[21]郑明刚,郑立,王玲,等.五种抗生素对等鞭金藻(Isochrysis sp.CCMM5001)叶绿素荧光特性的影响[J].海洋环境科学,2011,30(4):569-572.
ZHENG M G,ZHENG L,WANG L,et al.Effects of five kinds of antibiotics stressed on chlorophyll fluorescence parameters of Isochrysis sp. CCMM5001[J].Marine Environmental Science,2011,30(4):569-572.
[22]WANG Z Y,LI J,ZHAO J,et al.Toxicity and internalization of CuO nanoparticles to prokaryotic alga Microcystis aeruginosa as affected by dissolved organic matter[J].Environmental Science & Technology,2011,45(14):6032-6040.
[23]YOU X Q,CAO X Q,ZHANG X A,et al.Unraveling individual and combined toxicity of nano/microplastics and ciprofloxacin to Synechocystis sp.at the cellular and molecular levels[J].Environment International,2021,157:106842.
[24]张建国,罗学刚.水网藻生长及铀对其生长影响的模型构建[J].西南科技大学学报,2022,37(1):87-92.
ZHANG J G,LUO X G.Model construction of the growth of Hydrodictyon reticulatum and the effect of uranium on its growth[J].Journal of Southwest University of Science and Technology,2022,37(1):87-92.
[25]王应军,李娜,罗潇宇,等.多壁碳纳米管对铜绿微囊藻生长及生理特征的影响[J].生态毒理学报,2018,13(6):316-325.
WANG Y J,LI N,LUO X Y,et al.Effects of multi-walled carbon nanotubes on the growth and physiology of Microcystis aeruginosa[J].Asian Journal of Ecotoxicology,2018,13(6):316-325.
[26]朱津辉,郑泽欣,李吉平,等.脱水红霉素对蛋白核小球藻的生态毒性效应研究[J].生态毒理学报,2019,14(5):257-266.
ZHU J H,ZHENG Z X,LI J P,et al.Ecotoxicological effects of dehydroerythromycin on Chlorella pyrenlidosa[J].Asian Journal of Ecotoxicology,2019,14(5):257-266.
[27]夏洪宇,孔稳稳,徐蕊,等.利用放线菌酮提高黄素单氧化酶FMOGS-OX1亚细胞定位的准确性[J].生物技术通报,2017(5):83-88.
XIA H Y,KONG W W,XU R,et al.Improving the accuracy of FMOGS-OX1 subcellular localization using cycloheximide[J].Biotechnology Bulletin,2017(5):83-88.
[28]PAN X L,ZHANG D Y,CHEN X,et al.Effects of levofloxacin hydrochlordie on photosystem Ⅱ activity and heterogeneity of Synechocystis sp[J].Chemosphere,2009,77(3):413-418.
[29]HORIKOSHI M,MORITA Y.Effect of cycloheximide on protein breakdown in germinating rice seeds[J].Agricultural and Biological Chemistry,1981,45(2):527-529.
[30]CHOKSHI K,PANCHA I,GHOSH A,et al.Salinity induced oxidative stress alters the physiological responses and improves the biofuel potential of green microalgae Acutodesmus dimorphus[J].Bioresource Technology,2017,244:1376-1383.
[31]ZHONG X Q,ZHU Y L,WANG Y J,et al.Effects of three antibiotics on growth and antioxidant response of Chlorella pyrenoidosa and Anabaena cylindrica[J].Ecotoxicology and Environmental Safety,2021,211:111954.
[32]HAN Q Z,ZHENG Y,QI Q J,et al.Involvement of oxidative stress in the sensitivity of two algal species exposed to roxithromycin[J].Ecotoxicology,2020,29(5):625-633.
The research of toxic effects and mechanisms of cycloheximide on Chlorella sp.
Li Guangxin1, Gao Qiang1, You Mingtao2, Sun Weiling2, Shen Hong3, Qi Delin1, Yang Xi1
(1. College of EcoEnvironmental Engineering; State Key Laboratory of Plateau Ecology and Agriculture, Qinghai University, Xining 810016,
China; 2. College of Environmental Sciences and Engineering; State Environmental Protection Key Laboratory of All Material
Fluxes in River Ecosystems, Peking University, Beijing 100871, China; 3. State Key Laboratory of Fresh Water Ecology
and Biotechnology; Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China)
Abstract: To explore the toxic effect and mechanism of antibiotics on algae. cycloheximide(CHX) as a potential contaminant was used on Chlorella sp.. The amount of biomass, chlorophyll a, reactive oxygen species(ROS), malondialdehyde(MDA) and Optimal/maximal quantum yield of PSⅡ(Fv/Fm) were chosen as biochemical and physiological parameters. The results of the study showed that the EC50 of 96 h is 1.229 mg/L for Chlorella sp. under CHX. After 96 h of exposure to this concentration, the inhibition rate of CHX on algal biomass was 49.7%, the inhibition rate of CHX on chlorophyll a was 36.2% and the inhibition rate of CHX on Fv/Fm was 13.0%. In addition, the CHX could stimulate the production of ROS and MDA of Chlorella sp.:the promotion rate of ROS and MDA were 533.7% and 618.6% respectively. Therefore, the toxic effect of CHX on Chlorella sp. mainly acts on growth inhibition, its possible mechanism is to cause oxidative stress(such as the production of ROS and MDA), furthermore, it inhibits photosynthesis(reduces Fv/Fm).
Keywords: cycloheximide; Chlorella sp.; toxicity effect; Fv/Fm
[責任编校 刘洋 杨浦]

