基于动态对比增强磁共振成像列线图对直肠癌淋巴血管浸润的预测价值
叶清岚 敖炜群 侯金丹 蔡 磊 王 能 茅国群▲
1.浙江中医药大学附属江南医院放射科,浙江杭州 311201;2.浙江省立同德医院放射科,浙江杭州 310012;3.浙江中医药大学第二临床医学院,浙江杭州 310053
近年来,我国结直肠癌患病率呈现快速上升的趋势,2020 年中国癌症统计报告显示,我国结直肠癌发病率、死亡率在全部恶性肿瘤中分别位居第2 位和第5 位[1]。相比于发达国家,我国结直肠癌的早期诊断率依然滞后,多数患者确诊时已是中晚期,死亡率较高[2]。直肠癌早期的一种侵袭特征就是淋巴血管浸润(lymphovascular invasion,LVI),表现为肿瘤细胞对淋巴管和血管等组织的破坏。研究显示,LVI 与直肠癌的术后复发和不良预后相关[3-4]。尽管术后病理分级被视为诊断直肠癌LVI 的权威标准,但其具有侵入性,并可能由于手术位置的非一致性从而造成病理结果不准确[5]。因此,寻找一种无创且能精准预测LVI 的手段在治疗直肠癌并确定预后方面显得至关重要。
直肠癌无创诊断技术中,磁共振成像(magnetic resonance imaging,MRI)是最为推荐的检查方法之一[6];运用动态对比增强磁共振成像(dynamic contrast enhancement-magnetic resonance imaging,DCE-MRI)技术跟踪肿瘤血流动态变化,不仅能够得到精准的直肠癌图像,而且还能通过图像后处理得到包括容量转移常数(Ktrans)、血管外细胞外间隙体积百分比值(Ve)、速率常数(Kep)等参数[7]。表面扩散系数(apparent diffusion coefficient,ADC)可以分析水分子的弥散特性,以反映生物组织的某些组织学特性[8]。本研究探讨DCE-MRI 定量参数(Ktrans、Ve、Kep)和ADC 值对预测直肠癌患者LVI 的有效性,以期帮助临床找到更有效的治疗策略,并准确预估患者的临床预后。
1 资料与方法
1.1 一般资料
回顾性收集2019 年1 月至2022 年12 月浙江省立同德医院住院治疗的直肠癌患者。纳入标准:①行MRI 扫描前接受直肠镜检查,并由手术病理证实为直肠癌;②行DCE-MRI 检查;③检查完成后2 周内进行手术切除。排除标准:①接受过放疗、化疗或盆腔手术治疗;②对造影剂过敏;③患者影像学和临床资料不完整;④MRI 图像质量不佳,影响图像分析。本研究共纳入79 例患者,其中男50 例,女29 例;年龄21~88 岁,平均(63.1±12.1)岁。本研究经浙江省立同德医院医学伦理委员会批准(浙同德快审字第[2019]044号)。
1.2 设备及检查方法
1.2.1 设备及检查前准备 采用德国SIEMENS 公司生产的3.0T Verio 超导磁共振成像仪。采用体部阵列线圈,检查时患者采用头先进的仰卧位。患者检查前禁食、禁水4~6 h 并对其进行呼吸训练。造影剂为钆喷替酸葡甲胺注射液(北陆药业股份有限公司),剂量为0.2 mmol/kg,经肘静脉途径高压注射,速率为2 ml/s。
1.2.2 扫描参数T2加权成像的矢状位、冠状位、轴位扫描,T1加权成像的轴位扫描,弥散加权成像扫描及动态增强扫描。T2加权成像的轴位扫描利用TSE 序列及脂肪抑制技术,TR 3 900 ms/TE 80 ms,FOV 250 mm×380mm,层厚为5mm,层间距离为1mm。T1加权成像的轴向扫描利用SE 序列,参数为TR 400 ms/TE 16 ms,FOV 250 mm×380 mm,层厚为5 mm,层间距为1 mm。弥散加权成像扫描利用EPI-stir 序列,设定b 值为0、400、800、1500;扫描参数包括:TR9700ms、TE 40.3 ms(b=0 s/mm2)、TE 53.8 ms(b=400 s/mm2)、TE 102.6 ms(b=1 500 s/mm2),层厚为3.5 mm,组间距为0.7 mm,3 次信号采集。动态增强扫描采用3D-VIBE序列和脂肪抑制技术,具体参数为TR 3.3 ms/TE 1.3 ms,FOV 250 mm×380 mm,层厚为3 mm,层距为0 mm。共完成连续35 个序列自动扫描。经高压注射器注射造影剂前开始即启动扫描,第2 个扫描序列开始时注射造影剂。总扫描时间约为30 min。
1.2.3 图像及数据处理 所有图像由1 名10 年腹部诊断经验医师操作,由另1 名17 年腹部诊断经验医师确认,如有异议决定讨论。
ADC 测量方法:应用Functool 软件处理,在ADC图像上勾画感兴趣区(region of interest,ROI)。参照MRI 的平扫及增强图像来选择ROI,测量时均选取病灶最大截面勾画,ROI 形状为圆形并尽可能覆盖肿瘤,在测量的过程中,尽可能避开肉眼能观察到的血管、出血及坏死区域,然后将测量的ADC 值记录下来,重复3 次,取平均值。
DCE 处理步骤:①拖动患者文件夹到TISSUE 4D后处理中;②运动校正,目的为修正扫描过程中患者自主运动及器官不自主运动导致靶器官多期之间的位置偏差;③根据MRI 平扫及增强的图像,锁定病灶范围及形态;④选取病灶的最大截面手动勾画ROI,面积约20 mm2的圆形,软件自动生成时间-信号曲线,其中横、纵坐标分别代表扫描时间和信号强度;⑤选用双室Tofts 模型及合适的动脉输入函数模型,获得选定ROI 的灌注伪彩图,计算并显示定量参数Ktrans、Ve、Kep值;⑥保存后处理图像,将所测得各定量参数计算结果的平均值作为各定量参数的标准值。
1.3 分组
根据病理结果将患者分为LVI 阴性组及LVI 阳性组。
1.4 统计学方法
采用PASW 23.0 和R 语言3.5.1 统计学软件进行数据分析。符合正态分布的计量资料用均数±标准差()表示,比较采用t 检验;不符合正态分布的计量资料采用中位数(M)和四分位间距(Q)表示,比较采用Mann-Whiney U 检验。计数资料用例数或百分率表示,比较采用χ2检验。影响因素分析采用logistic回归分析。绘制受试者操作特征(receiver operating characteristic,ROC)曲线,曲线下面积(area under the curve,AUC)量化预测概率,并以Delong 检验进行比较。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床病理特征比较
79 例直肠癌患者中,LVI 阴性46 例(58.2%),LVI阳性33 例(41.8%)。见图1~2。
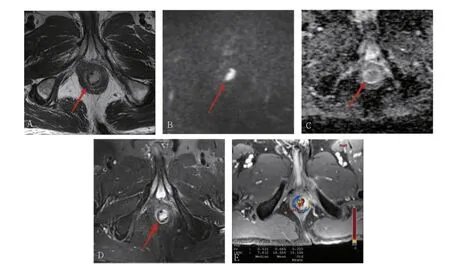
图1 直肠癌LVI 阴性患者影像图

图2 直肠癌LVI 阳性患者影像图
两组病理T 分期、病理N 分期、长径比较,差异有统计学意义(P<0.05);两组性别、年龄、癌胚抗原、位置、浸润深度比较,差异无统计学意义(P>0.05)。见表1。
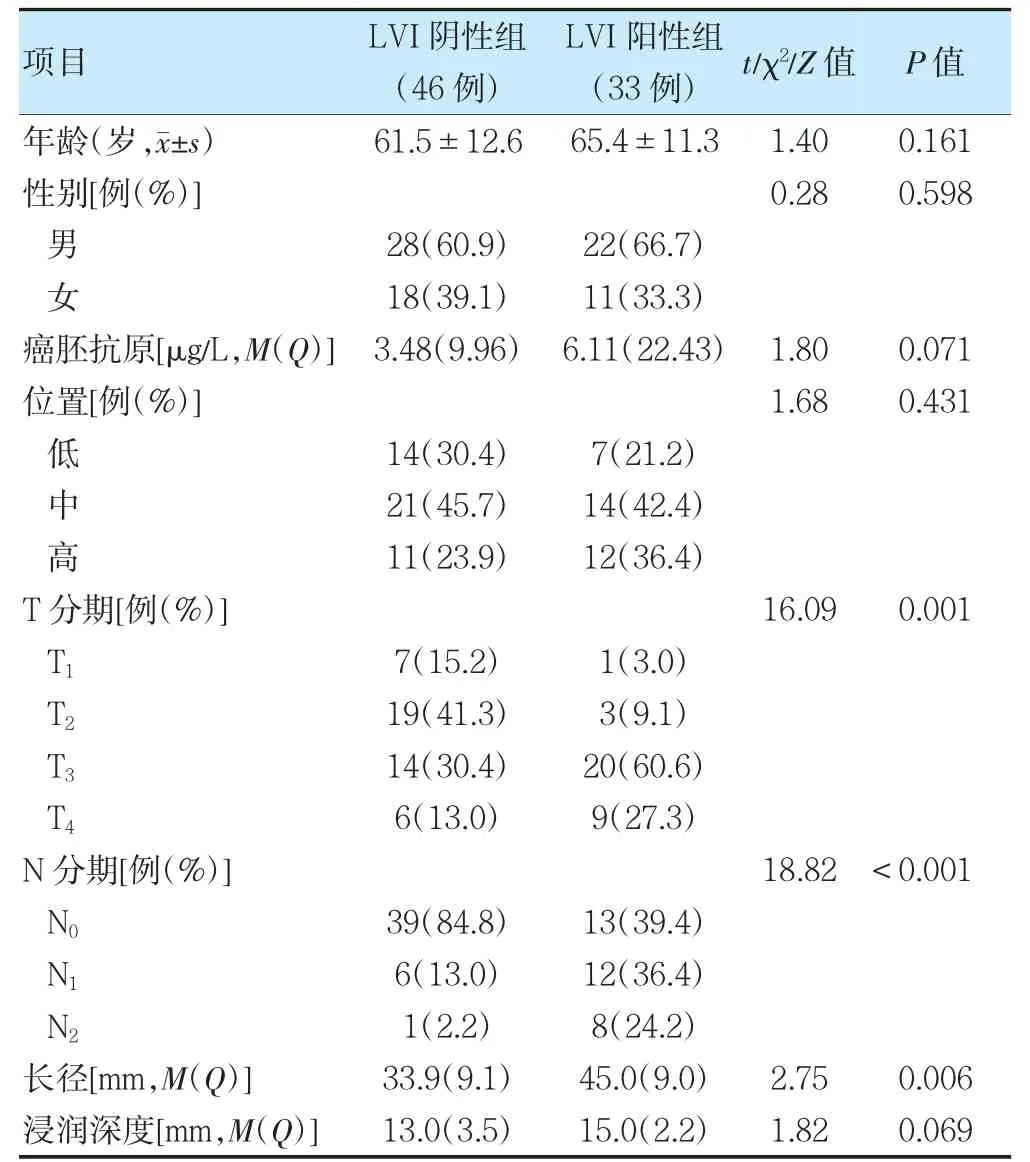
表1 两组临床病理特征比较
2.2 两组DCE-MRI 定量参数、ADC 值比较
LVI 阳性组Ktrans、Kep、Ve值高于LVI阴性组(P<0.05);两组ADC 值比较,差异无统计学意义(P>0.05)。见表2。

表2 两组DCE-MRI 定量参数、ADC 值比较[M(Q)]
2.3 logistic 回归分析
以LVI 为因变量(阳性=1,阴性=0),Ktrans、Ve、Kep、ADC 值为协变量(原值带入),进行多元logistic 回归分析。结果显示,Ktrans(OR=143.46,P=0.003)和Ve(OR=50.92,P=0.027)为直肠癌LVI 阳性的危险因素。见图3。

图3 单因素和多因素logistic 回归分析森林图
2.4 独立预测因素列线图的构建和评估
基于logistic 回归分析的结果,构建结合Ktrans、Ve预测LVI 阳性的列线图,见图4;基于LVI 预测风险与实际LVI 结果的列线图校准曲线见图5,虚线与实线之间越靠近说明列线图的预测准确性越高。

图4 预测直肠癌LVI 阳性的列线图

图5 列线图模型的校准曲线
2.5 Ktrans、Ve 及列线图对直肠癌LVI 阳性的诊断效能
列线图预测直肠癌LVI 阳性的AUC 值高于Ve(Z=2.032,P=0.042)。见图6、表3。

表3 Ktrans、Ve 及列线图对直肠癌LVI 阳性的诊断效能

图6 Ktrans、Ve 及列线图诊断直肠癌LVI 阳性的ROC 曲线
2.6 模型的临床应用价值
列线图模型的决策曲线分析见图7。图中,X 轴代表阈值概率,Y 轴代表净获益,灰色曲线表示所有样本都为阳性,都接受干预;黑色水平线表示所有样本都为阴性,不做任何干预;红色曲线表示结合Ktrans、Ve的列线图模型。阈值在0.10~0.97 的范围内,列线图有更好的净获益。
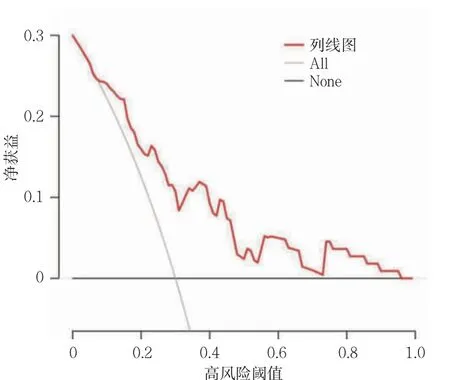
图7 列线图模型的决策曲线分析
3 讨论
LVI 定义为任何病灶内发现血管壁或其残留物即可认定存在血管淋巴管浸润,即小脉管侵犯及静脉侵犯。小脉管侵犯指淋巴管及小静脉的侵犯,静脉侵犯指肿瘤细胞侵犯血管内皮包绕成分,如红细胞及平滑肌细胞等[9]。研究表明,直肠癌LVI 阳性患者发生淋巴结转移及远处转移的风险高于LVI 阴性患者,并且LVI 与直肠癌的术后复发和不良预后相关[10-15]。因此,准确识别直肠癌LVI 对于直肠癌早期转移的诊断及治疗具有十分重要的作用。
本研究结果显示,两组病理T分期、病理N分期、长径、Ktrans、Kep和Ve值比较,差异有统计学意义(P<0.05);两组浸润深度、ADC 值比较,差异无统计学意义(P>0.05)。一般来说,随着肿瘤恶性程度的增高,肿瘤组织为满足其自身营养物质的需求,新生血管增多,但是由于肿瘤的新生血管没有正常的血管结构,并且病灶区血管的渗透性增大,使得对比剂漏到血管外间隙的速度增快,从而导致Ktrans值增加;同样,Kep受肿瘤血管细胞外间隙的造影剂浓度和部分体积分数的影响,Kep值越高,同时血液返回到血管的程度越大[16-17]。因此,Kep值可准确地反映肿瘤毛细血管的程度。Ve值与病灶的恶性程度相关,随着恶性程度的增加,Ve值也逐渐增大[18]。本研究也证实了Ktrans、Kep、Ve值能够精确地展现直肠癌病变处的血流供应状况,可以准确反映直肠癌病灶的血流灌注情况,同时其也是客观衡量肿瘤恶性增殖、局部侵犯及邻近转移的指标[19-22]。
本研究结果显示,Ktrans和Ve是直肠癌LVI 阳性的危险因素,以Ktrans、Ve构建列线图,通过ROC 曲线分析,列线图预测直肠癌LVI 阳性的AUC 值高于Ve。校准曲线显示,列线图模型预测准确性良好。决策曲线显示,在0.10~0.97 的阈值范围内,列线图模型能带来较高的净获益。Li 等[23]研究发现,体素内不相干运动定量参数(D 值)对于鉴别二者有一定的差异,但诊断效能较低仅为0.646。Chen 等[24]通过测量弥散加权成像和T2加权成像上的肿瘤总体积值来评估术前直肠癌LVI,但由于体积测量和评估需要耗费大量的时间,实验结果与操作者流程密切相关,故可重复性较差。对比可见本研究不但在操作上简便易行,并且通过校准曲线检验本研究的预测精准。
近年来,虽然脉管浸润的研究在乳腺癌、结直肠癌、子宫内膜癌等领域中已经开展,但目前利用DCE-MRI 定量参数研究在直肠癌的脉管浸润方面相对较少[25-26]。本研究不但筛选出了独立因素Ktrans、Ve,并联合两者构建了列线图,可能为直肠癌患者的风险分层和个体化治疗方案的制订提供精准的预测价值。
本研究不足之处在于:①本研究为回顾性分析,可能存在选择性偏差;②本研究虽然在测量时选取病灶最大截面勾画ROI,能更真实地反映肿瘤的异质性,但由于主观因素的存在,可能会导致研究结果的差异;③本研究样本量相对较小,可能会影响统计能力。
综上所述,DCE-MRI 定量参数Ktrans和Ve值为直肠癌LVI 阳性的危险因素,以Ktrans、Ve构建的列线图可作为术前无创性预测LVI 状态的可靠工具,为直肠癌患者治疗方案的选择和预后评估提供更精准的预测价值。
利益冲突声明:本文所有作者均声明不存在利益冲突。

