利用TSA/Opal技术实现肾活检石蜡切片多重免疫荧光染色
王 宇
肾活检病理是肾小球疾病诊断的金标准[1],诊断的手段包括光镜、免疫荧光和电镜。三种观察方法对组织处理的要求不同,因此穿刺的肾活检标本需要人为地进行分割。这一操作容易造成某一观察项目没有肾小球的情况,此外也无法在同一肾小球中同时进行光镜、免疫荧光及电镜观察。尽管在体视镜或普通光学显微镜下分割肾组织可以尽量避免没有肾小球的情况,但操作非常依赖穿刺医师的水平,且对于出现硬化或缺血肾小球的组织,即使在显微镜下辨别穿刺组织中的肾小球亦非常困难。更重要的是,对于仅表现为局灶性病变的疾病,人为分割很可能导致在一个检查项目中观察到病变,在另外的检查项目中观察不到。此外,三种观察手段的观察重点不同,免疫荧光主要观察是否存在免疫复合物及补体的沉积,光镜主要观察整体的形态学改变,电镜则主要观察超微结构异常。尽管三种观察方法是分开的,但我们需要整合三种观察内容对疾病进行整体分析,因此假如在同一肾小球中能同时获得免疫、形态学和超微结构的信息更有利于我们做出准确的诊断和开展发病机制的研究。
TSA/Opal是实现石蜡切片多重免疫荧光染色的一项新兴技术[2]。随着单细胞测序、空间蛋白组学以及肿瘤微环境等研究的开展,越来越多的实验团队选择这项技术来实现病理组织多靶点的原位观察[3]。本实验借鉴了TSA/Opal在肿瘤学研究的应用方法,尝试在肾活检标本石蜡切片中进行染色,旨在减少肾活检穿刺标本的分割,并实现在同一肾小球中观察免疫异常和形态学改变的目的,结果表明该技术能准确识别免疫球蛋白及补体,与同一患者冷冻切片的免疫荧光结果有很好的一致性,且具有敏感性和特异性高的优点,是一种可以常规开展的病理技术,现介绍如下。
1 材料与方法
1.1 临床标本收集哈尔滨医科大学附属第二医院肾内科住院患者的肾活检石蜡组织标本。经病理诊断为IgA肾病、膜性肾病和狼疮性肾炎各3例。
1.2 实验试剂柠檬酸抗原修复液粉剂(pH 6.0,福州迈新公司);吐温20(北京索莱宝公司)。磷酸盐缓冲液(PBS,pH 7.0,北京中杉金桥公司);抗原修复用胰蛋白酶(北京中杉金桥公司);内源性过氧化物酶封闭液(碧云天公司);即用型封闭用山羊血清(博士德公司);兔抗人IgA、IgG、IgM、C1q、C3c、C4c抗体购自福州迈新公司,小鼠抗人κ、λ抗体购自Abcam公司;山羊抗鼠兔通用二抗(北京中杉金桥公司)。350、488、594酪胺及酪胺放大缓冲液购自苏州UElandy公司。
1.3 实验仪器微波炉(格兰仕公司)。恒温鼓风干燥箱(天津泰斯特公司)。4 ℃冰箱(海尔公司)。荧光显微镜(尼康公司)。
1.4 染色方法石蜡切片60 ℃烤片30 min,脱蜡至水。内源性过氧化物酶封闭10 min,蒸馏水流水冲洗5 min。切片浸没于柠檬酸抗原修复液中,100%火力3 min,50%火力7 min,静置15 min。吐温20配置PBS缓冲洗液(PBST)洗片3次,每次5 min。胰蛋白酶37 ℃恒温修复30 min。PBST洗片3次,每次5 min。山羊血清恒温封闭30 min。弃血清,滴加第一种一抗(浓度均为1∶100),4 ℃过夜。恢复室温,PBST洗片3次,每次5 min。37 ℃恒温孵育二抗1 h。PBST洗片3次,每次5 min。酪胺放大缓冲液配置酪胺37 ℃避光孵育10 min。PBST避光洗片3次,每次5 min。切片浸没于柠檬酸抗原修复液中,100%火力3 min,50%火力7 min,静置15 min,进行抗体洗脱。重复上述抗体孵育和酪胺孵育过程,分别孵育第二种和第三种一抗(本实验中IgA、IgG、IgM于一个组织,C1q、C3c、C4c于一个组织,轻链κ、λ于一个组织分别进行三色或两色荧光染色)。
2 结果
IgA肾病组织免疫荧光显示系膜区高亮度的红色IgA和C3荧光染色,在同一组织中未见IgG(绿色)和IgM(蓝色)或C1q(红色)和C4c(蓝色)荧光信号(图1)。膜性肾病组织免疫荧光显示毛细血管基底膜外侧高亮度绿色IgG荧光染色,在同一组织中未见IgA(红色,毛细血管内有节段非特异IgA沉积)和IgM(蓝色)或C1q(红色)和C4c(蓝色)特异性荧光信号(图2)。狼疮性肾炎患者系膜区和毛细血管基底膜IgA(红色)和IgG(绿色)共定位,且与光镜连续切片的同一肾小球有组织对应关系;另一狼疮性肾炎患者κ(红色)和λ(绿色)共定位,且与光镜连续切片的同一肾小球有组织对应关系(图3)。
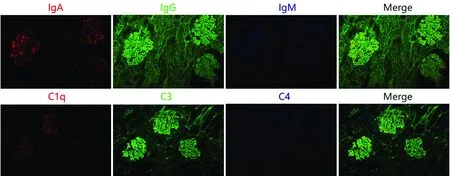
图2 膜性肾病石蜡切片免疫荧光染色:免疫球蛋白IgA、IgG、IgM在同一张石蜡切片同一肾小球中的沉积及另一张连续切片中补体C1q、C3、C4的沉积
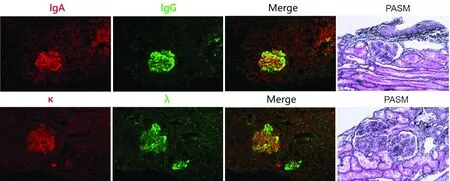
图3 狼疮性肾炎石蜡切片免疫荧光染色及与光镜连续切片六胺银染色(PASM)的组织对应:免疫球蛋白IgA、IgG在同一张石蜡切片同一肾小球中的沉积及与光镜六胺银染色切片同一肾小球的组织对应;另一例狼疮性肾炎患者轻链κ、λ在同一张石蜡切片同一肾小球中的沉积,与光镜六胺银染色切片同一肾小球的组织对应
3 讨论
尽管肾脏病理学家长期以来都希望在同一个肾小球中同时观察免疫异常和组织结构异常,但技术的限制阻碍了石蜡切片免疫荧光染色的广泛应用。随着病理技术的发展,基于TSA/Opal技术的多重石蜡免疫荧光吸引了越来越多病理学家的关注。本实验证实了TSA/Opal技术作为肾活检常规免疫荧光方法的可靠性。利用TSA/Opal技术进行石蜡切片免疫荧光染色可以获得与冷冻切片相似甚至更强的信号[4],无需提高一抗浓度即可保证检测的敏感性。特异性方面,与传统石蜡切片免疫荧光相比,TSA/Opal染色的石蜡切片背景更清晰,信噪比更好。此外,由于与光镜切片使用的是同一石蜡组织,连续切片制作的免疫荧光切片中的肾小球与光镜中观察的肾小球一致,可以实现免疫异常和组织结构异常的同位观察,这对于局灶性病变的诊断尤为重要(病变可能仅存在于部分肾小球中,人为分割肾组织可能导致仅能在荧光切片中观察到病变而光镜不能,或反之亦然)。
免疫荧光染色是肾活检病理必不可少的观察手段。现普遍使用的是分割肾活检组织的冷冻切片来进行免疫荧光染色。但在临床实践中,冷冻切片中没有肾小球的情况时有发生,此时需要使用石蜡免疫荧光染色进行补救。此外,当在冷冻组织中预期有免疫球蛋白或轻链成分但未检测到时(通常在怀疑有单克隆免疫球蛋白沉积的情况下),同样需要行石蜡切片免疫荧光染色以除外假阴性[5]。但石蜡切片免疫荧光存在敏感性差的缺点,即使在酶修复和热修复后,为了获得确切的荧光信号,也需要提高一抗浓度。
冷冻切片免疫荧光的优点是抗原暴露好,检查的敏感性高,染色步骤简单,但其缺点是缺乏固定,不能很好地展示组织结构,尤其不能满足明确靶蛋白亚细胞定位的需要。我们在另一项基础研究中观察到,主要定位于细胞核中的靶蛋白在冷冻切片中广泛出现在细胞质内。此外,在进行单克隆免疫球蛋白相关肾病及C3肾小球病等疾病的诊断时,为了避免冷冻切片抗原“遮蔽”,石蜡切片免疫荧光已被推荐为常规进行的病理检查项目[6]。若未来石蜡切片免疫荧光作为常规的免疫荧光观察方法,我们将不必在进行冷冻切片免疫荧光后再行石蜡切片免疫荧光。
一直以来,多重免疫荧光染色都仅能使用冷冻切片。即使在基础研究中,对固定的动物组织或细胞标本进行多重荧光染色也非常有技术挑战,往往需要针对不同的抗体进行多次预实验才能确定实验步骤。更让人困扰的是,基于抗原抗体结合原理的传统免疫荧光染色方法在检测多重靶点时,为避免标记不同荧光信号的二抗与不同一抗结合发生交叉反应,要求必须使用不同种属来源的一抗和针对性二抗,这大大限制了科研人员选择商业抗体的范围,也提高了成本。TSA/Opal技术的原理与传统免疫组化相似,不同的是它利用了二抗结合的辣根过氧化物酶激活酪胺,之后这些被荧光信号标记的酪胺可以与抗体周围的组织酪氨酸残基结合,实现信号标记。由于每个二抗都能激活大量的酪胺,因此这种方法放大了信号,提高了敏感性,且由于酪胺仅在抗体结合部位被激活,因此也具有很好的特异性。每轮染色结束时,利用微波热修复方法即可将该轮结合的抗体洗脱,重复上一轮的操作即可孵育下一种抗体。从上述原理可知,该技术的信号直接标记在靶抗原上,上一种抗体洗脱后,不用担心会与下一种抗体发生交叉反应,因此可以使用多个来源于同一种属的不同一抗和相同二抗进行多重免疫荧光染色[7]。多个靶标的同位观察对于一些特殊肾病非常有价值,且该技术为我们利用珍贵活检组织进行机制研究提供了支持。
本实验仅探讨了利用石蜡切片免疫荧光减少冷冻切片组织分割的情况,事实上,目前光镜-电镜关联成像技术已整合了荧光和电镜技术,使超微结构和蛋白靶标的同位观察成为可能[8],但高昂的设备成本和繁琐的技术要求限制了该技术还仅应用在科研领域。相信随着科技发展,在同一肾小球中同位观察免疫沉积、组织结构和超微结构异常的设想会被实现。此外,本实验在进行多重荧光染色时使用的是手工操作,因此整体染色时间略长,目前已有TSA/Opal自动化平台能在1天内完成3个靶点的多重染色,大大节省了人力和时间,据报道该技术平台最多可在同一组织中进行7个靶点的荧光染色。
总之,本实验证实了TSA/Opal技术可提高肾活检病理石蜡免疫荧光的敏感性,同时其不依赖于抗体种属的多靶点同位检测不仅节省了组织,还能有效整合免疫和组织结构的病理信息,为精确诊断和发病机制研究提供了技术保障。

