CD56在甲状腺未分化癌诊断及预后评估中的应用
朱卫东,郭凌川
甲状腺未分化癌(anaplastic thyroid carcinoma, ATC)具有高度恶性和侵袭性,患者疾病发展迅速,中位生存期不足1年,其发生率在甲状腺恶性肿瘤中不足5%,多见于60岁以上患者[1-2]。研究发现,正常甲状腺滤泡上皮细胞及甲状腺腺瘤组织中CD56均呈阳性,而在分化型甲状腺癌(differentiated thyroid carcinoma, DTC)组织中CD56多呈阴性,近年来有研究提出CD56可作为DTC的免疫组化诊断指标[3-6]。目前,关于CD56在ATC中的表达及其与预后的关系罕见报道。本文现收集6例ATC和12例DTC病例为研究对象,对其肿瘤和癌旁组织蜡块重新切片行CD56免疫组化染色,以期初步了解CD56表达在ATC诊断和预后评估中的意义。
1 材料与方法
1.1 临床资料检索2016~2021年苏州大学附属第一医院病理科确诊的6例ATC。由于ATC较为少见,为避免偏差,参照ATC患者年龄、性别和肿瘤大小,匹配筛选12例ATC甲状腺乳头状癌(papillary thyroid carcinoma, PTC)作为对照。收集患者年龄、性别、肿瘤大小、联系方式等信息,与患者或其家属取得联系了解患者预后情况。
1.2 方法将ATC、PTC和癌旁组织蜡块制成4 μm厚石蜡切片,行常规HE染色和CD56免疫组化染色,免疫组化染色采用EnVision两步法。HE试剂购自Dako公司(货号CS700、CS701),CD56一抗购自Dako公司(货号M7304,克隆号123C3),二抗和DAB显色试剂购自Dako公司(货号GV800),具体染色步骤参照试剂说明书进行。
1.3 结果判断CD56定位于细胞膜,阳性信号呈棕褐色。以细胞膜无棕褐色信号为“-”(阴性);以细胞膜有浅棕褐色信号为“+”(弱阳性);以细胞膜有完整但不均匀的浅至中等深度棕褐色信号为“”(中阳性);以细胞膜有完整且均匀的深棕褐色信号为“”(强阳性)。若为多灶阳性,记录阳性程度最高的结果。采用Image J软件(National Institutes of Health, USA, http://rsb.info.nih.gov)分析并计算图像中CD56阳性组织区域的占比。以组织中任意阳性强度的区域面积>10%为CD56阳性,否则为缺失。
1.4 统计学方法所有数据采用SPSS 26.0软件(IBM, USA)进行统计学分析。以t检验分析不同生存期ATC患者(>1年或<1年)和CD56阳性组织区域面积占比的差异。采用χ2检验分析不同生存期ATC患者性别和CD56阳性强度及阴阳性差异。采用相关性分析CD56阳性与ATC患者生存期的关系。
2 结果
2.1 临床特征6例ATC中,男性5例,女性1例,中位年龄67岁,随访截至2022年12月,5例死亡,其中生存期最短者仅3个月(表1)。匹配入组12例PTC,均为2020年1~12月确诊,截至2021年12月均存活良好无复发。

表1 6例甲状腺未分化癌临床资料及CD56染色结果
2.2 CD56染色结果免疫组化结果显示,CD56定位于肿瘤细胞或甲状腺滤泡上皮细胞胞膜(图1)。在ATC肿瘤组织中,CD56多呈强阳性(3例,2例/+),阳性区域面积占比>10%者占66.7%(4/6);在ATC癌旁组织中,CD56呈弱阳性(3例/+),阳性区域面积占比>10%者占50.0%(3/6)。在PTC肿瘤组织中,CD56绝大多数阴性,仅1例呈弱阳性(+),其阳性区域面积占比为14.3%,其余均为阴性(11/12);在PTC癌旁组织中,CD56呈中至强阳性(5例,7例),阳性区域面积均>10%(12/12)。
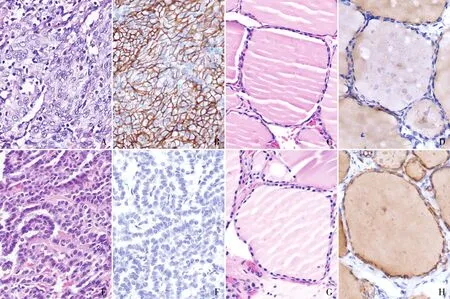
图1 A.甲状腺未分化癌肿瘤组织HE染色;B.甲状腺未分化癌肿瘤组织CD56定位于肿瘤细胞膜,呈强阳性,EnVision两步法;C.甲状腺未分化癌癌旁组织HE染色;D.甲状腺未分化癌癌旁组织CD56定位于滤泡上皮细胞膜,表达极弱,EnVision两步法;E.甲状腺乳头状癌肿瘤组织HE染色;F.甲状腺乳头状癌肿瘤组织CD56呈阴性,EnVision两步法;G.甲状腺乳头状癌癌旁组织HE染色;H.甲状腺乳头状癌癌旁组织CD56定位于滤泡上皮细胞膜,呈强阳性,EnVision两步法
2.3 CD56表达与ATC临床病理特征及预后的关系在生存期>1年或<1年的ATC患者中,肿瘤组织CD56阳性区域占比(5.1±5.2vs29.4±7.5,F=0.852,P=0.008)差异有统计学意义,而癌旁组织CD56阳性区域占比(8.9±7.3vs8.3±7.7,F=0.014,P=0.923)差异无统计学意义。
χ2检验结果显示,生存期>1年或<1年的ATC患者中性别(P=0.374)、肿瘤(P=0.083)及癌旁(P=0.414)组织CD56阴阳性均无统计学意义。Spearman相关性分析显示,ATC患者生存期与患者年龄(P=0.156)、肿瘤大小(P=0.787)、肿瘤(P=0.156)和癌旁(P=0.329)组织CD56阳性区域占比均无统计学意义。Kendall相关性分析显示,ATC患者生存期分组与肿瘤组织CD56阳性强度(P=0.037)和CD56阳性区域面积是否>10%(P=0.049)均存在相关性。
3 讨论
ATC是一种高度恶性的肿瘤,中位生存期仅3~5个月,病死率接近100%。ATC较为罕见,仅占甲状腺恶性肿瘤的1%~1.5%。与其他病理分型的甲状腺癌相类似,ATC更常见于女性(男女比为1.5∶2)[1],主要发生于60岁以上老人。有研究报道ATC的肿瘤体积、肿瘤区域耗竭T细胞占比以及患者年龄、收入水平,是ATC患者预后不良的风险因素。目前,手术切除结合放、化疗仍然是ATC主要的治疗方法。近年来有临床研究陆续报道达拉非尼、曲美替尼等小分子抑制剂和PD-1、PD-L1等抗体类药物在ATC靶向治疗中的积极作用。基于这些新的治疗方法,ATC患者的2年生存率从2000~2013年的18%,提高至2017~2019年的42%,总生存率也较20年前提高了1倍[7]。
ATC具有多种组织学特征,以肉瘤样(恶性梭形细胞构成,具有多形性)、巨细胞样(呈高度多形性)或上皮样(呈紧密排列的鳞状细胞巢)以及伴坏死常见,极少数变异病例可呈小细胞样、血管瘤样、横纹肌样等改变[8]。大部分病例肿瘤组织同时呈2种或多种组织结构[8]。研究发现,58%ATC患者曾有DTC病史,90%ATC病例肿瘤组织存在DTC成分[9]。因此有研究提出,ATC可能起源于甲状腺滤泡上皮细胞[2],但此假设尚存争议。本实验结果显示,66%(4/6)的ATC中CD56呈阳性,12例PTC和3例ATC癌旁组织中CD56也呈阳性,因此认为部分ATC与甲状腺滤泡上皮具有相同的CD56表达特征,因此推测这类ATC或起源于甲状腺滤泡上皮。
文献报道ATC多呈PAX8(+)(70%)、CK(+)(75%)、TP53(局灶+),TG(-)(96%)、TTF-1(-)(70%),与DTC存在较大差异[2,8]。2008年,一项基于185例甲状腺病变的研究报道显示[6],CD56在PTC和桥本甲状腺炎组织中表达缺失,但在良性甲状腺腺瘤、甲状腺增生组织和正常甲状腺滤泡上皮细胞膜,呈一致的弥漫强阳性。另一项基于72例甲状腺癌和21例甲状腺腺瘤的研究显示,CD56鉴别PTC与其他甲状腺病变的灵敏度和特异性均为100%[10]。Solmaz等[11]将CD56应用于甲状腺细针穿刺细胞学诊断,发现该指标细胞学阳性者经组织学诊断均为良性病变,因此认为CD56缺失是疑似PTC病例明确诊断的重要标志物。也有研究发现,CD56表达缺失的现象主要存在于PTC和浸润性滤泡变异型中,在其他DTC组织学亚型中可能存在异常表达[5]。Muthusamy等[3]研究发现,90.3%PTC(28/31)中CD56表达缺失,但仅25%(1/4)ATC呈CD56表达缺失。本组中91.7%(11/12)PTC和33.3%(2/6)ATC肿瘤组织CD56表达缺失,与上述文献报道相符,因此认为CD56对ATC的诊断和鉴别诊断存在一定意义。
CD56属于神经细胞黏附分子,在神经细胞、神经胶质细胞、活化T细胞、NK细胞呈阳性,临床常将其作为神经内分泌肿瘤的标志物。CD56表达减少或缺失被发现与肿瘤迁移、种植及预后不良相关[12]。关于CD56与血液肿瘤预后相关性的报道较多,认为CD56阳性与多发性骨髓瘤[13]、髓系白血病[14]预后良好相关,但却是成人急性淋巴细胞白血病预后不良的标志物之一[15]。在实体瘤的研究发现,尤因肉瘤患者骨髓血样本中无或少CD56阳性细胞者的无进展生存率更高,CD56阳性细胞数量高是局部复发的独立风险因素[16]。还有研究报道CD56与胰腺癌神经周围浸润及预后不良相关[17],但与乳腺浸润性导管癌患者预后无关[18]。目前,CD56表达与ATC预后的关系尚未见报道。本实验发现,生存期>1年ATC患者肿瘤组织CD56阳性区域占比,显著小于生存期<1年者(5.1±5.2vs29.4±7.5,F=0.852,P=0.008);此外,ATC患者生存期分组(>1年和<1年)还与肿瘤组织CD56阳性强度(P=0.037)和阳性区域面积(P=0.049)存在相关性。由此可见,肿瘤组织CD56表达与ATC患者预后有相关性。
综上,CD56在大部分ATC肿瘤组织中呈阳性,其阳性强度、阳性区域面积与ATC患者预后相关,提示CD56对ATC的诊断和鉴别诊断以及预后评估具有一定临床意义。由于ATC病例少见,本研究样本量极为有限,仍有待进一步扩大样本进行验证。

