EpCAM和HDAC6在前列腺癌中的表达及其对前列腺癌细胞迁移的影响
张 月,权春姬,金雪梅,张金山,张紫薇,金仁顺,李珍玲
上皮细胞黏附分子(epithelial cell adhesion molecule, EpCAM)是一种Ⅰ型跨膜糖蛋白,是黏附分子家族的重要成员,主要介导上皮细胞中同型细胞间的黏附,同时参与细胞之间的信号传导、细胞迁徙、增殖分化和组织再生等过程[1]。多项研究表明,EpCAM作为一种重要的细胞表面抗原,在肿瘤治疗中发挥重要作用,可作为判断预后和复发的重要指标[2]。组蛋白(Histon)作为构成染色质的重要成分,可在其尾部的氨基酸残基上进行乙酰化修饰,导致染色质构象发生改变,调控基因的转录[3],成为恶性肿瘤预防和治疗的研究热点。组蛋白去乙酰化酶6(histone deacetylase, HDAC6)作为HDACs的主要成员,在多种恶性肿瘤中异常高表达,参与调节细胞的增殖、迁移、转运和血管生成,诱导肿瘤的发生发展。本研究采用免疫组化和Western blot法检测EpCAM和HDAC6蛋白在前列腺癌及癌旁良性组织中的表达,分析两蛋白表达的相关性及与前列腺癌临床病理特征的关系,通过体外实验探讨EpCAM和HDAC6对前列腺癌细胞迁移及上皮-间质转化(epithelial-mesenchymal transition, EMT)的影响,为临床前列腺癌的诊断及预后评估提供理论依据。
1 材料与方法
1.1 一般资料收集2015年3月~2020年9月延边大学附属医院病理科确诊并存档的前列腺癌手术标本115例和癌旁良性组织标本37例。切片经高年资病理医师重新阅片,证实为前列腺腺癌。患者年龄51~91岁,平均76岁,术前均未接受放、化疗及免疫抑制和激素治疗。根据患者年龄分为:≤70岁组(39例)和>70岁组(76例);根据肿瘤大小及浸润程度分为:T1-T2组(14例)和T3-T4组(57例);根据Gleason评分(gleason score, GS)分为:≤7分组(58例)和>7分组(57例);根据ISUP预后分级分组系统(ISUP grade group, GG)分为:GG 1组(13例)、GG 2组(22例)、GG 3组(23例)、GG 4组(28例)和GG 5组(29例);根据血清PSA值分为:≤10 ng/mL组(14例)和>10 ng/mL组(40例);根据有无淋巴结转移分为:有转移组(57例)和无转移组(14例)。
1.2 方法
1.2.1生物信息学分析 通过TCGA数据库检索和分析EpCAM及HDAC6在多种癌症中的mRNA表达情况,进而对前列腺癌和正常前列腺组织中的表达差异进行比较分析。Starbase数据库检索和分析499例前列腺癌组织中EpCAM mRNA与HDAC6 mRNA表达的相关性。
1.2.2实验材料与试剂 实验试剂包括DMEM培养基、胎牛血清(Gibco公司);EpCAM siRNA和阴性对照siRNA(北京合生生物公司);脂质体Lipofectamine 3000转染试剂盒(Thermo Fisher Scientific公司);EpCAM、HDAC6、E-cadherin、vimentin、β-actin单克隆抗体和二抗(CST公司);荧光二抗(APExBIO公司);蛋白提取试剂盒、Western blot法检测试剂盒(Solarbio科技公司);Transwell小室(Corning公司);Matrigel基质胶(BD公司)。
1.2.3免疫组化检测EpCAM和HDAC6的表达 所有标本经10%中性福尔马林固定,常规石蜡包埋、连续切片,经EDTA液高压高温抗原修复,过氧化物酶孵育后,加入EpCAM和HDAC6一抗4 ℃孵育过夜,二抗37 ℃孵育后,DAB显色。常规乙醇脱水,二甲苯透明,中性树胶封固,显微镜下观察、采图。阴性对照用PBS作为一抗。免疫组化结果判定:(1)着色细胞数:阳性细胞数<10%判定为0分、10%~50%判定为1分、>50%判定为2分;(2)着色程度:无阳性着色判定为0分、着淡黄色判定为1分、着棕黄色判定为2分。两项评分相乘作为最终结果:0分为阴性(-)、1分为弱阳性(+)、2分为中等阳性()、4分为强阳性()。将(~)划分为高表达组。
1.2.4细胞的培养与转染 人前列腺癌DU145细胞由我院中心实验室提供,细胞培养于DMEM完全培养液(含10%FBS和1%青-链霉素),置于5%CO2、37 ℃细胞培养箱中培养。si-EpCAM序列由北京合生生物公司设计合成,参考Lipofectamine 3000转染试剂说明书进行细胞转染。DU145细胞接种于6孔板中,待细胞融合度达70%~90%时开始细胞转染,继续培养18~48 h,荧光显微镜下观察细胞转染效率,并用Western blot法进行验证。选用si-NC空载体作为对照组。期间观察细胞状态,继续进行后续实验。
1.2.5细胞划痕实验 取生长状态良好的对数生长期细胞,将细胞密度调整为2×105/mL,分别接种到6孔板内,待细胞融合达70%时,用200 μL的移液枪枪头垂直于孔均匀划痕,分别在0 h、24 h、48 h时用显微镜拍照并分析划痕的修复程度。细胞愈合率=0 h或24 h或48 h EpCAM沉默组的划痕面积/0 h对照组的划痕面积×100%。用image J软件测量各组的面积,GraphPad Prism 8.0进行统计分析和统计图绘制,重复实验3次。
1.2.6Transwell侵袭小室实验 取生长状态良好的对数生长期细胞,将细胞密度调整为1×104/mL,取150 μL接种在上室中,取750 μL含20%FBS的完全培养基加入下室。继续培养24 h后取出Transwell上室,PBS冲洗后,甲醛固定、0.1%结晶紫染色、擦拭小室表面上的细胞;显微镜下随机选取5个高倍视野,用image J软件进行各组细胞计数,GraphPad Prism 8.0进行统计分析和统计图绘制。
1.2.7Western blot实验 采用蛋白裂解液提取细胞总蛋白,根据蛋白浓度检测试剂盒检测蛋白浓度,取30 μg蛋白经6%~12% SDS-PAGE胶分离,转膜后5%脱脂奶粉封闭、一抗孵育过夜、二抗孵育,后置于成像系统中曝光,采图并分析。以目的蛋白与内参β-actin的灰度值之比表示目的蛋白的相对表达水平。
1.3 统计学方法所有数据应用SPSS 25.0和GraphPad Prism 8.0软件进行统计学分析。EpCAM和HDAC6蛋白表达与临床病理特征的关系采用χ2检验或Fisher精确检验,其表达的相关性采用Spearman等级相关检验,两组间比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 前列腺癌中EpCAM和HDAC6 mRNA的表达通过TIMER数据库检索发现,EpCAM和HDAC6在多种恶性肿瘤组织中表达上调,前列腺癌组织中EpCAM mRNA的表达水平明显高于癌旁良性组织(P<0.001,图1A),前列腺癌与癌旁良性组织中HDAC6 mRNA表达差异无统计学意义(图1B)。UALCAN数据库分析显示,与癌旁正常组织相比,前列腺癌组织中EpCAM和HDAC6 mRNA的表达水平显著上调(P<0.001,P<0.05,图2A、B)。进一步分析EpCAM和HDAC6 mRNA表达与前列腺癌临床病理特征的关系,发现EpCAM和HDAC6 mRNA与Gleason评分和淋巴结转移密切相关:与癌旁良性组织相比,EpCAM蛋白在不同Gleason评分前列腺癌组织中均表达增高(图2C);而HDAC6蛋白在Gleason评分8、9的前列腺癌组织中的表达显著高于癌旁正常组织(图2D);前列腺癌无淋巴结转移(N0)和有淋巴结转移(N1)组织中的EpCAM和HDAC6 mRNA表达水平均高于癌旁良性组织(图2E、F)。
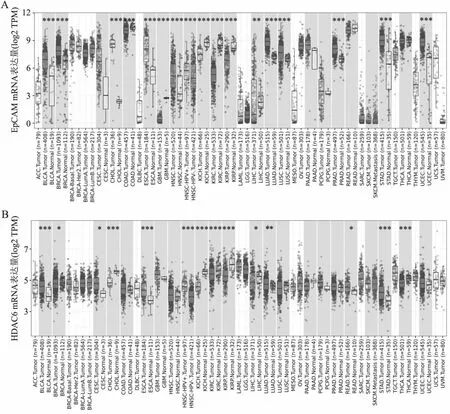
图1 EpCAM和HDAC6 mRNA在不同肿瘤组织中的表达:TIMER数据库分析各种肿瘤组织中EpCAM(A)和HDAC6(B)mRNA表达
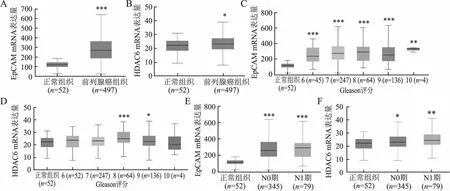
图2 UALCAN数据库分析EpCAM和HDAC6 mRNA在不同前列腺癌组织中的表达差异:UALCAN数据库中EpCAM(A)和HDAC6(B)mRNA在正常前列腺组织及前列腺癌组织中表达水平;EpCAM (C)和HDAC6 mRNA(D)表达水平与前列腺癌Gleason评分的关系;EpCAM(E)和 HDAC6 mRNA(F)表达水平与前列腺癌淋巴结转移的关系;与正常组相比,*P<0.05,**P<0.01,***P<0.001
2.2 前列腺癌组织中EpCAM和HDAC6蛋白的表达免疫组化结果显示,EpCAM蛋白在癌旁良性组织中呈(-~+),前列腺癌组织中呈(~),且主要定位于细胞膜(图3)。前列腺癌组织中EpCAM蛋白的高表达率为62.61%(72/115),高于癌旁良性组织(21.62%,8/37),差异有统计学意义(P<0.001,表1)。HDAC6蛋白表达主要定位于细胞质,强表达时细胞膜也有一定的表达。HDAC6在前列腺癌组织中呈(~),而在癌旁良性组织中呈(-~+)(图4)。HDAC6蛋白在前列腺癌组织中高表达率为81.74%(94/115),高于癌旁良性组织(43.24%,16/37),差异有统计学意义(P<0.001,表1)。

表1 前列腺癌和癌旁良性组织中EpCAM和HDAC6蛋白的表达
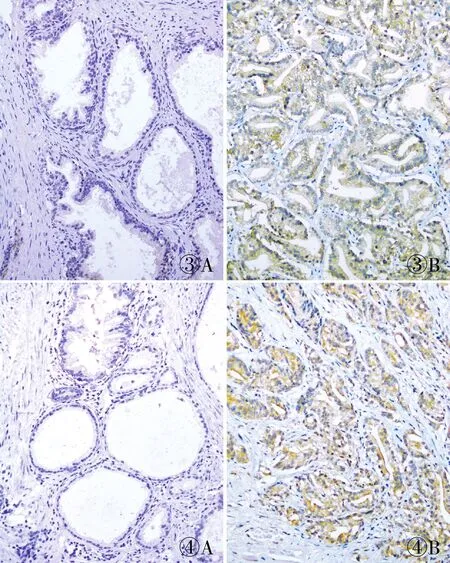
图3 前列腺癌及癌旁良性组织中EpCAM蛋白的表达:A.前列腺癌旁良性组织中EpCAM呈阴性;B.前列腺癌组织中EpCAM呈阳性,EnVision法 图4 前列腺癌及癌旁良性组织中HDAC6蛋白的表达:A.前列腺癌旁良性组织中HDAC6呈阴性;B.前列腺癌组织中HDAC6呈阳性,EnVision法
2.3 EpCAM和HDAC6高表达与前列腺癌临床病理特征的关系进一步对EpCAM和HDAC6蛋白高表达与前列腺癌临床病理特征的关系进行分析发现,EpCAM表达与前列腺癌肿瘤大小及浸润深度(P=0.007)、Gleason评分(P<0.001)以及WHO/ISUP预后分级分组(P=0.005)有关;而与患者年龄、血清PSA值和淋巴结转移无关(P>0.05,表2)。HDAC6蛋白在前列腺癌组织中的表达水平与WHO/ISUP预后分级分组具有一定相关性,但差异并不显著(P=0.05),而与患者年龄、肿瘤大小及浸润深度、Gleason评分、血清PSA和淋巴结转移均无统计学意义(P>0.05,表2)。
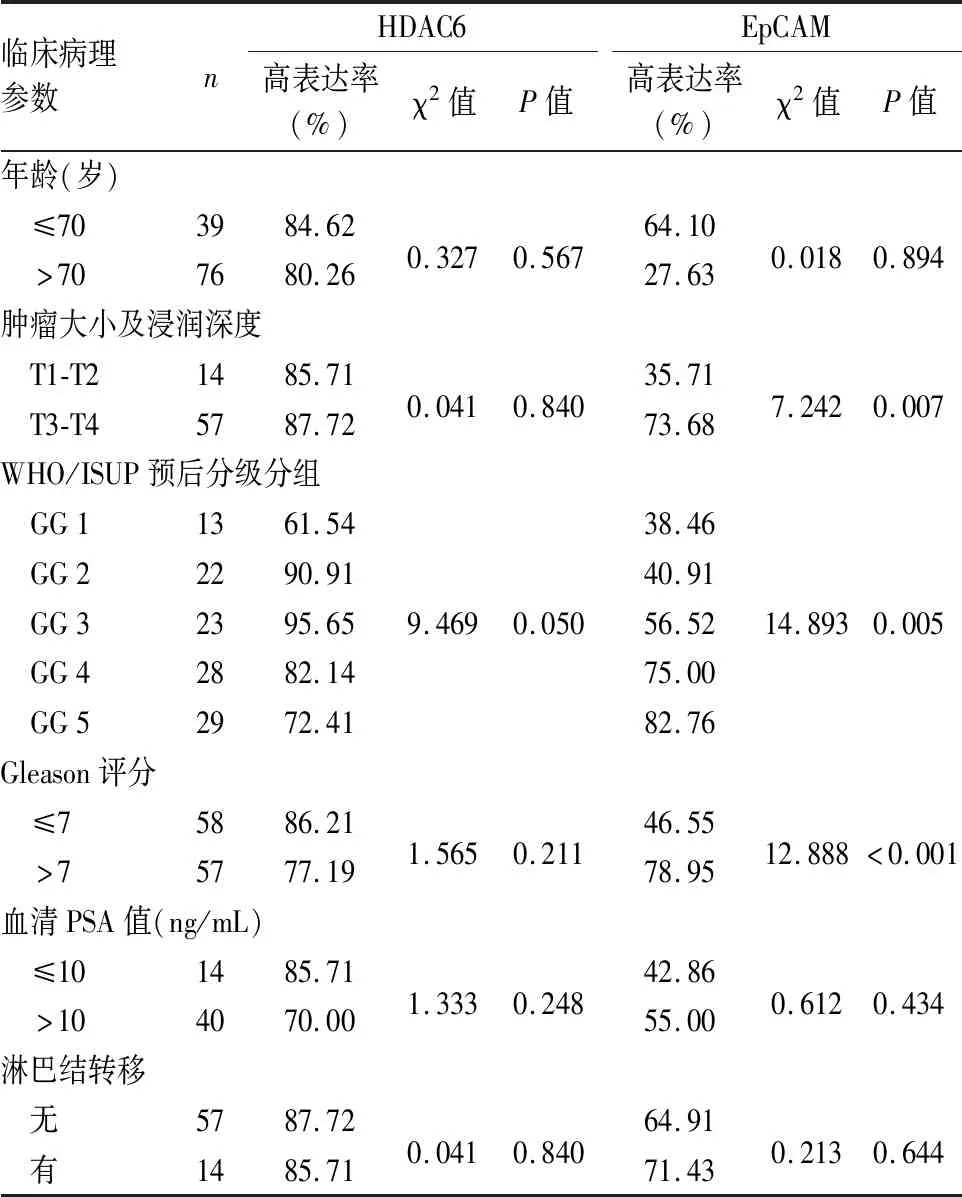
表2 EpCAM和HDAC6蛋白高表达与前列腺癌临床病理特征的关系
2.4 前列腺癌中EpCAM和HDAC6蛋白表达的相关性Starbase数据库分析结果显示,在499例前列腺癌组织中EpCAM与HDAC6的mRNA表达呈正相关(r=0.206,P=3.44e-06,图5)。免疫组化结果显示,EpCAM阴性时HDAC6蛋白也呈阴性,同样EpCAM呈强阳性时HDAC6蛋白也呈强阳性,两蛋白表达具有一致性(图6)。Spearman相关性分析结果显示,在115例前列腺癌组织标本中,EpCAM和HDAC6蛋白同时高表达64例,两者同时低表达13例,两者在前列腺癌组织中的表达呈正相关(r=0.454,P<0.001,表3)。
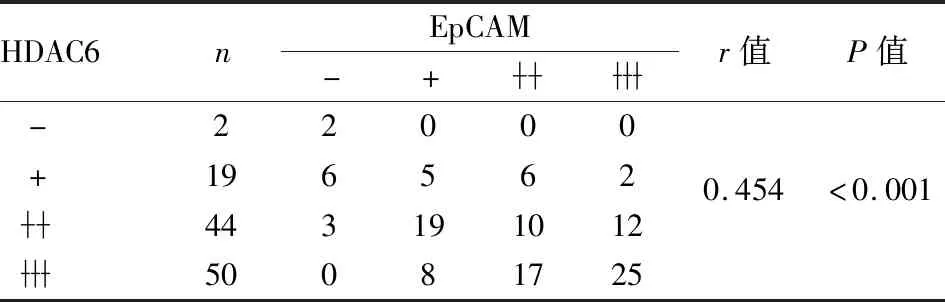
表3 前列腺癌中EpCAM与HDAC6蛋白表达的相关性
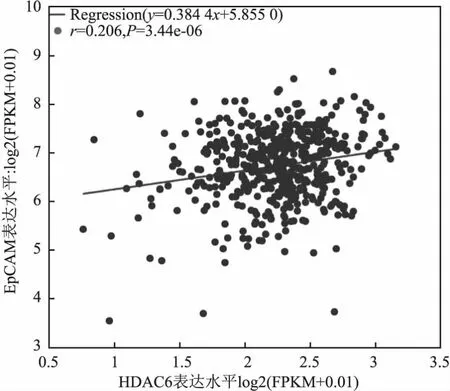
图5 前列腺癌组织中EpCAM与HDAC6 mRNA表达的相关性
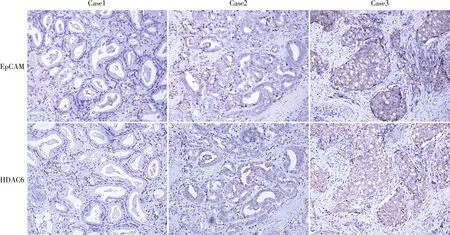
图6 前列腺癌组织中EpCAM和HDAC6的表达:case1.EpCAM和HDAC6均呈阴性;case2.EpCAM和HDAC6均呈阳性;case3.EpCAM和HDAC6均呈强阳性,EnVision法
2.5 EpCAM沉默对前列腺癌细胞迁移及EMT的影响Western blot法结果显示:与si-NC组相比,si-EpCAM处理组的EpCAM蛋白表达显著减少(si-EpCAM-1:P<0.05,si-EpCAM-2:P<0.01)。此外,si-EpCAM转染后,DU145细胞中HDAC6蛋白表达水平也相应减少,但差异无统计学意义(图7)。
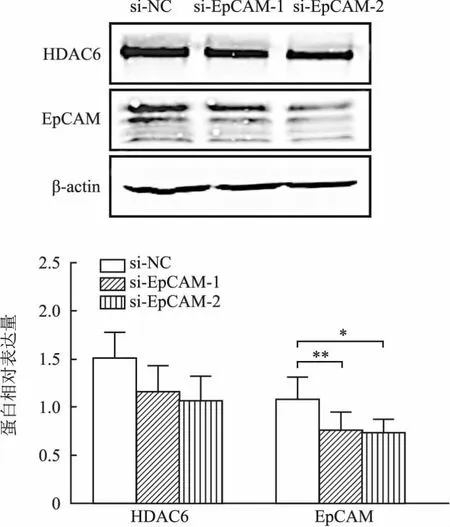
图7 Western blot检测各组细胞中EpCAM和HDAC6蛋白的表达:与对照组相比,*P<0.05,**P<0.01
划痕实验结果显示,与si-NC组(0.864±0.024)相比,si-EpCAM组的细胞迁移及修复能力明显减弱(si-EpCAM-1:0.141±0.014,si-EpCAM-2:0.110±0.013),差异具有统计学意义(P<0.001,图8),提示沉默EpCAM表达可抑制前列腺癌细胞迁移能力。同样,Transwell实验结果也显示:EpCAM沉默后DU145细胞的迁移数目减少(图9),上述结果均提示EpCAM参与前列腺癌细胞的迁移。为进一步观察EpCAM对EMT相关蛋白表达的影响,采用Western blot法检测si-EpCAM转染后EMT相关蛋白的表达。结果显示,与si-NC组相比,si-EpCAM组E-cadherin蛋白表达轻微升高,vimentin蛋白表达显著降低(P<0.05,图10)。
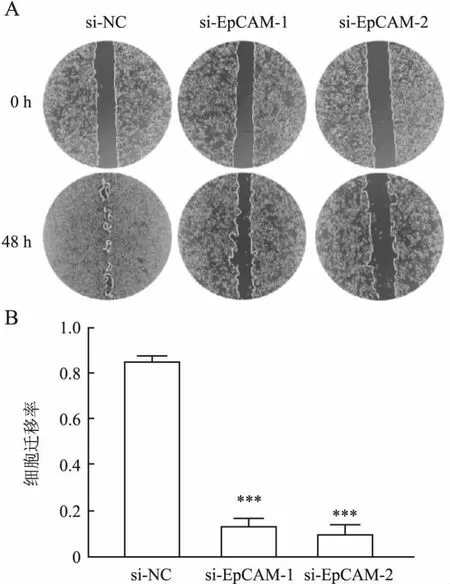
图8 划痕实验检测各组细胞的迁移能力:A.si-EpCAM转染后,DU145细胞的迁移能力;B.各组细胞的迁移百分比统计图;与对照组相比,***P<0.001
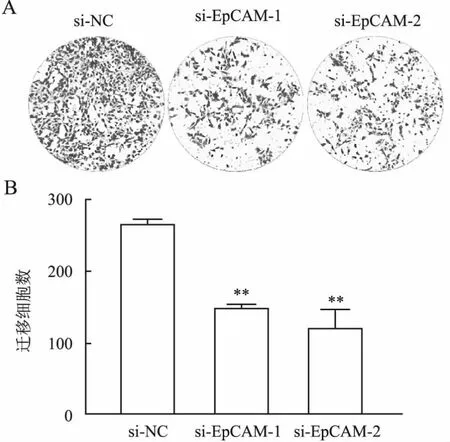
图9 Transwell实验检测各组细胞的迁移能力:A.si-EpCAM转染后,DU145细胞的迁移能力,结晶紫染色;B.各组细胞的迁移数量统计图,与对照组相比,**P<0.01
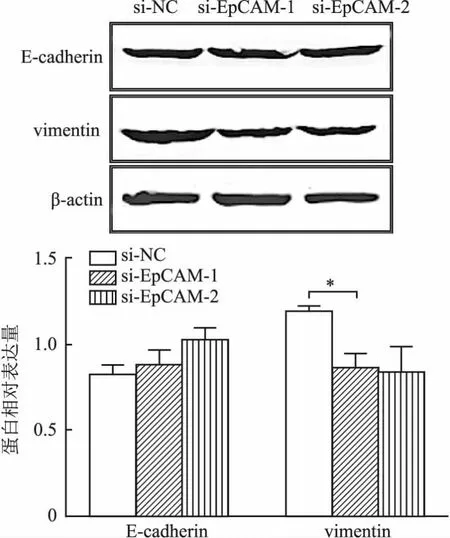
图10 EpCAM沉默后DU145细胞中EMT相关蛋白的表达
3 讨论
EpCAM介导上皮细胞中与Ca2+无关的同型细胞之间的黏附,在乳腺癌、卵巢癌、胃癌等多种肿瘤细胞中表达增高,促进肿瘤细胞的增殖和侵袭,而抑制其表达可导致肿瘤细胞的增殖减少,降低肿瘤转移的概率[4-7]。此外,研究发现EpCAM+细胞具有肿瘤干细胞(cancer stem cell, CSC)特征,有更高的集落形成效率、成瘤能力、自我更新和分化的潜力,可作为CSC的标志物用于筛选循环CSC[8]。然而,目前关于EpCAM在前列腺癌发生、发展过程中的作用及调节机制研究甚少。本实验通过生物信息学分析和免疫组化染色结果发现,前列腺癌组织中EpCAM mRNA和蛋白表达水平均显著高于良性前列腺组织,其表达与肿瘤大小及浸润程度、Gleason评分及WHO/ISUP预后分级分组有关。有研究证实,EpCAM蛋白与前列腺癌患者血清PSA值、临床病理分级、淋巴结转移及复发情况等指标有关,参与肿瘤的发生及恶化,其低表达更有利于患者的预后[9]。然而,另有研究认为EpCAM蛋白与前列腺癌患者Gleason评分、淋巴结转移及预后情况等无明显相关[10],研究结果具有异质性。虽然研究结果尚存在争议,但结合本组前期研究[11]及本研究结果,说明EpCAM参与前列腺癌的发生、发展及演进过程,其蛋白高表达与前列腺癌的恶性程度及不良预后等密切相关,可作为前列腺癌的早期诊断及预后评估指标。
HDAC6是HDACs家族中最大的成员,属于Ⅱb类HDACs,主要调节细胞迁移、血管生成,介导肿瘤细胞增殖和凋亡,降解错折叠蛋白质等生物学过程[12]。研究表明,HDAC6的去乙酰化功能与底物蛋白乙酰化状态的动态平衡对生理功能的调节起重要作用,且HDAC6抑制剂在心血管疾病、恶性肿瘤及神经退行性疾病等治疗方面均显现了广阔的应用前景[13]。本研究中,HDAC6蛋白在前列腺癌组织中的表达强度及阳性率均高于癌旁良性组织,然而其表达与前列腺癌患者年龄、肿瘤大小及浸润程度、Gleason评分、血清PSA值及淋巴结转移均无明显相关性。国内外对HDAC6在不同癌症中的研究结果也不尽相同,众多研究认为HDAC6蛋白在喉癌、食管鳞状细胞癌及胃癌等恶性肿瘤中高表达,但其高表达与临床分期、肿瘤分化程度、患者年龄、肿瘤大小和淋巴结转移的关系结果不全一致[14-17]。虽然,HDAC6参与肿瘤发生发展已成为共识,但结合本研究结果,认为HDAC6不能作为评估前列腺癌恶性程度及进展的独立指标。数据库分析及Spearman相关分析结果显示,前列腺癌组织中EpCAM和HDAC6的蛋白及mRNA表达均呈正相关,提示EpCAM和HDAC6能协同参与前列腺癌的发展和转移,联合检测EpCAM和HDAC6有望成为前列腺癌诊断和判断预后的有效指标。
EMT是指具有上皮特征的细胞失去其特征,并获得间质细胞特征的一过性过程。在恶性肿瘤的发展过程中EMT被重新激活,从而促进肿瘤转移、侵袭及耐药,在前列腺癌的发生、侵袭和转移中发挥重要作用。研究发现,前列腺癌细胞经多西他赛处理后,EpCAM蛋白表达上调,促进EMT进程,证实在前列腺癌治疗过程中多西他赛耐药细胞的出现可能与EpCAM蛋白表达上调和EMT的发生有关[18]。此外,EpCAM通过调控PI3K/AKT/mTOR信号通路参与前列腺癌的增殖、侵袭、转移及化疗耐药[19],而HDAC6也可通过调控Wnt/β-catenin和PTEN/AKT/mTOR信号通路,参与肿瘤细胞的增殖、迁移、侵袭及CSC的自我更新能力[20]。本实验中,前列腺癌组织EpCAM表达缺失导致HDAC6蛋白表达减少,并且沉默前列腺癌细胞DU145的EpCAM蛋白表达,细胞的迁移能力明显下降,EMT相关蛋白E-cadherin表达上调,vimentin表达下调,但参与的信号通路及分子机制有待进一步研究。
综上所述,前列腺癌组织中EpCAM与HDAC6表达呈正相关,其高表达预示前列腺癌的恶性程度和不良预后,对前列腺癌患者的早期诊断和预后评估具有一定的指导意义。沉默DU145前列腺癌细胞的EpCAM蛋白表达,可下调HDAC6蛋白表达,抑制细胞的迁移,逆转EMT进程,但具体作用机制及信号通路仍不清楚,有待后续深入探讨。

