PD-L1及微血管密度在肉瘤样肾细胞癌中的表达及意义
赵 媛,陈 红,谢 燕,李 宁,金木兰
肾细胞癌(renal cell carcinoma, RCC)是泌尿系统常见的恶性肿瘤之一,2020年约占全球所有恶性肿瘤新发病例的2.2%,其发病率呈逐年上升趋势。其中,伴肉瘤样分化的肾细胞癌常被称为肉瘤样肾细胞癌(sarcomatoid renal cell carcinoma, sRCC),该肿瘤呈低分化或未分化状态,通常为WHO/ISUP 4级,进展迅速,生物学行为较常见的肾癌更具侵袭性,预后较差,大多数患者在1年内死于肿瘤转移[1]。尽管靶向治疗有效延长了晚期RCC患者的生存期,但该治疗方法对sRCC患者的疗效有限。研究表明,RCC中肉瘤样成分的存在可能导致靶向治疗的耐药性[2]。近年研究发现,PD-1和PD-L1在sRCC中的表达水平显著高于非sRCC,提示阻断PD-1/PD-L1轴可能是一种新的治疗策略[3]。研究显示,在RCC治疗中采用PD-1/PD-L1抑制剂联合靶向治疗的疗效优于单用靶向治疗,并且可以有效延长患者的无进展生存期和提高客观缓解率[4]。本研究纳入16例sRCC,探讨肿瘤组织中PD-L1表达、肿瘤内微血管密度及其与sRCC预后的关系,为进一步探索sRCC免疫治疗及靶向治疗方案提供新的思路和依据。
1 材料与方法
1.1 临床资料收集并筛选2016年1月~2022年12月在首都医科大学附属北京朝阳医院经病理确诊的16例sRCC患者(癌成分均为透明细胞肾细胞癌)。收集患者临床病理资料包括性别、年龄、肿瘤部位、肿瘤最大径、肉瘤样区域占比、病理TNM分期、治疗及预后情况。影像学监测肿瘤的复发、转移情况。无进展生存期 (progression free survival, PFS)定义为患者接受治疗至患者出现肿瘤进展或末次随访日。总生存期(overall survival, OS)定义为患者术后至各种原因导致死亡的时间或末次随访日。本研究经北京朝阳医院伦理委员会批准,遵循《药物临床试验质量管理规范》和《赫尔辛基宣言》实施。所有患者均知情同意。
1.2 方法组织标本均经10%中性缓冲福尔马林固定,常规脱水、石蜡包埋,5 μm厚切片,HE染色,光镜下观察。免疫组化一抗包括PD-L1、CD31和CD34,其中PD-L1(SP263)购自美国罗氏公司,使用Bench Mark ULTRA全自动免疫组化染色平台检测PD-L1的表达,CD31和CD34购自北京中杉金桥公司,免疫组化染色采用EnVision两步法。
通过免疫组化法检测PD-L1在sRCC肿瘤细胞(tumor cell, TC)和肿瘤相关免疫细胞(immune cell, IC)中的表达。IC包括淋巴细胞、巨噬细胞、树突状细胞、浆细胞、中性粒细胞和嗜酸性粒细胞。TC PD-L1判读:任意强度的、部分或完全细胞膜PD-L1染色的肿瘤细胞占标本中所有肿瘤细胞的百分比。肿瘤细胞质染色、肿瘤内间质及坏死区域不包含在评判范围内。IC PD-L1阳性判读:肿瘤区域内、任意强度的、细胞质或细胞膜PD-L1染色的免疫细胞所占肿瘤面积的百分比。肿瘤面积包含肿瘤细胞、肿瘤内间质及肿瘤周围连续性相关间质,不包含坏死区域。采用联合阳性评分(combined positive score, CPS)来代表TC及IC联合表达,结果用0~100数值来表示。当计算结果超过100时,最终结果按100来计算[4]。所有染色的组织样本均由2名泌尿生殖病理专业的病理医师进行复核。
通过免疫组化法检测CD31和CD34的表达情况[5]。单个内皮细胞或内皮细胞簇的胞膜和(或)胞质染色视为阳性,可用于微血管密度(microvessel density, MVD)计数,不计瘤细胞稀少区、硬化区及其接近正常组织区域的微血管数量。微血管密度计数方法:先在100倍光镜下观察切片确定肿瘤内血管密度最高处,选取CD31、CD34阳性染色较多的热点区(5个),再在200倍光镜下在各热点区范围内进行MVD计数。
1.3 统计学方法计量资料以均数±标准差表示,计数资料以率或百分比表示,两组均数间的比较应用t检验。采用Kaplan-Meier曲线描绘患者的总体生存率。P<0.05为差异有统计学意义。
2 结果
2.1 临床病理特征16例sRCC临床病理特征见表1,其中男性12例(75.0%),女性4例(25.0%),男女比为3∶1,年龄31~75岁,中位年龄53.5岁。5例(31.3%)肿瘤位于左肾,11例(68.7%)肿瘤位于右肾。肿瘤最大径4.0~13.5 cm,中位最大径7.0 cm。肉瘤样区域占肿瘤瘤体5%~70%不等。根据WHO/ISUP肿瘤分级系统,肾细胞癌伴有肉瘤样分化WHO/ISUP分级均为G4。病理TNM分期Ⅰ~Ⅳ期患者分别为3例(18.8%)、3例(18.8%)、7例(43.7%)、3例(18.8%)。所有患者均接受肾癌根治术,其中分期为pT1的2例患者术后定期复查,未接受其他治疗,其余患者在术后根据病情变化应用了靶向治疗或免疫治疗。
2.2 MVD检测结果对本组16例sRCC进行组织学观察,16例sRCC肿瘤组织中同时含有癌和肉瘤样成分,肉瘤样区域肿瘤细胞呈梭形,弥漫片状分布(图1A),癌成分均为透明细胞肾细胞癌(图1B)。肿瘤中微血管呈网状、管状散在或弥漫分布,血管形态差异性较大。CD31免疫组化标记的肉瘤样分化区域MVD计数为68.6±25.8,不伴肉瘤样分化区域的MVD计数为38.7±16.0,肉瘤样分化区域MVD明显高于不伴肉瘤样分化的区域(图1C、D),差异具有统计学意义(P=0.000 5,表2);CD34免疫组化标记的肉瘤样分化区域MVD计数为69.5±28.1,周边不伴肉瘤样分化区域MVD计数为40.1±18.4,肉瘤样分化区域MVD明显高于不伴肉瘤样分化的区域(图1E、F),差异具有统计学意义(P=0.001 5,表2)。
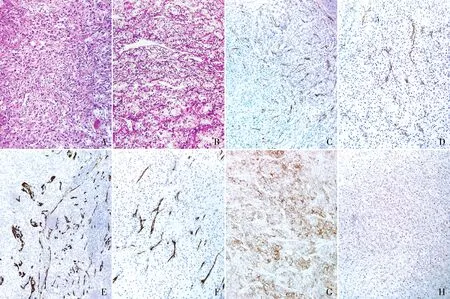
图1 A.肉瘤样肾细胞癌的肉瘤样区域:肿瘤细胞呈梭形,弥漫片状分布,胞质嗜酸性;B.肉瘤样肾细胞癌的非肉瘤样区域:肿瘤细胞胞质透明,呈现透明细胞肾细胞癌形态;C.CD31免疫组化标记的肉瘤样肾细胞癌肉瘤样区域微血管内皮细胞,EnVision法;D. CD31免疫组化标记的肉瘤样肾细胞癌非肉瘤样区域微血管内皮细胞,EnVision法;E.CD34免疫组化标记的肉瘤样肾细胞癌肉瘤样区域微血管内皮细胞,EnVision法;F. CD34免疫组化标记的肉瘤样肾细胞癌非肉瘤样区域微血管内皮细胞,EnVision法;G. PD-L1在肉瘤样肾细胞癌肉瘤样区域中的表达,EnVision法;H.PD-L1在肉瘤样肾细胞癌非肉瘤样区域中的表达,EnVision法
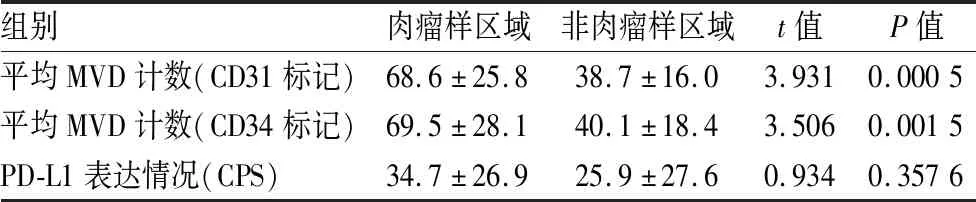
表2 肉瘤样肾细胞癌中肉瘤样区域与非肉瘤样区域MVD计数及PD-L1表达情况
2.3 PD-L1表达情况16例sRCC中肉瘤样区域与非肉瘤样区域PD-L1染色结果显示(图1G、H,表1),肉瘤样区域PD-L1的CPS为34.7±26.9,非肉瘤样区域PD-L1的CPS为25.9±27.6。肉瘤样区域PD-L1的表达水平高于非肉瘤样区域,但差异无统计学意义(P=0.357 6,表2)。
2.4 随访及预后对所有患者进行随访,中位随访时间36.5个月(10~84个月),14例患者出现肿瘤进展,其中7例患者死亡,患者总体生存曲线见图2。

图2 16例肉瘤样肾细胞癌患者的总体生存曲线图
3 讨论
sRCC是一种去分化的癌,它并不是一个独立的组织学类型,任何RCC亚型都可能伴有肉瘤样成分,其复发率、转移率高,总体预后差。传统疗法对sRCC的疗效不佳,中位OS约为19个月[6]。对于sRCC,目前尚无有效的系统治疗方法。随着靶向治疗药物(如舒尼替尼、索拉非尼、帕唑帕尼、阿昔替尼等)的出现,RCC患者的预后生存得到了一定程度的改善[7]。分子靶向药物的主要作用机制是通过抑制肿瘤血管生成来抑制肿瘤生长。血管生成是指肿瘤附近血管的增殖和出芽,在肿瘤的增殖和进展中起着至关重要的作用[8]。MVD是最常用的量化肿瘤内血管生成的参数,也是衡量肿瘤血管生成的金标准,在肺癌、乳腺癌和结直肠癌中是公认的预后相关因素[9-11]。然而,一些研究发现,在RCC患者中MVD与OS之间无明显相关性[5]。Yao等[12]认为RCC中存在两种微血管类型:未分化型微血管和分化型微血管。该研究认为分化型微血管比例越高,恶性程度越低,预后越好;未分化型微血管比例越高,恶性程度越高,预后越差,即未分化型MVD是RCC患者的独立预后因素。临床对检测MVD计数的常用指标为CD31和CD34。CD31是泛内皮细胞标志物,不仅与新形成的微血管有关,也涉及肿瘤中已有的血管。CD34常在血管周细胞中表达,但在正常血管内皮和淋巴内皮中表达较少,因此能突出显示较小的、不成熟的微血管或单一的内皮细胞[5]。本研究发现,sRCC中血管密度增加,尤其是CD34标记的未成熟血管数量增加,MVD计数高于非肉瘤样区域,差异有统计学意义(P=0.001 5),提示sRCC可能从抑制血管生成的靶向治疗中获益。
随着肿瘤免疫治疗的发展,免疫治疗被认为是治疗高危肾癌的一种有前景的治疗方法。研究发现,sRCC中PD-1和PD-L1的表达量明显高于普通病理类型的肾癌,同时肿瘤相关淋巴细胞的浸润也较高。Kawakami等[3]发现,与非肉瘤性4级透明细胞肾细胞癌相比,伴肉瘤样分化的透明细胞肾细胞癌的PD-L1表达更高。该研究表明,sRCC中PD-1/PD-L1的表达比例可能比非sRCC更高。本研究对16例sRCC肿瘤组织进行了PD-1和PD-L1免疫组化染色,所有患者肿瘤组织PD-L1均有不同程度表达,且肉瘤样区域的阳性百分比均高于非肉瘤样区域,但差异无统计学意义。基于本研究结果及其他研究报道,sRCC患者有可能从免疫治疗中获益。
在组织学方面,肾细胞癌具有丰富的血管和肿瘤浸润淋巴细胞。因此,抗血管生成靶向药物和免疫检查点抑制剂有望在肾癌联合治疗中发挥协同增效作用。研究显示,靶向药物联合PD-1/PD-L1抑制剂在晚期RCC的治疗中获得了良好的疗效。例如,KEYNOTE-426临床研究对帕博利珠单抗和阿昔替尼联合与舒尼替尼单药治疗晚期肾细胞癌疗效进行了比较。有研究显示,与舒尼替尼相比,联合治疗组患者的PFS明显延长(15.4个月vs11.1个月,P<0.000 1),客观缓解率显著提高(59.3%vs35.7%,P<0.000 1),并且无论患者PD-L1的表达状况如何,联合治疗组均可获益[13-14]。CLEAR研究显示,仑伐替尼联合帕博利珠单抗与舒尼替尼相比,患者的PFS得到明显延长(23.9个月vs9.2个月,P<0.001),联合治疗组的OS也优于舒尼替尼组(P=0.005),并且联合治疗组的客观缓解率达71%,明显优于其他药物的临床研究数据[15]。因此,联合靶向治疗和免疫治疗,与单独使用靶向治疗或免疫治疗相比,可有效改善晚期RCC的治疗效果。一项研究显示,与65例单独接受舒尼替尼治疗的sRCC患者相比,74例接受伊匹单抗联合纳武单抗治疗的患者中位PFS、中位OS、完全缓解率和局部缓解率均显著增加[16]。因此,靶向治疗联合免疫治疗也可能成为sRCC潜在有效的治疗方法。
本研究显示,采用靶向治疗联合免疫治疗的sRCC患者,相比于单独采用靶向治疗者,PFS与OS均有所提升。例如,例13在肾癌根治术后第50个月发现肿瘤进展,应用靶向联合免疫治疗,目前随访69个月病情平稳,相比于同为pT3期、仅追加靶向治疗的患者,其预后明显改善。例14在肾癌根治术后第16个月发现肿瘤肺转移,应用索拉非尼靶向治疗,未联合免疫治疗,于术后第25个月去世;而同为pT4期的例15,在肾癌根治术后第19个月发现肿瘤肺转移,应用靶向治疗联合免疫治疗,目前随访30个月患者仍生存,肿瘤控制平稳。例16在肾癌根治术后第8个月时肿瘤复发,应用靶向治疗联合免疫治疗后,于第29个月去世;而同为pT4期且复发后未联合免疫治疗的例14,其复发后生存期仅9个月,两者相比,前者复发后生存期更长(21个月vs9个月),提示靶向联合免疫治疗在延长sRCC患者OS方面可能发挥潜在改善作用。
综上,sRCC较为少见,患者预后较差,靶向联合免疫治疗可能是此类患者临床治疗方案中的一项重要选择。然而,本研究样本量小,可能存在选择偏差,未来还需要更大样本的前瞻性研究来验证本研究的结果。

